Similar presentations:
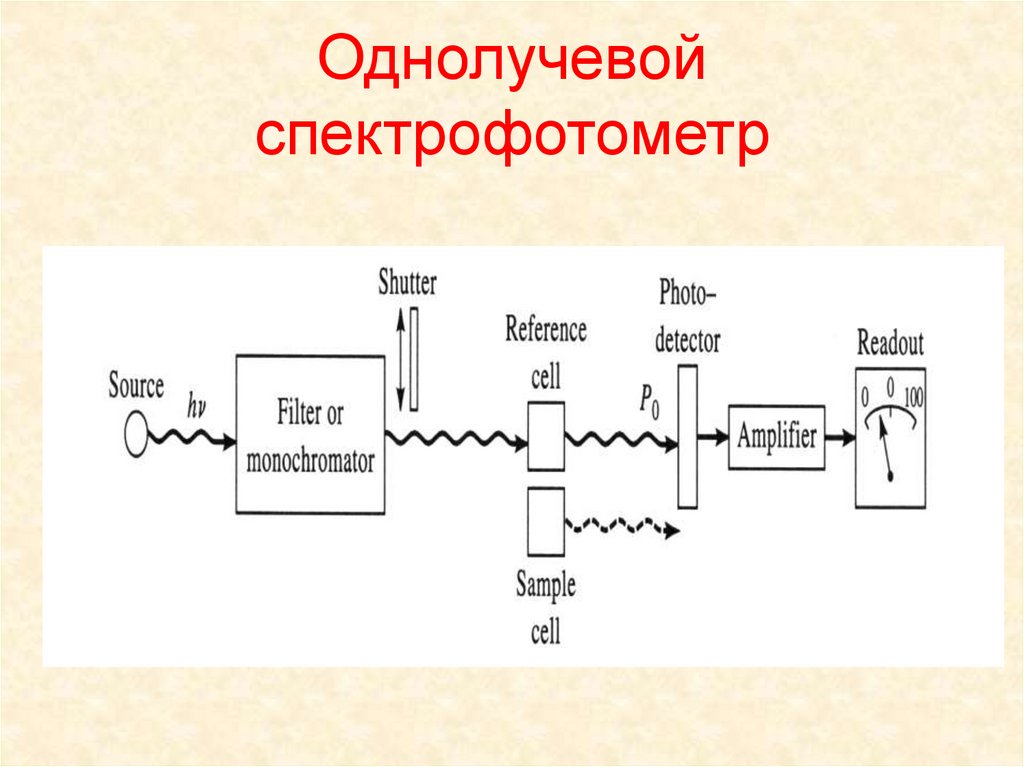
Однолучевой спектрофотометр
1. Однолучевой спектрофотометр
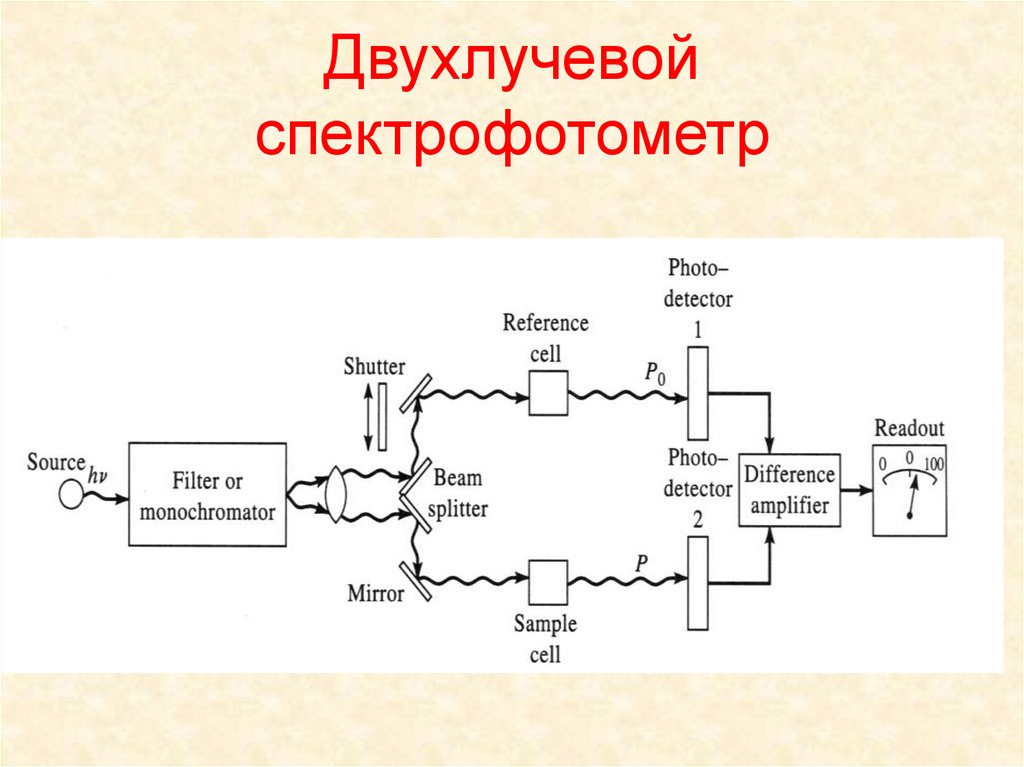
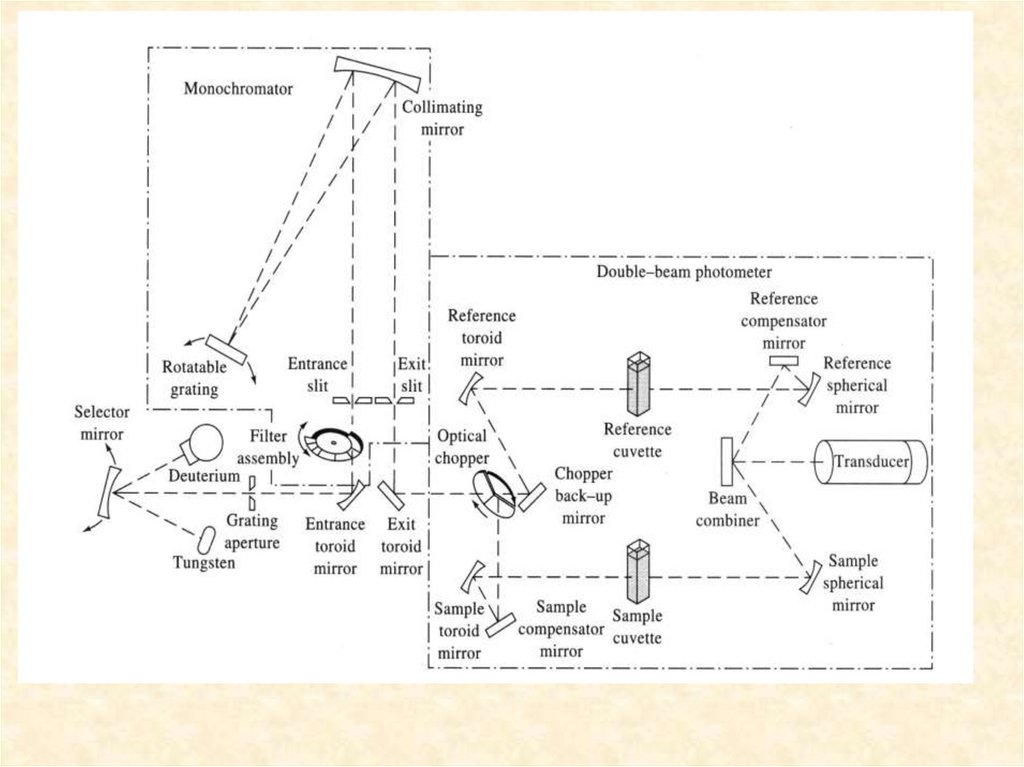
2. Двухлучевой спектрофотометр
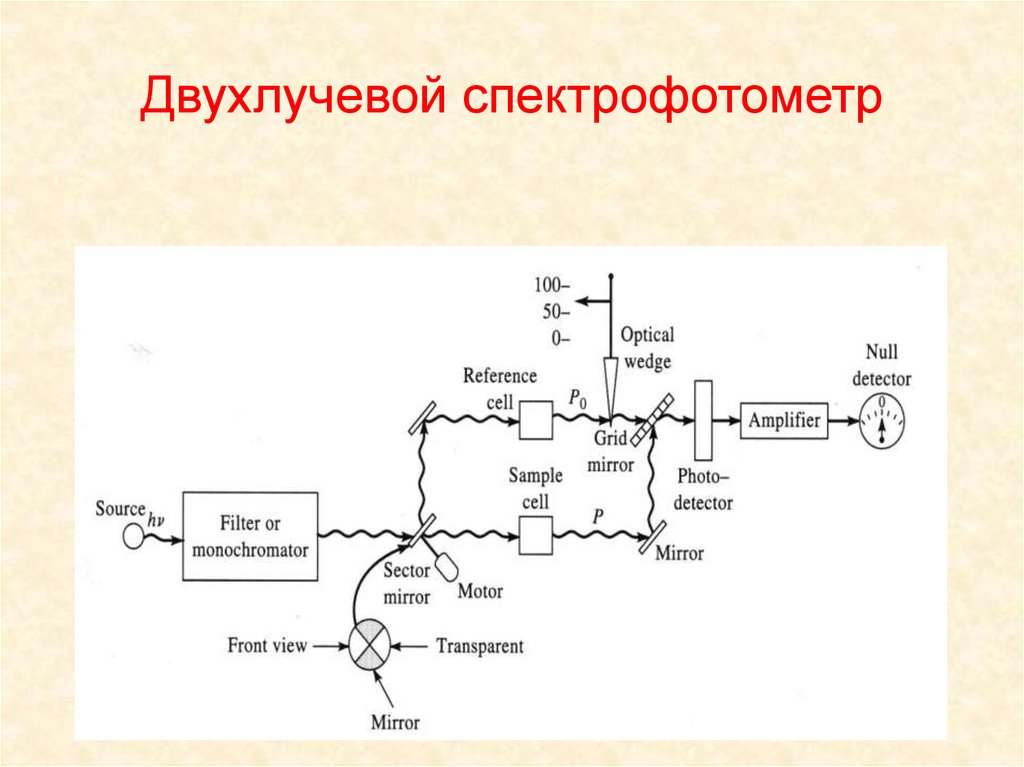
3. Двухлучевой спектрофотометр
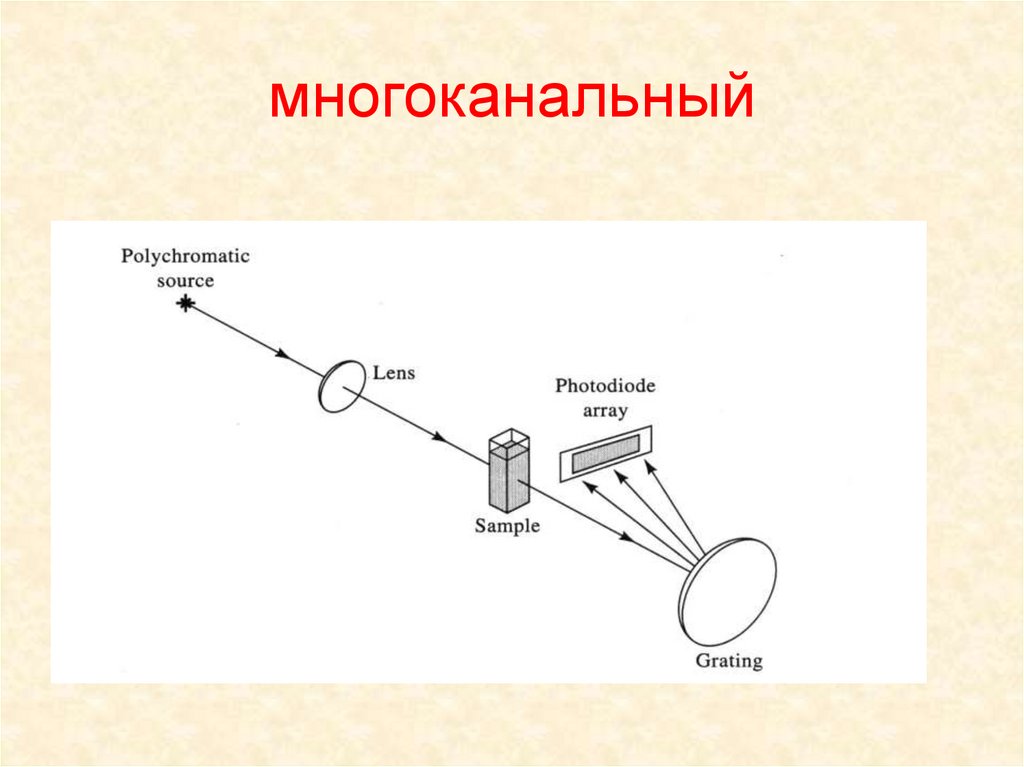
4. многоканальный
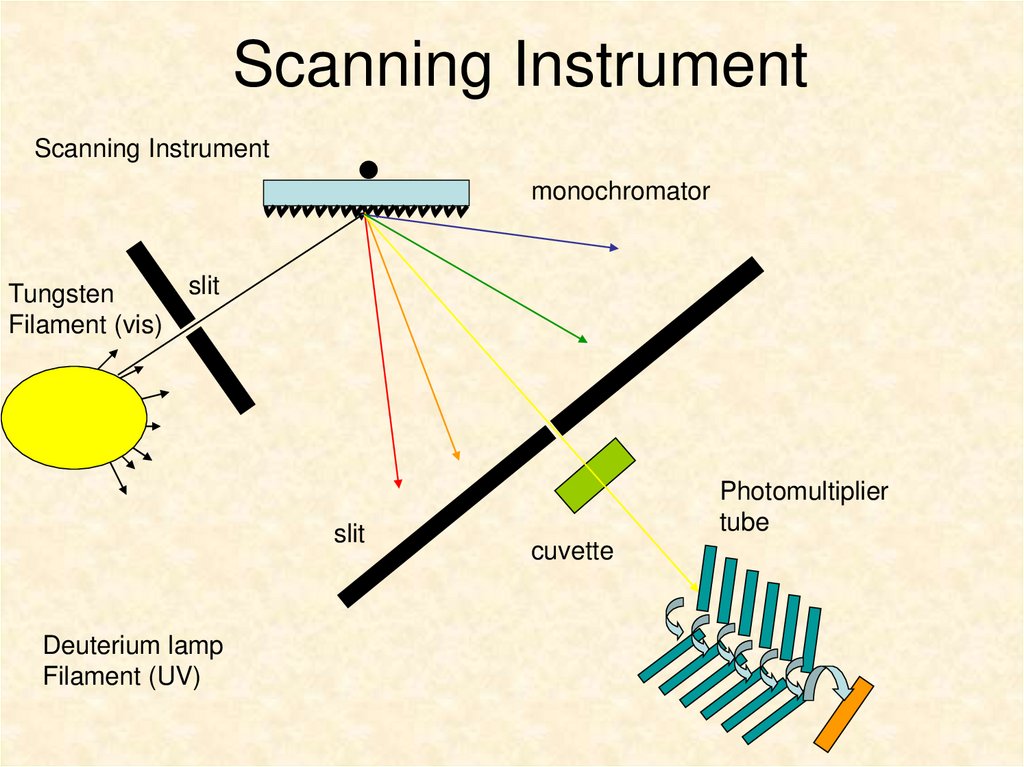
5. Scanning Instrument
Scanning Instrumentmonochromator
Tungsten
Filament (vis)
slit
slit
Deuterium lamp
Filament (UV)
Photomultiplier
tube
cuvette
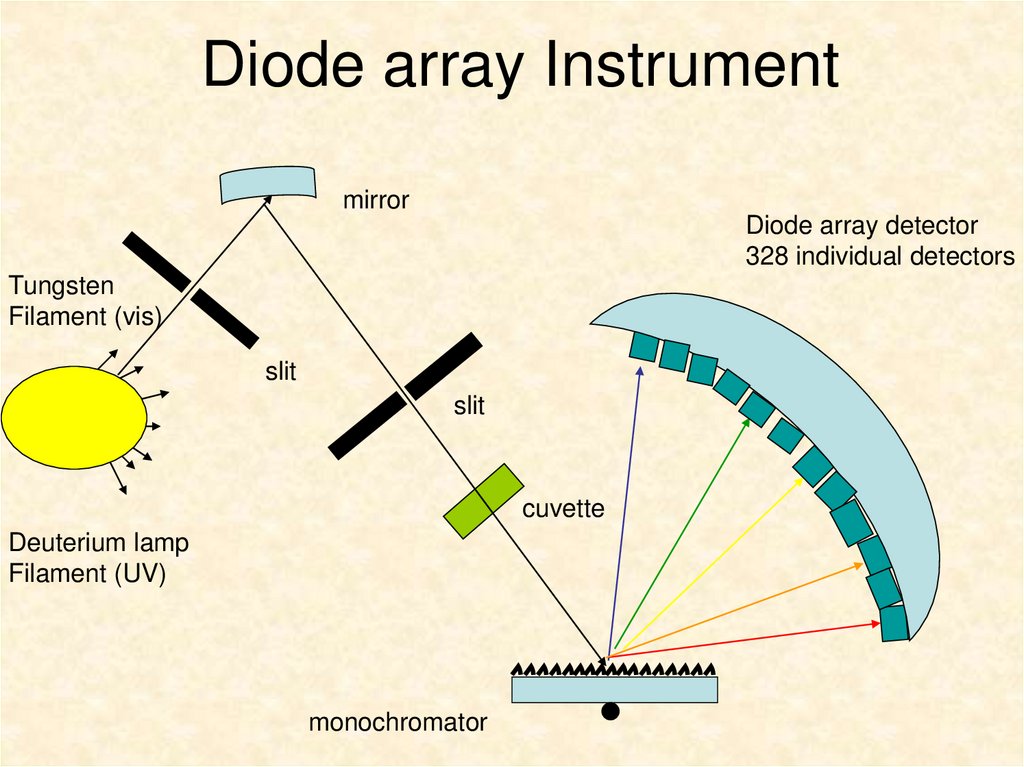
6. Diode array Instrument
mirrorDiode array detector
328 individual detectors
Tungsten
Filament (vis)
slit
slit
cuvette
Deuterium lamp
Filament (UV)
monochromator
7. Дейтеревая лампа
8.
9.
10.
11.
12.
13.
14.
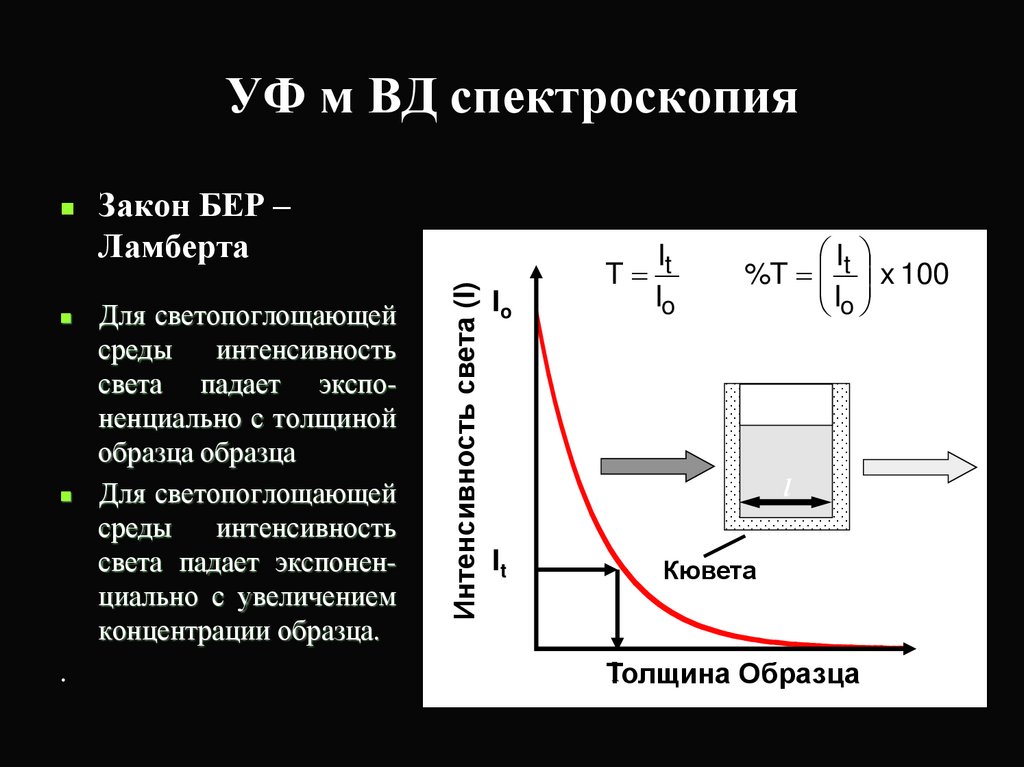
15. УФ м ВД спектроскопия
.Закон БЕР –
Ламберта
Для светопоглощающей
среды
интенсивность
света падает экспоненциально с толщиной
образца образца
Для светопоглощающей
среды
интенсивность
света падает экспоненциально с увеличением
концентрации образца.
Интенсивность света (I)
Io
It
T
Io
It
%T x 100
Io
Io
It
l
It
Кювета
l
Толщина
Образца
16. УФ-ВИД спектроскопия
ПоглощениеA cl
A log 10 T
Отрицательный логарифм T
называется поглощением (A), и он
прямо пропорционален глубине
образца (называемой длиной
пути, l) и концентрации образца
(c). Уравнение называется
законом Бера-Ламберта
Концентрация
называется
молярный
коэффициент
поглощения и имеет
ед. измерения dm3
mol-1 cm-1
17.
Процедурные детали
Выбор длины волны: для достижения максимальной чувствительности,
спектрофотометрический
Измерения оптической плотности обычно проводятся на максимальной длине волны.
поглощения.
Переменные, которые влияют на абсорбцию: растворитель, pH раствора, температура,
высокие концентрации электролита и присутствие мешающих веществ.
Соотношение между поглощением и концентрацией: калибровка
стандарты должны максимально приблизить общий состав
фактические образцы и должны охватывать разумный диапазон концентраций аналита.
Стандартный метод добавления: состав калибровочных стандартов должен
Примерный состав образцов для анализа.
18.
Метод множественных добавлений часто выбирают для фотометрического или
спектрофотометрического анализа.
Несколько порций стандартного раствора добавляются к аликвотам образцов
одинакового размера.
Каждый раствор затем разбавляют до фиксированного объема перед измерением его
оптической плотности.
Когда количество пробы ограничено, стандартные добавления могут быть выполнены
путем последовательного добавления приращений стандарта к одной измеренной
аликвоте неизвестного.
Измерения производятся на исходном растворе и после каждого добавления
стандартного аналита.
19.
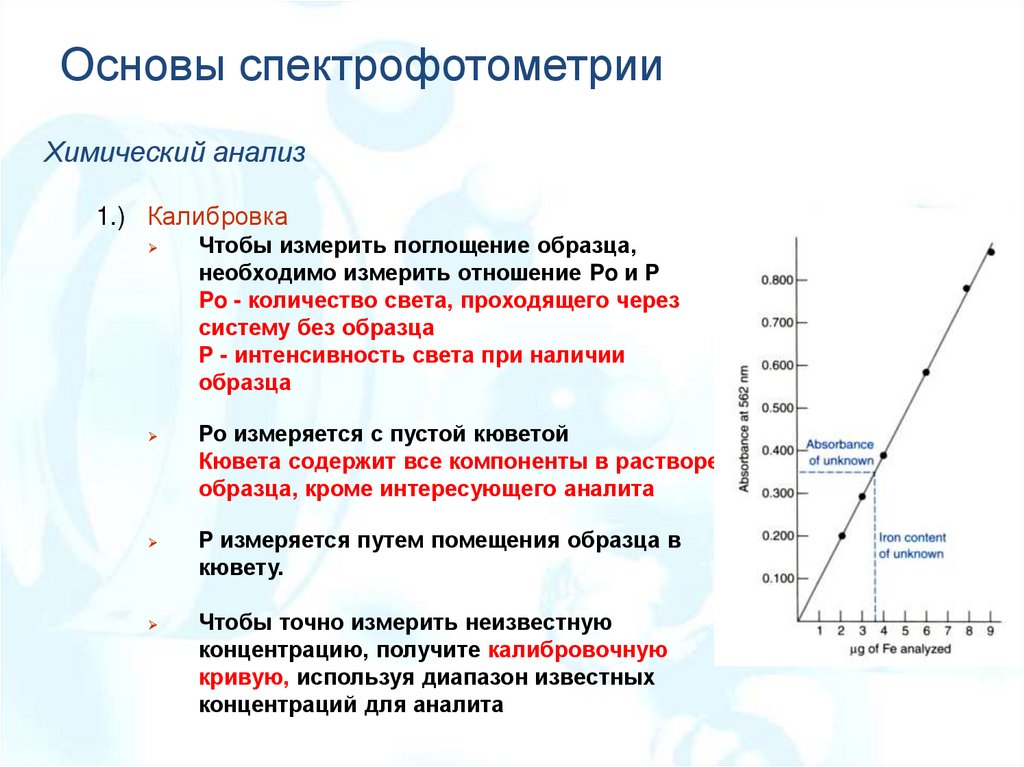
Основы спектрофотометрииХимический анализ
1.) Калибровка
Чтобы измерить поглощение образца,
необходимо измерить отношение Po и P
Po - количество света, проходящего через
систему без образца
Р - интенсивность света при наличии
образца
Ро измеряется с пустой кюветой
Кювета содержит все компоненты в растворе
образца, кроме интересующего аналита
Р измеряется путем помещения образца в
кювету.
Чтобы точно измерить неизвестную
концентрацию, получите калибровочную
кривую, используя диапазон известных
концентраций для аналита
20.
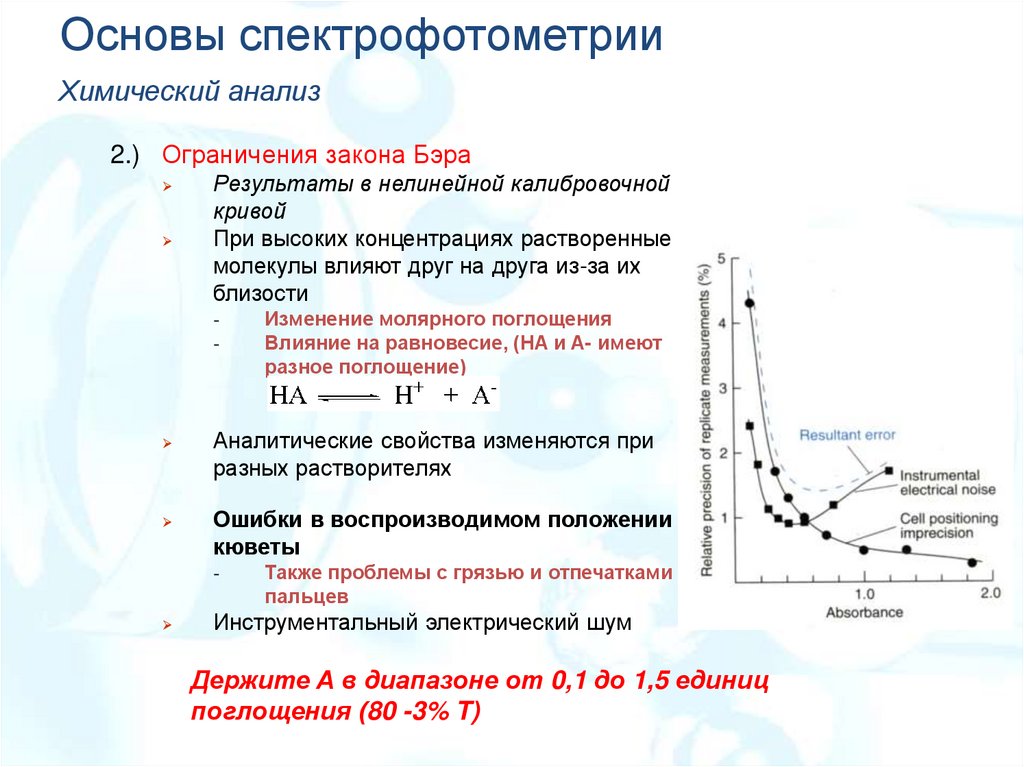
Основы спектрофотометрииХимический анализ
2.) Ограничения закона Бэра
Результаты в нелинейной калибровочной
кривой
При высоких концентрациях растворенные
молекулы влияют друг на друга из-за их
близости
-
Аналитические свойства изменяются при
разных растворителях
Ошибки в воспроизводимом положении
кюветы
-
Изменение молярного поглощения
Влияние на равновесие, (HA и A- имеют
разное поглощение)
Также проблемы с грязью и отпечатками
пальцев
Инструментальный электрический шум
Держите A в диапазоне от 0,1 до 1,5 единиц
поглощения (80 -3% T)
21.
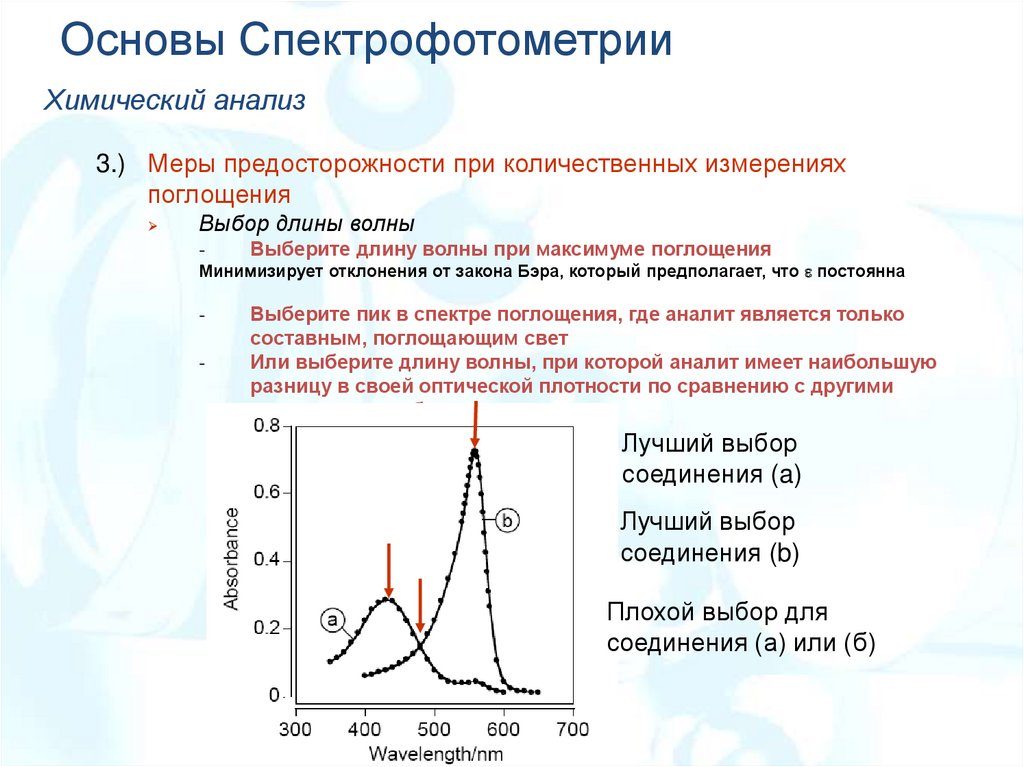
Основы СпектрофотометрииХимический анализ
3.) Меры предосторожности при количественных измерениях
поглощения
Выбор длины волны
-
Выберите длину волны при максимуме поглощения
-
Выберите пик в спектре поглощения, где аналит является только
составным, поглощающим свет
Или выберите длину волны, при которой аналит имеет наибольшую
разницу в своей оптической плотности по сравнению с другими
компонентами образца.
Минимизирует отклонения от закона Бэра, который предполагает, что постоянна
-
Лучший выбор
соединения (a)
Лучший выбор
соединения (b)
Плохой выбор для
соединения (а) или (б)
22.
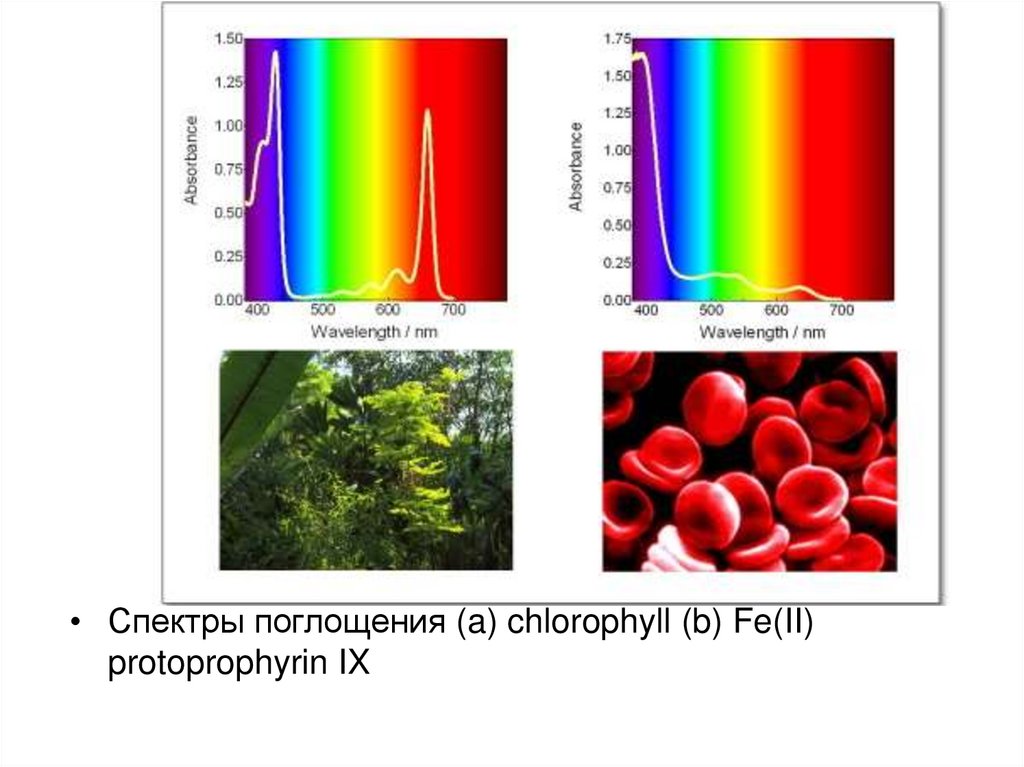
• Спектры поглощения (a) chlorophyll (b) Fe(II)protoprophyrin IX
23.
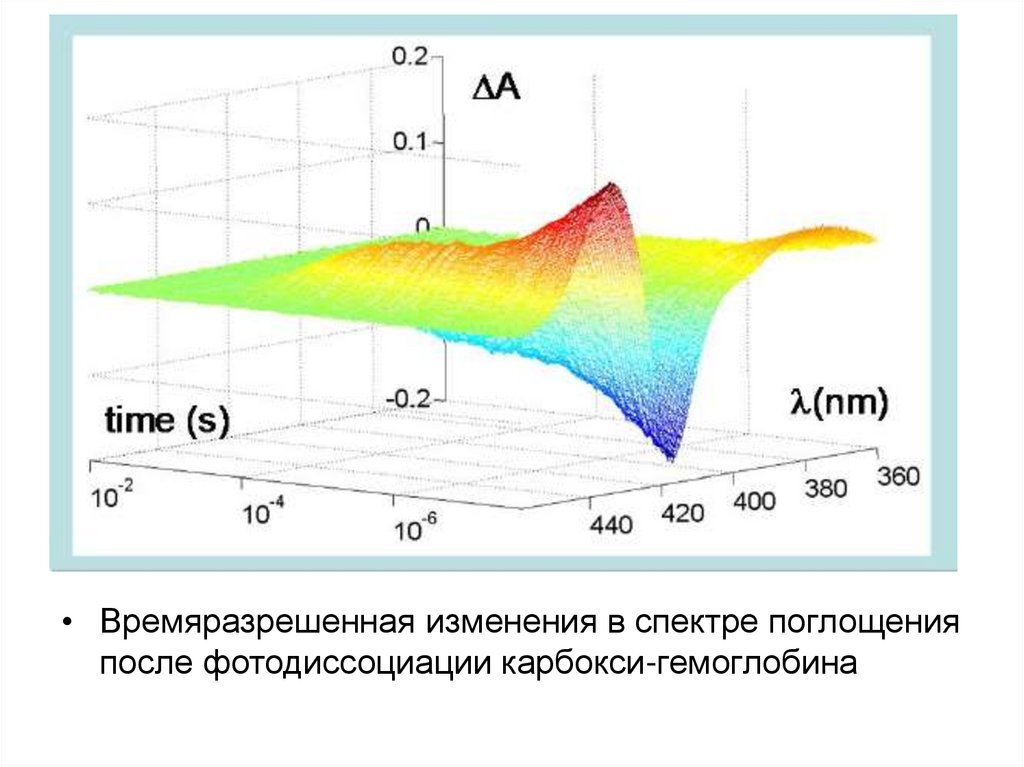
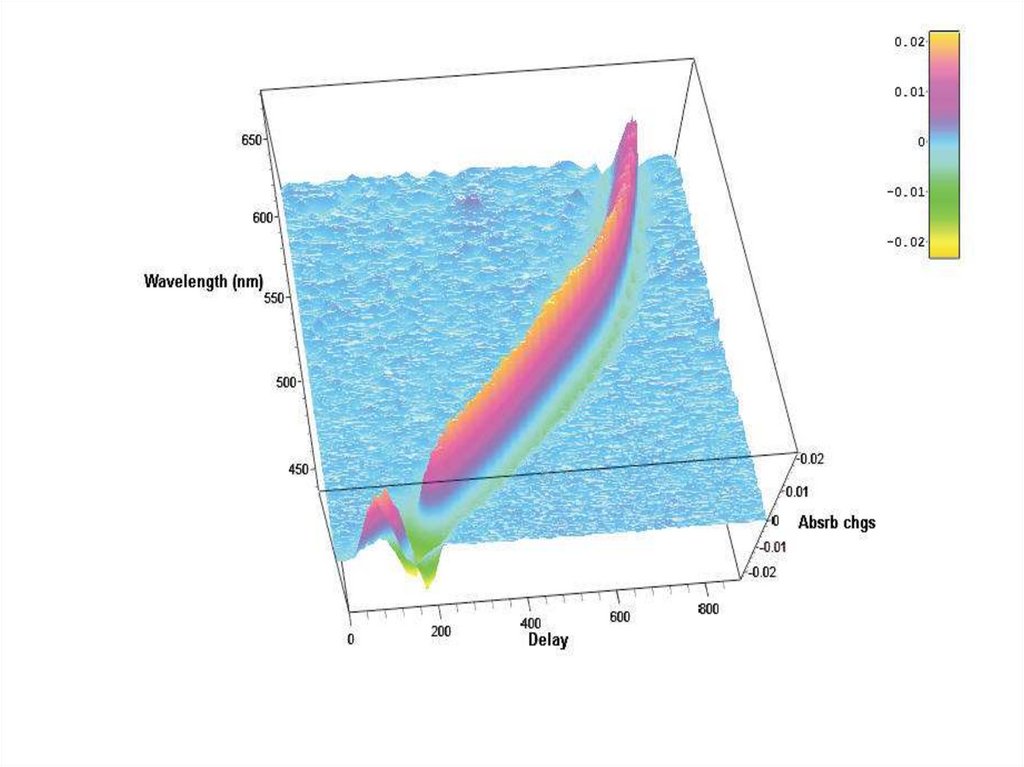
• Времяразрешенная изменения в спектре поглощенияпосле фотодиссоциации карбокси-гемоглобина
24.
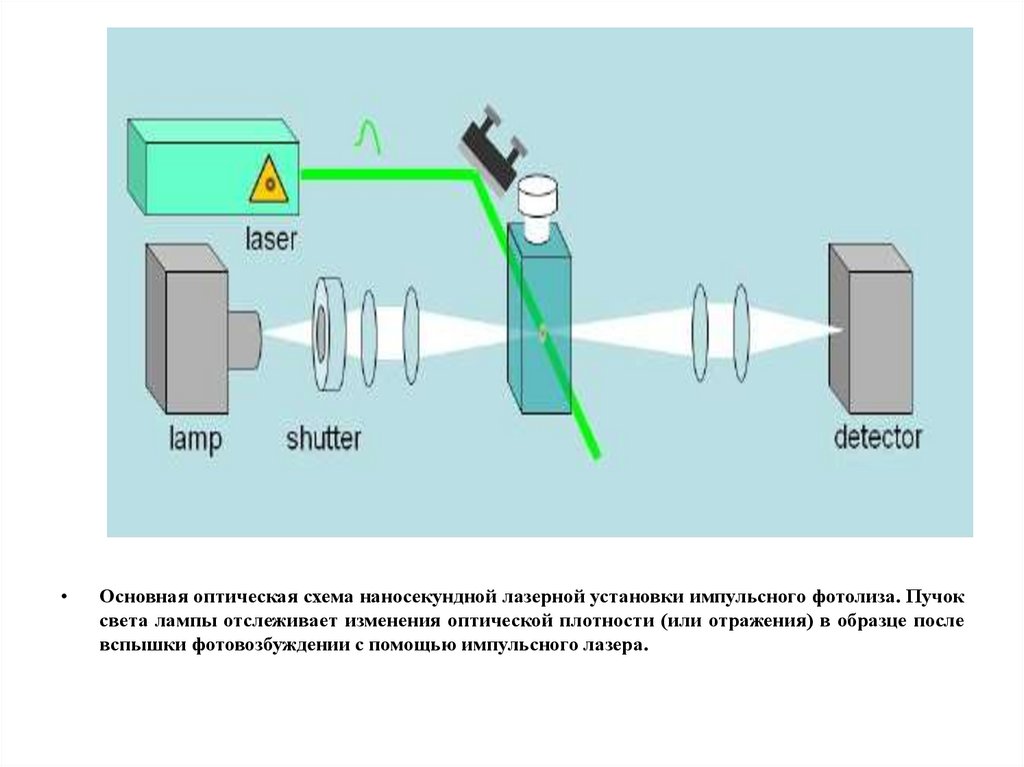
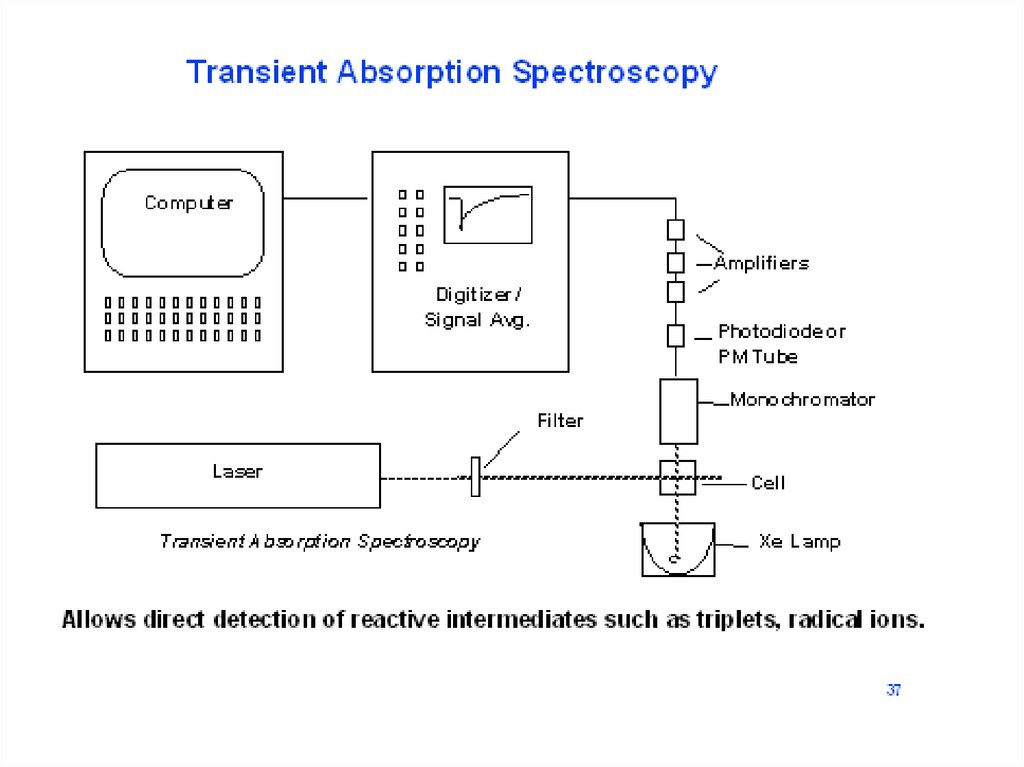
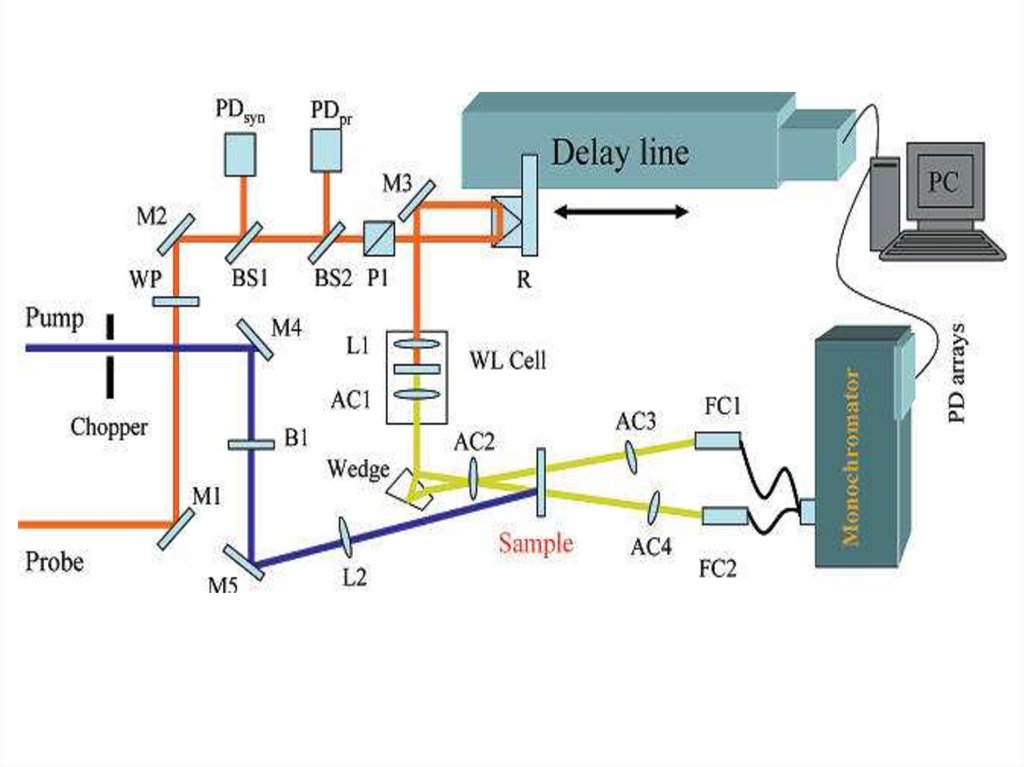
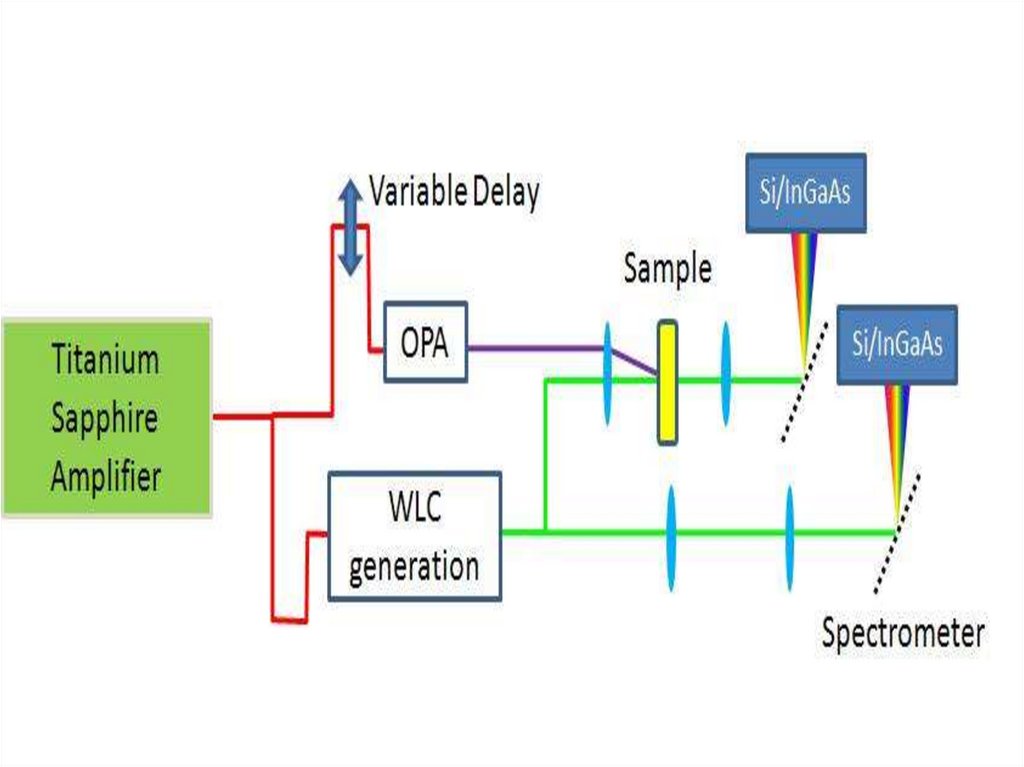
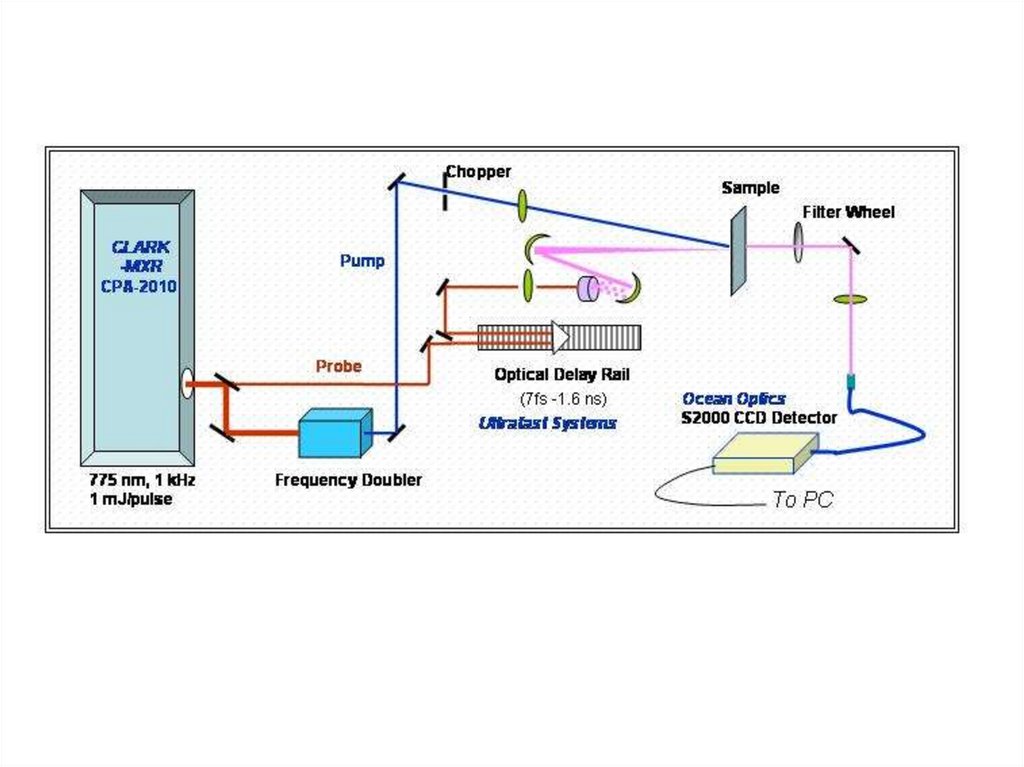
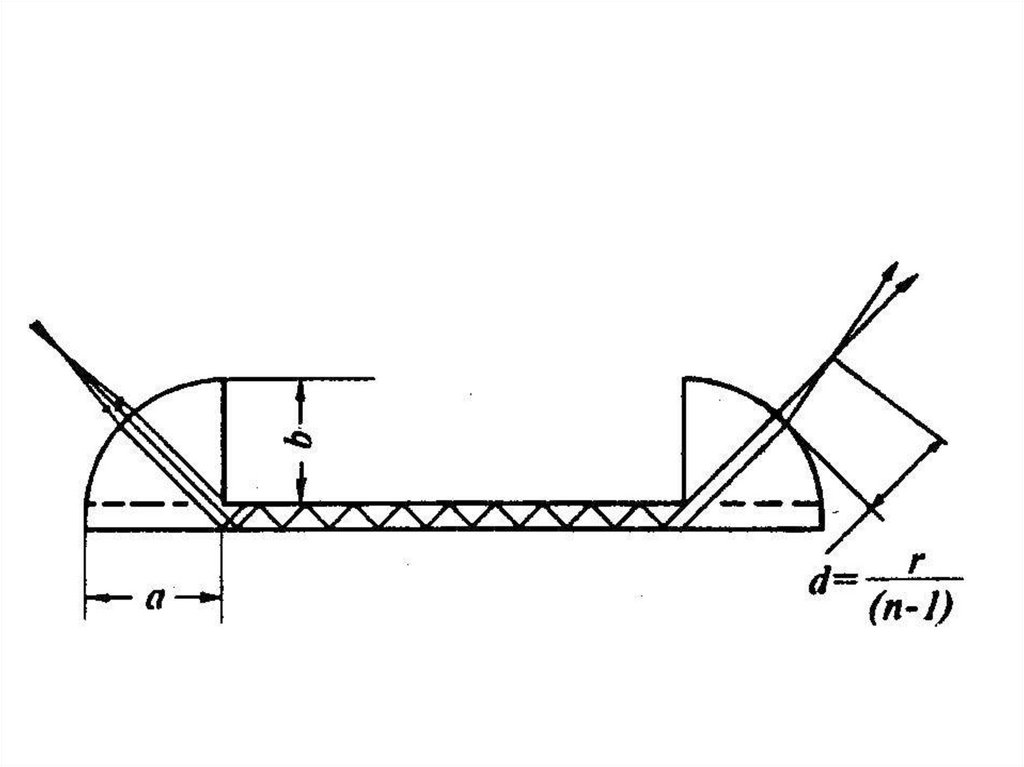
Основная оптическая схема наносекундной лазерной установки импульсного фотолиза. Пучок
света лампы отслеживает изменения оптической плотности (или отражения) в образце после
вспышки фотовозбуждении с помощью импульсного лазера.
25.
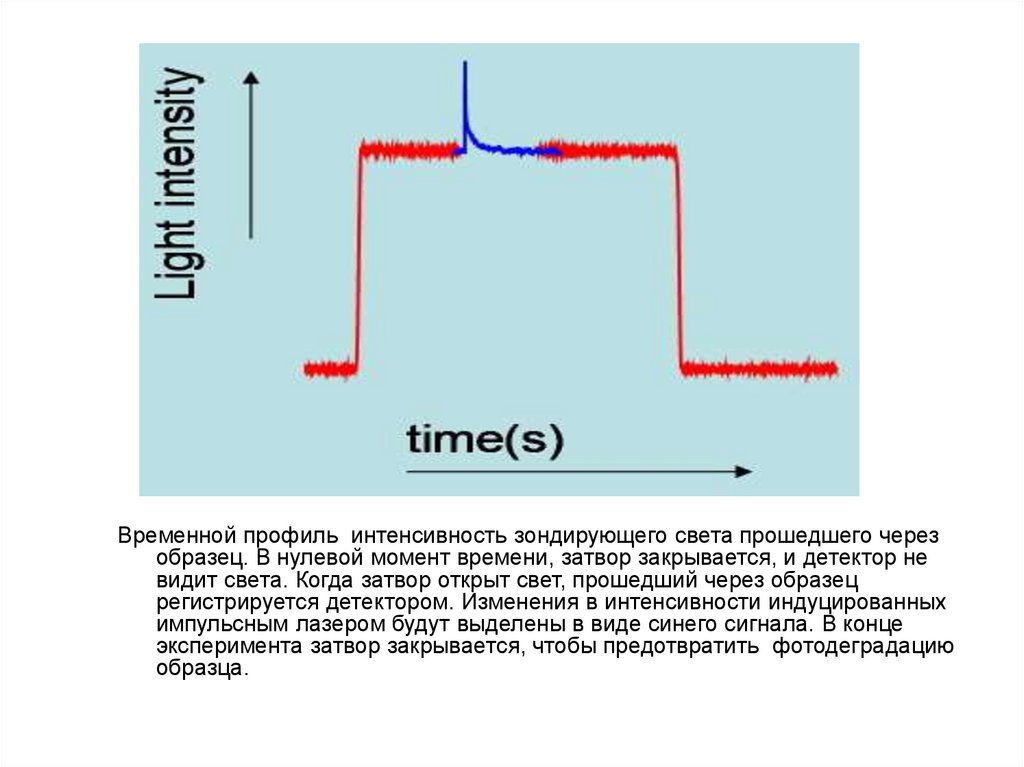
Временной профиль интенсивность зондирующего света прошедшего черезобразец. В нулевой момент времени, затвор закрывается, и детектор не
видит света. Когда затвор открыт свет, прошедший через образец
регистрируется детектором. Изменения в интенсивности индуцированных
импульсным лазером будут выделены в виде синего сигнала. В конце
эксперимента затвор закрывается, чтобы предотвратить фотодеградацию
образца.
26.
27.
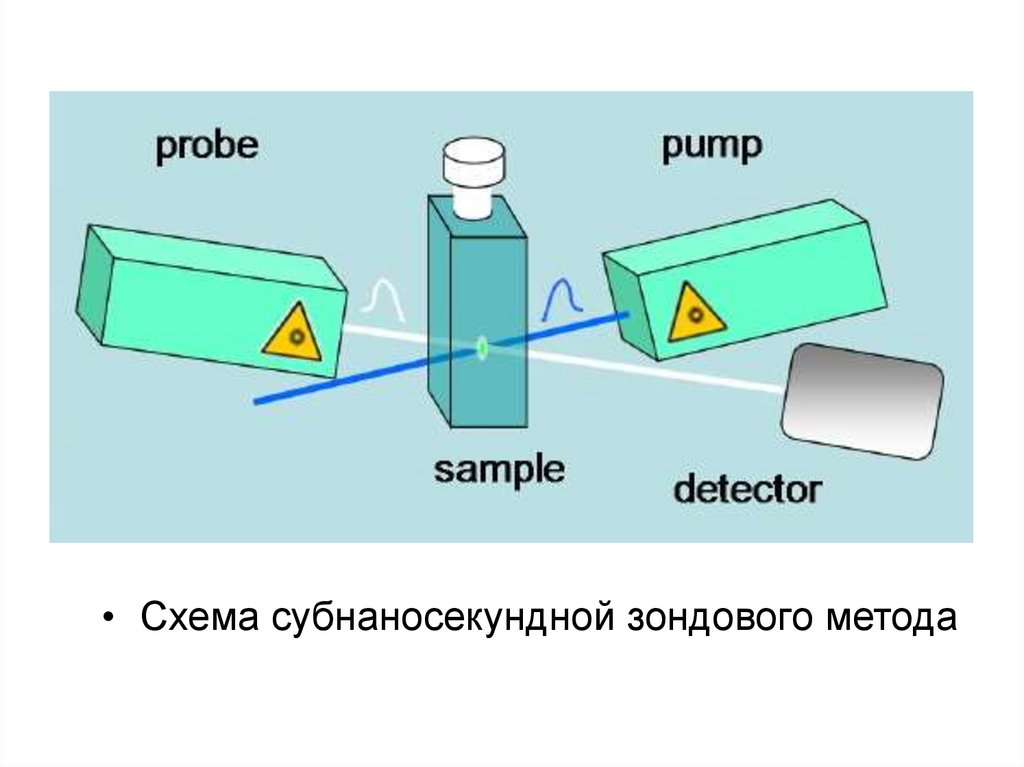
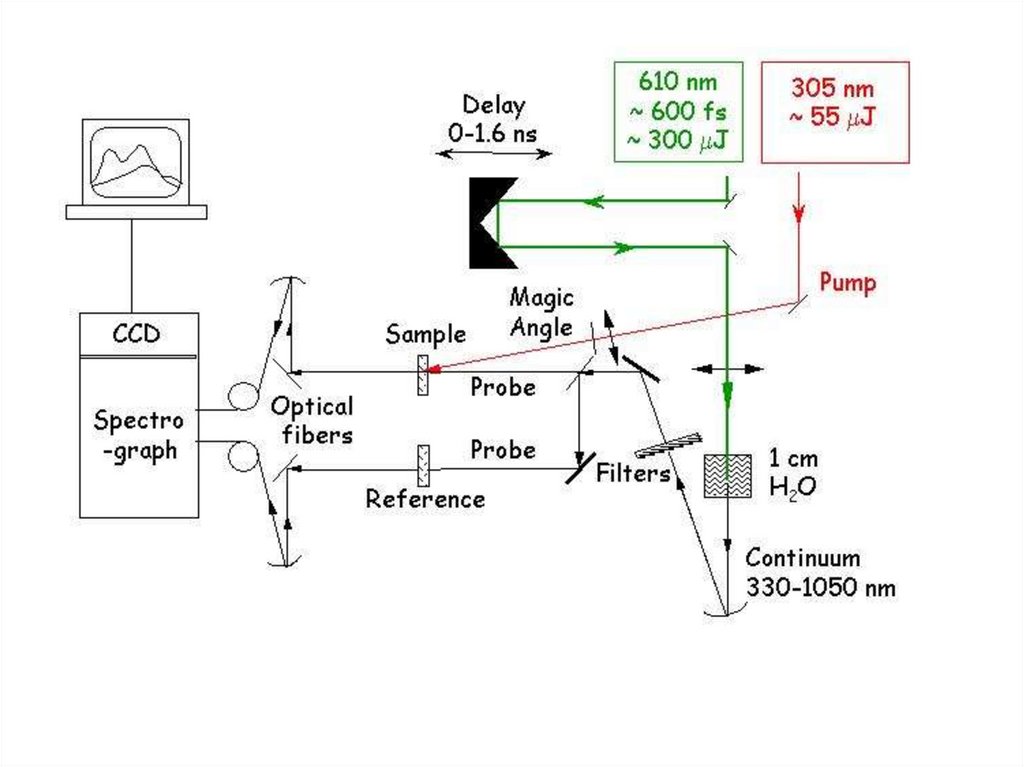
• Схема субнаносекундной зондового метода28.
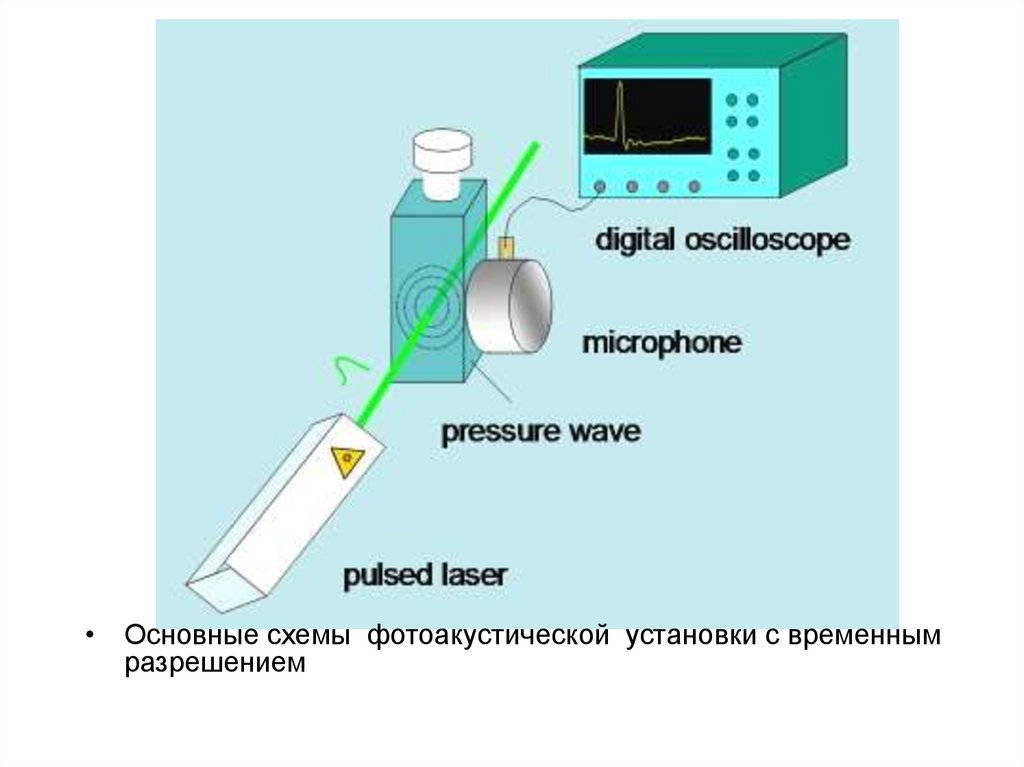
• Фотоакустическая спектроскопия с временным разрешениемФиксирует изменение давления изменения, вызванные в образце
после безызлучательной релаксации после возбуждения
(обычно) наносекундного импульсного лазера. Импульс
давления как правило, имеет два источника, оба ведущие к
изменению объема раствора, и связанные с безызлучательной
релаксации возбужденного состояния. Первый источник
тепловой
релаксации,,
сопровождающей
релаксацию
возбужденного состояния и реакции промежуточных продуктов.
Второй источник связан с изменением объема, обусловленным
структурными перестройками.
29.
• Основные схемы фотоакустической установки с временнымразрешением
30.
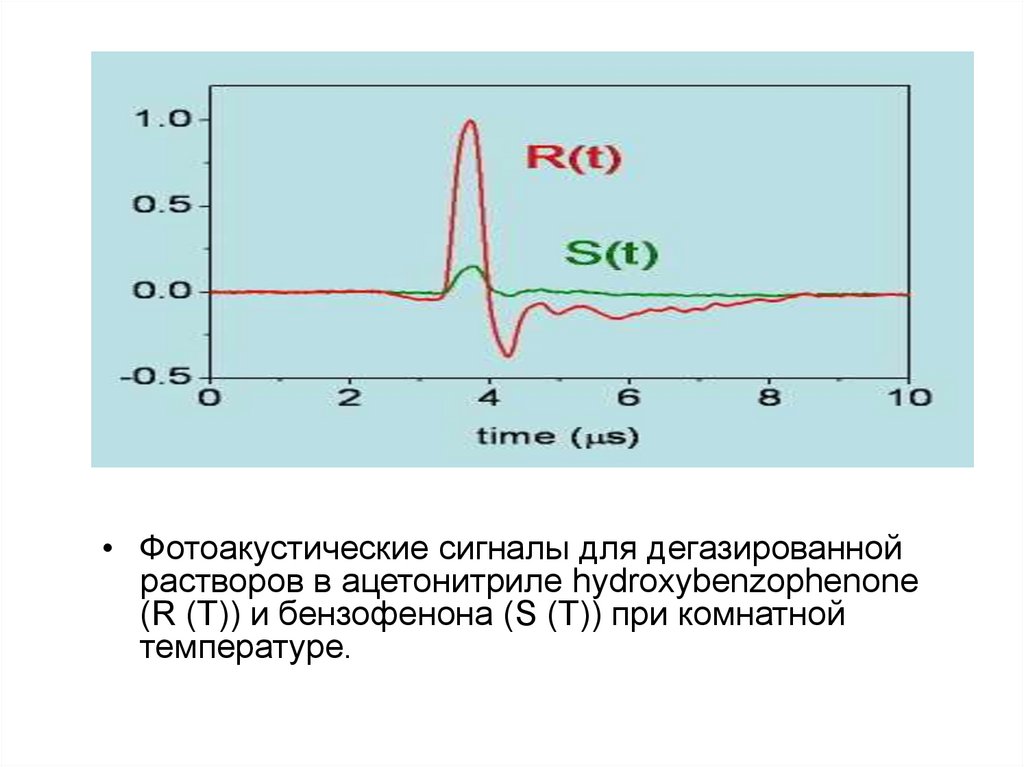
• Фотоакустические сигналы для дегазированнойрастворов в ацетонитриле hydroxybenzophenone
(R (T)) и бензофенона (S (T)) при комнатной
температуре.
31.
• Фоторефрактивные методыФототермическая линза, отклонения луча, и
решетка
–
это
методы
обнаружения
изменения показателя преломления при
изменении плотности (в связи с изменением
объема или
структурны), поглощения и
температуры. Когда образец возбуждается
лучом света, который обычно имеет гауссову
форму, концентрация возбужденных молекул
изменяется
в
результате
изменяется
геометрия пучка накачки.
32.
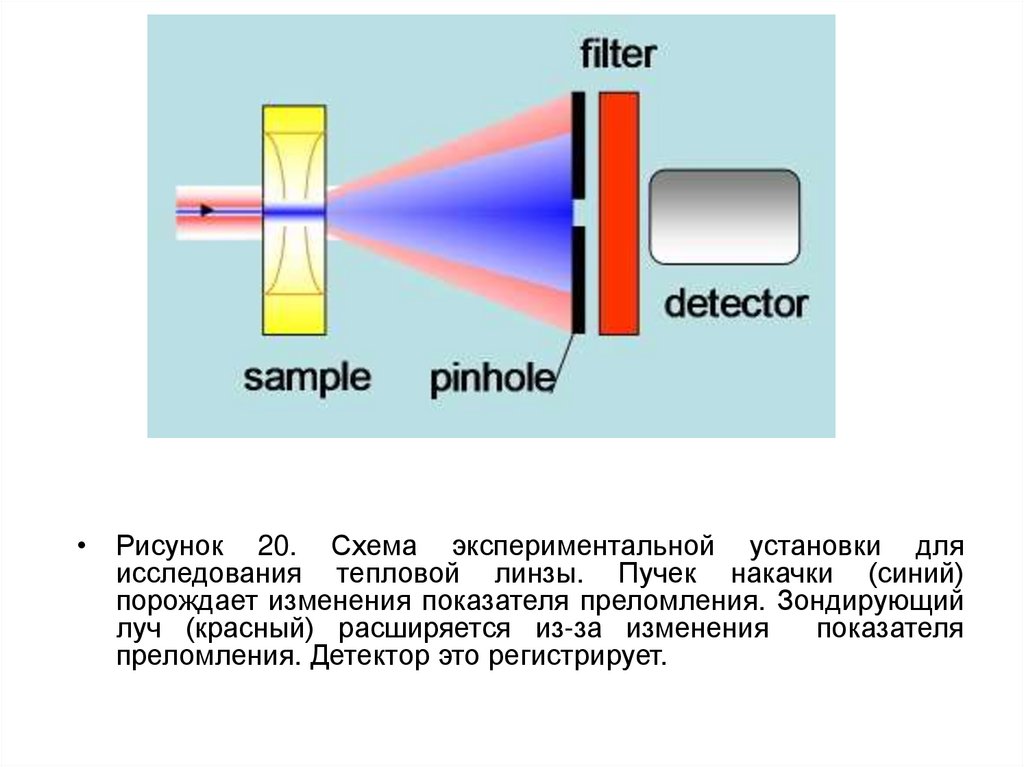
• Рисунок 20. Схема экспериментальной установки дляисследования тепловой линзы. Пучек накачки (синий)
порождает изменения показателя преломления. Зондирующий
луч (красный) расширяется из-за изменения
показателя
преломления. Детектор это регистрирует.
33.
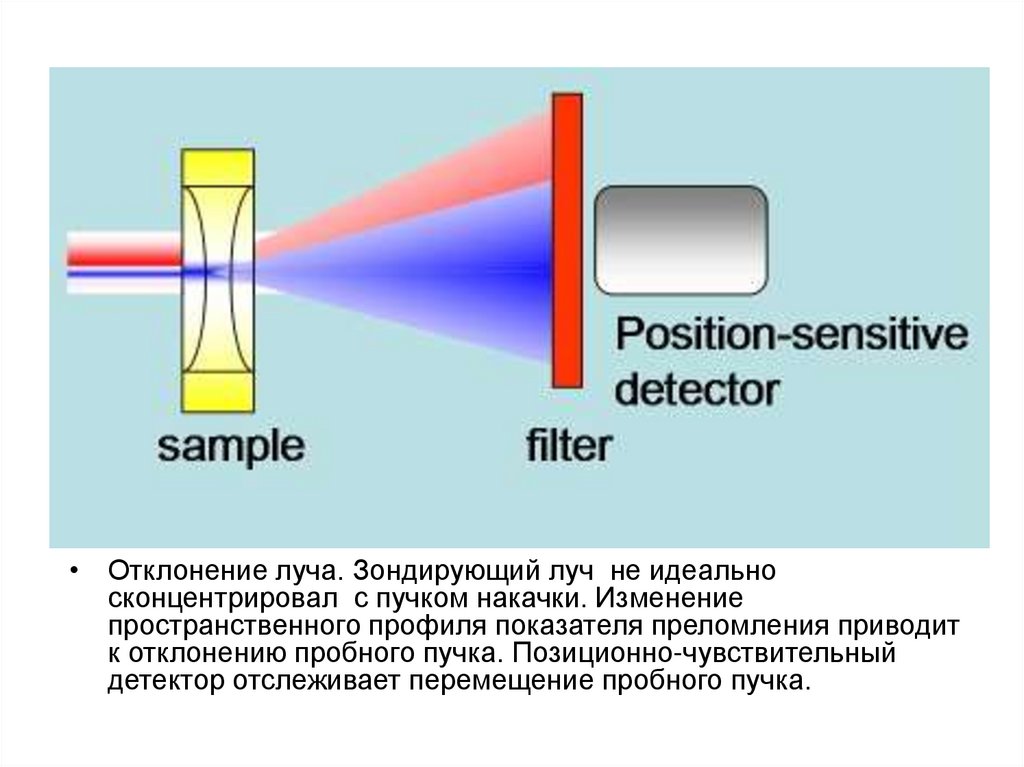
• Отклонение луча. Зондирующий луч не идеальносконцентрировал с пучком накачки. Изменение
пространственного профиля показателя преломления приводит
к отклонению пробного пучка. Позиционно-чувствительный
детектор отслеживает перемещение пробного пучка.
34.
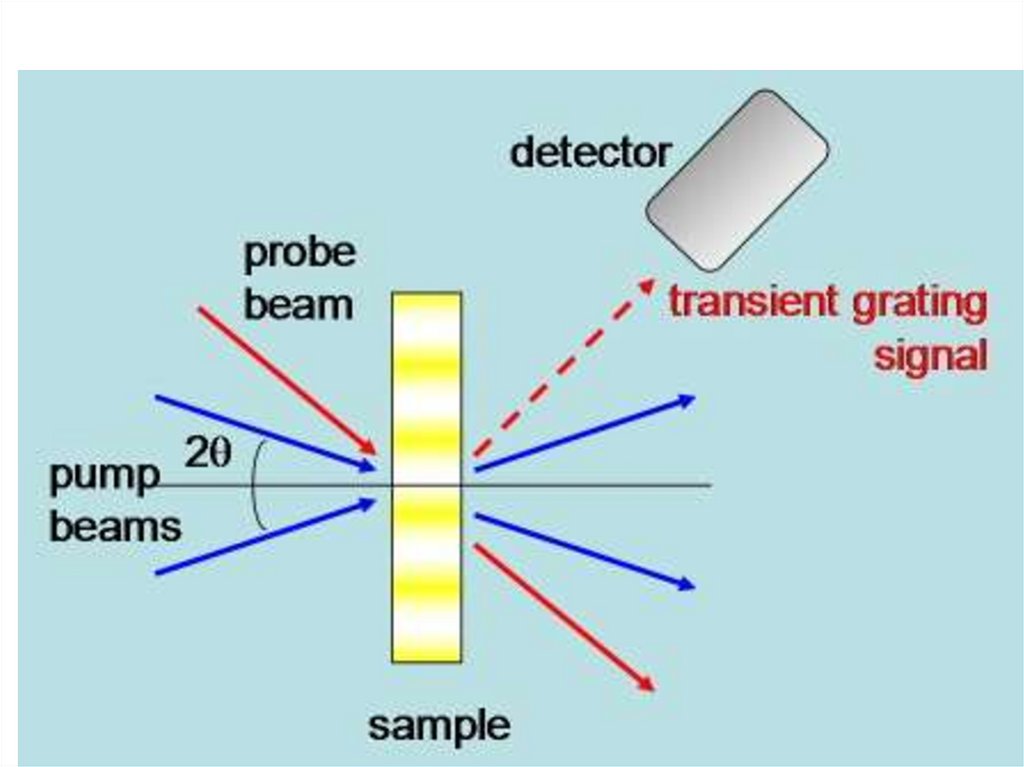
• Пропускающая решетка . Двалазерных
пучков с параллельной поляризацией падают
на образец под углом - интерференционная
картина - модуляция интенсивности .
Изменения
показателя
преломления,
происходящих
из
фотоиндуцированных
процессов отражает эту модуляцию, и могут
быть измерены с помощью
третьего
лазерного
луча,
который
испытывает
дифракцию на этой решетке. Динамическая
голография.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
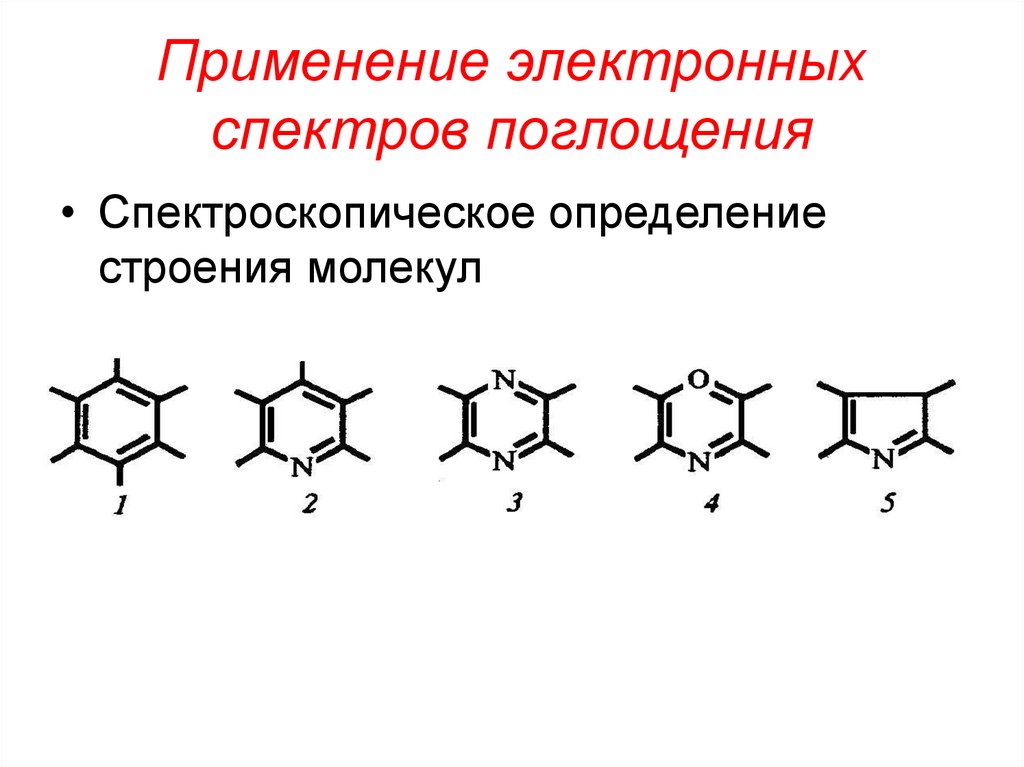
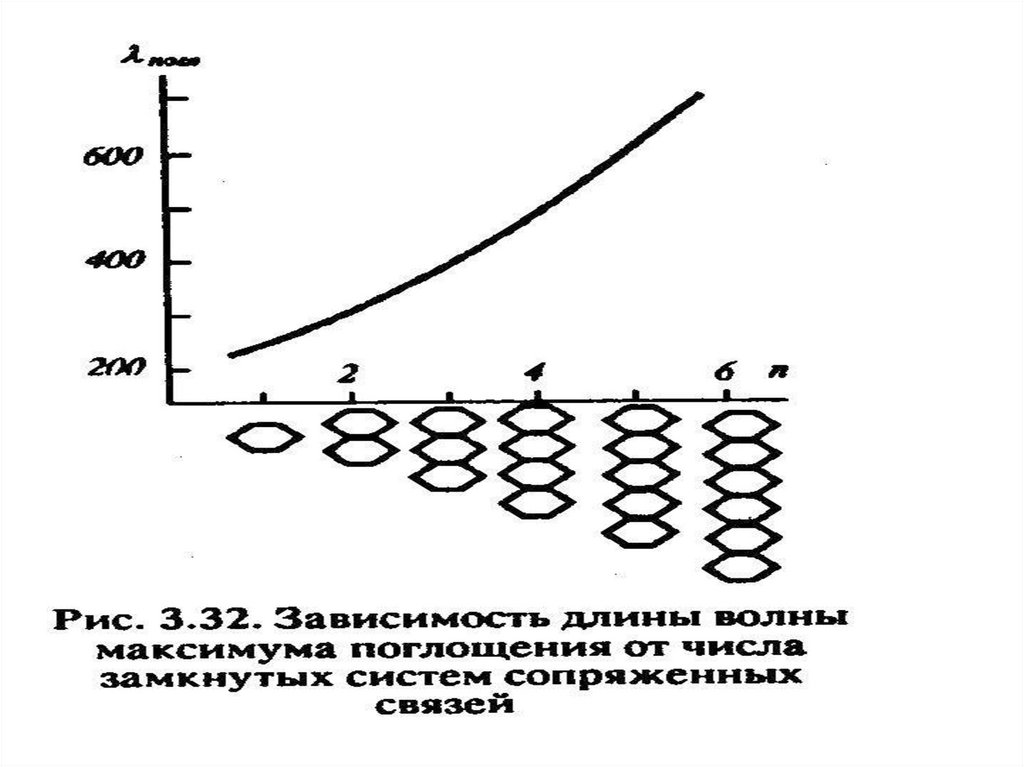
46. Применение электронных спектров поглощения
• Спектроскопическое определениестроения молекул
47.
48.
49.
50.
51.
52. Качественный и количественный анализ
53.
54.
55.
56.
57.
58. Проявление межмолекулярных взаимодействий в электронных спектрах поглощения
59.
Поляризуемость и взаимодействияВан-дер-Ваальса:
Почему нейтральные молекулы притягиваются
друг для друга?
60. Полярность молекул
• Межмолекулярная сила находится из F = - dw/dr• Все потенциалы взаимодействия (и силы) между молекулами
имеют электростатическое происхождение..
• Нейтральная молекула является полярной, когда ее
распределение электронного заряда не симметрично
относительно ее ядерного (+ ve заряженного) центра..
• В неполярной молекуле центр электронного (-ve) заряда не
совпадает с центром ядерного (+ ve) заряда.
_
+
_
+
61.
Дипольные моментыПолярность молекулы описывается ее дипольным
моментом u, который задается как:
u = q
Где заряды +q и -q
разделены расстоянием
Обычно q - это заряд электрона: 1,602 x 10-19 Кл, а
величина порядка 1Å = 10-10 м, что дает u = 1,602 x
10-29 См.
«Удобная» (и условная) единица измерения
полярности называется Дебая (D)::
+
1 D = 3.336 x 10-30 Cm
-
62.
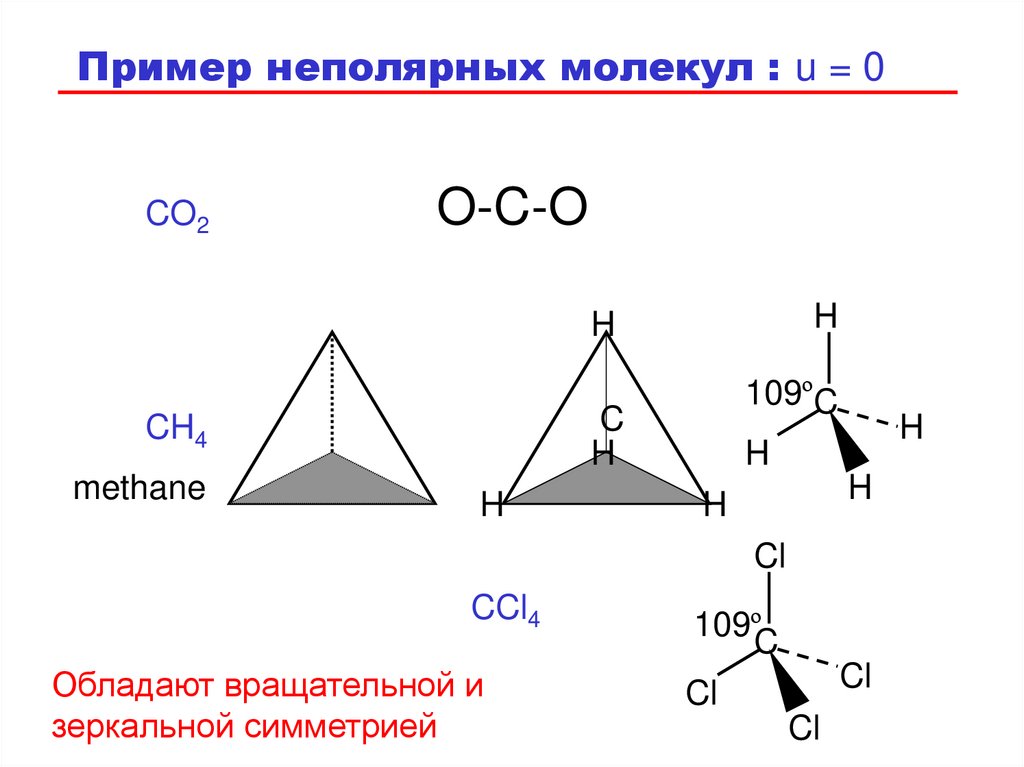
Пример неполярных молекул : u = 0CO2
O-C-O
H
H
C
H
CH4
methane
109ºC
H
H
H
H
H
Cl
CCl4
Обладают вращательной и
зеркальной симметрией
109ºC
Cl
Cl
Cl
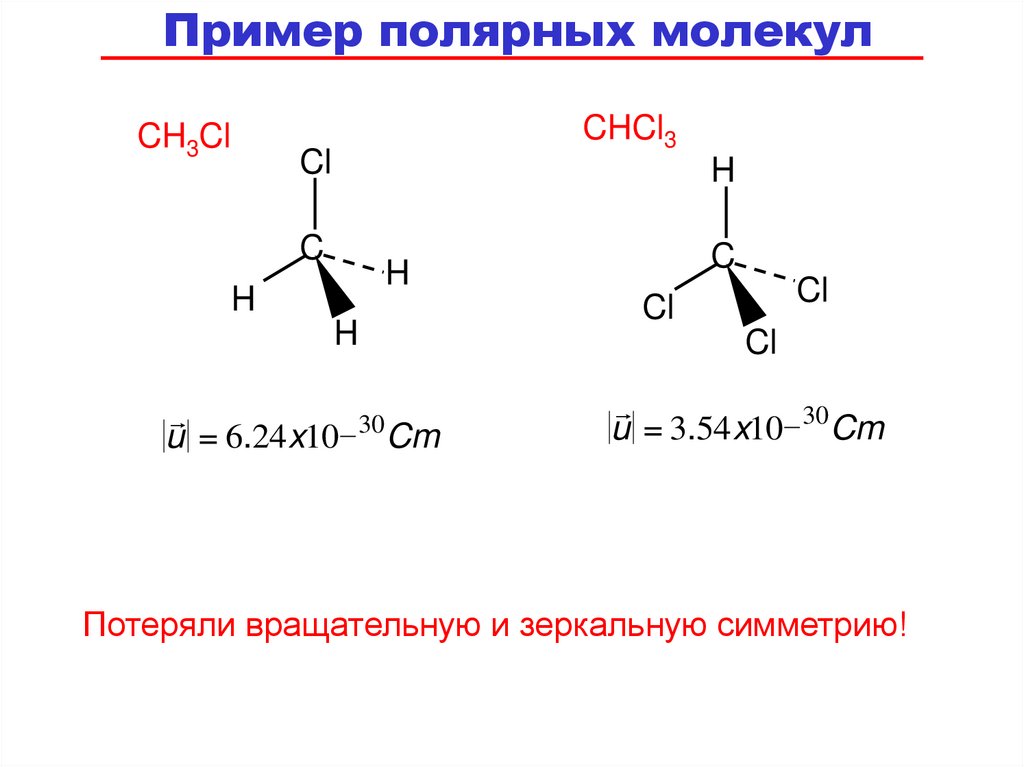
63.
Пример полярных молекулCH3Cl
CHCl3
Cl
H
C
C
H
H
H
u = 6.24 x10 _ 30 Cm
Cl
Cl
Cl
u = 3.54 x10 _ 30 Cm
Потеряли вращательную и зеркальную симметрию!
64.
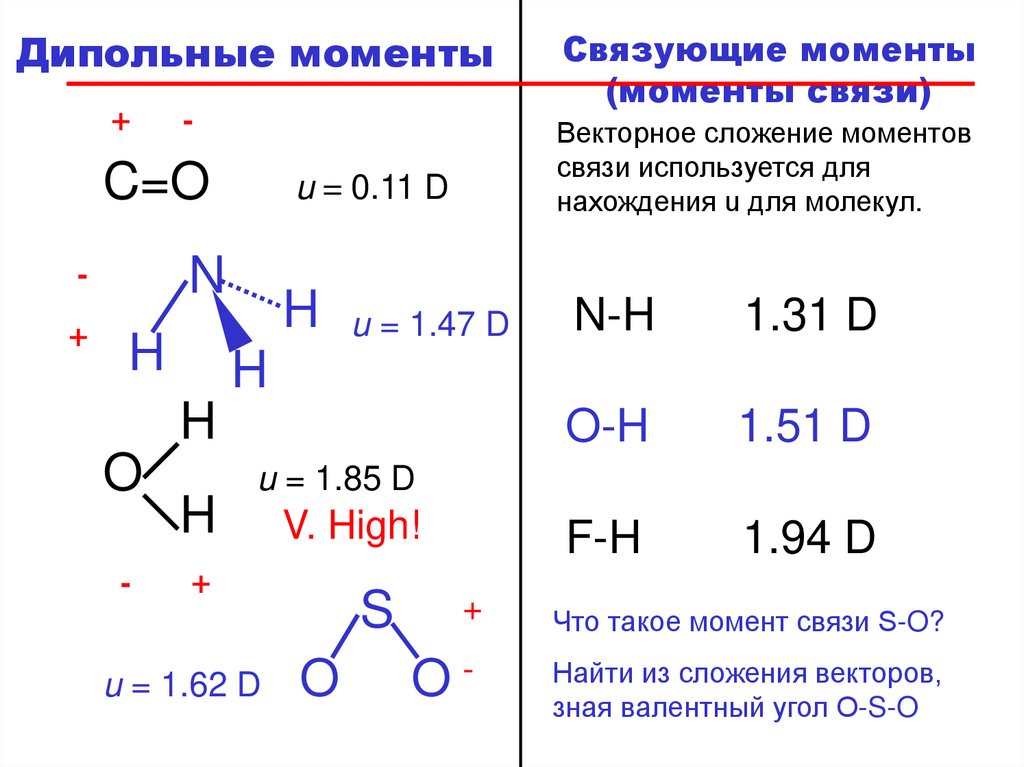
Дипольные моменты+
-
C=O
+
H
Векторное сложение моментов
связи используется для
нахождения u для молекул.
u = 0.11 D
N
-
H
u = 1.47 D
-
N-H
1.31 D
O-H
1.51 D
F-H
1.94 D
H
H
O
Связующие моменты
(моменты связи)
H
u = 1.85 D
V. High!
+
u = 1.62 D
S
O
+
O-
Что такое момент связи S-O?
Найти из сложения векторов,
зная валентный угол O-S-O
65.
Векторное сложение моментов связиУчитывая, что валентный угол H-O-H составляет 104,5
° и что момент связи OH равен 1,51 D, каков
дипольный момент воды?
O
1.51 D
q/2
H
H
uH2O = 2 cos(q/2)uOH = 2 cos (52.25 °) x 1.51 D = 1.85 D
Момент связи и момент молекулы совпадают для двухатомной
молекулы
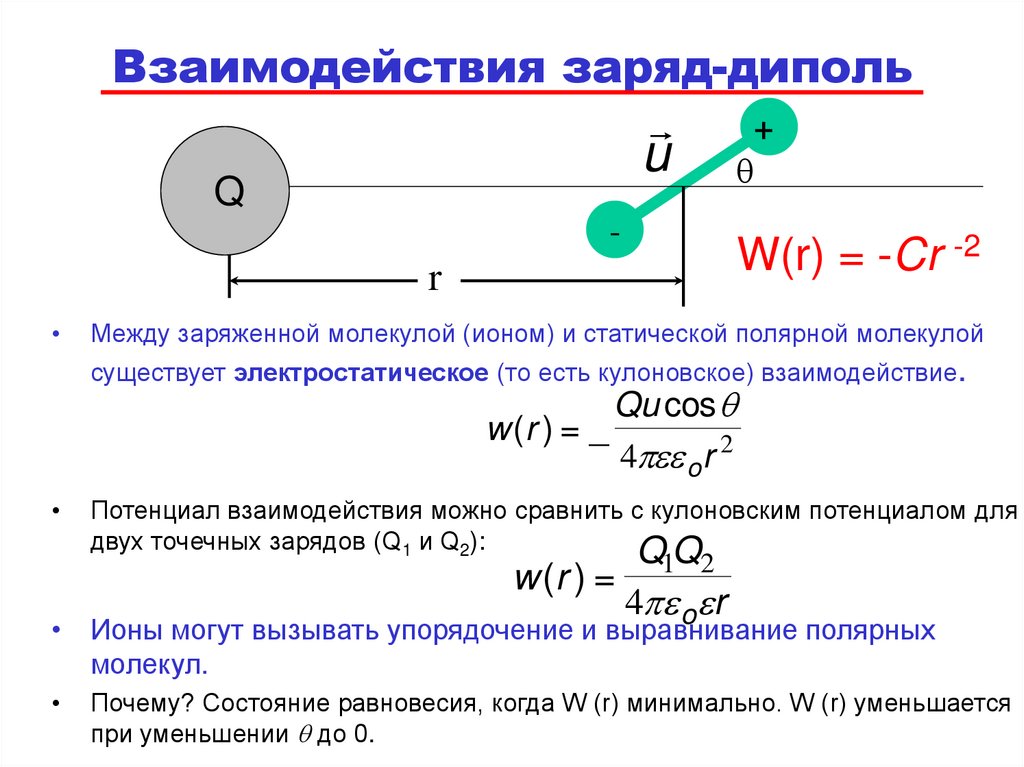
66. Взаимодействия заряд-диполь
uQ
-
r
+
q
W(r) = -Cr -2
Между заряженной молекулой (ионом) и статической полярной молекулой
существует электростатическое (то есть кулоновское) взаимодействие.
w (r ) = _
Qu cos q
4 o r 2
Потенциал взаимодействия можно сравнить с кулоновским потенциалом для
двух точечных зарядов (Q1 и Q2):
Q1Q2
w (r ) =
4 o r
• Ионы могут вызывать упорядочение и выравнивание полярных
молекул.
Почему? Состояние равновесия, когда W (r) минимально. W (r) уменьшается
при уменьшении q до 0.
67. Диполь-дипольные взаимодействия
u1-
+
+
q1
-
u2
q2
• Есть кулоновские взаимодействия между + ve и ve зарядами, связанными с каждым диполем.
• В жидкостях тепловая энергия вызывает
непрерывное движение, то есть переворачивание
диполей относительно друг друга.
• В твердых телах диполи обычно закреплены на
решетке с определенной ориентацией, q1 и q2 .
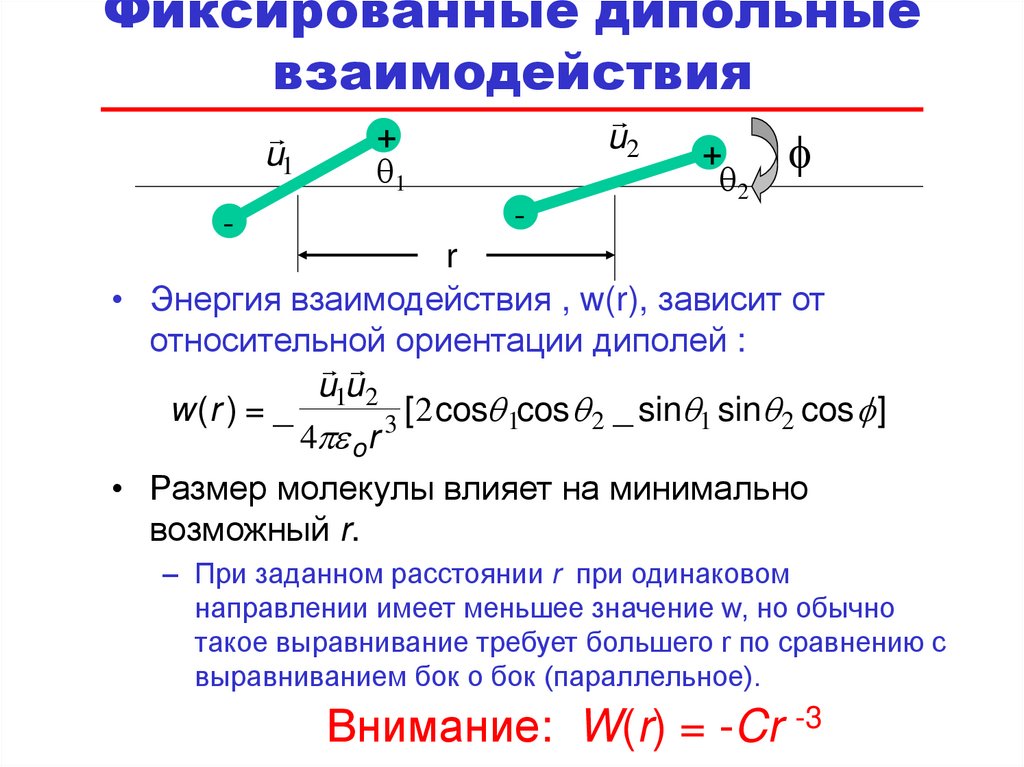
68. Фиксированные дипольные взаимодействия
u1-
u2
+
q1
-
+
q2
f
r
• Энергия взаимодействия , w(r), зависит от
относительной ориентации диполей :
u1u2
w (r ) = _
3 [ 2 cosq 1cos q 2 _ sinq1 sinq 2 cos f ]
4 o r
• Размер молекулы влияет на минимально
возможный r.
– При заданном расстоянии r при одинаковом
направлении имеет меньшее значение w, но обычно
такое выравнивание требует большего r по сравнению с
выравниванием бок о бок (параллельное).
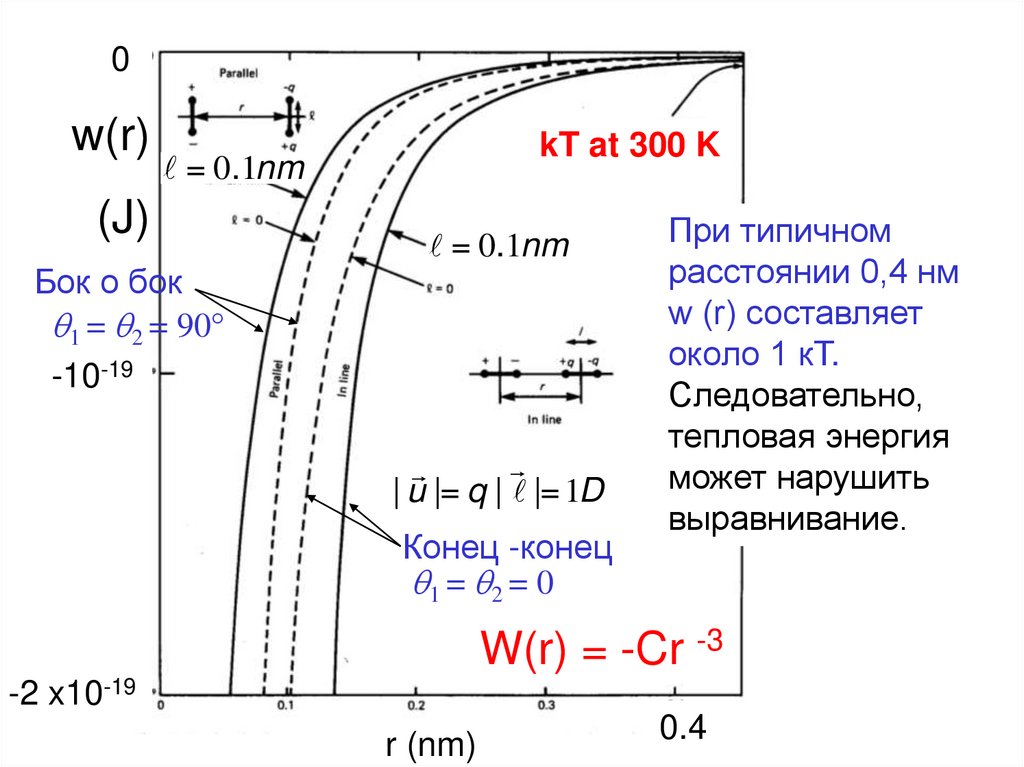
Внимание: W(r) = -Cr -3
69.
0w(r)
kT at 300 K
= 0.1nm
(J)
Бок о бок
q1 = q2 = 90°
-10-19
= 0.1nm
| u |= q | |= 1D
Конец -конец
q1 = q2 = 0
При типичном
расстоянии 0,4 нм
w (r) составляет
около 1 кТ.
Следовательно,
тепловая энергия
может нарушить
выравнивание.
W(r) = -Cr -3
-2 x10-19
r (nm)
0.4
70. Свободно вращающиеся диполи
• Внекоторых
случаях
диполи
не
имеют
фиксированного положения и ориентации на
решетке, а постоянно перемещаются.
• Это происходит, когда тепловая энергия больше
фиксированной энергии дипольного
взаимодействия:
u1u2
kT >
4 o r 3
• Энергия взаимодействия обратно пропорциональна
T, и из-за постоянного движения угловая
зависимость отсутствует.
u12u2 2
w (r ) = _
3( 4 o )2 kTr 6
Внимание: W(r) = -Cr -6
71. Поляризуемость
• Все молекулы могут иметь диполь,индуцированный внешним
E
электромагнитным полем.,
• Сила наведенного дипольного момента
|uind|определяется поляризуемостью a
молекулы:
uind
a=
E
Единицы
поляризуемости :
Cm Cm C 2m C 2m 2
=
=
=
J
N
N
J
C
Cm
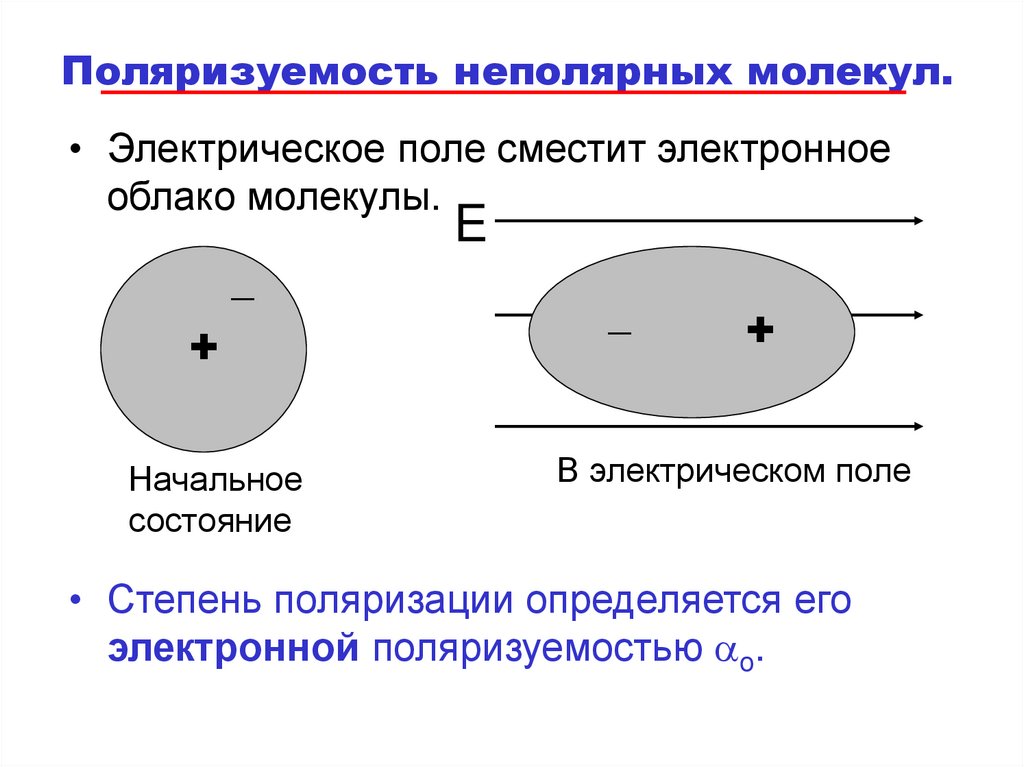
72. Поляризуемость неполярных молекул.
• Электрическое поле сместит электронноеоблако молекулы.
_
+
Начальное
состояние
E
_
+
В электрическом поле
• Степень поляризации определяется его
электронной поляризуемостью ao.
73.
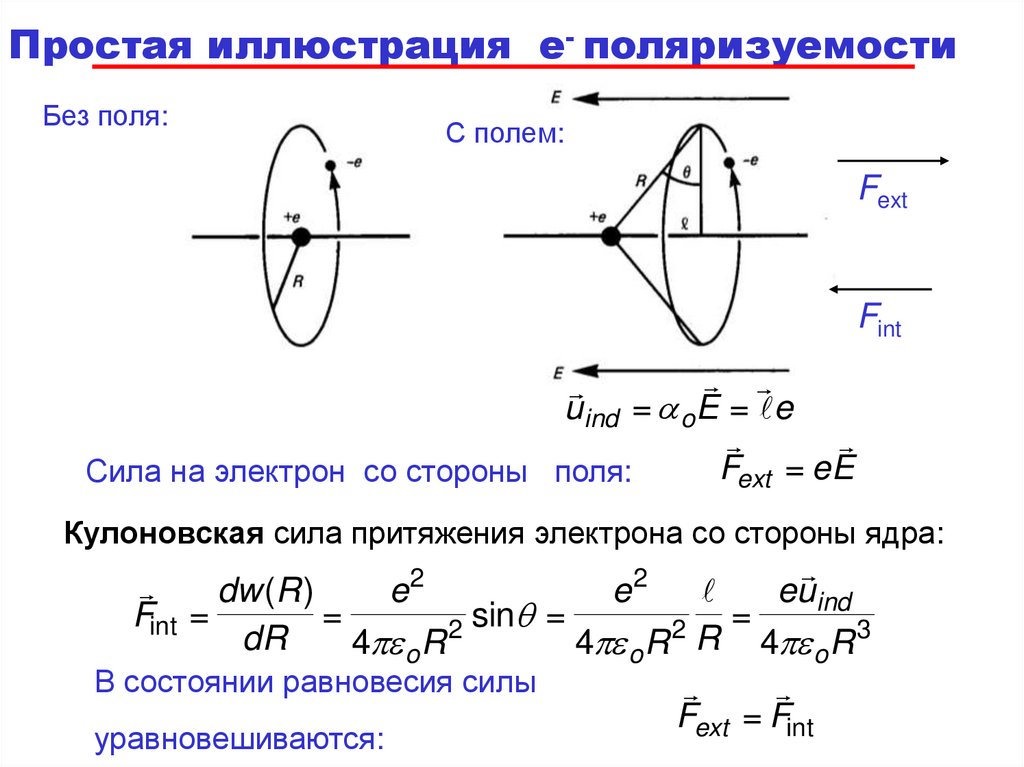
Простая иллюстрация e- поляризуемостиБез поля:
С полем:
Fext
Fint
uind = a o E = e
Fext = eE
Сила на электрон со стороны поля:
Кулоновская сила притяжения электрона со стороны ядра:
2
2
euind
dw (R )
e
e
Fint =
=
sinq =
=
2
2
dR
4 o R
4 o R R 4 o R 3
В состоянии равновесия силы
Fext = Fint
уравновешиваются:
74.
Простая иллюстрация e- поляризуемостиuind = a o E = e
Fext = Fint
euind
Подставляя
eE =
выражения для сил:
4 o R 3
3
Решение для индуцированного дипольного момента:
uind = 4 o R E
Таким образом, мы получаем выражение
a o = 4 oR 3
для поляризуемости:
Исходя из этого грубого рассмотрения, мы предсказываем, что
электронная поляризуемость пропорциональна размеру молекулы.!
75. Единицы электронной поляризуемости
ao определяется как:2
ao
4 o
2 _1
C m J
2 _1
C J m
_1
=m
3
Единицы объема
76. Электронные поляризуемости
МалыеHe
0.20
H2O
1.45
O2
1.60
CO
1.95
(4 o)10-30 m3
NH3
2.3
=1.11 x 10-40 C2m2J-1
CO2
2.6
Xe
4.0
CHCl3
8.2
CCl4
10.5
Единицы:
Большие
77.
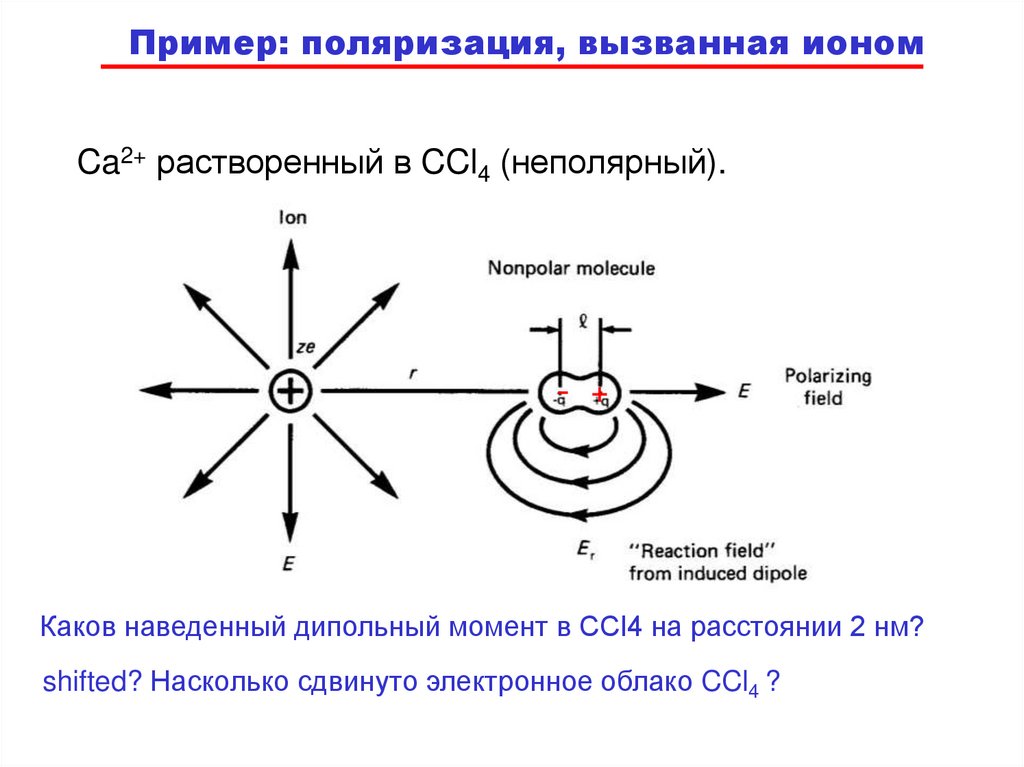
Пример: поляризация, вызванная иономCa2+ растворенный в CCl4 (неполярный).
-
+
Каков наведенный дипольный момент в CCl4 на расстоянии 2 нм?
shifted? Насколько сдвинуто электронное облако CCl4 ?
78.
Пример: поляризация, вызванная иономCa2+ Растворенный в CCl4 (неполярный).
E=
Поле Ca2+ :
Из литературы для
CCl4:
uind = a o E
2e
4 o r 2
ao
= 10.5x10 _ 30 m 3
4 o
Зависит от диэлектрической
проницаемости CCl4: = 2.2
a o 2e
uind =
4 o r 2
Получаем для r = 2 нм:
u = 3.82 x 10-31 Cm
Таким образом, электрон с
зарядом е сдвигается на:
u
= = 2.38x10 _ 12 m = 0.02 Å
e
79.
Поляризуемость полярных молекулВ жидкости молекулы непрерывно вращаются и поворачиваются, поэтому
усредненный по времени дипольный момент для полярной молекулы в
жидком состоянии равен 0.
Внешнее электрическое поле может частично выровнять диполи
E
+
-
q
Пусть q представляет собой угол между дипольным моментом молекулы
2
и направлением внешнего E-поля.
u E
Индуцированный дипольный момент равен u
=
cos 2 q
ind
kT
Усредненное по пространству значение <cos2q> = 1/3
Т.к. u = aE, мы можем определить ориентационную
поляризуемость
a orient
u2
=
3kT
Молекула все еще имеет электронную поляризуемость, поэтому
2
u
общая поляризуемость, a, определяется как:
a = ao +
3kT
Уравнение Дебая-Ланжевена
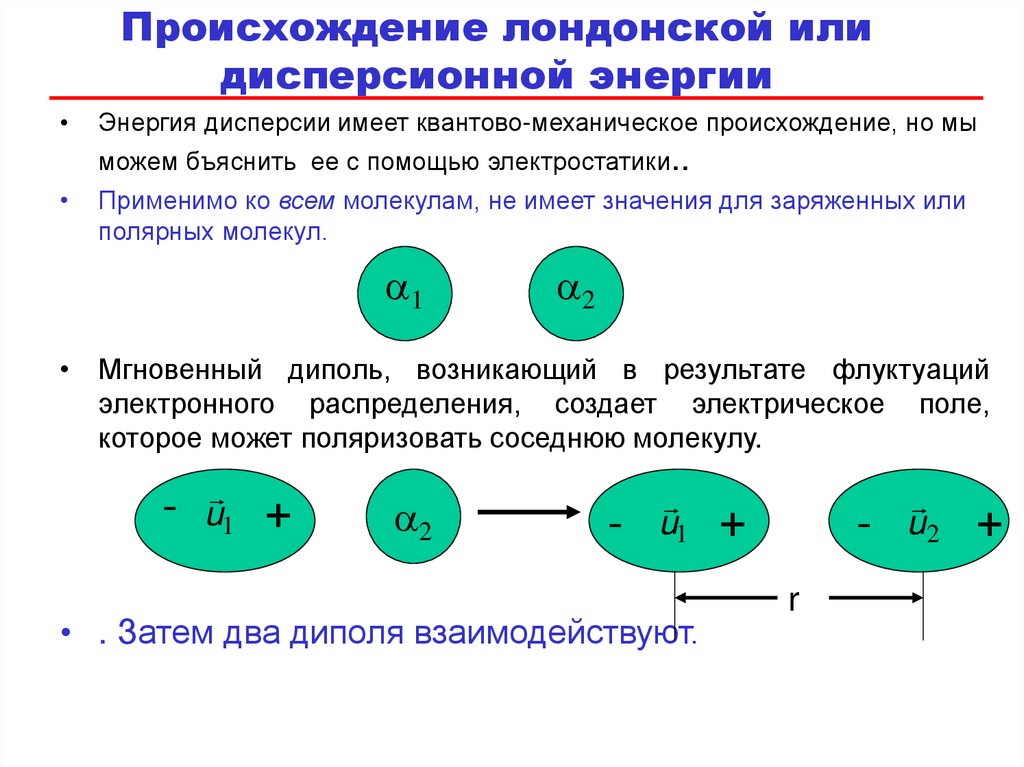
80. Происхождение лондонской или дисперсионной энергии
Энергия дисперсии имеет квантово-механическое происхождение, но мы
можем бъяснить ее с помощью электростатики..
Применимо ко всем молекулам, не имеет значения для заряженных или
полярных молекул.
a1
a2
• Мгновенный диполь, возникающий в результате флуктуаций
электронного распределения, создает электрическое поле,
которое может поляризовать соседнюю молекулу.
-
u1
+
a2
-
u1
• . Затем два диполя взаимодействуют.
+
r
u2
+
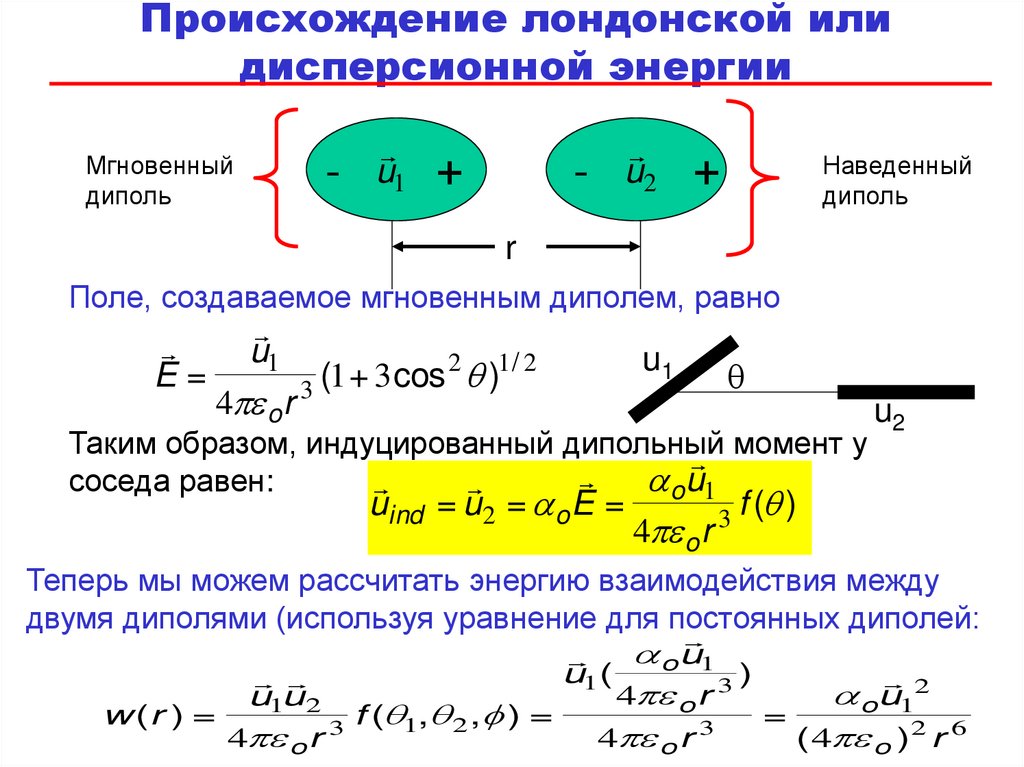
81.
Происхождение лондонской илидисперсионной энергии
Мгновенный
диполь
-
u1
+
-
u2
Наведенный
диполь
+
r
Поле, создаваемое мгновенным диполем, равно
E=
u1
4 o r
2 1/ 2
(
1
+
3
cos
q)
3
u1
q
Таким образом, индуцированный дипольный
момент у
a ou1
соседа равен:
uind = u2 = a o E =
4 o r
u2
3 f (q )
Теперь мы можем рассчитать энергию взаимодействия между
двумя диполями (используя уравнение для постоянных диполей:
a ou1
u1(
3)
4 o r
a ou12
u1u 2
w (r ) =
=
3 f (q1,q 2 ,f ) =
3
4 o r
4 o r
( 4 o )2 r 6
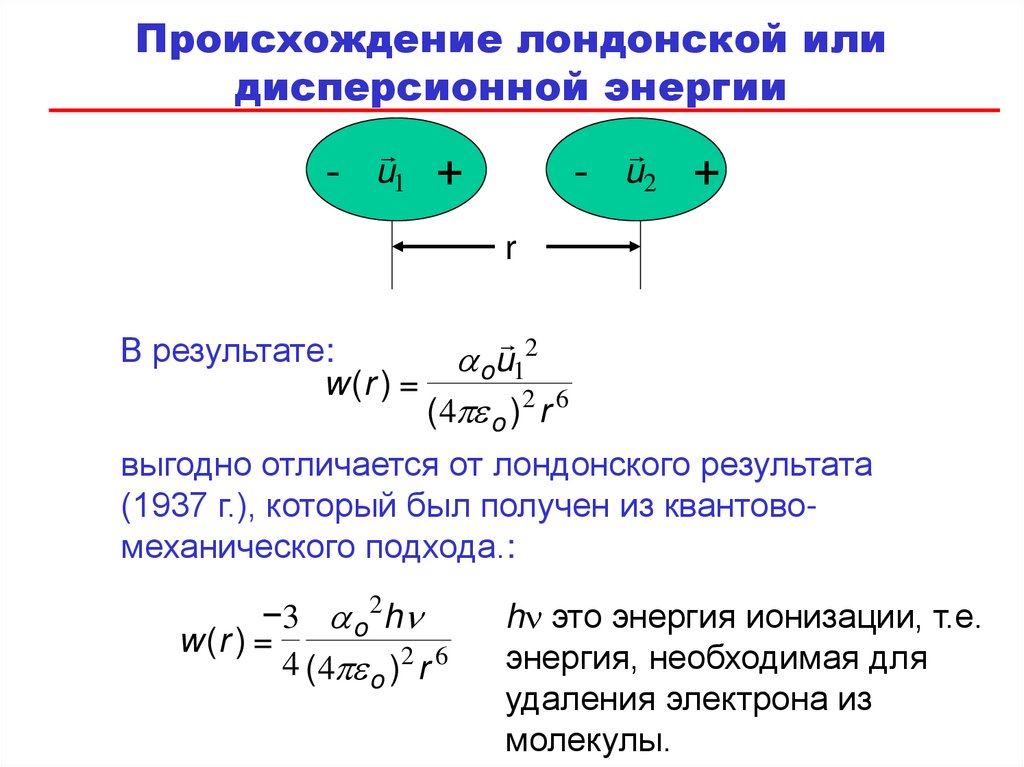
82.
Происхождение лондонской илидисперсионной энергии
-
u1
+
-
u2
+
r
В результате:
w (r ) =
2
a ou1
( 4 o )2 r 6
выгодно отличается от лондонского результата
(1937 г.), который был получен из квантовомеханического подхода.:
3 a o 2 h
w (r ) =
4 ( 4 o )2 r 6
h это энергия ионизации, т.е.
энергия, необходимая для
удаления электрона из
молекулы.
83.
Лондон или дисперсионная энергия3 a o 2 h
w (r ) =
4 ( 4 o )2 r 6
Лондонский результат имеет вид:
w (r ) =
C
r
6
Где С называется константой
Лондона :
3 a o 2 h
C=
4 ( 4 o )2
В простых жидкостях и твердых телах, состоящих из
неполярных молекул, таких как N2 или O2, дисперсионная
энергия несет единоличную ответственность за сцепление
конденсированной фазы..
Необходимо учитывать энергии парного взаимодействия
всех «ближайших» соседей.
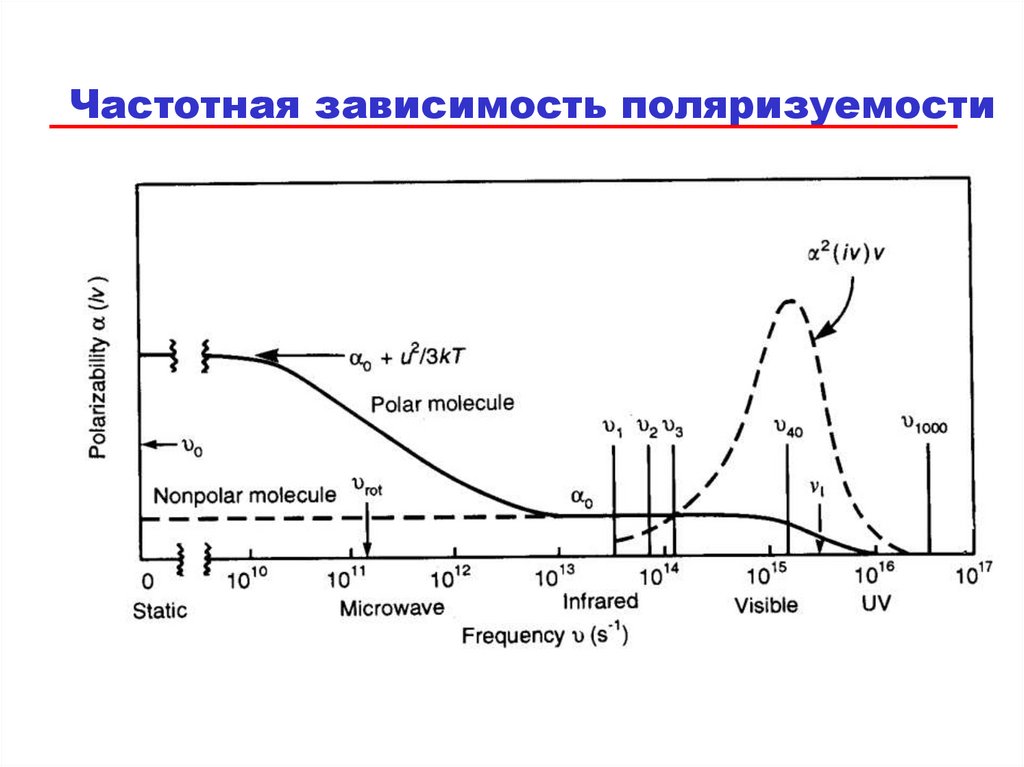
84. Измерение поляризуемости
• Поляризуемость зависит от частоты электрическогополя..
• Уравнение Клаузиуса-Моссотти связывает
диэлектрическую постоянную молекулы с
объемом v и a:
a
_ 1 3v
=(
)
4 o
+ 2 4
•Однако на частоте видимого света активна только
электронная поляризуемость ao .
• На этих частотах уравнение Лоренца-Лоренца
связывает показатель преломления (n2 = ) с ao:
ao
n 2 _ 1 3v
=( 2
)
4 o
n + 2 4
85.
Частотная зависимость поляризуемости86.
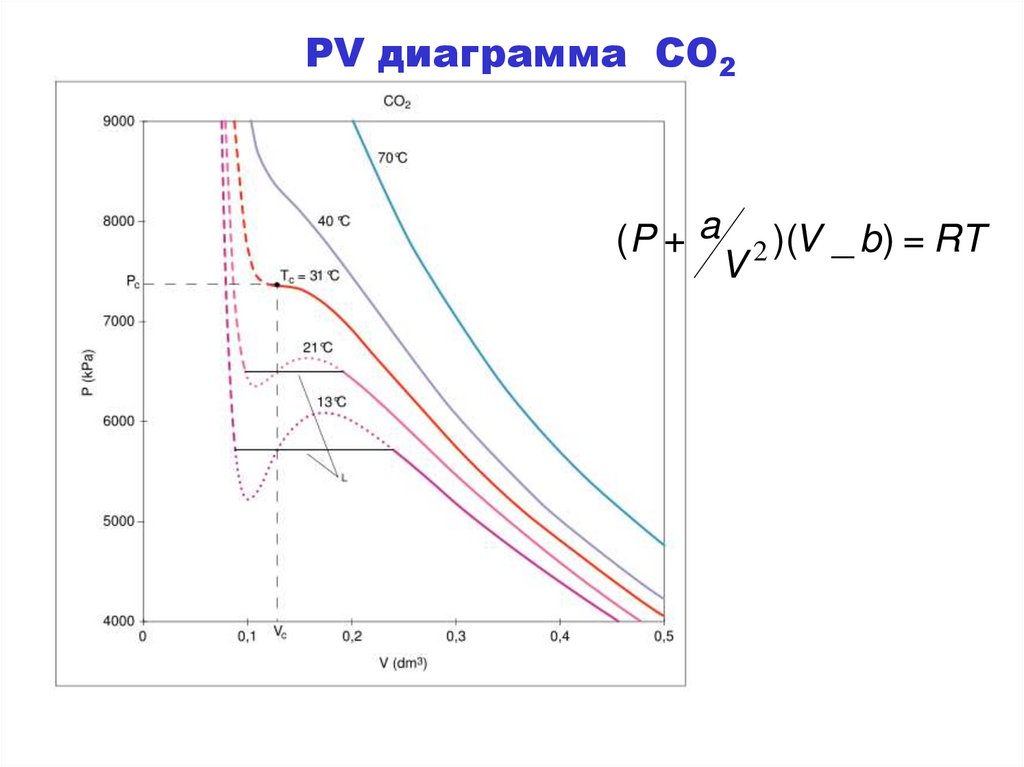
PV диаграмма CO2(P + a
V
2 )(V
_ b ) = RT
87. Измерение поляризуемости
• Газовый закон Ван-дер-Ваальса может быть записан(с V = молярный объем) как:
(P + a
V
2 )(V
_ b ) = RT
Константа a напрямую связана с постоянной
Лондона, C:
a
_ 1 3v
=(
)
2 C
4 o
+ 2 4
a= 3
3
ao
n 2 _ 1 3v
=( 2
)
4 o
n + 2 4
где - диаметр молекулы (ближайшее расстояние
между молекулами). Мы можем использовать
уравнения Клаузиуса-Моссотти Лоренц-Лоренца и
Ван-дер-Ваальса можем определить ao и a.
88. Взаимодействия Ван-дер-Ваальса
• Относится ко всем взаимодействияммежду полярными или неполярными
молекулами, варьирующимся как r -6.
• Включает взаимодействия Кизома,
Дебая и дисперсионные
взаимодействия.
• Значения энергии взаимодействия
обычно всего несколько kT.
89.
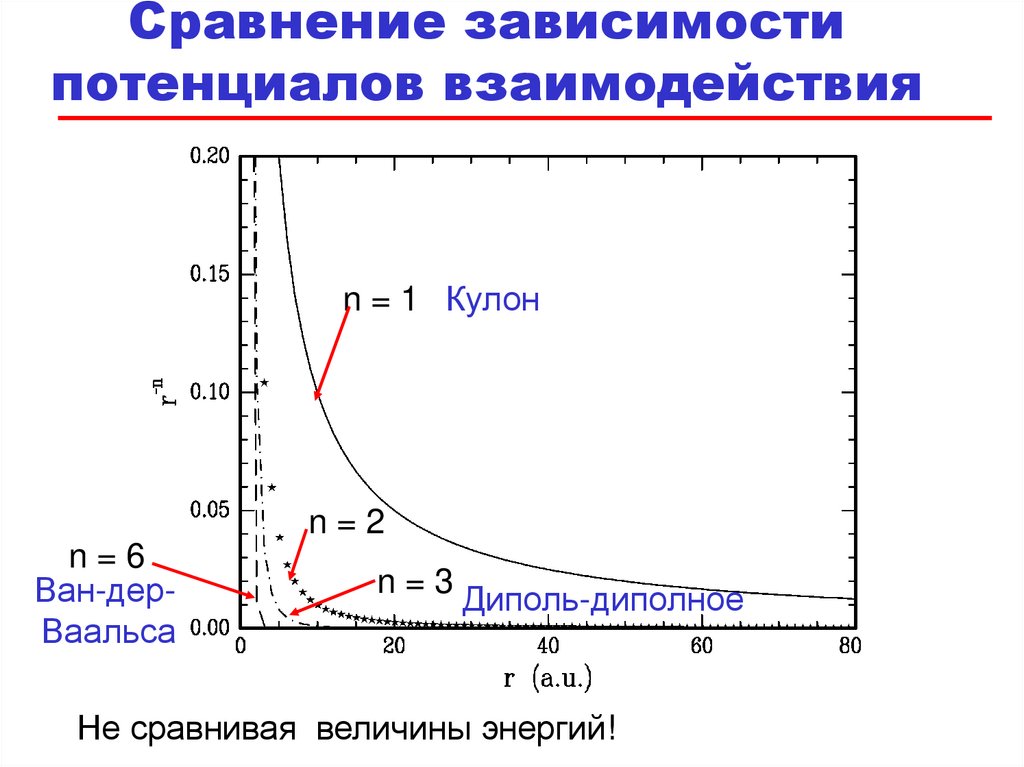
Сравнение зависимостипотенциалов взаимодействия
отr
n = 1 Кулон
n=2
n=6
Ван-дерВаальса
n=3
Диполь-диполное
Не сравнивая величины энергий!
90. Водородная связь
d-O
H
d+
d-
Hd+
H O
d+
Hd+
• В ковалентной связи электрон распределяется между двумя
атомами.
• Водород обладает только одним электроном и поэтому может
ковалентно связываться только с ОДНИМ другим атомом.
• Протон неэкранирован и образует электроположительный конец
связи: ионный характер.
• Энергия связи обычно выше, чем v.d.W., обычно 25-100 кТ.
• Потенциал взаимодействия трудно описать, но он выражается
примерно как r-2 и в некоторой степени направлен.
• Водородные связи могут привести к слабому структурированию в
воде.
91. Сдвиг спектров поглощения
AА
А
А
hD A = h ( PA- P - ГАЗ
+ D ОР
+ D ИНД
+ D АДИСП )
)= h (D ОТТ
УН = ОР + ИНД + ДИС
Притяжения
92.
2ОР (R) = 3 kTR
2
1
2
2
6
Потенциал Кеезома
93. Индуктивные взаимодействия
1. Взаимодействиемежду
молекулами
растворенного
вещества,
имеющими
постоянный
дипольный
момент
и
дипольными моментами, индуцированными
в молекулах растворителя. Это имеет место
в том случае, когда растворенное вещество
полярно, а растворитель неполярен.
94.
2.Взаимодействия
между
молекулами
растворителя,
имеющими
постоянный
дипольный
момент
и
молекулами
растворенного вещества, у которых молекулы
растворителя индуцируют дипольный момент.
Это реализуется, когда растворитель полярен,
а растворенное вещество неполярно.
95.
3.Взаимодействия
между
дипольным
моментом перехода молекулы растворенного
вещества и диполями, наведенными им у
молекул растворителя. Это наблюдается, когда
молекулы
растворенного
вещества
и
растворителя
не
имеют
постоянного
дипольного момента.
96.
ИНД (R ) =(a
2
1 1
+ a 2
R
2
2
)
6
где a1 и a2 – изотропные поляризуемости взаимодействующих молекул
(определяют способность их электронных оболочек смещаться под влиянием
возбуждающей световой волны), 1, 2 - дипольные моменты
взаимодействующих молекул, один из которых
97.
3 ED1 ED2 a1a2ДИС (R)= 6
2 ED1 + ED2 R
Где ED1 и ED2- энергии ионизации молекул и растворенного вещества и
растворителя, соответственно
Энергия ионизации представляет собой наименьшую энергию, необходимую
для удаления электрона от свободного атома в его низшем энергетическом
(основном) состоянии на бесконечность
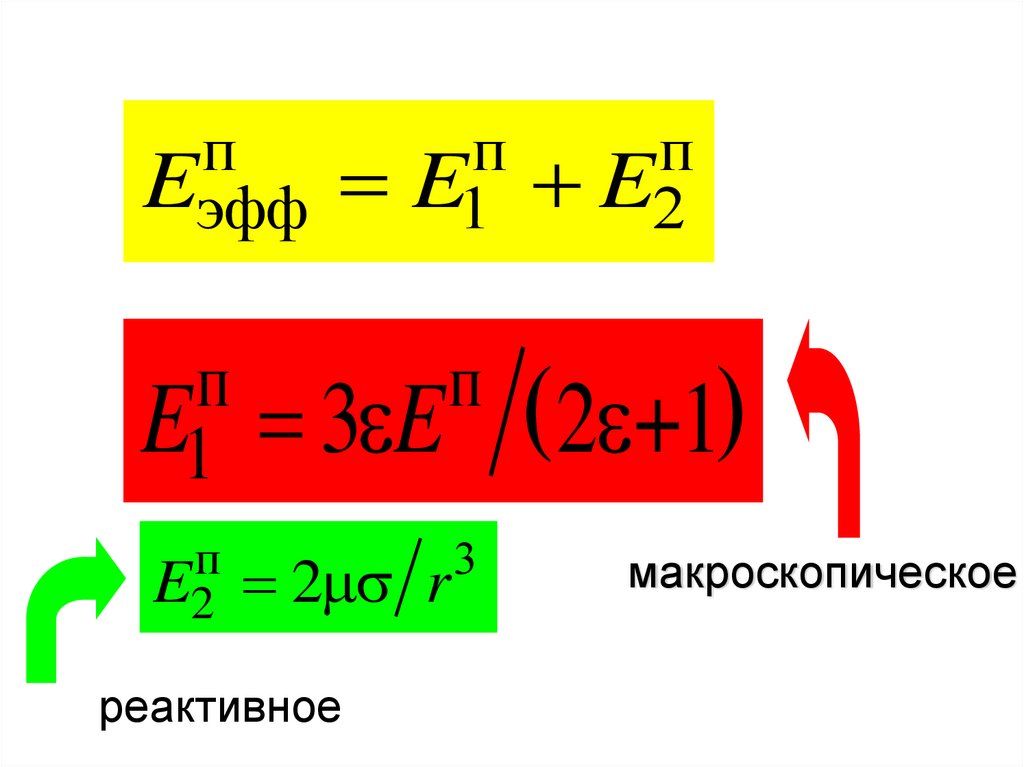
98. реактивное
пEэфф
п
E1
п
E2
п
E1
п
E2
3 E 2 +1
п
2 r
реактивное
3
макроскопическое
99.
100.
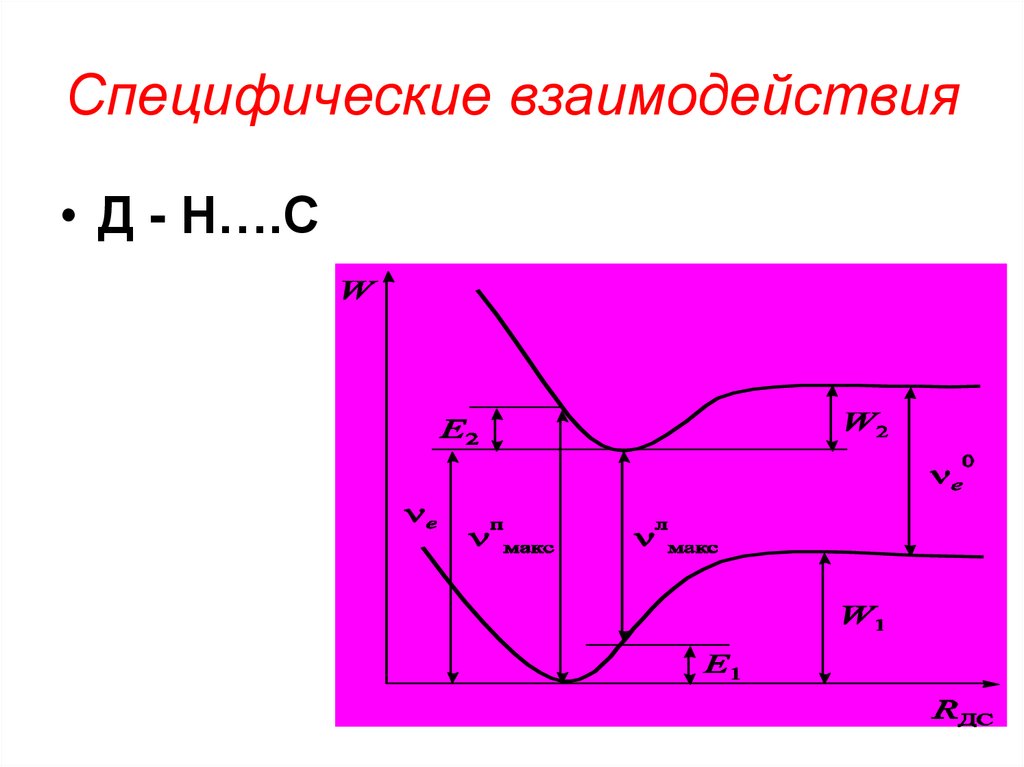
101. Специфические взаимодействия
• Д - Н….С102.
h ve hп
h vмакс
h
л
h vмакс
h
0
ve ve
п
0
vмакс ve
л
vмакс
0
ve
W1 W2
W1 W2 E2
W1 W2 E1
103.
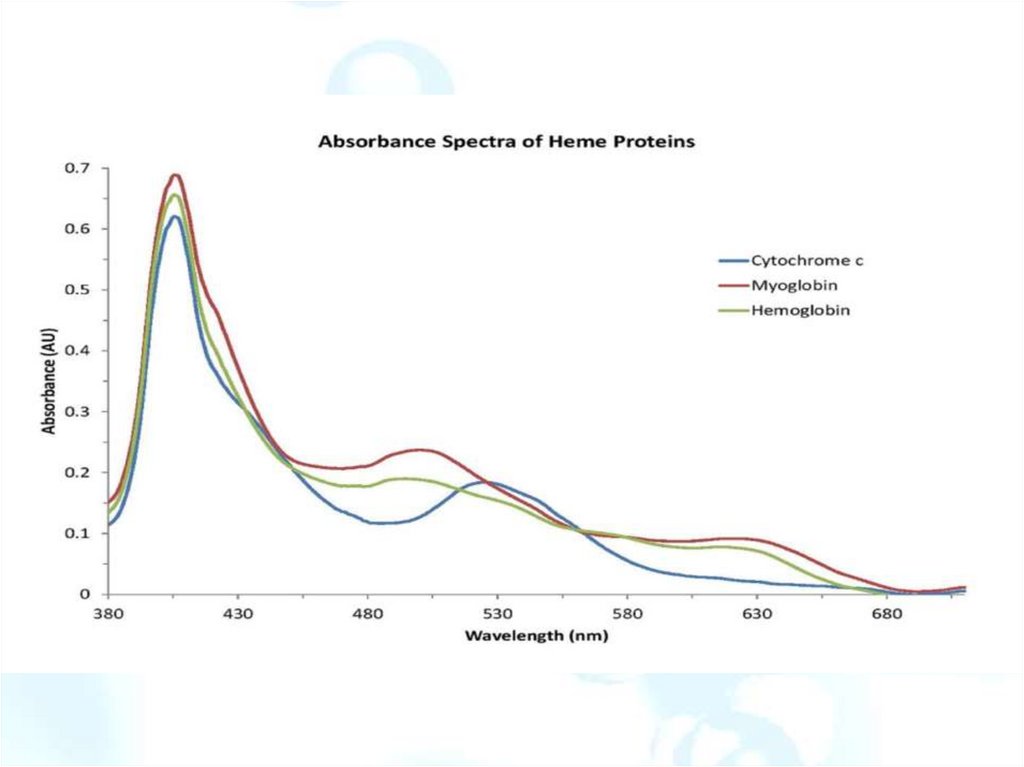
104. Абсорбционная спектроскопия белков (диагностики заболеваний)
105.
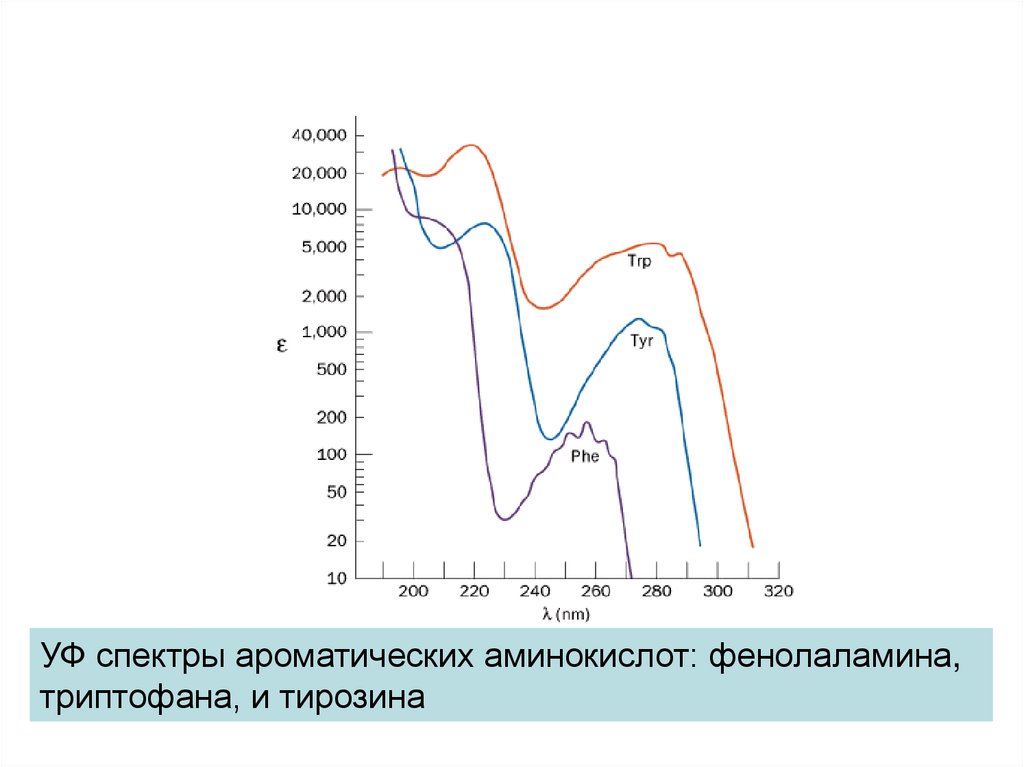
УФ спектры ароматических аминокислот: фенолаламина,триптофана, и тирозина
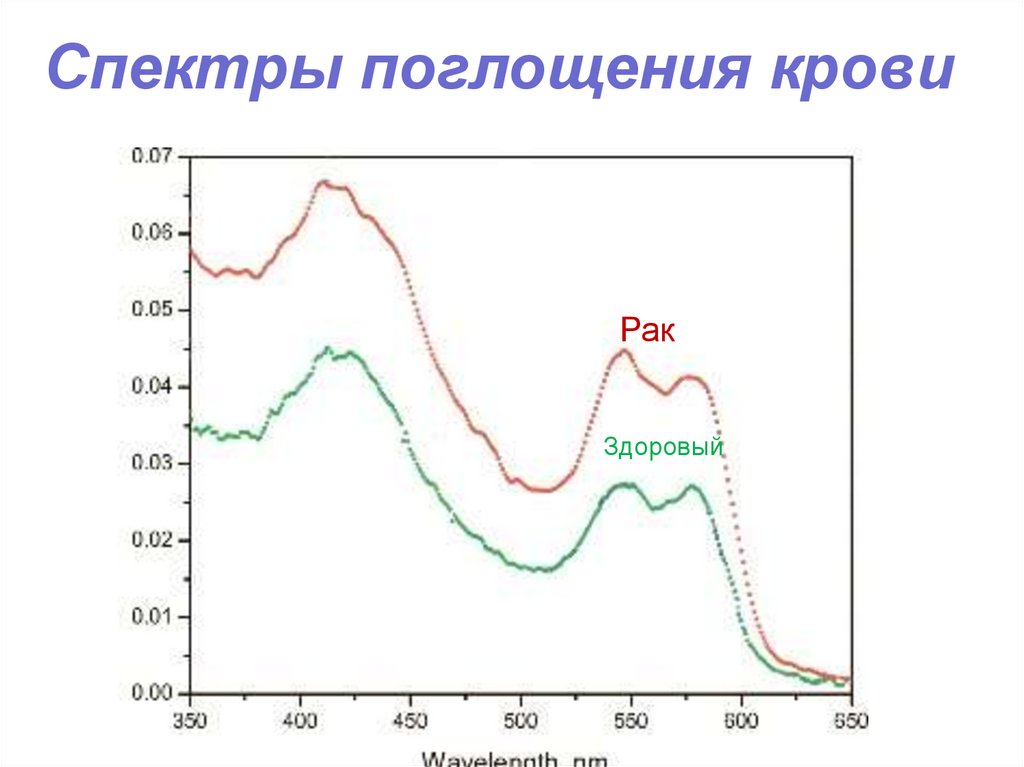
106. Спектры поглощения крови
РакЗдоровый
107.
гемовые белкиГемовые белки играют жизненно важную роль в физиологии
млекопитающих. Они хранят и транспортируют кислород в кровотоке
и транспортируют электроны в митохондриях для синтеза
высокоэнергетических
молекул,
используемых
для
управления
клеточными процессами.
Гем-белки могут нести до четырех молекул кислорода, при этом конформация
белка различается в зависимости от присутствия молекулы кислорода и
количества связанных молекул кислорода. Таким образом, спектроскопия
является полезным инструментом для измерения уровня кислорода в крови. Это
важно во множестве медицинских применений, включая ситуации, когда
пациенты находятся в состоянии седативного действия, находятся в коме или
иным образом не могут выражать тошноту или обморок, которые являются
общими признаками низкой оксигенации крови
108.
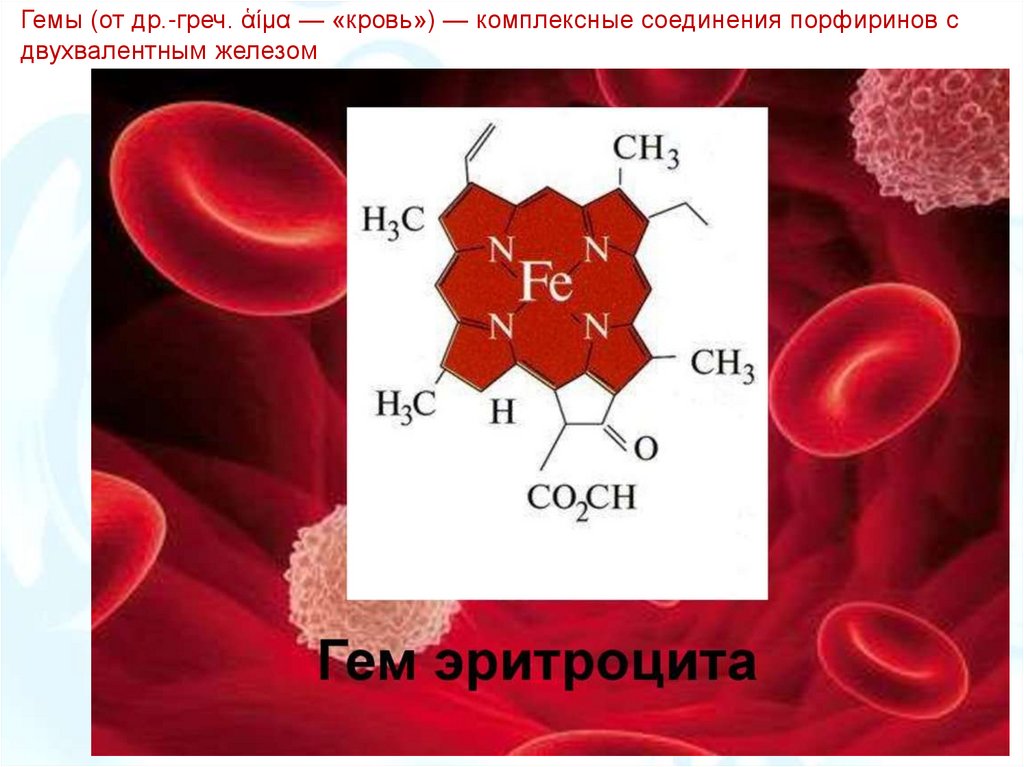
Гемы (от др.-греч. ἁίμα — «кровь») — комплексные соединения порфиринов сдвухвалентным железом
109.
МиоглобинКислородосвязывающий
белок скелетных мышц и
мышцы сердца. Функция
миоглобина заключается
в создании в мышцах
кислородного резерва,
который расходуется по
мере
необходимости,
восполняя временную
нехватку кислорода
110.
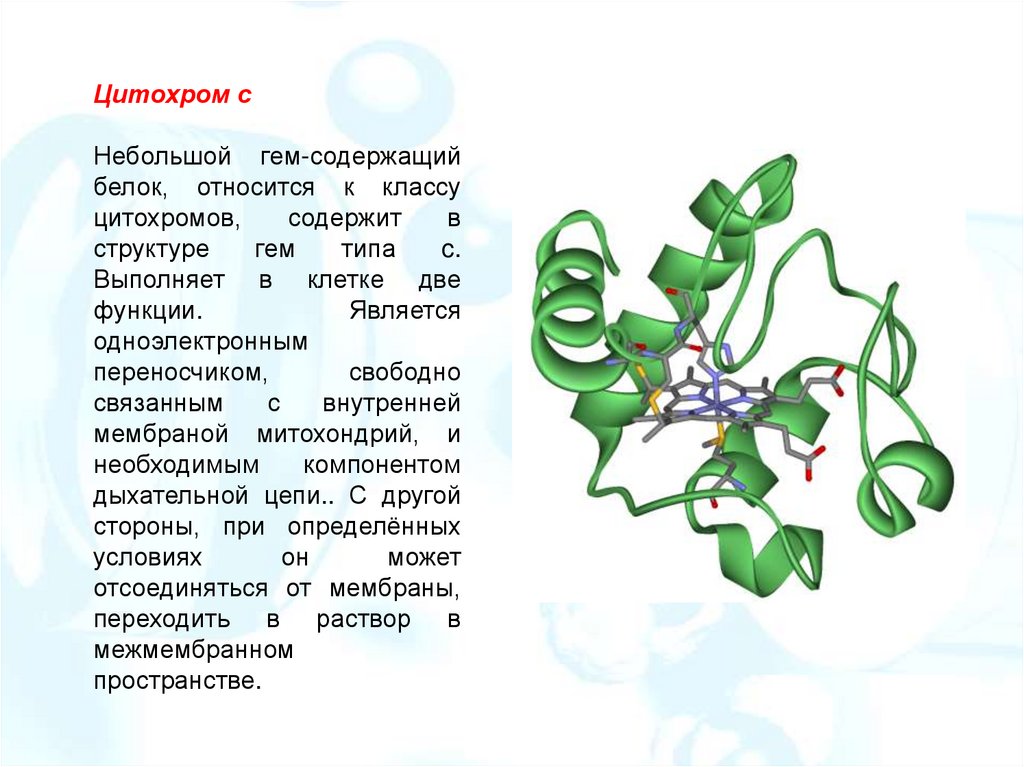
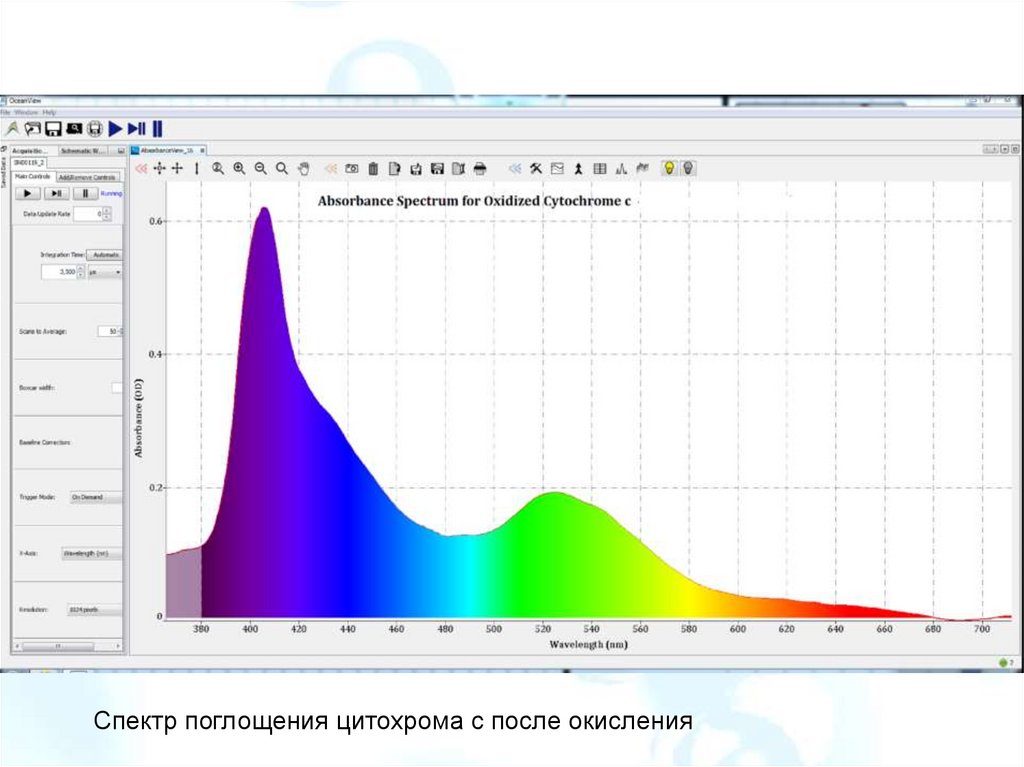
Цитохром cНебольшой гем-содержащий
белок, относится к классу
цитохромов,
содержит
в
структуре
гем
типа
c.
Выполняет в клетке две
функции.
Является
одноэлектронным
переносчиком,
свободно
связанным
с
внутренней
мембраной митохондрий, и
необходимым
компонентом
дыхательной цепи.. С другой
стороны, при определённых
условиях
он
может
отсоединяться от мембраны,
переходить в раствор в
межмембранном
пространстве.
111.
112.
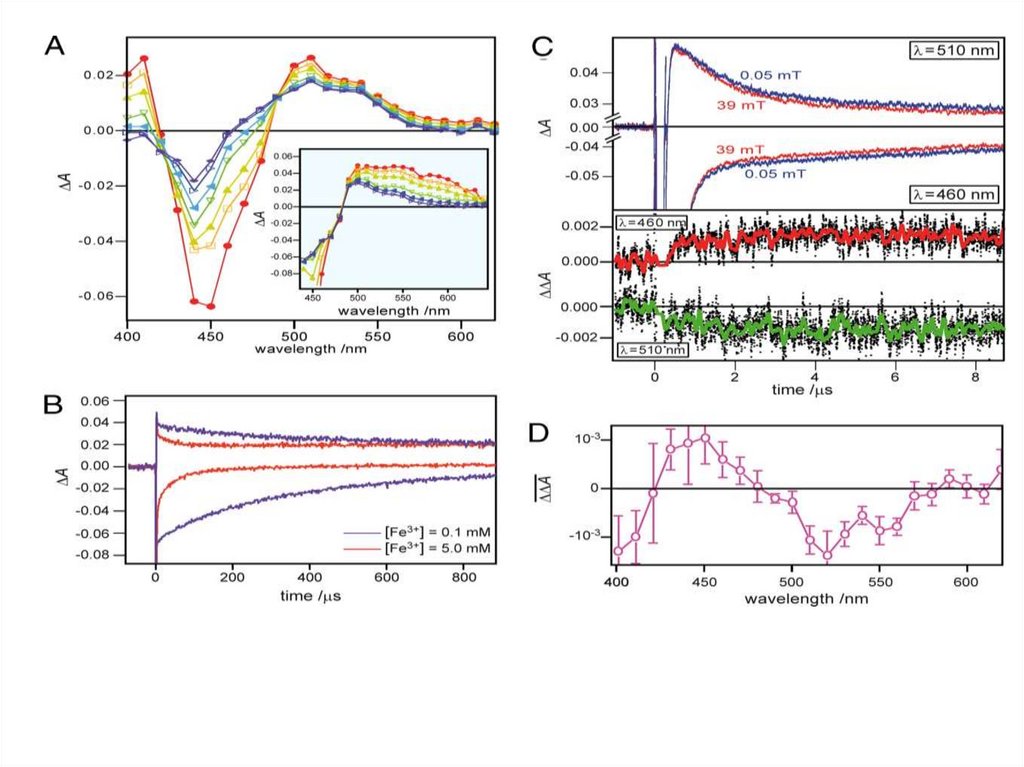
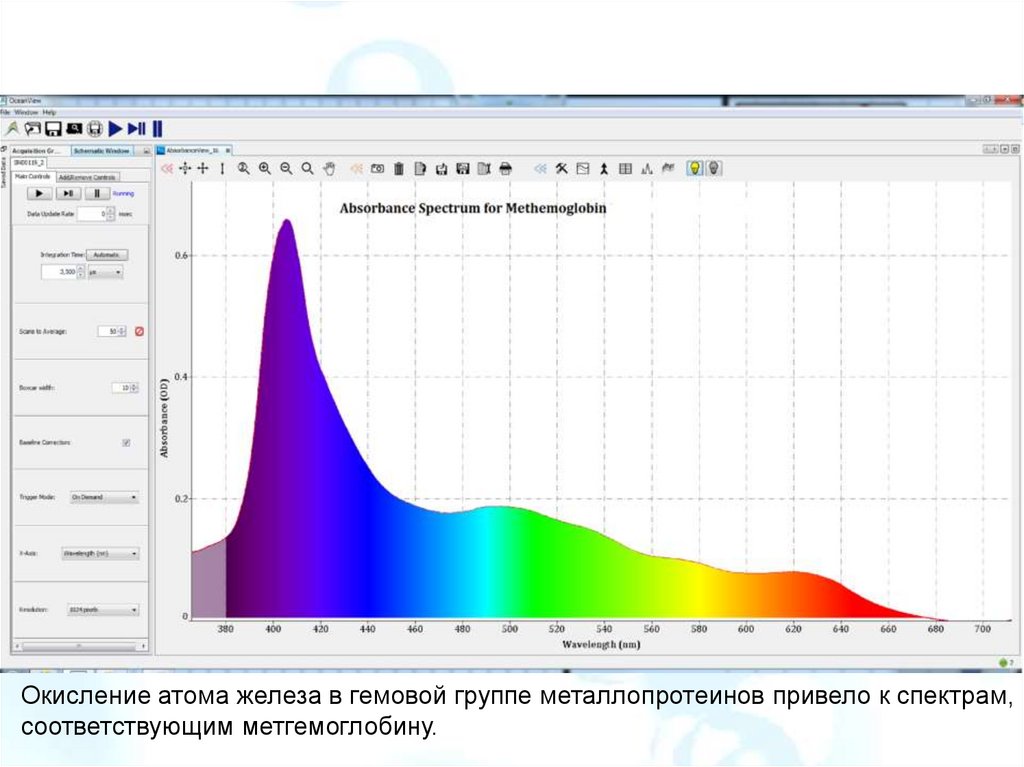
Окисление атома железа в гемовой группе металлопротеинов привело к спектрам,соответствующим метгемоглобину.
113.
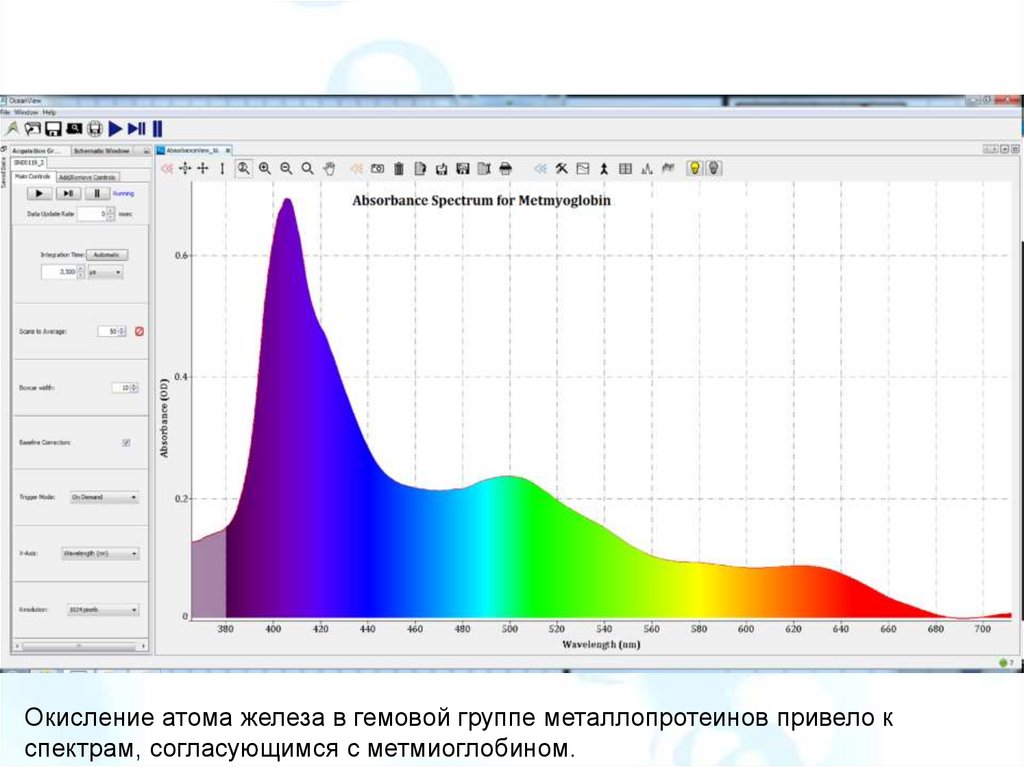
Окисление атома железа в гемовой группе металлопротеинов привело кспектрам, согласующимся с метмиоглобином.







































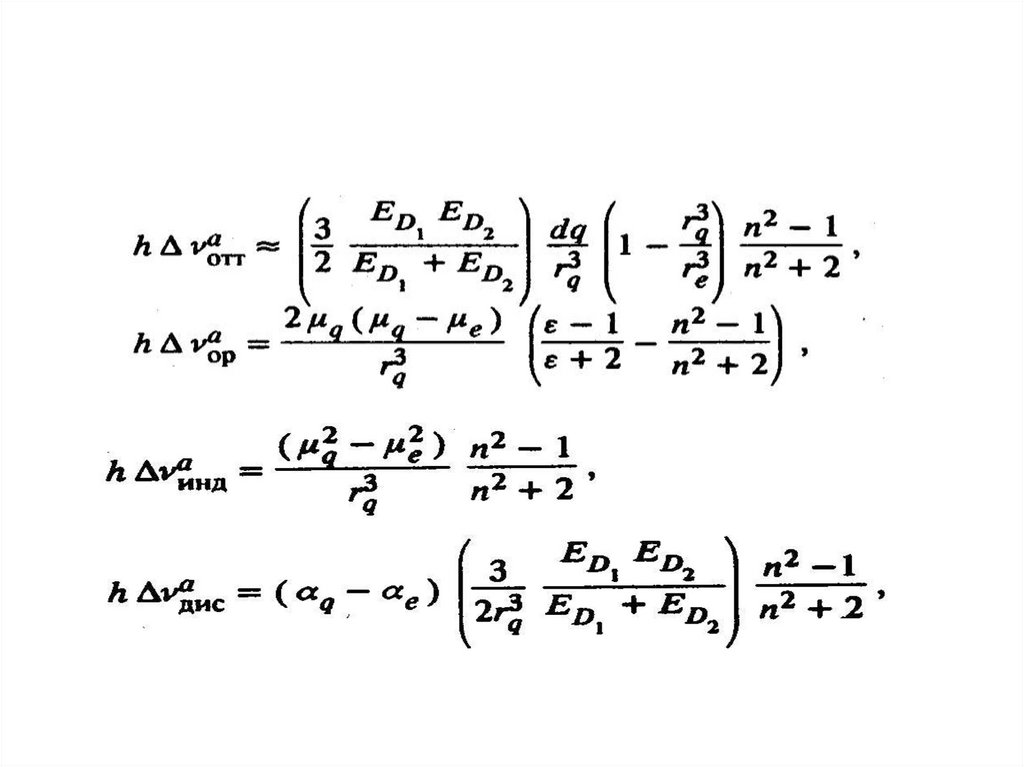
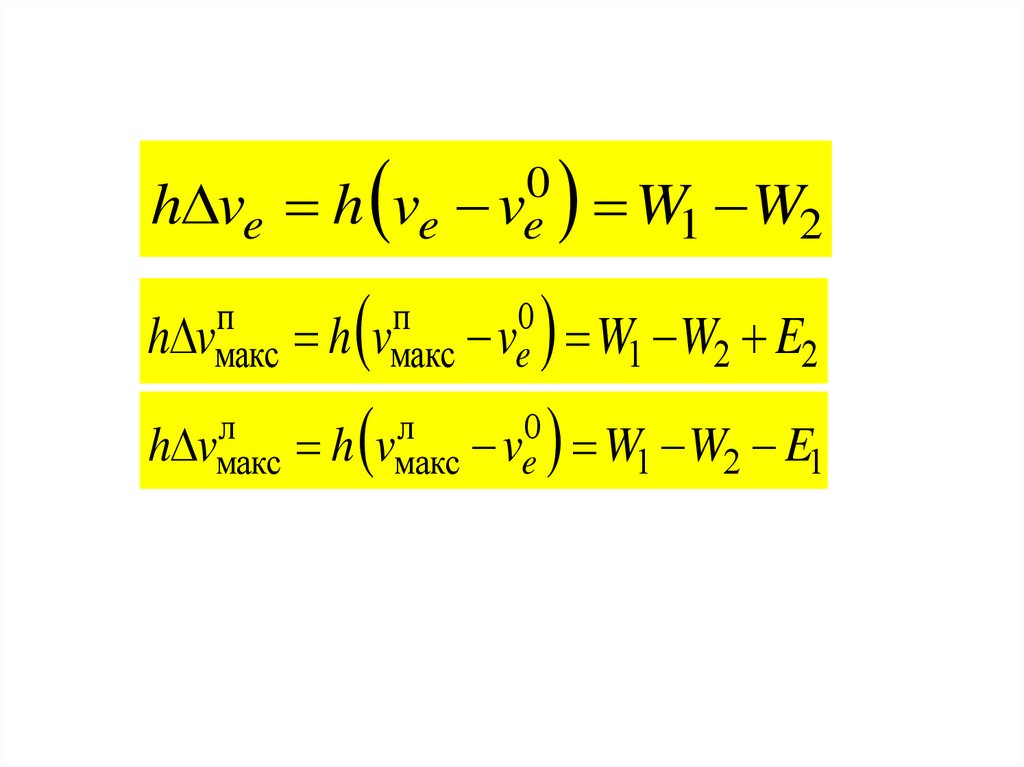




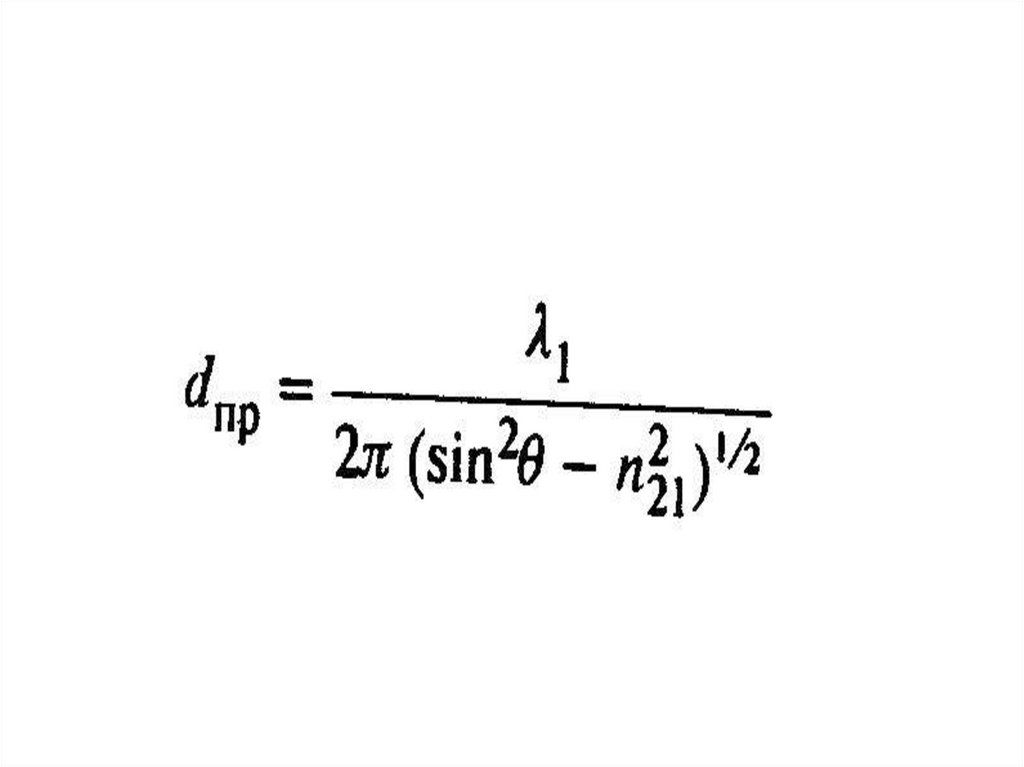
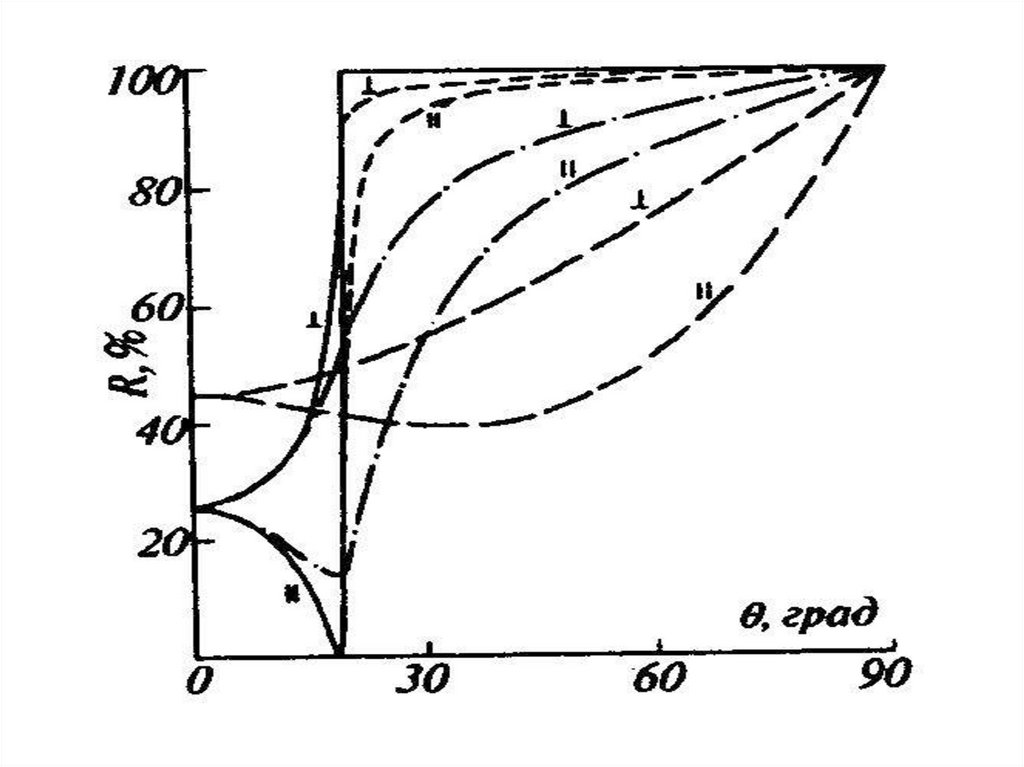

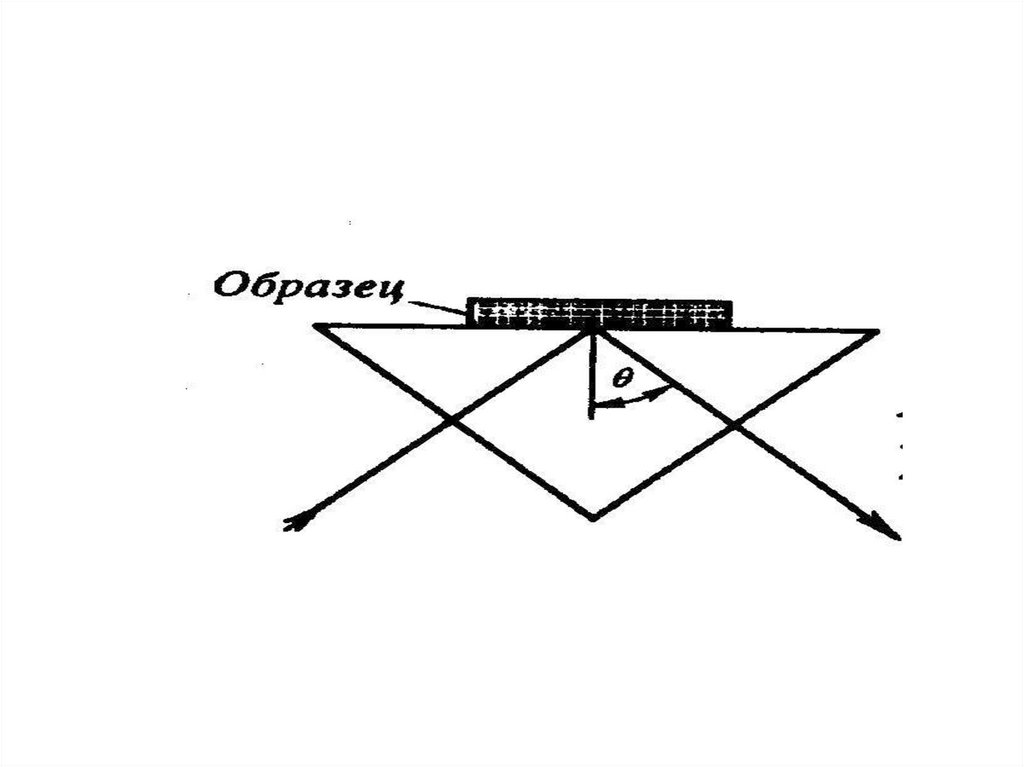
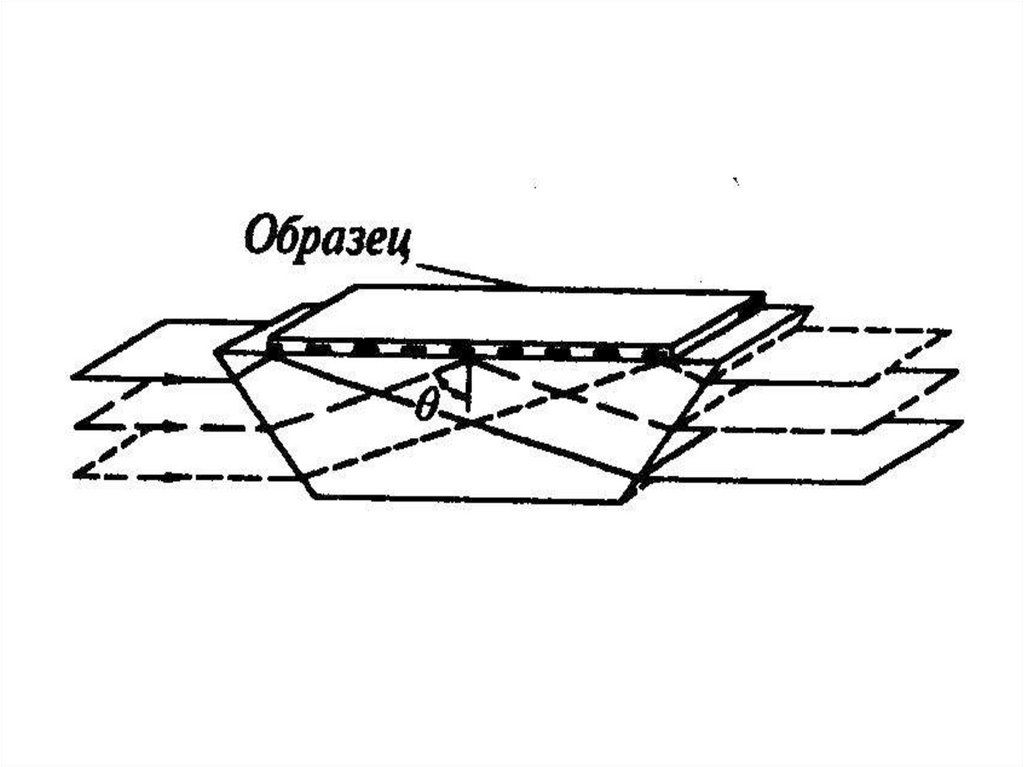
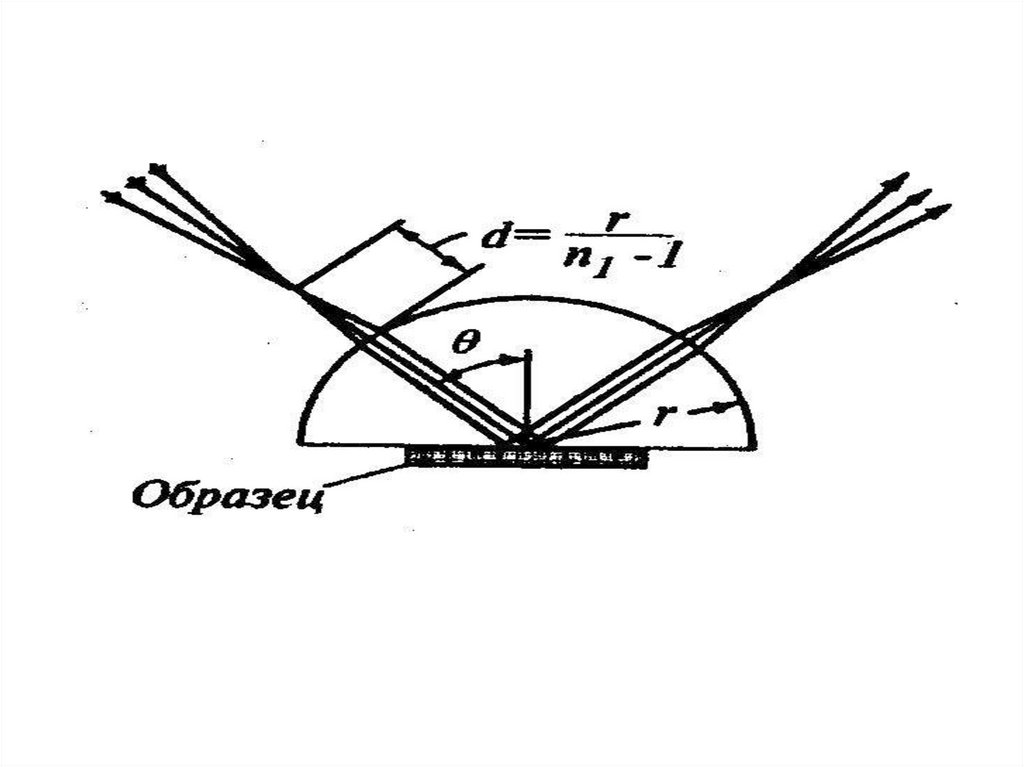
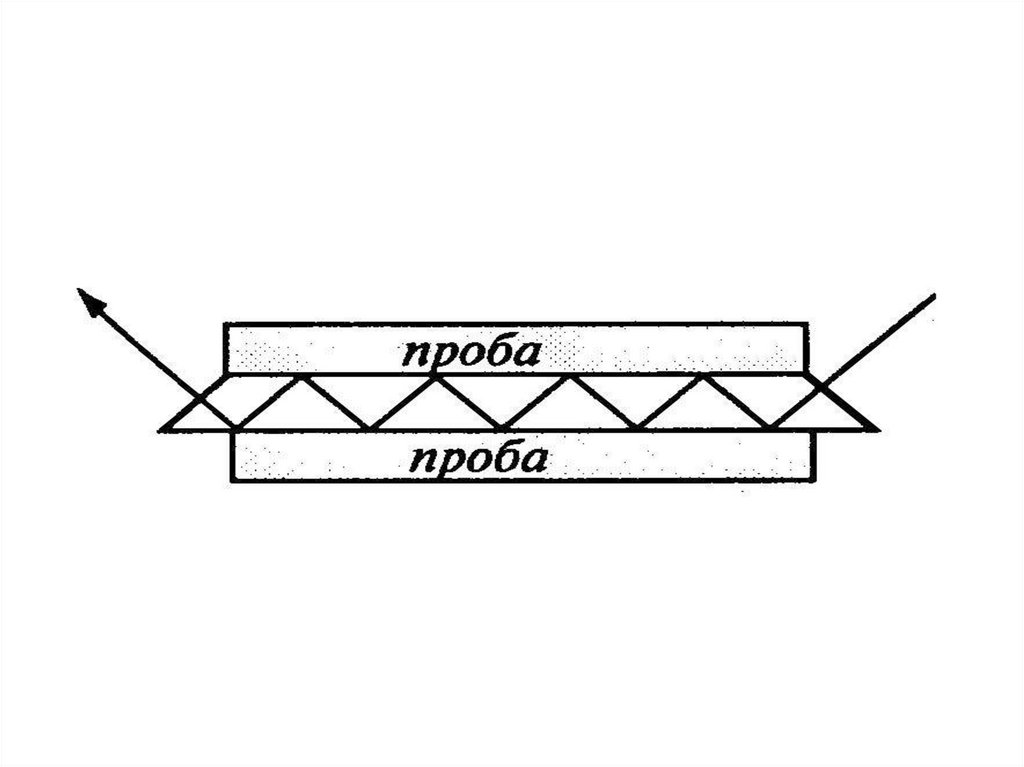
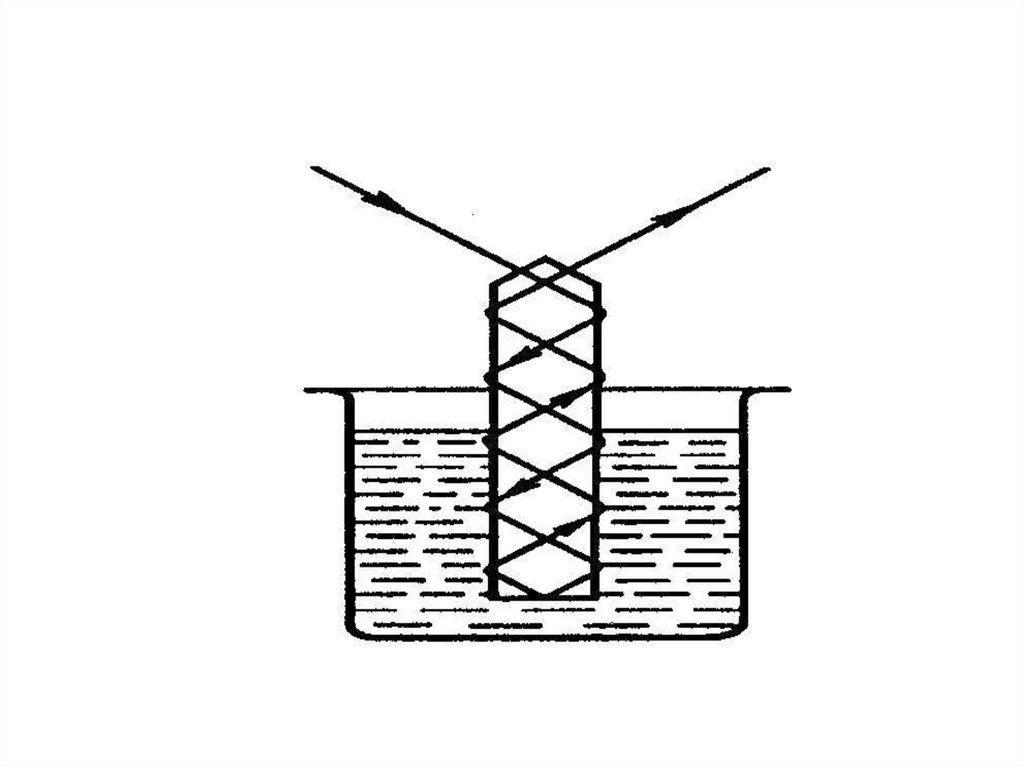
 chemistry
chemistry








