Similar presentations:
Межмолекулярные взаимодействия (лекция № 1)
1. Основные положения молекулярно-кинетической теории. Межмолекулярные взаимодействия
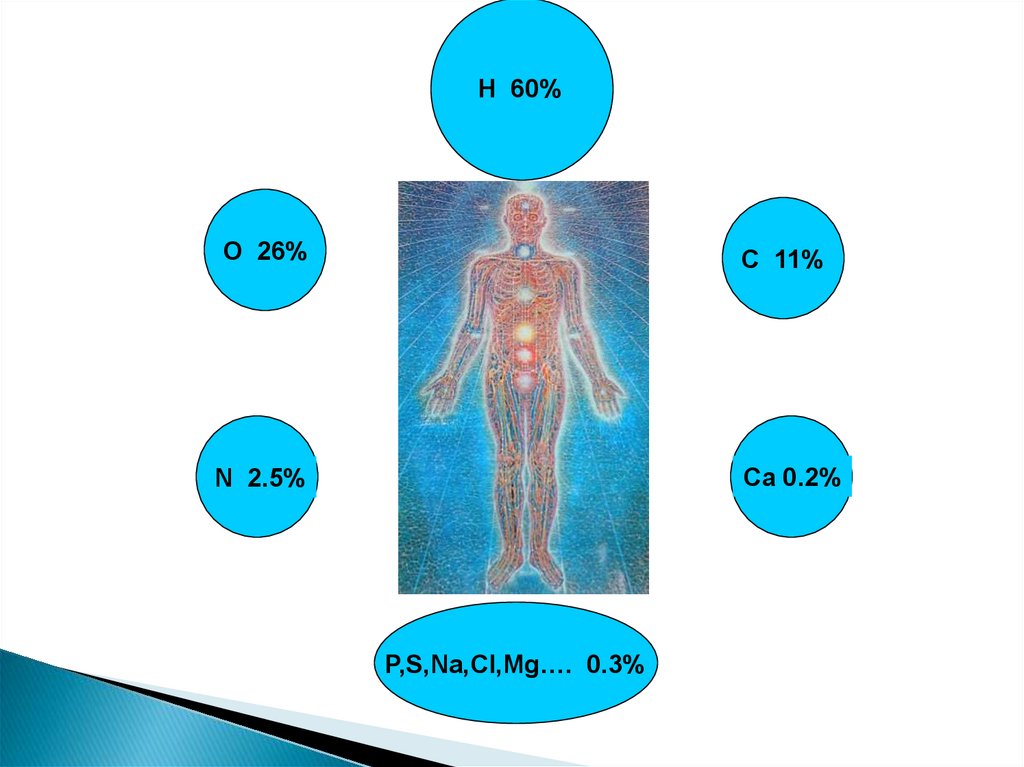
Лекция №12. Состав живых организмов….
3.
H 60%O 26%
C 11%
N 2.5%
Ca 0.2%
P,S,Na,Cl,Mg…. 0.3%
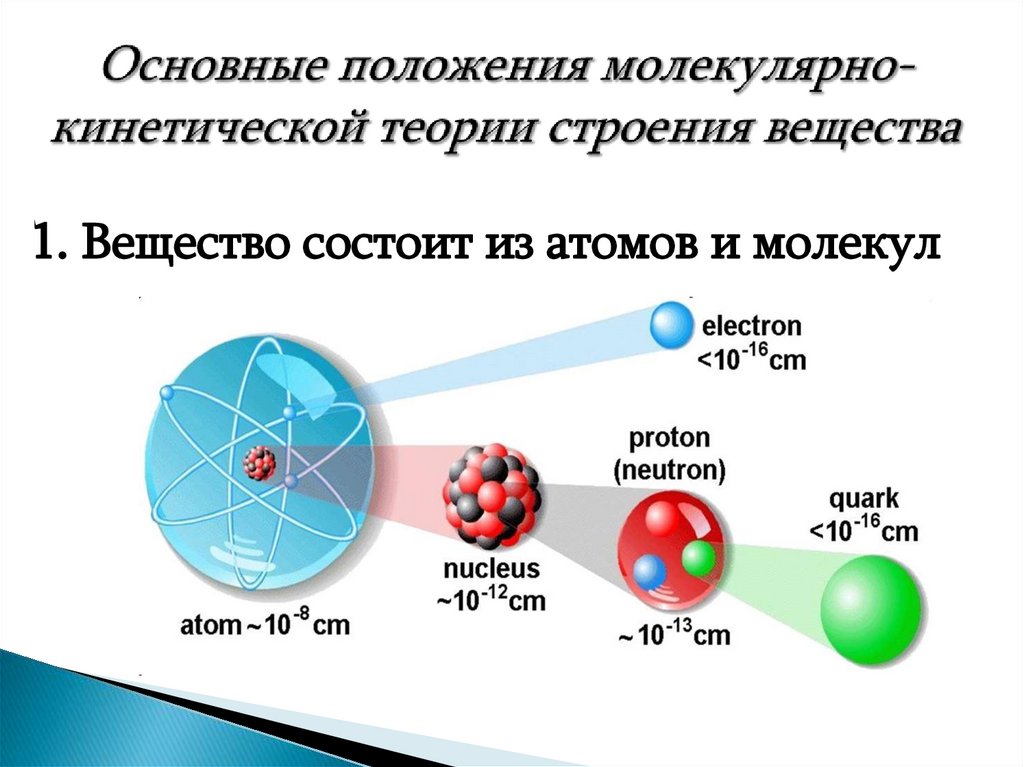
4. Основные положения молекулярно-кинетической теории строения вещества
1. Вещество состоит из атомов и молекул5.
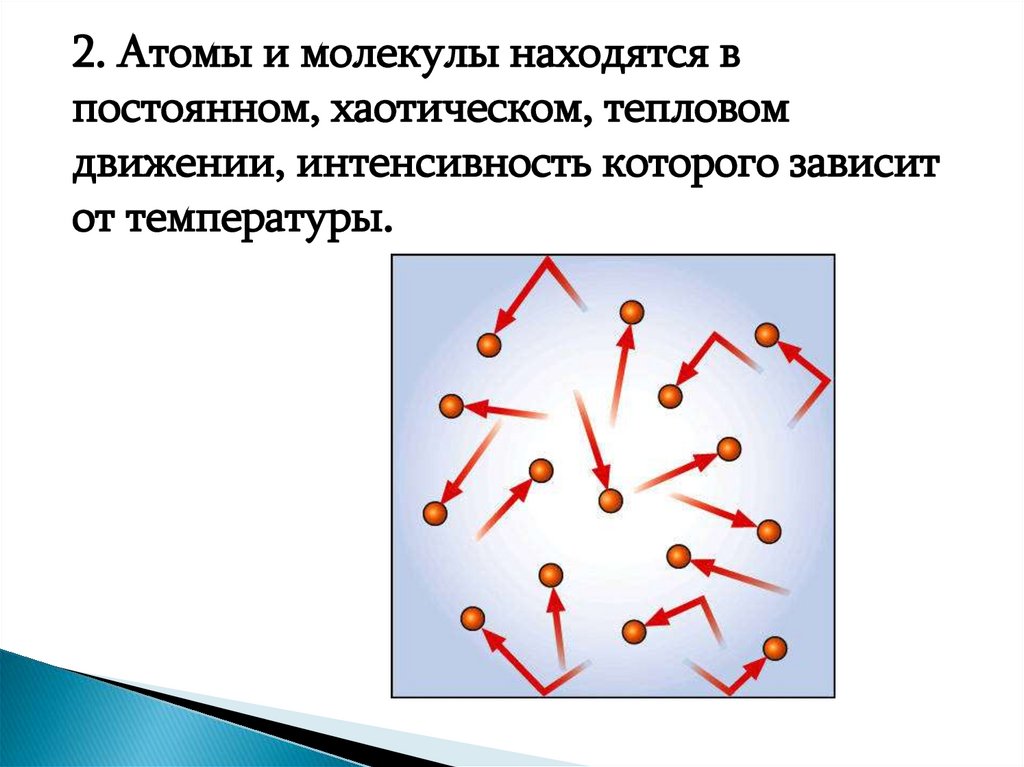
2. Атомы и молекулы находятся впостоянном, хаотическом, тепловом
движении, интенсивность которого зависит
от температуры.
6.
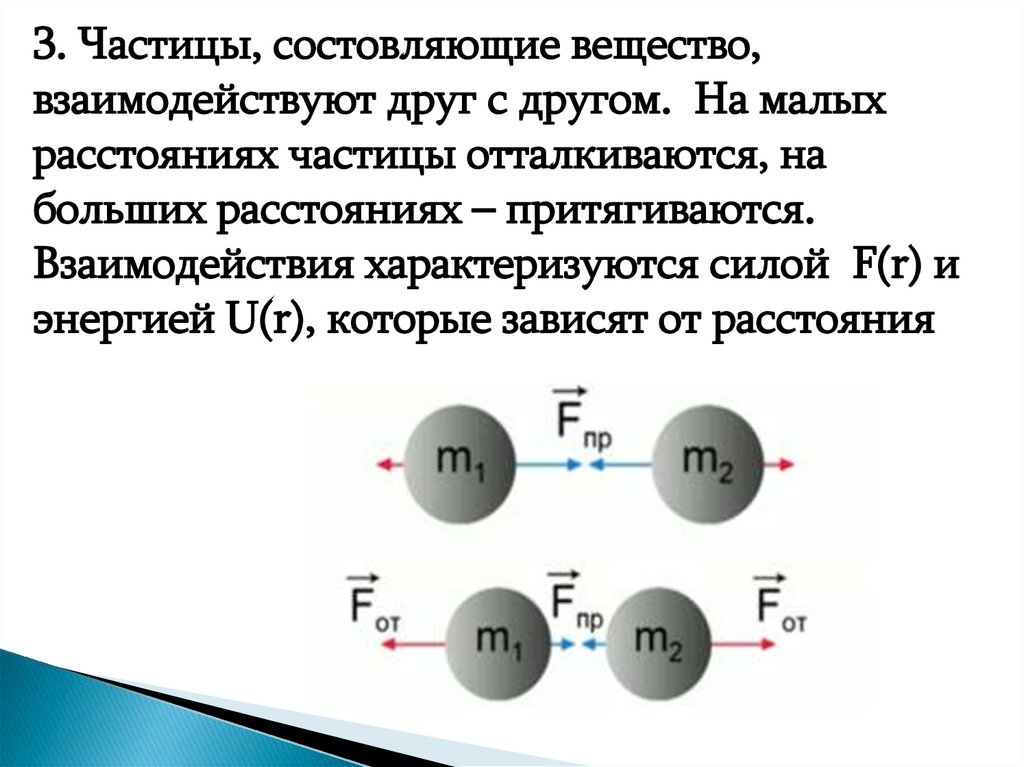
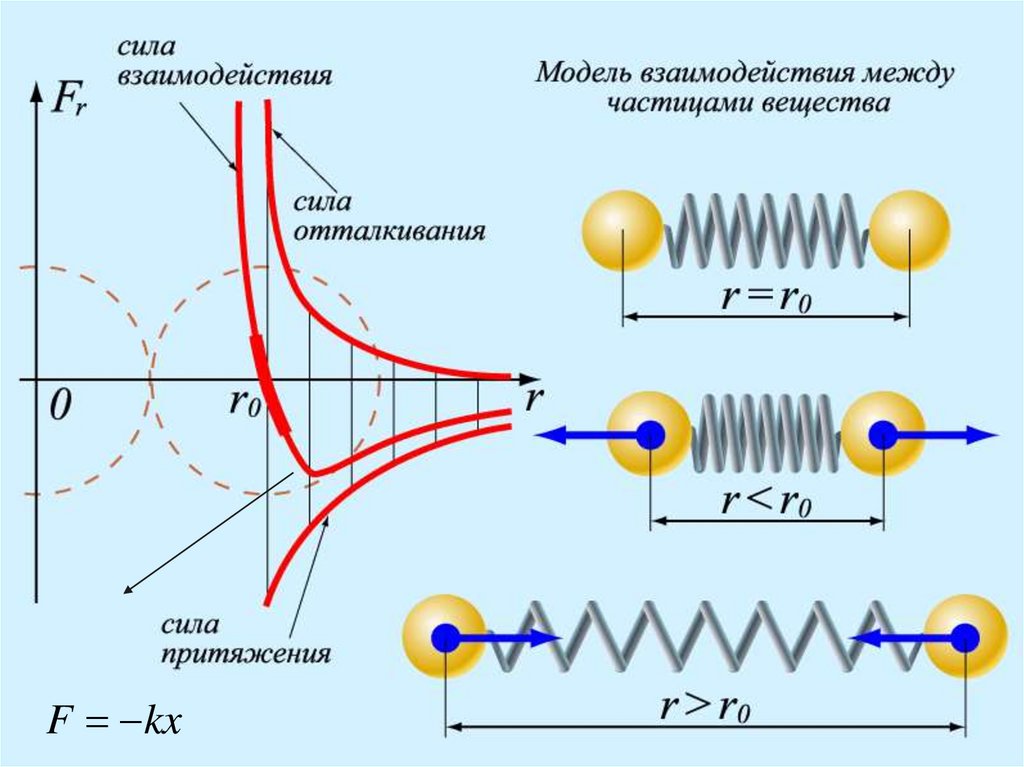
3. Частицы, состовляющие вещество,взаимодействуют друг с другом. На малых
расстояниях частицы отталкиваются, на
больших расстояниях – притягиваются.
Взаимодействия характеризуются силой F(r) и
энергией U(r), которые зависят от расстояния
7.
F kx8.
U r U от r U пр rU r
U от r
r0
r
U пр r
9.
dU rF r
U r
dr
dU r F r dr
U r F r dr
10. Расстояние , на котором силы притяжения и отталкивания уравновешивают друг друга, называется равновесным расстоянием. Ему
r0U min r r0
U r 0
F r 0
11.
Рассмотрим силы взаимодействиямежду нейтральными молекулами
вещества. Так как в их состав входят
положительно и отрицательно
заряженные частицы, то между ними
действуют слабые, не валентные силы
взаимодействия, которые имеют
природу притяжения и отталкивания
12.
• Схематически электрическинейтральная молекула состоит из
из двух равных по величине
разноименных зарядов,
расположенных на некотором
расстоянии друг от друга. Такая
система называется
электрическим диполем
13.
+q-q
l
ql
ql
Кл м
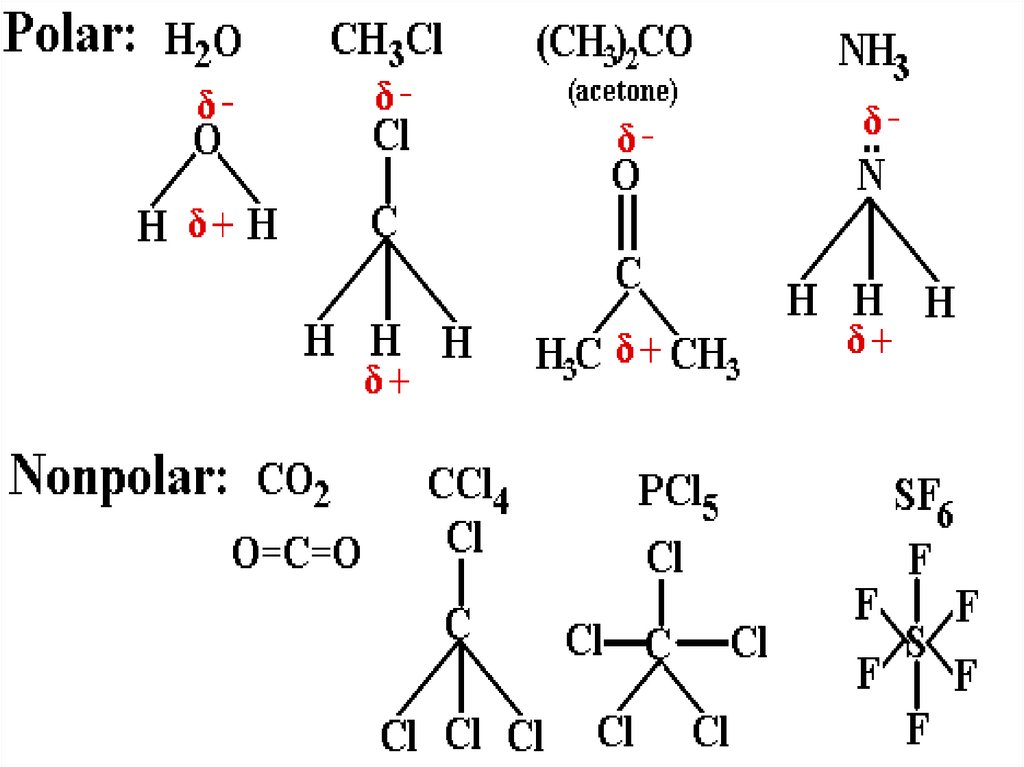
14. В зависимости от природы распределения электрического заряда в молекулах, они делятся на..
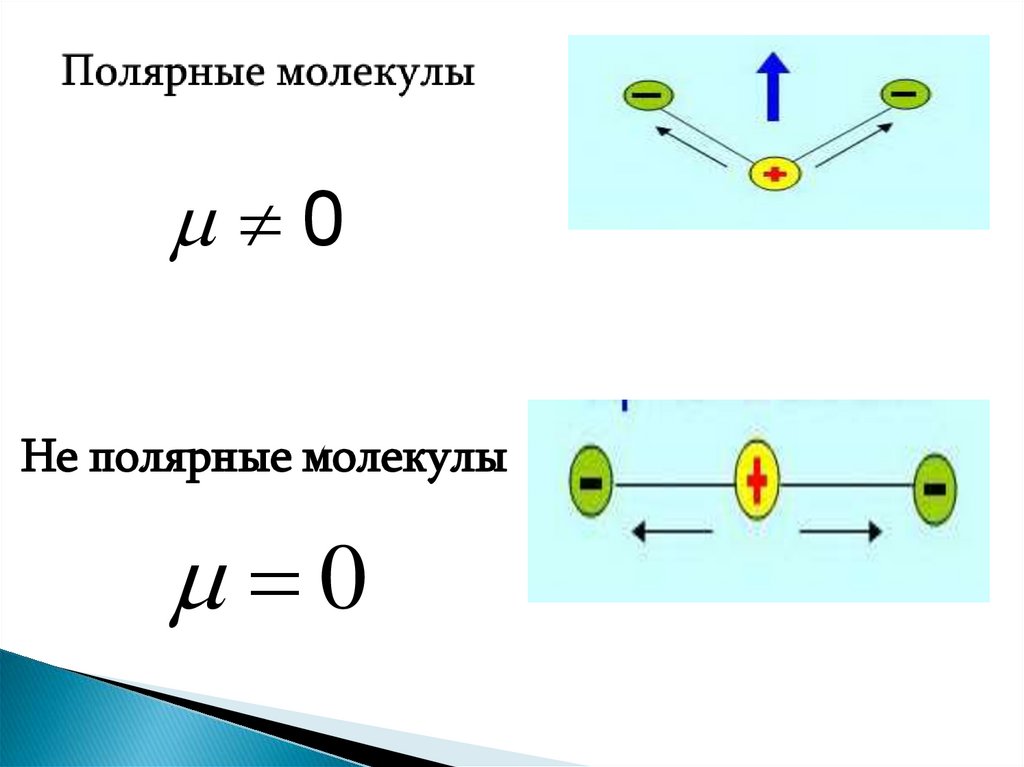
Полярные– центры распределения
положительного и отрицательного
зарядов не совпадают
Неполярные - центры распределения
положительного и отрицательного
зарядов совпадают
15.
16. Полярные молекулы
00
Не полярные молекулы
0
17. Типы взаимодействия между молекулами
• Электростатическое взаимодействие• Вандерваальсовское взаимодействие
• Водородная связь
18.
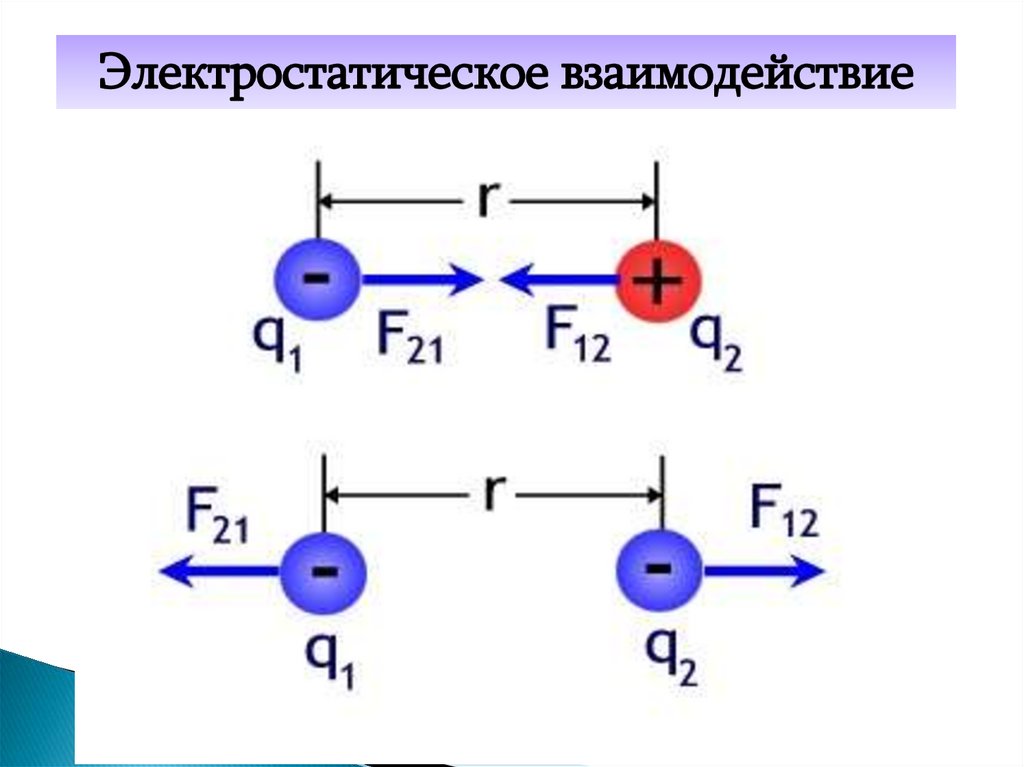
Электростатическое взаимодействие19. Сила электростатического взаимодействия
q1 q21 q1 q2
F k
2
2
r
4 0 r
0 8.85 10
12
Кл / Н м Ф / м
2
2
1
F~ 2
r
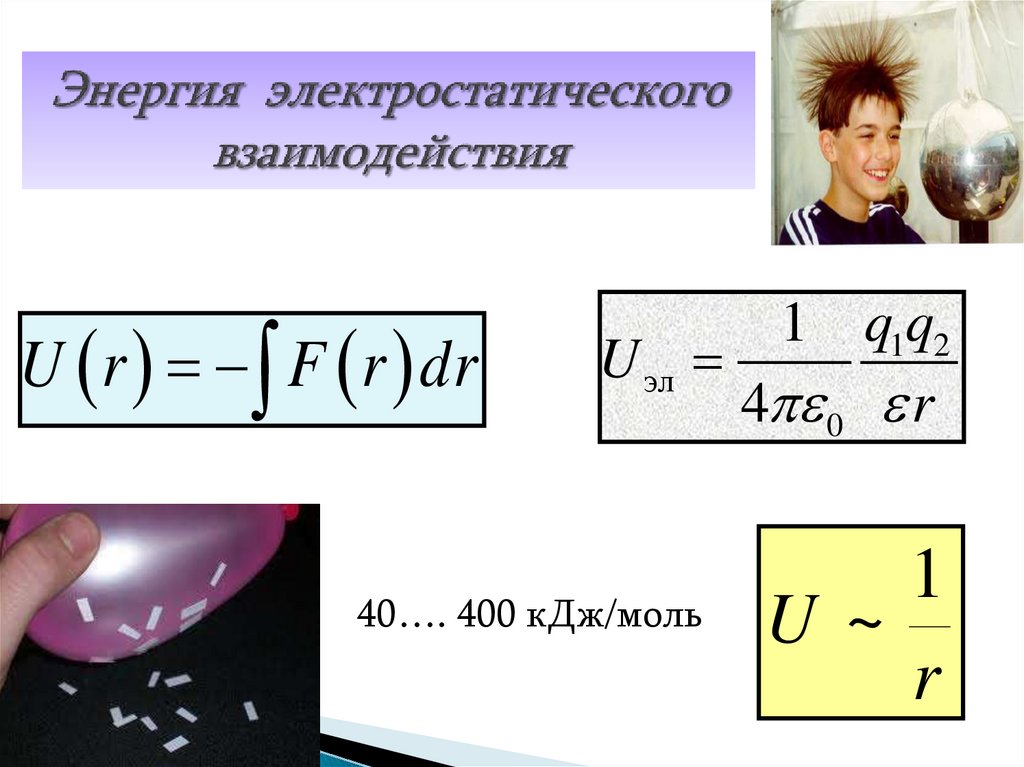
20. Энергия электростатического взаимодействия
U r F r dr1 q1q2
U эл
4 0 r
40…. 400 кДж/моль
1
U ~
r
21. Силы Ван-дер-Ваальса
Силы взаимодействия междунейтральными молекулами имеющие
только природу притяжения
называются силами Вандерваальса
1
F~ 7
r
1
U~ 6
r
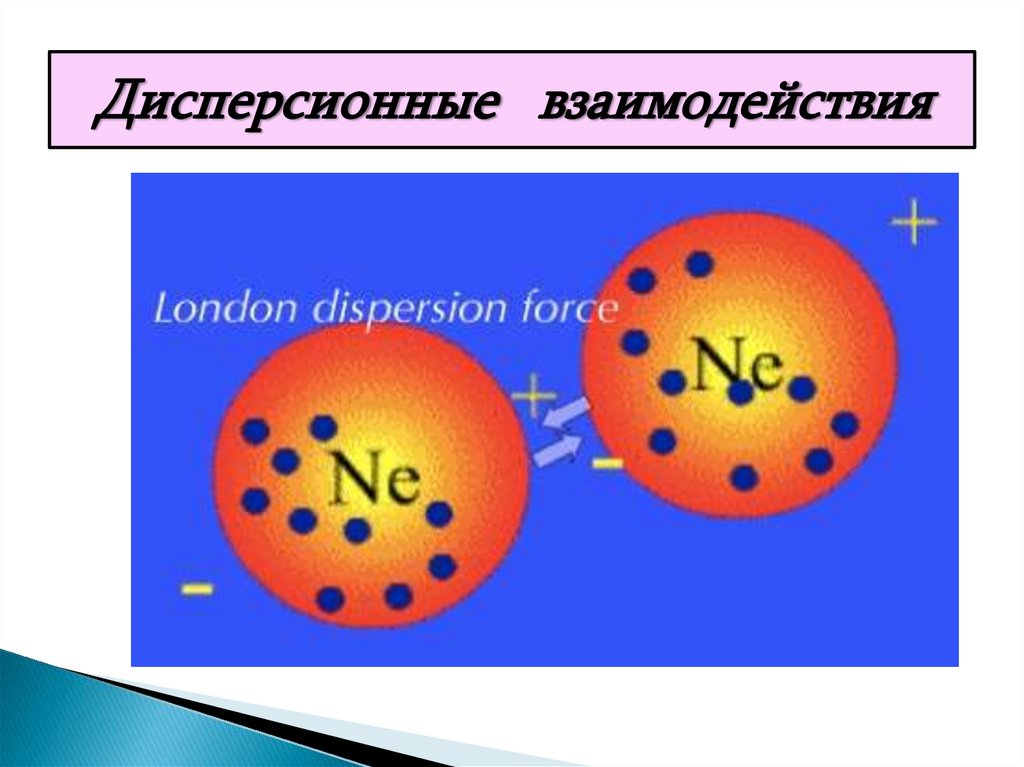
22. 1. Дисперсионные силы
Эти силы возникают в результатевозбуждения колебаний электронов в
молекуле под влиянием колебаний
электронов в другой молекуле. Колебания
электронов происходят в одинаковой фазе
и приводят к притяжению двух молекул.
4 40
кДж/моль
23. - потенциал ионизации - это энергия, необходимая для отрыва электрона. - степень поляризации - это способность электронной
3 I1I 2 1 2Uд
6
2 I1 I 2 r
I
E
24.
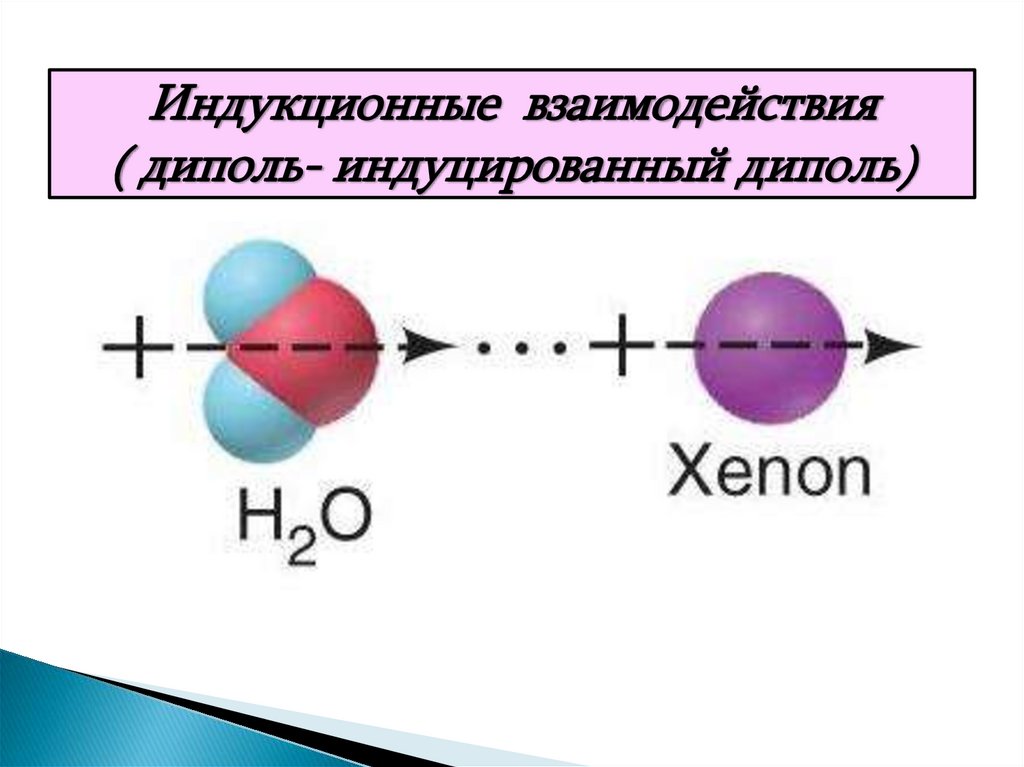
Дисперсионные взаимодействия25. 2. Индукционные силы ( диполь- индуцированный диполь)
Эти силы возникают между молекулами, обладающимивысокой поляризуемостью. Если молекулы достаточно
сближены, то под действием электрического поля одной
из них в другой возникает индуцированный дипольный
момент.
0.4кДж/моль
4
1
Uu
6
2 0 r
2
26.
Индукционные взаимодействия( диполь- индуцированный диполь)
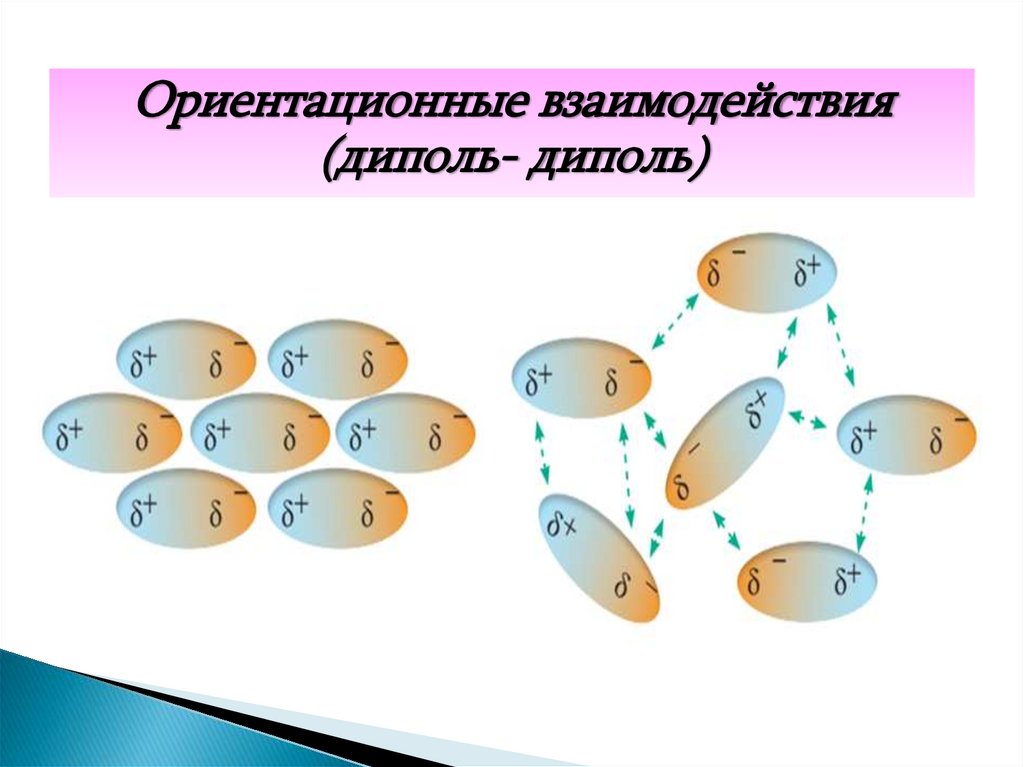
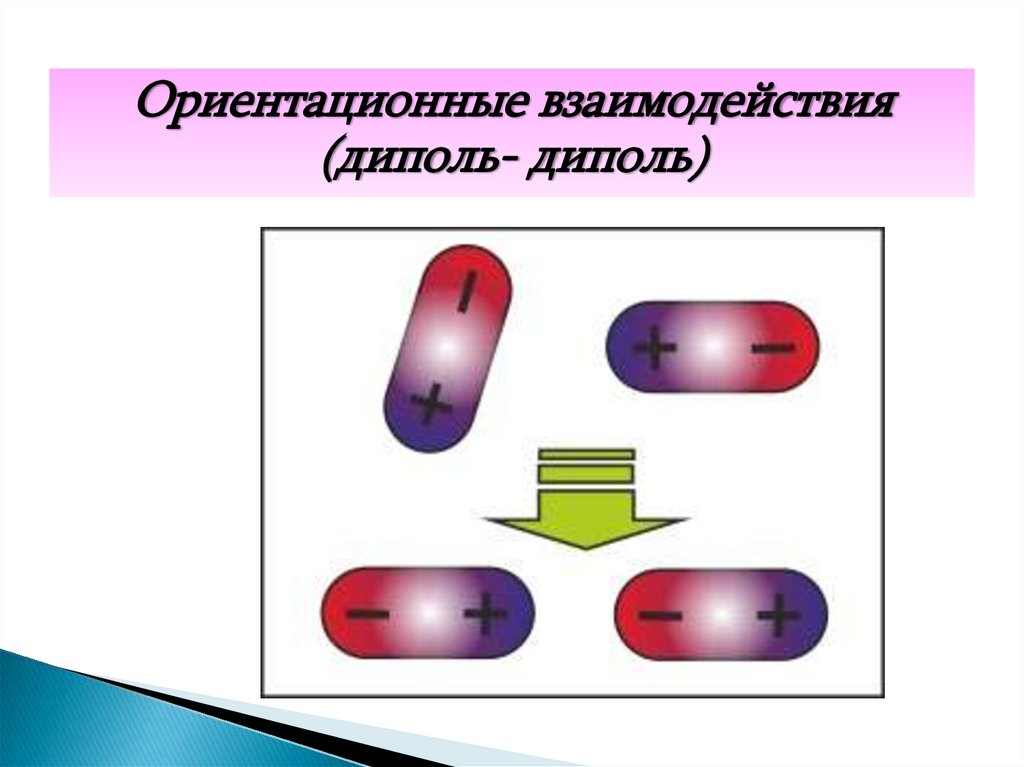
27. 3. Ориентационные силы (диполь- диполь)
Эти силы возникают между двумя молекулами,обладающими постоянными дипольными моментами,
и стремятся упорядоченно расположить молекулы
так, чтобы векторы дипольных моментов
ориентировались вдоль одной прямой. Такому
расположению препятствует тепловое движение
молекул
Uo
6
6 0 kT r
1
2
1
2
2
28.
Ориентационные взаимодействия(диполь- диполь)
29.
Ориентационные взаимодействия(диполь- диполь)
30.
Энергия вандерваальсовского притяженияA
U пр 6
r
Энергия отталкивания
B
U от n
r
n 8 13
A, B 0
31. В общем случае
A BU r 6 n
r
r
A
r
U r 6 Be
r
32.
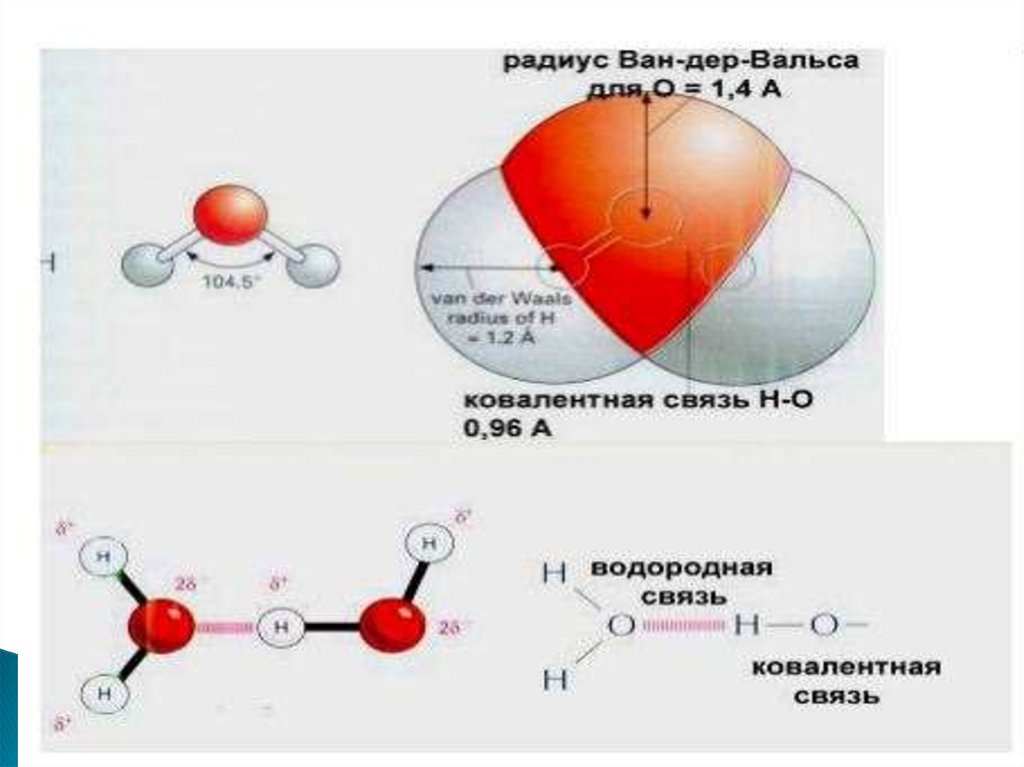
Водородная связьВодородная связь - короткодействующая
связь, которая образуется между
электроотрицательными атомами
O ,N ,S ,P
и атомом водорода
H
33. Свойства водородной связи
большая направленность в пространственасыщенность связи
определенная длина связи, которая
зависит от среды и элементов,
образующих эту связь
-12,6…-33,6 кДж/моль



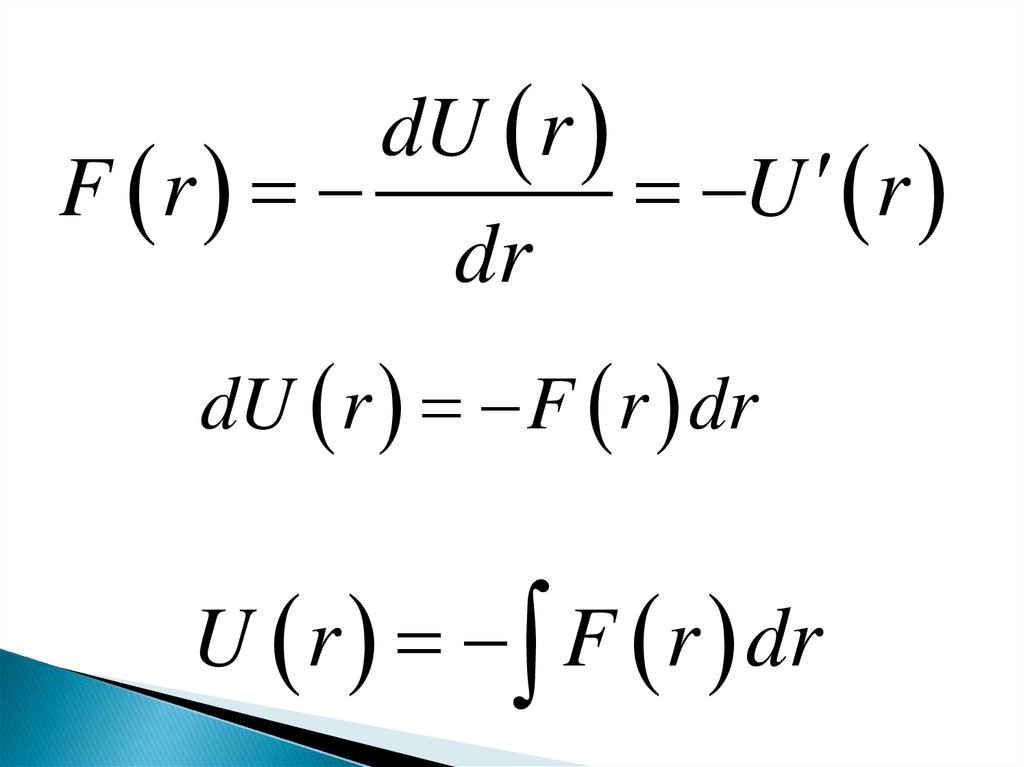



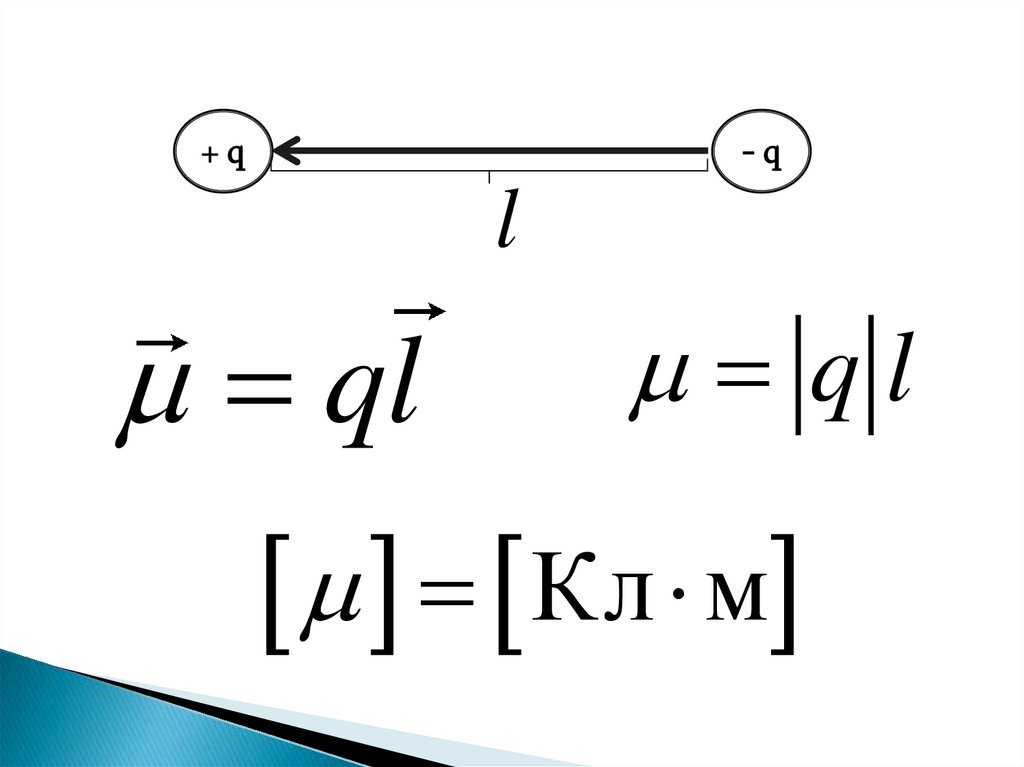












 chemistry
chemistry








