Similar presentations:
Кислоты: названия, получение, свойства, применение
1. Кислоты
.1. Названия
2. Получение
3. Свойства
4. Применение
2. Кислоты
это сложные вещества, имеющие в своемсоставе водород, способный замещаться на
металл, и кислотный остаток.
Н Cl
3. Узнай загадочную кислоту
“Из всех кислот она конечно, прима!Присутствует везде и зримо и не зримо.
В животных и в растеньях есть она.
С ней техника и медицина навсегда!
Ее потомство “ацетаты” - очень нужные
ребята,
всем известный “аспирин” - он как добрый
господин,
жар больного понижает и здоровье
возвращает!”
Уксусная кислота
4. Самая важная кислота
Для взрывчатых веществ нужна она,для красителей, лаков, лекарств идет
самая важная из кислот.
Фотопленка, целлулоид, полимеры,
удобренья – вот ее примененье.
Азотная кислота
5. Узнай загадочную кислоту
Алхимикам удалось получить этукислоту еще в X веке при прокаливании
некоторых сульфатов (купоросов).
Отсюда произошло ее историческое
название – купоросное масло.
Серная кислота
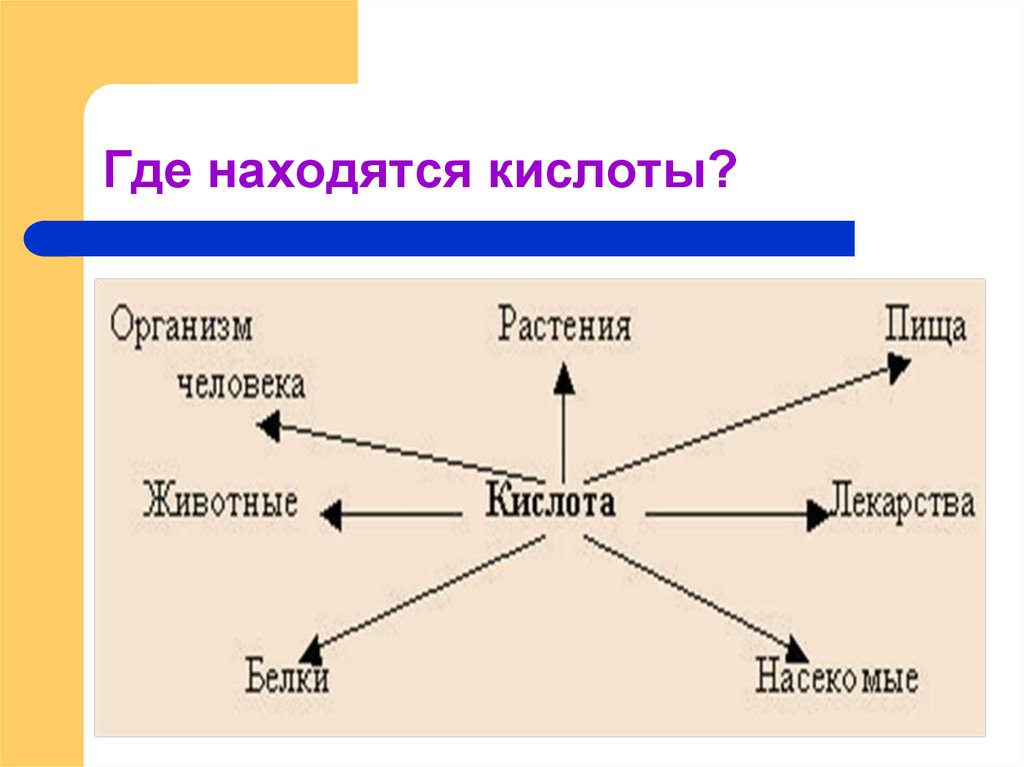
6. Где находятся кислоты?
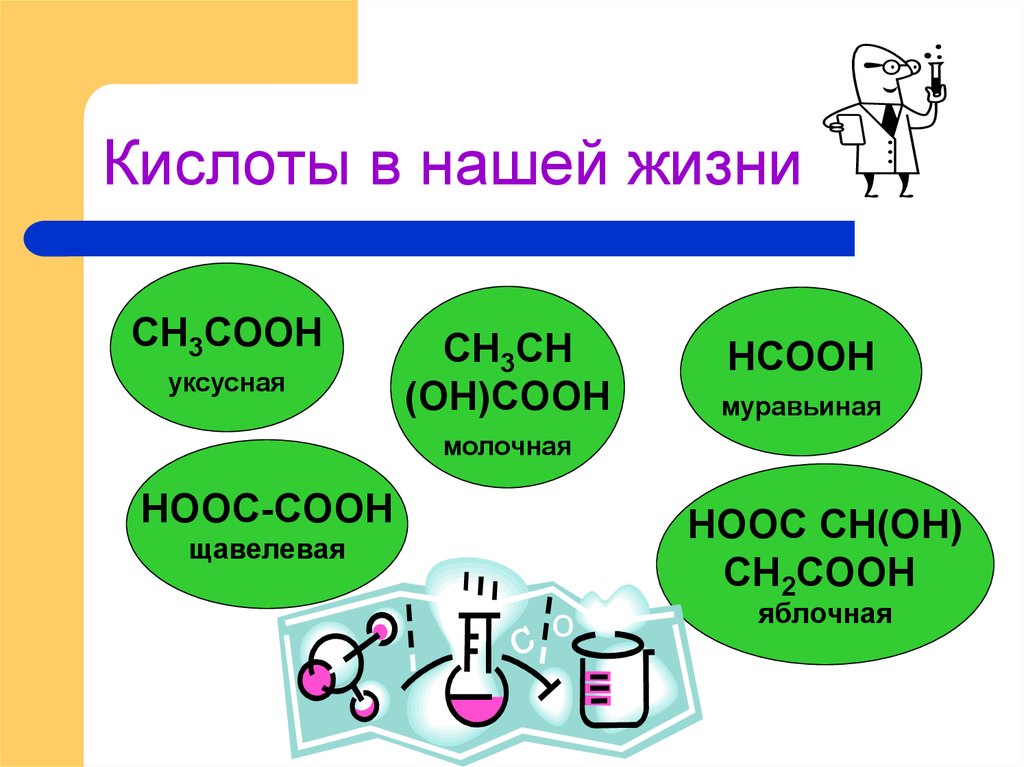
7. Кислоты в нашей жизни
СH3COОHуксусная
СH3CH
(OH)COОH
HCOОH
муравьиная
молочная
НOОС-COОH
щавелевая
НOОС СН(ОН)
СН2COОH
яблочная
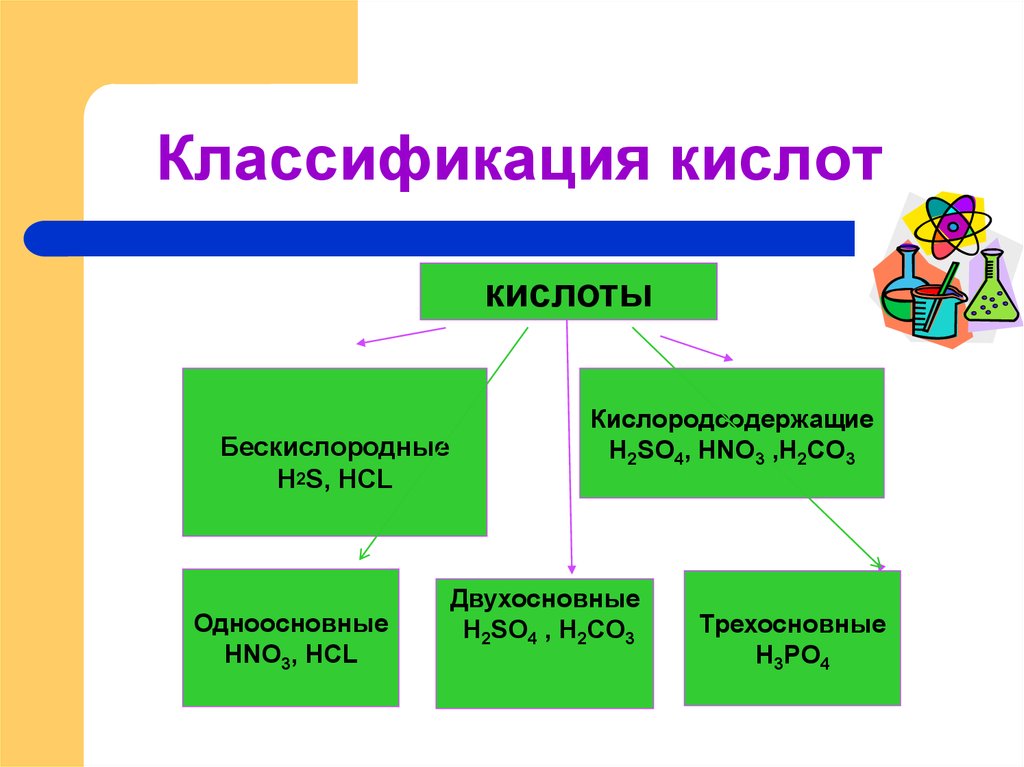
8. Классификация кислот
кислотыБескислородные
H2S, HCL
Одноосновные
HNO3, HCL
Кислородсодержащие
H2SO4, HNO3 ,H2CO3
Двухосновные
H2SO4 , H2CO3
Трехосновные
H3PO4
9. Получение кислот
10. Получение кислот
Кислотный оксид +Н2О = КислотаSO3 + Н2О = Н2SO4
Простое вещ-во + Простое вещ-во = Кислота
Н2 + Cl2 = 2НCl
Соль + Кислота = Нерастворимая кислота
Na2SiO3 + 2НCl = Н2SiO3 + 2NaCl
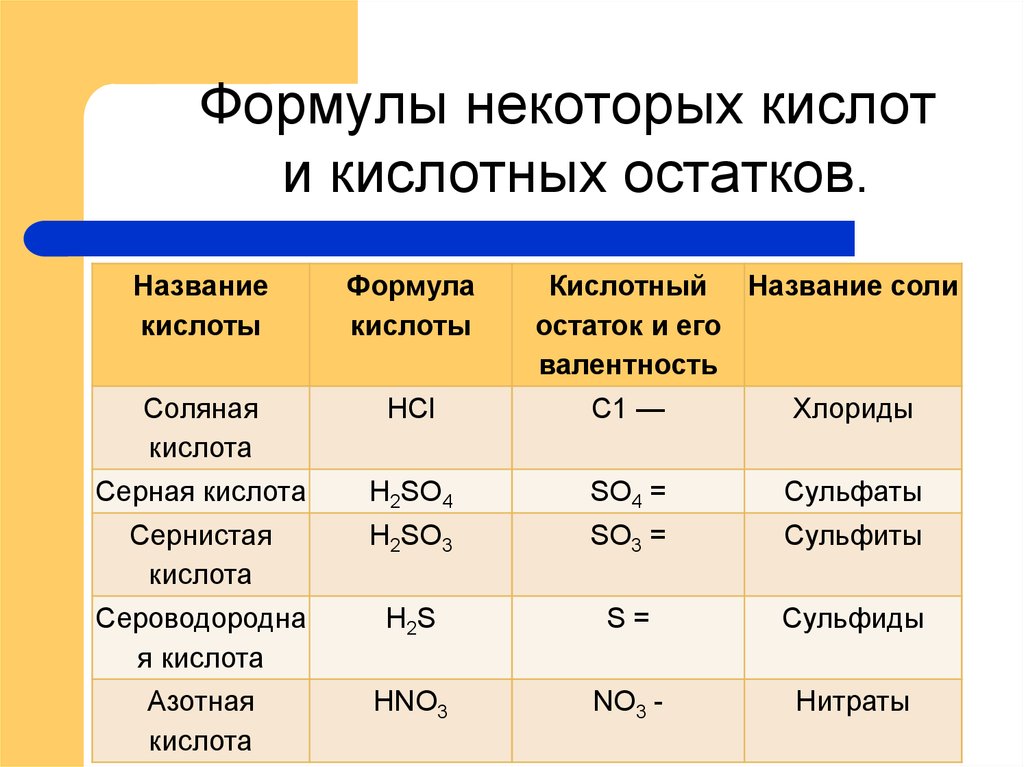
11. Формулы некоторых кислот и кислотных остатков.
Названиекислоты
Формула
кислоты
Кислотный Название соли
остаток и его
валентность
Соляная
кислота
НСl
С1 —
Хлориды
Серная кислота
H2SO4
SO4 =
Сульфаты
Сернистая
кислота
Н2SО3
SO3 =
Сульфиты
Сероводородна
я кислота
H 2S
S=
Сульфиды
Азотная
кислота
НNО3
NO3 -
Нитраты
12.
Азотистаякислота
НNО2
NO2 -
Нитриты
Угольная
кислота
Н2СО3
СOз=
Карбонаты
Кремниевая
кислота
Н2SiO3
SiO3 =
Силикаты
Бромоводород
ная кислота
НВr
Br —
Бромиды
Фтороводородн
ая кислота
HF
F-
Фториды
Иодоводородна
я кислота
HI
I—
Иодиды
13. Свойства кислот
14. Физические свойства кислот
а) жидкости (кроме кремниевой кислоты),б) без цвета,
в) без запаха,
г) кислые на вкус.
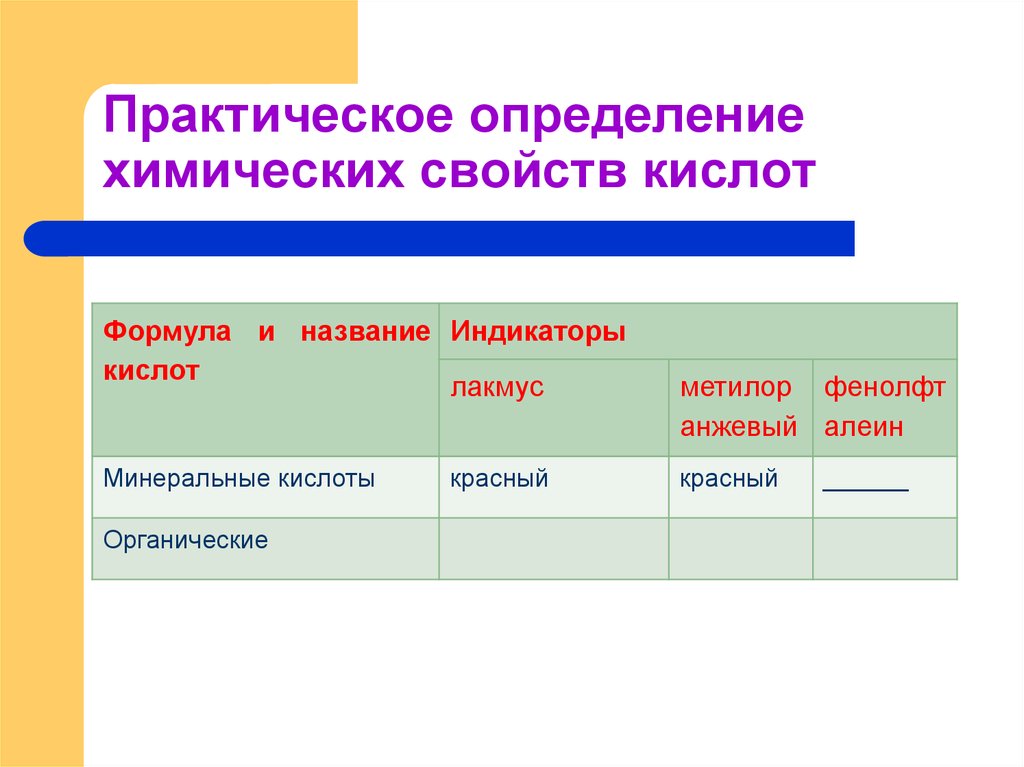
15. Практическое определение химических свойств кислот
Формула и название Индикаторыкислот
лакмус
Минеральные кислоты
Органические
красный
метилор фенолфт
анжевый алеин
красный
______
16. Химические свойства кислот
1.2.
3.
4.
5.
Действие индикатора.
Взаимодействие с металлами.
Взаимодействие с основными оксидами.
Взаимодействие с гидроксидами.
Взаимодействие с солями
17. Домашнее задание
§20,стр 76 таблицаКому было легко – упражнение 4,2,5;
Кто затруднялся - упражнение1;
Кому было трудно- конспект
урока.
Для желающих – составить
компьютерную презентацию
по данной теме.














 chemistry
chemistry








