Similar presentations:
Основные биохимические особенности трансформации органических ксенобиотиков
1.
Тема 3б:ОСНОВНЫЕ БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ
ТРАНСФОРМАЦИИ ОРГАНИЧЕСКИХ КСЕНОБИОТИКОВ
План лекции
Подготовительный метаболизм
Основные реакции, участвующие в подготовительном метаболизме.
Реакции окисления.
Оксигеназы: монооксигеназы и диоксигеназы.
Метанмонооксигеназа.
Разрыв ароматического кольца.
Орто- и мета-пути подготовительного метаболизма.
Реакции восстановления.
Реакции деградации.
Реакции конъюгации.
Особенности микроорганизмов – деструкторов органических
ксенобиотиков.
Особенности подбора и селекции микроорганизмов-деструкторов.
РХТУ АЕК
2.
Вопросы в экзаменационных билетах1. Биохимические механизмы деградации ксенобиотиков. Пути
подготовительного метаболизма.
2. Биохимические механизмы деградации ксенобиотиков. Первичное
гидроксилирование как первый этап подготовительного метаболизма
ксенобиотиков.
3. Биохимические особенности разложения фенолов. Орто- и мета- пути
расщепления фенолов.
4. Биохимические механизмы деградации ксенобиотиков. Биодеградация
галогенсодержащих ксенобиотиков.
5. Особенности микроорганизмов – деструкторов органических
ксенобиотиков. Принципы подбора и конструирования микроорганизмовдеструкторов и особенности их роста в присутствии ксенобиотиков.
Кн. 1, с. 309-344, 376-385
РХТУ АЕК
3.
ОСНОВНЫЕ ЭТАПЫ МИКРОБИОЛОГИЧЕСКОЙ ТРАНСФОРМАЦИИТранспорт
к клетке
Транспорт
в клетку
- диффузия
- конвекция
- растворение
- активный
- пассивный
Первичная атака
(периферийный
метаболизм)
Центральный
метаболизм
Транспорт
продуктов из
клетки
- частичная
деградация
- минерализация
Основные стадии взаимодействия органического ксенобиотика и клетки
РХТУ АЕК
4.
Последовательная трансформация органического ксенобиотика водно из соединений, вступающего затем в основные
(центральные) пути катаболического или анаболического обмена,
происходит в ходе подготовительного (периферийного)
метаболизма.
Микроорганизмы под воздействием ферментов переводят
природные и синтетические вещества в ключевые соединения
метаболизма – вещества, из которых синтезируются все
необходимые компоненты клетки и извлекается необходимая
энергия.
Ферменты, катализирующие подготовительный метаболизм,
обычно индуцибельные.
Основные реакции, участвующие в путях подготовительного
метаболизма:
1) реакции окисления,
2) восстановления,
3) деградации, включая гидролиз,
4) конъюгации.
РХТУ АЕК
5.
Реакции окисления.В аэробных условиях подготовительный метаболизм начинается с реакций
включения кислорода (гидроксилирования) в молекулу субстрата.
Участвуют ферменты – монооксигеназы и диоксигеназы.
Особая роль принадлежит монооксигеназам со смешанной функцией комплексу мембрано-связанных ферментов, включающих цитохромы P450 и NАDPH-цитохром-P-450-редуктазы.
R + NADPH + H+ + O2
монооксигеназа
R-OH + NADP+ + H2O ,
где NADPH – донор электронов, R – субстрат, R-OH – окисленный субстрат.
РХТУ АЕК
6.
Метанмонооксигеназа – у метанокисляющих бактерийCH4 + NADH + H+ +O2 CH3OH + NAD+ + H2O
Далее:
CH3OH HCHO HCOOH CO2
Две формы метанмонооксигеназы: растворимая
цитоплазматическая и нерастворимая, связанная с мембраной.
Растворимая метанмонооксигеназа не обладает субстратной
специфичностью и одновременно с метаном способна соокислять
его гомологи (этан, пропан, бутан и др.), алкены, трихлорэтилен,
ароматические соединения и их хлорированные гомологи, а также
NH3 до NH2OH. Этим обусловлено значение реакций, катализируемых
метанмонооксигеназой, для удаления различных органических
загрязнений из природных сред.
Диоксигеназы катализируют внедрение в молекулу субстрата обоих
атомов молекулы кислорода.
Играют важную роль в деградации таких природных соединений, как
фенолы и их производные, лигнины, алкалоиды, терпены и др.
Наиболее важные реакции подготовительного метаболизма,
осуществляемые диоксигеназами, – реакции, ответственные за
разрыв ароматического кольца.
РХТУ АЕК
7.
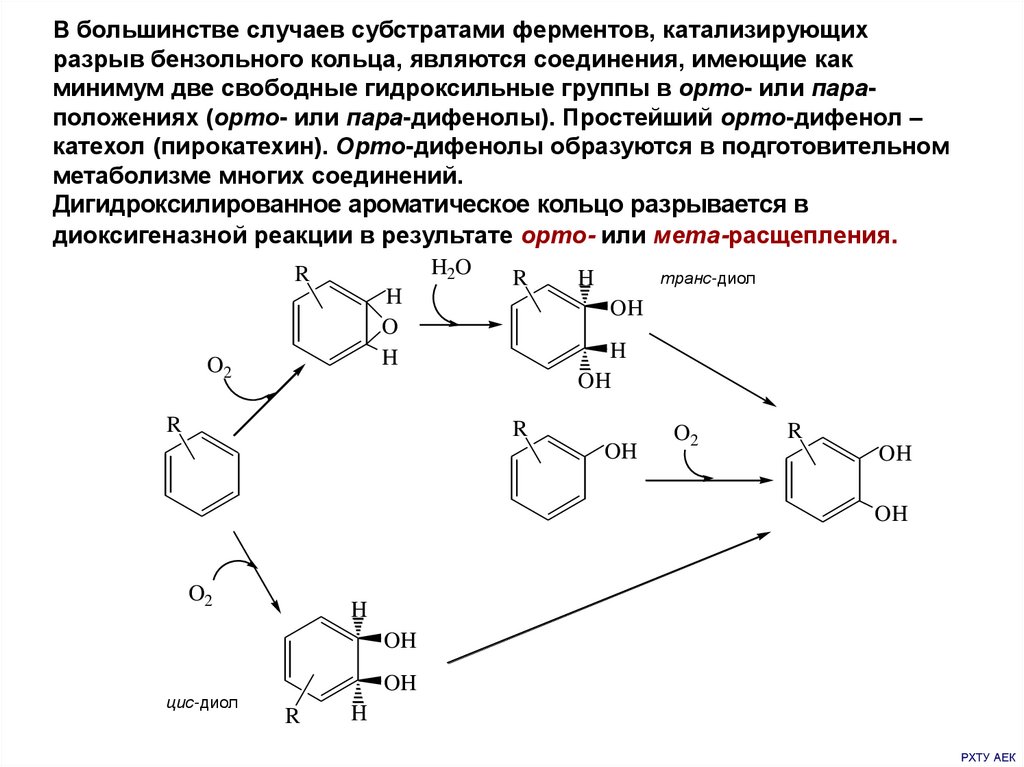
В большинстве случаев субстратами ферментов, катализирующихразрыв бензольного кольца, являются соединения, имеющие как
минимум две свободные гидроксильные группы в орто- или параположениях (орто- или пара-дифенолы). Простейший орто-дифенол –
катехол (пирокатехин). Орто-дифенолы образуются в подготовительном
метаболизме многих соединений.
Дигидроксилированное ароматическое кольцо разрывается в
диоксигеназной реакции в результате орто- или мета-расщепления.
H2O
R
H
O
H
O2
R
R
транс-диол
H
OH
H
OH
R
OH
O2
R
OH
OH
O2
H
OH
цис-диол
OH
R
H
РХТУ АЕК
8.
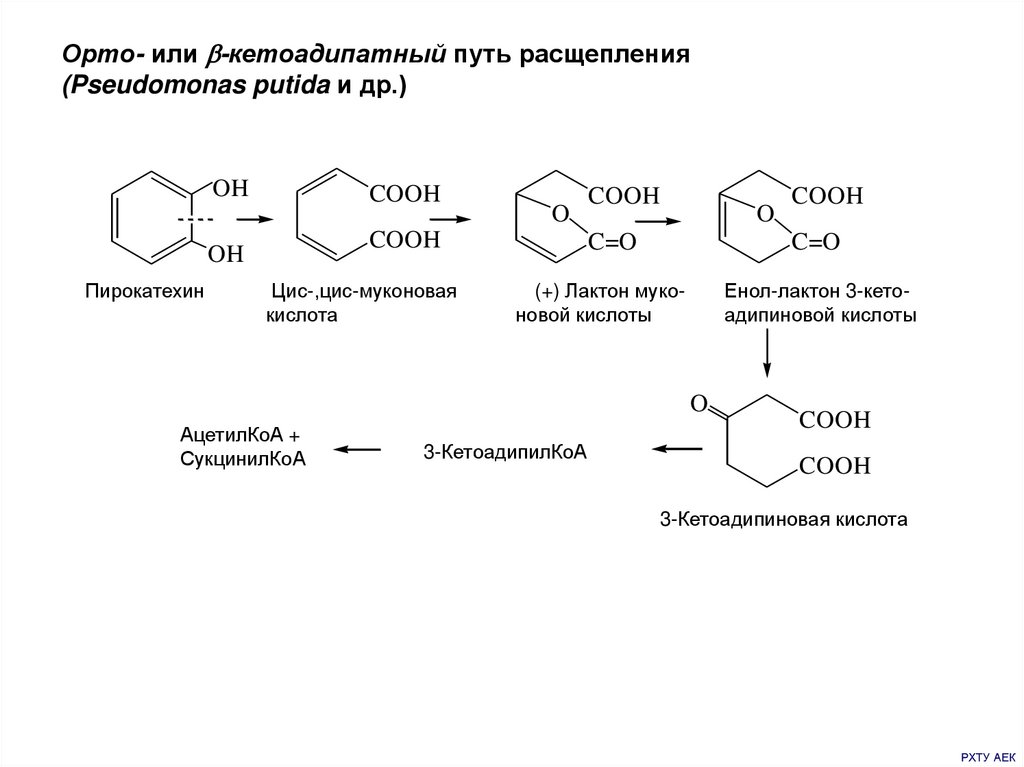
Орто- или -кетоадипатный путь расщепления(Pseudomonas putida и др.)
OH
COOH
COOH
OH
Пирокатехин
O
Цис-,цис-муконовая
кислота
COOH
O
C=O
C=O
(+) Лактон муконовой кислоты
Енол-лактон 3-кетоадипиновой кислоты
O
АцетилКоА +
СукцинилКоА
3-КетоадипилКоА
COOH
COOH
COOH
3-Кетоадипиновая кислота
РХТУ АЕК
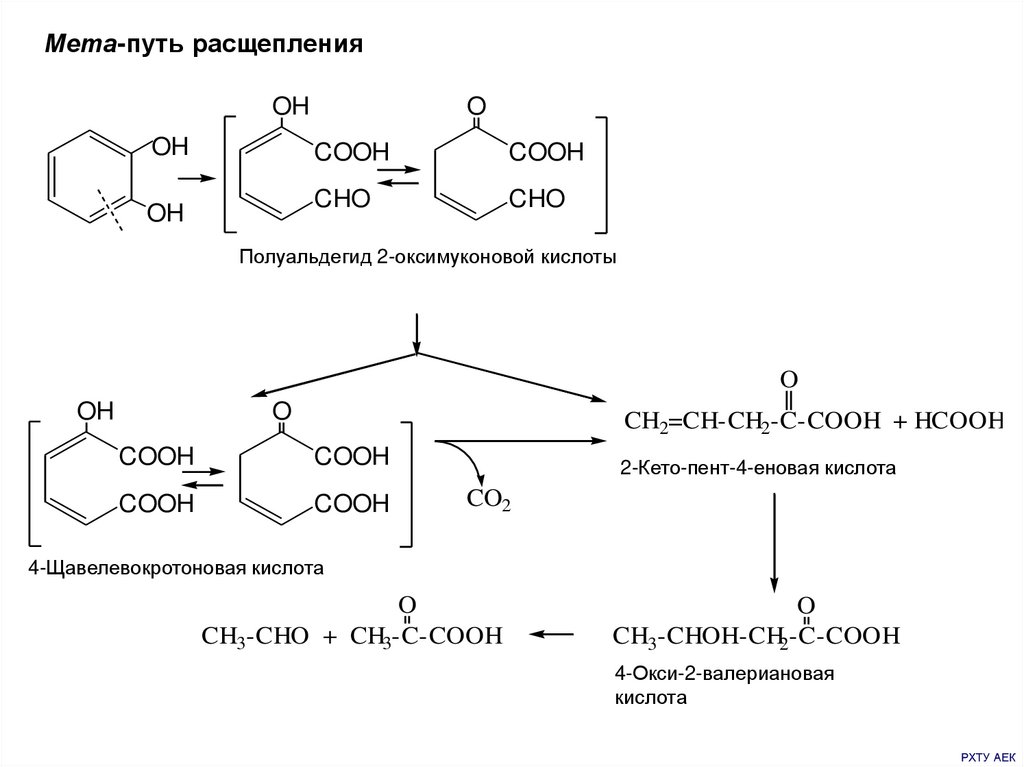
9.
Мета-путь расщепленияOH
OH
OH
O
COOH
COOH
CHO
CHO
Полуальдегид 2-оксимуконовой кислоты
O
OH
O
CH2=CH-CH2-C-COOH + HCOOH
COOH
COOH
COOH
COOH
2-Кето-пент-4-еновая кислота
CO2
4-Щавелевокротоновая кислота
O
CH3-CHO + CH3-C-COOH
O
CH3-CHOH-CH2-C-COOH
4-Окси-2-валериановая
кислота
РХТУ АЕК
10.
При мета-расщеплении ароматических колец микроорганизмы,как правило, растут быстрее, чем при орто-расщеплении. Однако
мета-расщепление
менее
эффективно
при
разложении
различных производных ароматических соединений, например
галогензамещенных,
поскольку
приводит
к
накоплению
промежуточных токсичных продуктов метаболизма и гибели
популяции микроорганизмов-деструкторов.
Гены, определяющие возможность орто-расщепления
ароматического кольца незамещенных фенолов, как правило,
содержатся в хромосоме, гены мета-расщепления
присутствуют в плазмидах биодеградации и определяют
разрыв кольца в метилированных фенольных соединениях.
Ферменты, катализирующие расщепление ароматического
кольца, – индуцибельные.
Орто- и мета-расщепление ароматического кольца способны
осуществлять бактерии, дрожжи и грибы.
РХТУ АЕК
11.
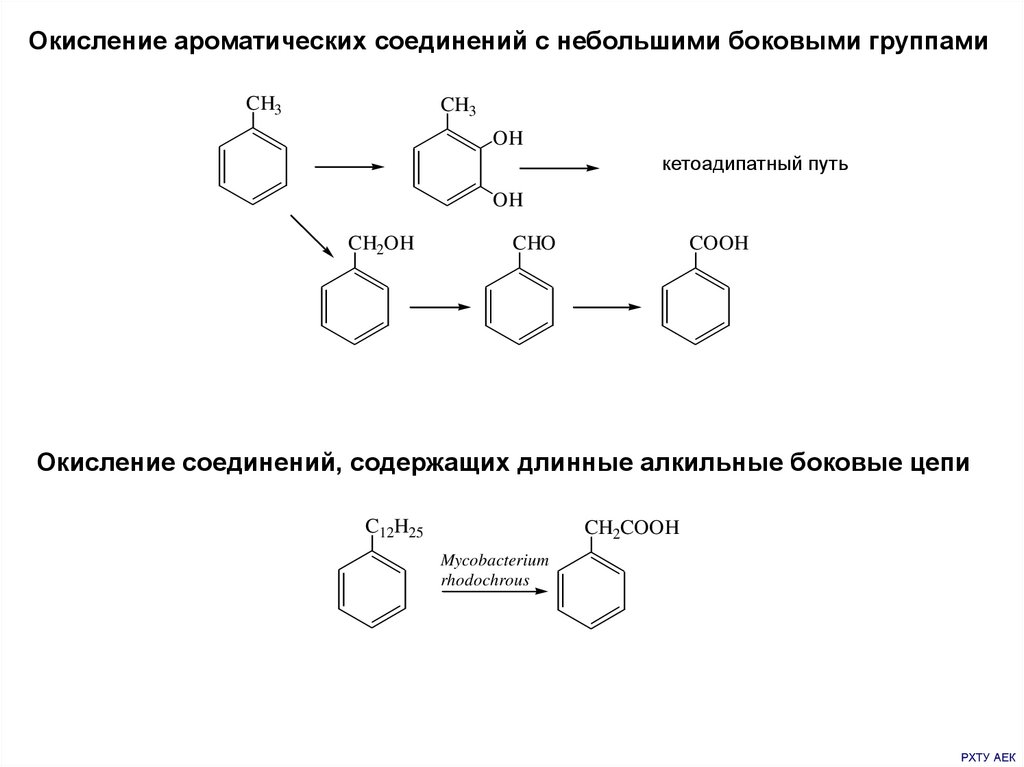
Окисление ароматических соединений с небольшими боковыми группамиCH3
CH3
OH
кетоадипатный путь
OH
CH2OH
CHO
COOH
Окисление соединений, содержащих длинные алкильные боковые цепи
C12H25
CH2COOH
Mycobacterium
rhodochrous
РХТУ АЕК
12.
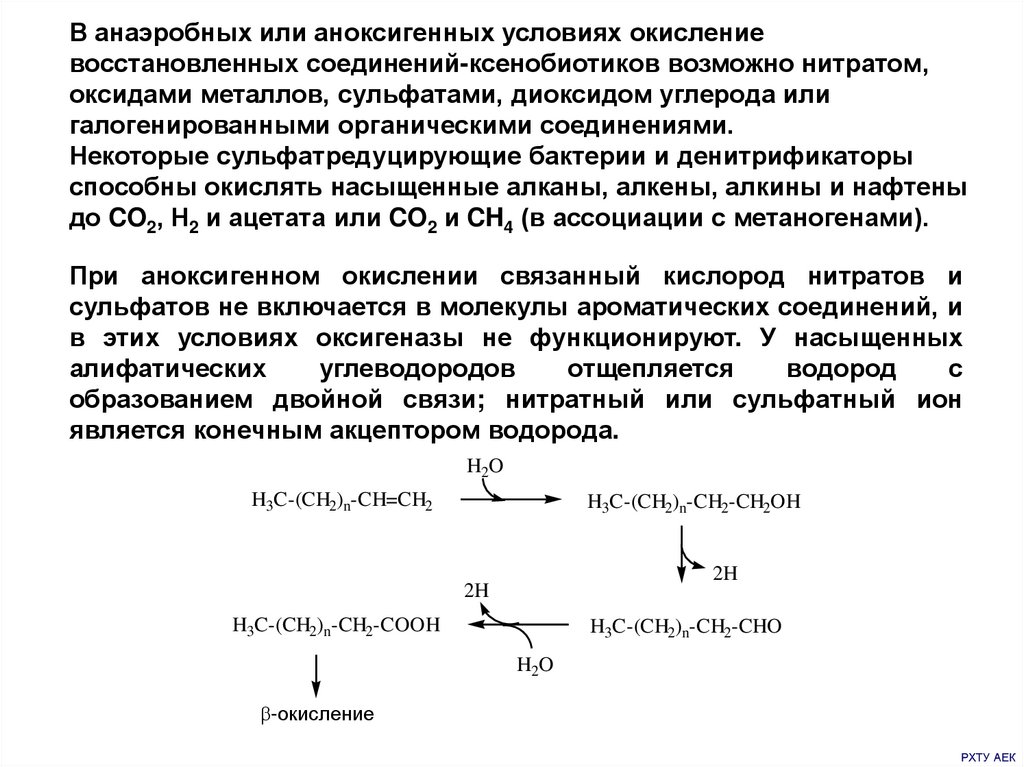
В анаэробных или аноксигенных условиях окислениевосстановленных соединений-ксенобиотиков возможно нитратом,
оксидами металлов, сульфатами, диоксидом углерода или
галогенированными органическими соединениями.
Некоторые сульфатредуцирующие бактерии и денитрификаторы
способны окислять насыщенные алканы, алкены, алкины и нафтены
до CO2, Н2 и ацетата или CO2 и CH4 (в ассоциации с метаногенами).
При аноксигенном окислении связанный кислород нитратов и
сульфатов не включается в молекулы ароматических соединений, и
в этих условиях оксигеназы не функционируют. У насыщенных
алифатических
углеводородов
отщепляется
водород
с
образованием двойной связи; нитратный или сульфатный ион
является конечным акцептором водорода.
H2O
H3C-(CH2)n-CH=CH2
H3C-(CH2)n-CH2-CH2OH
2H
2H
H3C-(CH2)n-CH2-COOH
H3C-(CH2)n-CH2-CHO
H2O
-окисление
РХТУ АЕК
13.
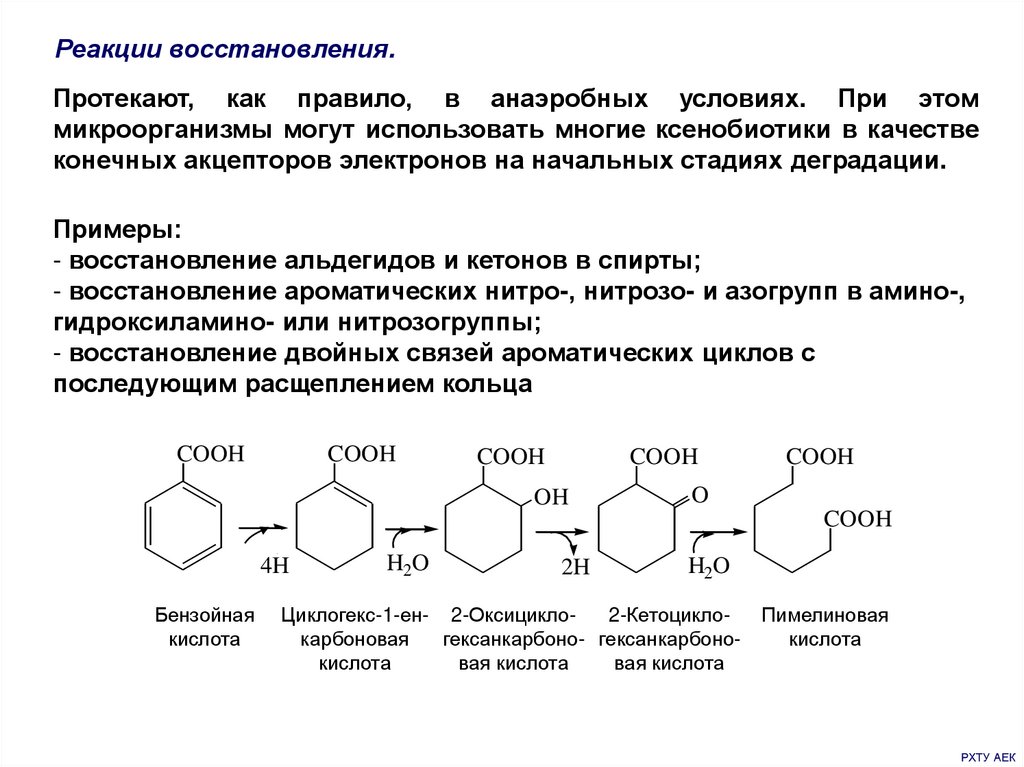
Реакции восстановления.Протекают, как правило, в анаэробных условиях. При этом
микроорганизмы могут использовать многие ксенобиотики в качестве
конечных акцепторов электронов на начальных стадиях деградации.
Примеры:
- восстановление альдегидов и кетонов в спирты;
- восстановление ароматических нитро-, нитрозо- и азогрупп в амино-,
гидроксиламино- или нитрозогруппы;
- восстановление двойных связей ароматических циклов с
последующим расщеплением кольца
COOH
COOH
COOH
COOH
OH
COOH
O
COOH
4H
Бензойная
кислота
H2O
2H
H2O
Циклогекс-1-ен- 2-Оксицикло2-Кетоциклокарбоновая
гексанкарбоно- гексанкарбонокислота
вая кислота
вая кислота
Пимелиновая
кислота
РХТУ АЕК
14.
Реакции деградации.Примеры:
- гидролиз эфиров, амидов, гидразидов и нитрилов, фосфатных и
полифосфатных групп;
- деалкилирование, при котором удаляются алкильные группы,
связанные с О, N, S и образуются фенолы, амины и тиолы;
- расщепление кольцевых структур (алициклические и
гетероциклические соединения), что важно для биодеградации
грибами лигнина и других природных полимеров.
РХТУ АЕК
15.
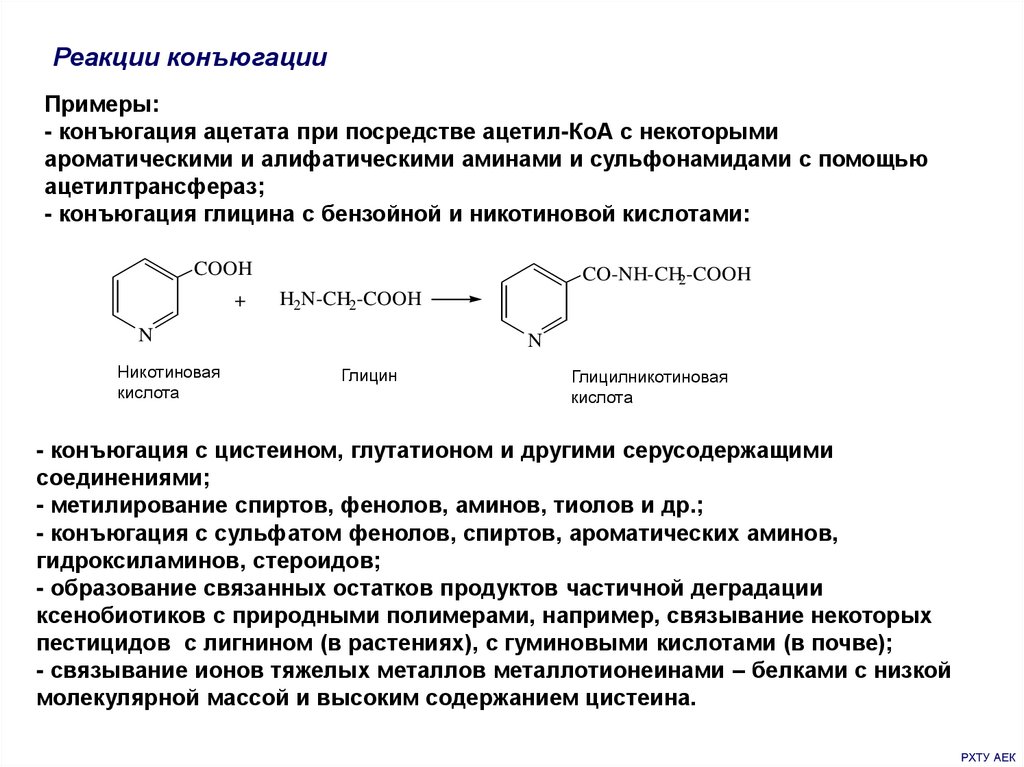
Реакции конъюгацииПримеры:
- конъюгация ацетата при посредстве ацетил-КоА с некоторыми
ароматическими и алифатическими аминами и сульфонамидами с помощью
ацетилтрансфераз;
- конъюгация глицина с бензойной и никотиновой кислотами:
COOH
+
CO-NH-CH2-COOH
H2N-CH2-COOH
N
Никотиновая
кислота
N
Глицин
Глицилникотиновая
кислота
- конъюгация с цистеином, глутатионом и другими серусодержащими
соединениями;
- метилирование спиртов, фенолов, аминов, тиолов и др.;
- конъюгация с сульфатом фенолов, спиртов, ароматических аминов,
гидроксиламинов, стероидов;
- образование связанных остатков продуктов частичной деградации
ксенобиотиков с природными полимерами, например, связывание некоторых
пестицидов с лигнином (в растениях), с гуминовыми кислотами (в почве);
- связывание ионов тяжелых металлов металлотионеинами – белками с низкой
молекулярной массой и высоким содержанием цистеина.
РХТУ АЕК
16.
ДегалогенированиеРасщепление связи C-Hal:
- дегалогеназы;
- спонтанное дегалогенирование нестабильных интермедиатов;
- ферменты с ослабленной субстратной специфичностью.
На способность галогенированного соединения вступать в тот или
иной тип реакции дегалогенирования влияет число атомов
галогена в молекуле соединения.
РХТУ АЕК
17.
1. Гидролитическоедегалогенирование
HH
Cl-C-C-Cl
HH
2. Замещение
глутатионом
HOOC
HCl
HS-Clut
H
Cl-C-Cl
H
3. Гидратация
H2O
HCl
H2O
Cl
H
Cl-C-S-Glut
H
HOOC
C C
H
4. Внутримолекулярное
замещение
OH
C C
H
H
HCl
H
HO O
H-C C C-H
H H H
HO HO Cl
H-C C C-H
H H H
COOH
5. Окислительное
дегалогенирование
HH
Cl-C-C-OH
HH
OH
Cl
OH
+ O2 + NADH + H+
+ NAD+ + CO2 + HCl
Cl
6. Дегидрогалогенирование
Cl
Cl
Cl
Cl
+ HCl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
H2
Cl
C C
7. Восстановительное
дегалогенирование
+ HCl
Cl
H
C C
Cl
HH
Cl-C-C-Cl
HH
HCl
H2
Cl
Cl
H
H
C C
2 HCl
H
H
РХТУ АЕК
18.
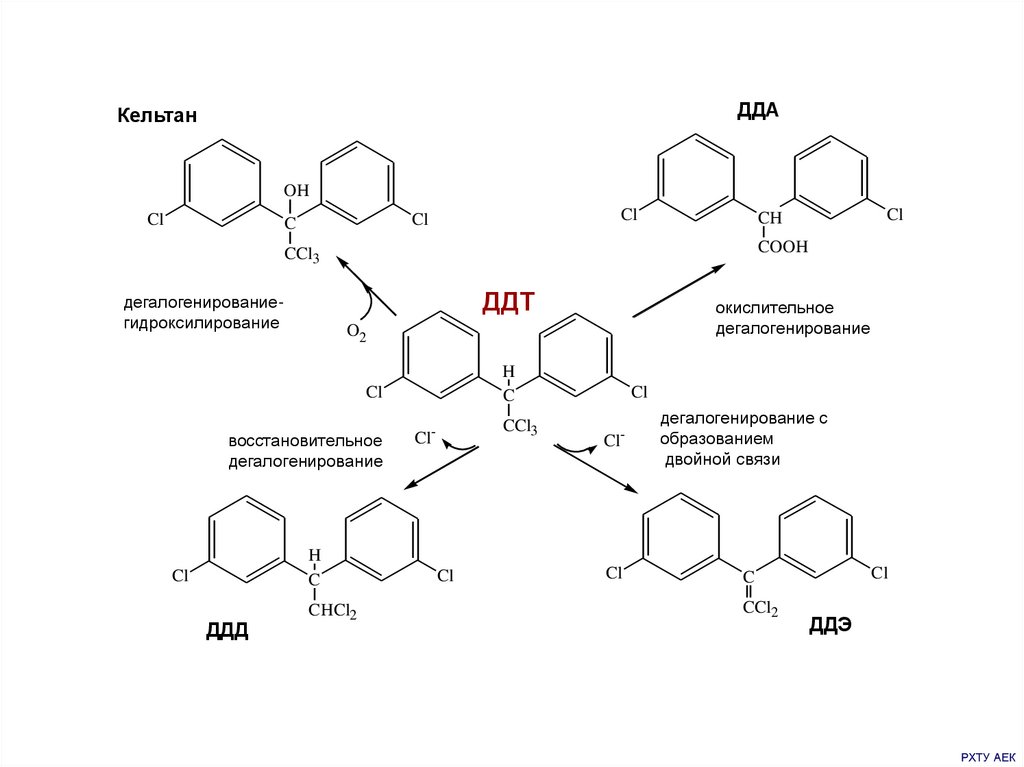
ДДАКельтан
OH
Cl
Cl
Cl
C
COOH
CCl3
ДДТ
дегалогенированиегидроксилирование
восстановительное
дегалогенирование
H
C
ДДД
окислительное
дегалогенирование
O2
H
C
Cl
Cl
Cl
CH
CHCl2
CCl3
-
Cl
Cl
Cl
Cl
дегалогенирование с
образованием
двойной связи
Cl
C
-
CCl2
Cl
ДДЭ
РХТУ АЕК
19.
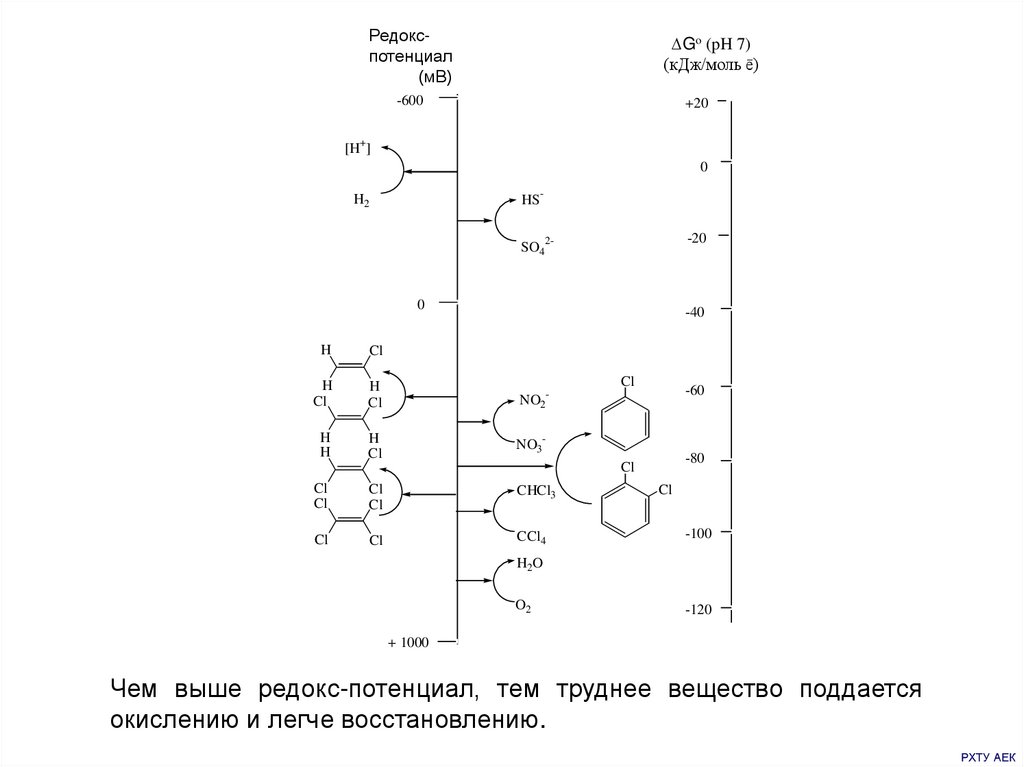
Редокспотенциал(мВ)
Go (pH 7)
(кДж/моль ē)
-600
+20
[H+]
0
HS-
H2
-20
SO42-
0
-40
H
Cl
H
Cl
H
Cl
NO2-
H
H
H
Cl
NO3-
Cl
-60
-80
Cl
Cl
Cl
Cl
Cl
CHCl3
Cl
Cl
CCl4
Cl
-100
H2O
O2
-120
+ 1000
Чем выше редокс-потенциал, тем труднее вещество поддается
окислению и легче восстановлению.
РХТУ АЕК
20.
Пример – трансформация перхлорэтилена.Cl
Cl анаэробноH
C
Cl
C
Cl
C
Cl
Перхлорэтилен
(тетрахлорэтилен)
Cl
C
C
Cl
Cl
Трихлорэтилен
восстановление
H
H
Cl
C
Cl
C
H
H
Дихлорэтилен
C
аэробно
минерализация
H
Винилхлорид
окисление
РХТУ АЕК
21.
ОСОБЕННОСТИ МИКРООРГАНИЗМОВ – ДЕСТРУКТОРОВОРГАНИЧЕСКИХ КСЕНОБИОТИКОВ
Ведущая роль – гетеротрофные микроорганизмы, особенно бактерии
(р. Pseudomonas и др.).
Смешанные популяции, как правило, быстрее и полнее разрушают
многие синтетические соединения.
Подбор и селекция микроорганизмов-деструкторов:
1. Выделение монокультуры или сообщества микроорганизмов (изолятов)
из различных природных или техногенных сред, загрязненных теми или
иными ксенобиотиками; лучше всего выделять микроорганизмы из мест с
застарелыми загрязнениями или с неоднократным поступлением
ксенобиотиков.
Для выделения таких изолятов эффективен метод накопительных культур,
при этом накапливают биологический материал для деградации веществазагрязнителя, как правило, на этом же субстрате либо на его легко
утилизируемых аналогах.
2. Использование уже известных штаммов-деструкторов (музейных
культур) или конструирование рекомбинантных штаммов на базе
существующих.
РХТУ АЕК
22.
Более легко адаптируются к потреблению субстрата-ксенобиотика:- микроорганизмы, у которых отсутствует только один из
ферментов подготовительного метаболизма;
- микроорганизмы, которые трансформируют синтетическое
соединение в одно из промежуточных соединений
подготовительного метаболизма его природного аналога уже на
первых этапах метаболизма.
Целесообразно сначала получить накопительную культуру с
использованием в качестве субстрата природного аналога данного
синтетического соединения или их смесь, а уж затем пытаться
адаптировать биодеструктор к потреблению ксенобиотика в
качестве единственного субстрата.
РХТУ АЕК
23.
В зависимости от условий получения необходимой массымикроорганизмов-деструкторов возможны два варианта
биоочистки и биоремедиации.
Первый вариант – обеспечение роста естественной микрофлоры,
включающей биодеструкторов, – для участков с застарелыми
загрязнениями, где почти всегда обитает дикая, аборигенная
микрофлора, способная их трансформировать. Такие загрязнения
можно удалять in situ (по месту) без внесения биопрепаратов.
Второй вариант – предварительное получение биологически
активного штамма, накапливание жизнеспособных клеток и
внесение в виде биопрепарата в загрязненную среду. Этот вариант
целесообразно применять в северных регионах и при обработке
мест с незастарелыми загрязнениями.
РХТУ АЕК
24.
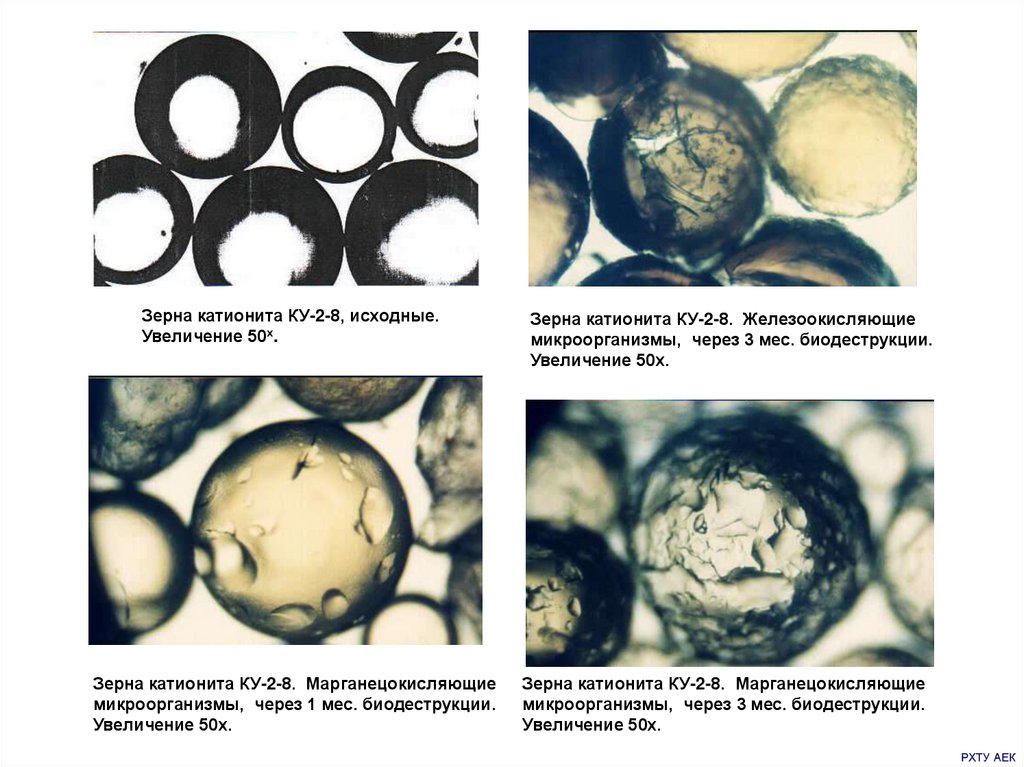
Зерна катионита КУ-2-8, исходные.Увеличение 50х.
Зерна катионита КУ-2-8. Марганецокисляющие
микроорганизмы, через 1 мес. биодеструкции.
Увеличение 50х.
Зерна катионита КУ-2-8. Железоокисляющие
микроорганизмы, через 3 мес. биодеструкции.
Увеличение 50х.
Зерна катионита КУ-2-8. Марганецокисляющие
микроорганизмы, через 3 мес. биодеструкции.
Увеличение 50х.
РХТУ АЕК
25.
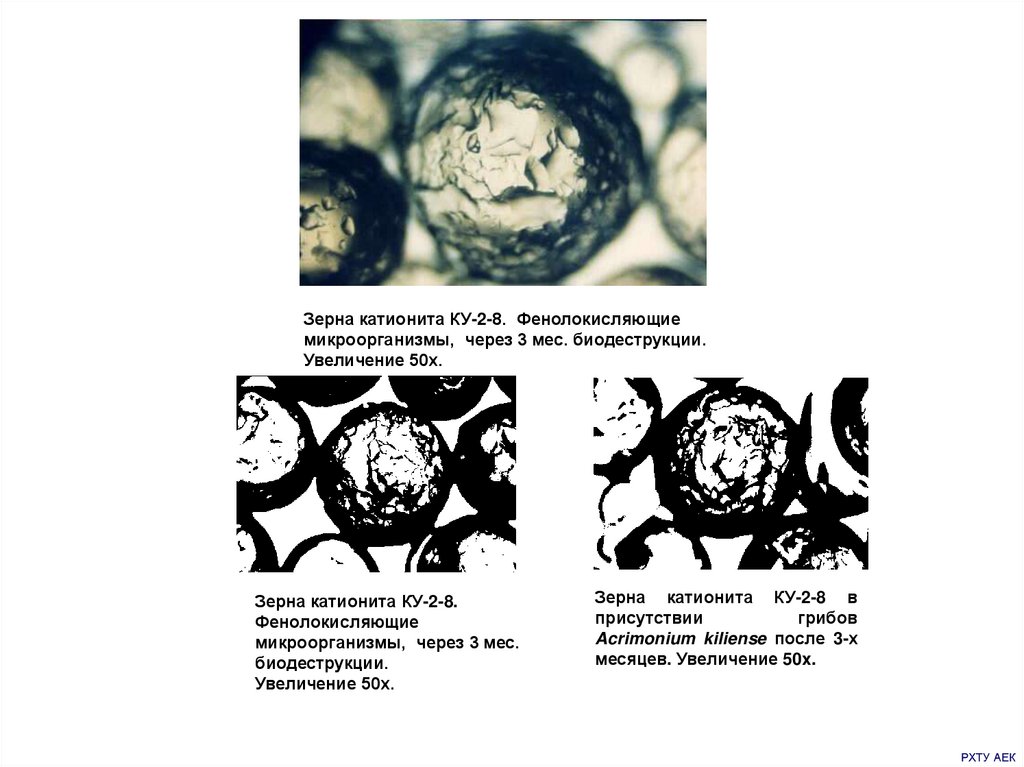
Зерна катионита КУ-2-8. Фенолокисляющиемикроорганизмы, через 3 мес. биодеструкции.
Увеличение 50х.
Зерна катионита КУ-2-8.
Фенолокисляющие
микроорганизмы, через 3 мес.
биодеструкции.
Увеличение 50х.
Зерна катионита КУ-2-8 в
присутствии
грибов
Acrimonium kiliense после 3-х
месяцев. Увеличение 50x.
РХТУ АЕК














 chemistry
chemistry








