Similar presentations:
Ферменты: классификация и применение. Тема 7
1.
Ферменты: классификацияи применение
2.
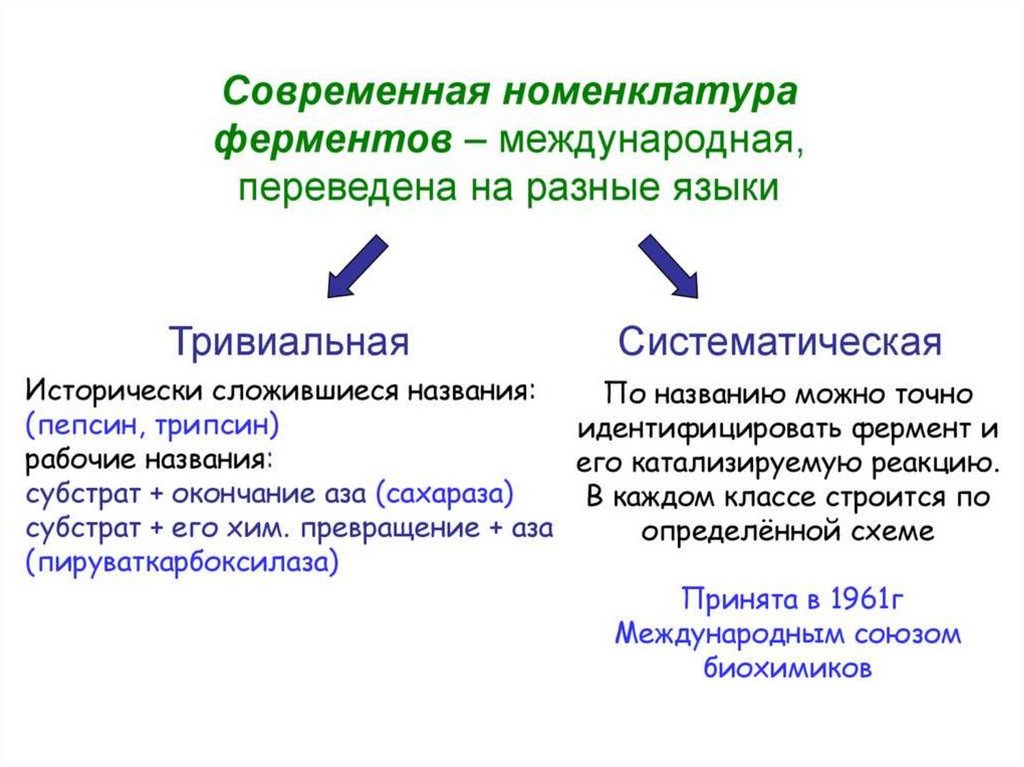
Классификация ферментовНоменклатура ферментов была введена
Международным биохимическим союзом.
Ферменты классифицируют в соответствии
с
типом
реакции,
который
они
катализируют.
Реакции
и
ферменты,
которые
их
катализируют,
подразделяются
на
6
классов, в каждом из которых имеется
несколько подклассов.
3.
4.
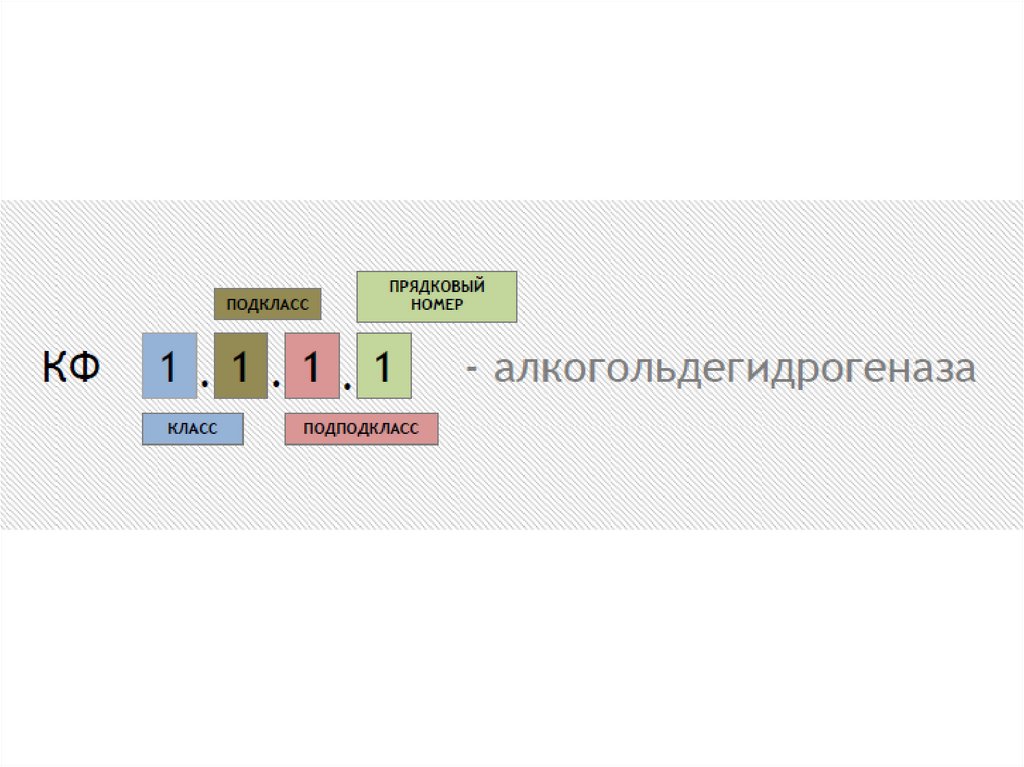
Каждыйфермент
имеет
кодовый
номер
по
классификации ферментов (КФ). В англоязычном
варианте номер фермента по этой классификации
обозначается как EC (Enzyme Classification).
Расшифровка:
- первая цифра характеризует класс реакции (от 1 до 6)
- вторая — подкласс, характеризует основные виды
субстратов, участвующих в данном типе химических
реакций
- третья — подподкласс, определяет более частные
подгруппы, отличающиеся природой химических
соединений доноров или акцепторов, участвующих в
данной подгруппе реакций.
- четвертая цифра, указывает порядковый номер
фермента в его подподклассе.
5.
Пример: фермент КФ 2.7.1.1 (EC 2.7.1.1)Расшифровка:
-фермент относится к классу 2 (трансфераза),
-подклассу 7 (перенос фосфата с АТФ)
-подподклассу 1 (акцептором фосфата является
спирт).
-последняя
цифра
обозначает
фермент
гексокиназу:
Результат:
фермент
D-гексозо-6фосфотрансфераза, фермент, катализирующий
перенос фосфата с АТФ на гидроксильную
группу атома углерода в шестом положении
глюкозы.
6.
7.
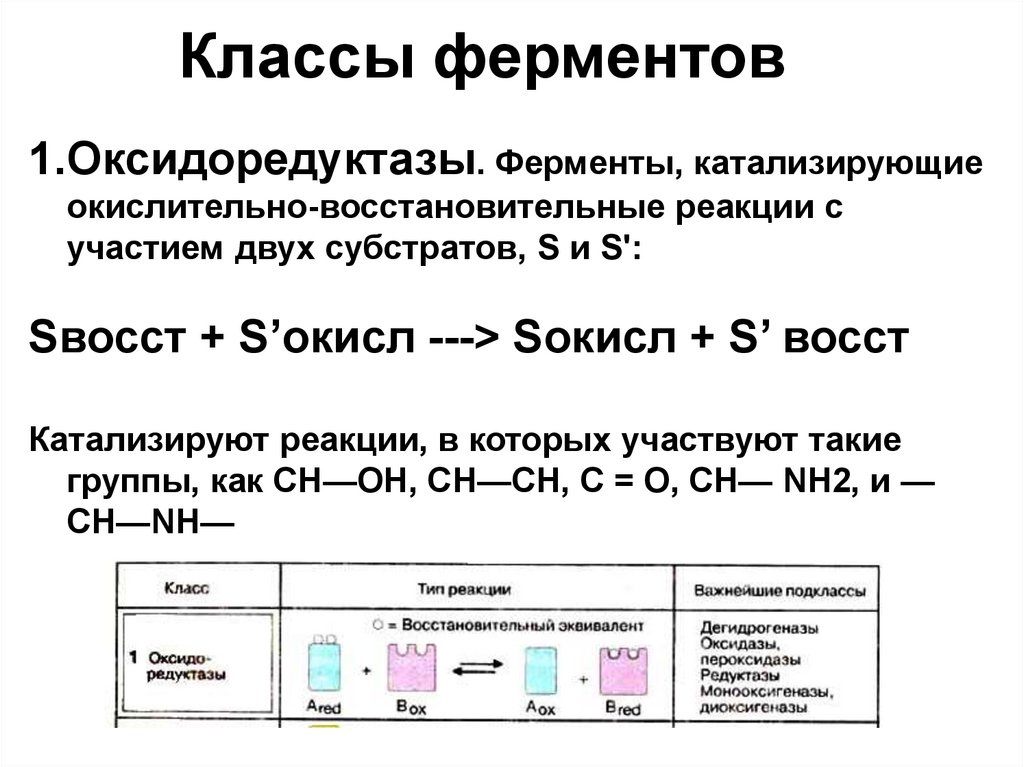
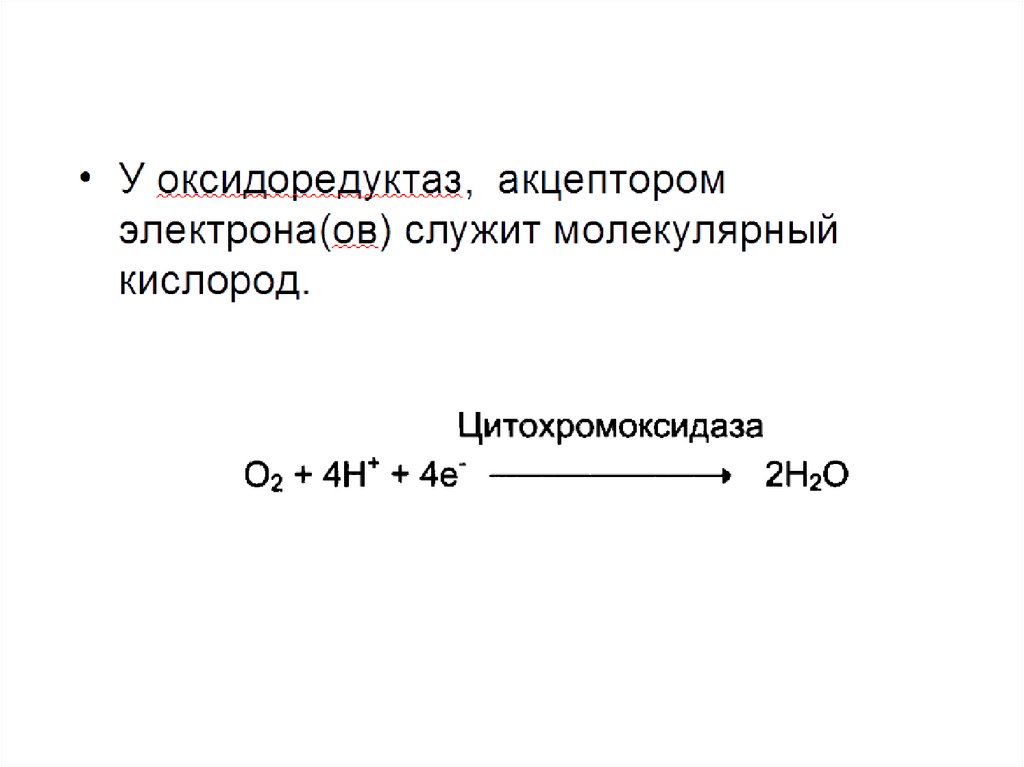
Классы ферментов1.Оксидоредуктазы. Ферменты, катализирующие
окислительно-восстановительные реакции с
участием двух субстратов, S и S':
Sвосст + S’окисл ---> Sокисл + S’ восст
Катализируют реакции, в которых участвуют такие
группы, как СН—ОН, СН—СН, С = О, СН— NH2, и —
СН—NH—
8.
9.
10.
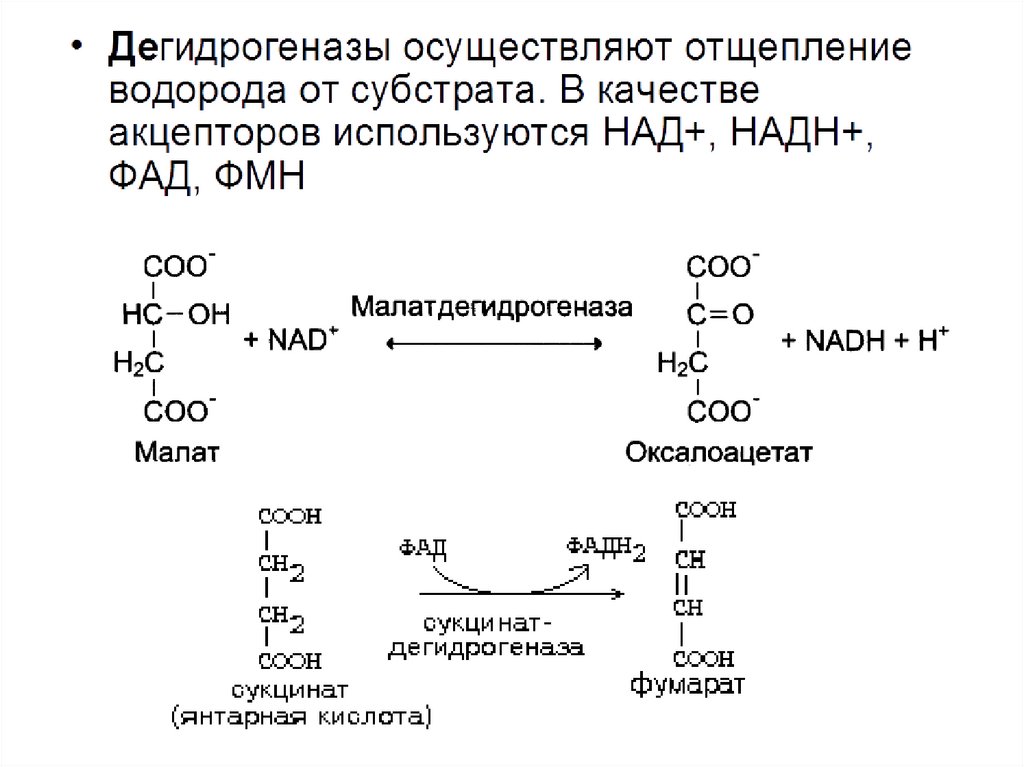
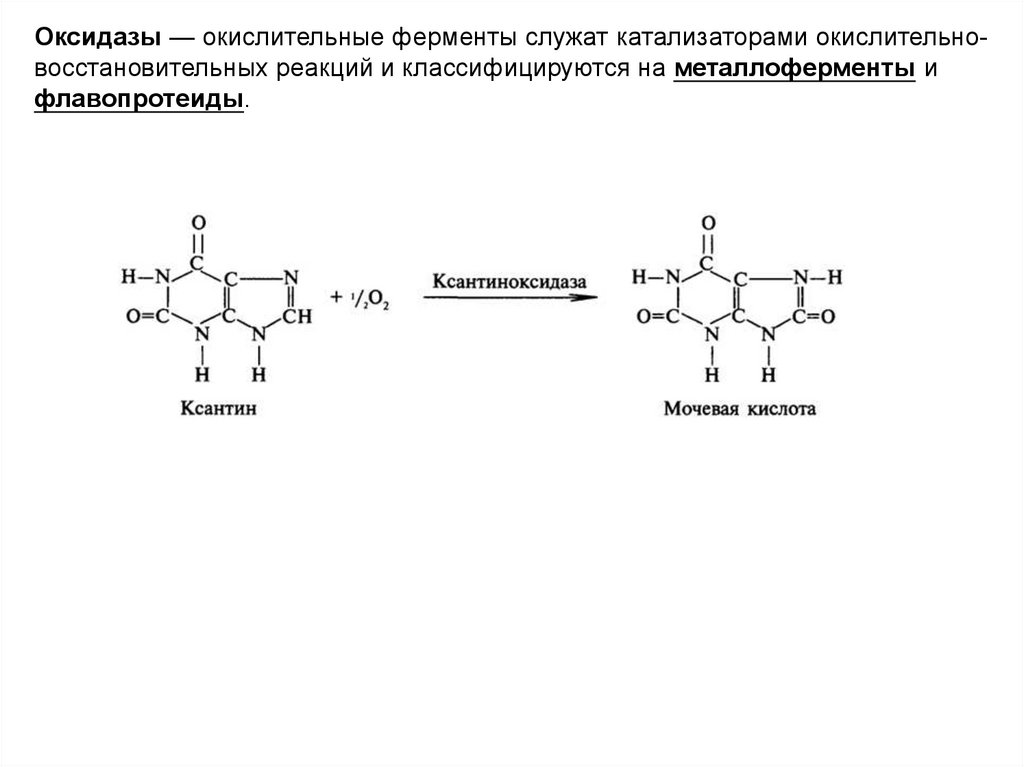
Оксидазы — окислительные ферменты служат катализаторами окислительновосстановительных реакций и классифицируются на металлоферменты ифлавопротеиды.
11.
Пероксидазы(донор:
пероксид
катализируют окисление с помощью H2O2
веществ
водорода
оксидоредуктазы)
неорганических и органических
12.
13.
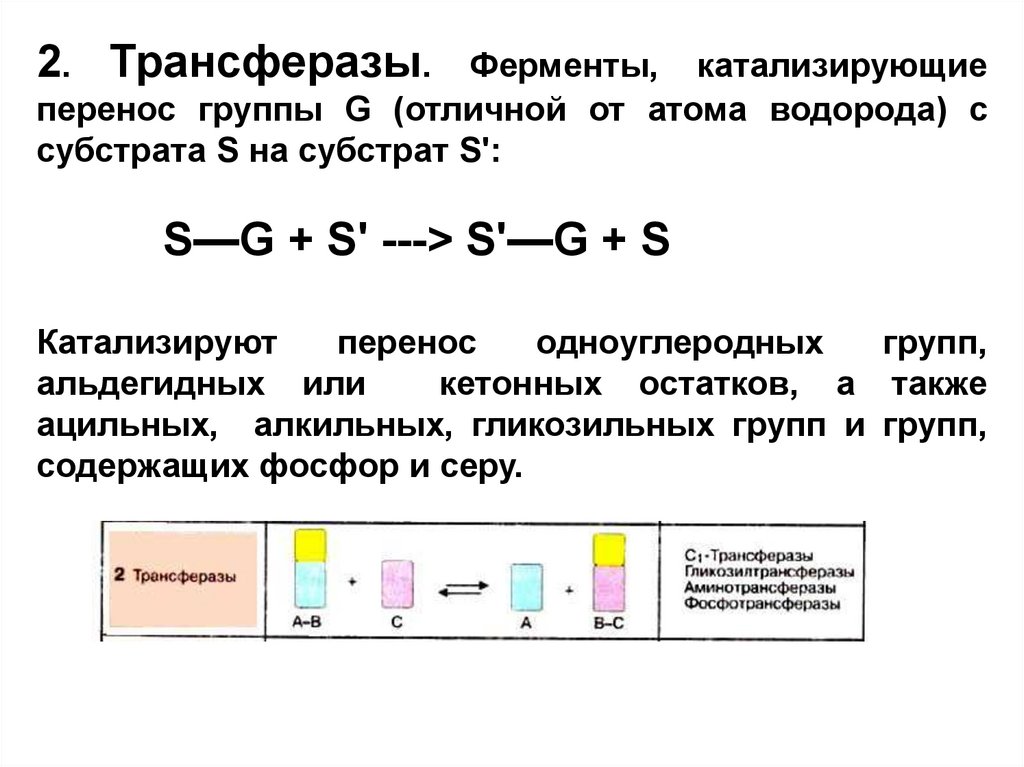
2. Трансферазы.Ферменты, катализирующие
перенос группы G (отличной от атома водорода) с
субстрата S на субстрат S':
S—G + S' ---> S'—G + S
Катализируют
перенос
одноуглеродных
групп,
альдегидных или
кетонных остатков, а также
ацильных, алкильных, гликозильных групп и групп,
содержащих фосфор и серу.
14.
15.
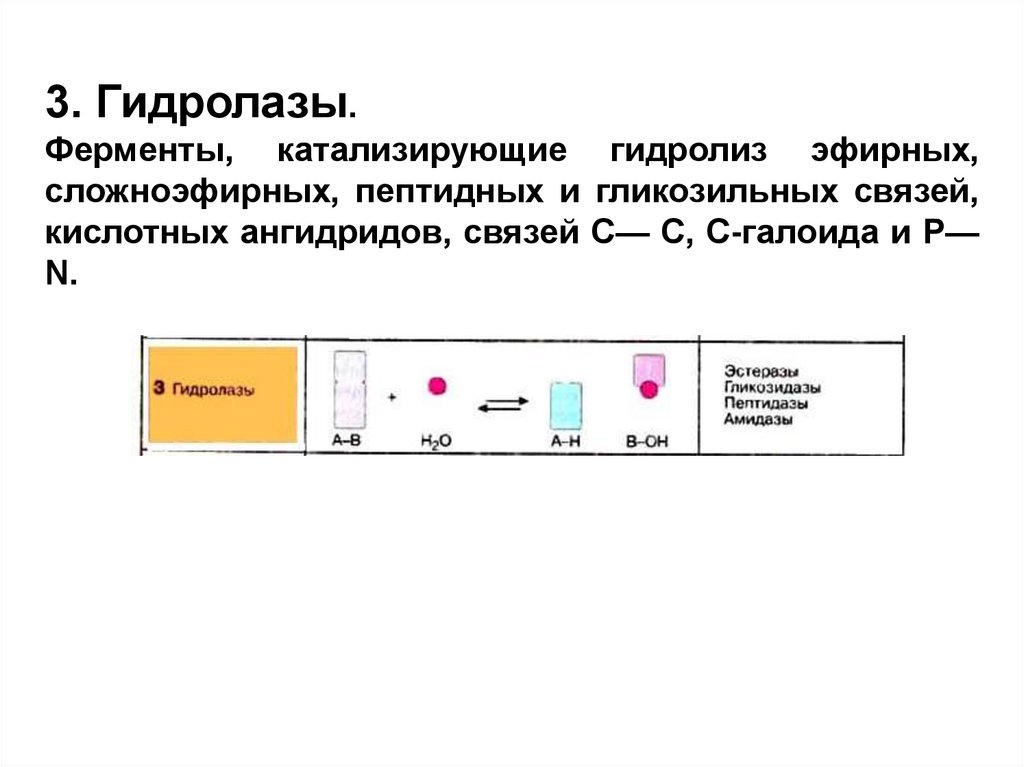
3. Гидролазы.Ферменты, катализирующие гидролиз эфирных,
сложноэфирных, пептидных и гликозильных связей,
кислотных ангидридов, связей С— С, С-галоида и Р—
N.
16.
17.
Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозилгидролаза, расщепляющий крахмал до олигосахаридов, относитсяк ферментам пищеварения. В истории амилаза стала первым
открытым
ферментом,
когда
французский
химик
Ансельм
Пайен описал в 1833 году диастазу — фермент (на самом деле, смесь
ферментов), расщепляющий крахмал до мальтозы.
По субстратной специфичности амилазы классифицируют на альфа-,
бета- и гамма-амилазу.
1. Альфа-амилаза находится в секрете слюнных желез и
поджелудочной железы. Есть у животных, и также обнаружена у
растений.
2. β-Амилаза присутствует у бактерий, грибов и растений, но
отсутствует у животных.
3. Гамма-амилаза, есть у животных и
расщепляет гликоген и
крахмал до глюкозы; играет важную роль во внутриклеточном
обмене гликогена.
18.
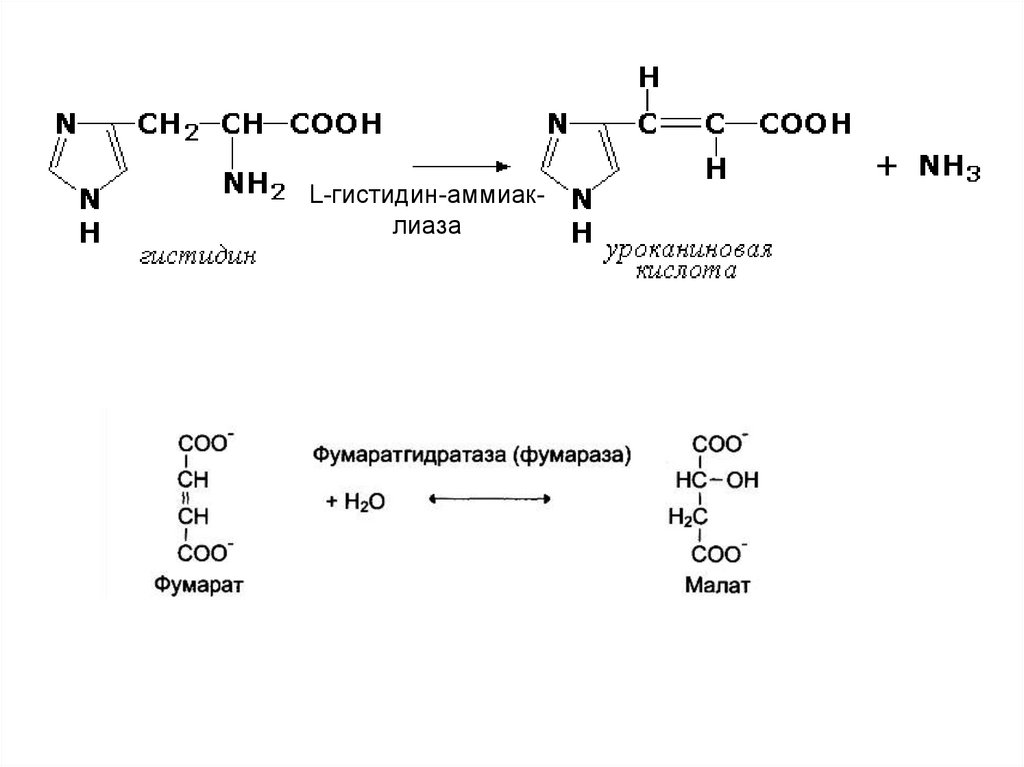
4. Лиазы.Ферменты, отщепляющие группы от
субстратов по негидролитическому механизму, с
образованием двойных связей.
С(X)— С(Y) ---> X— Y + С = С
Ферменты, действующие на связи С — С, С — О, С— N,
С — S и С — галоид.
19.
L-гистидин-аммиаклиаза20.
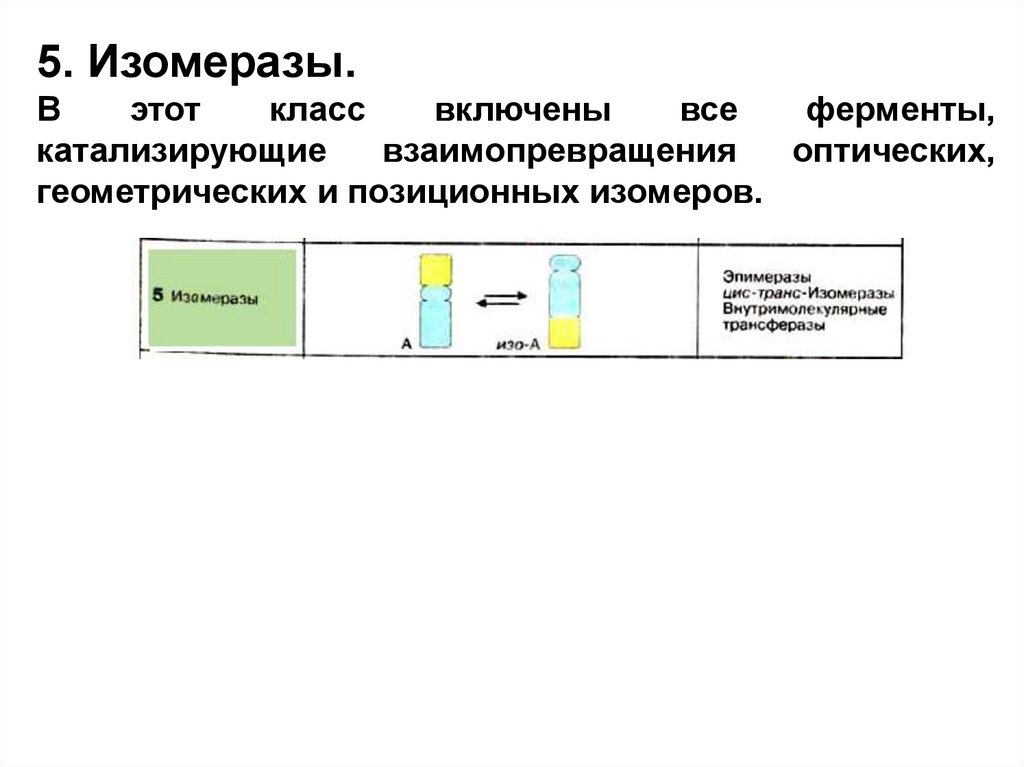
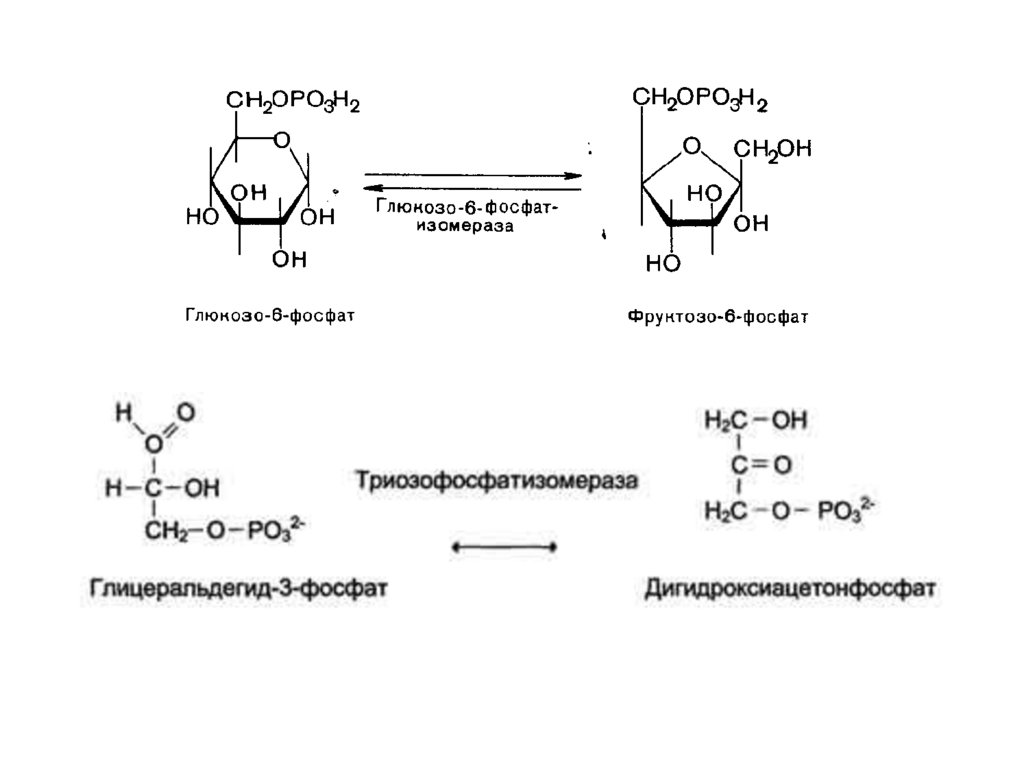
5. Изомеразы.В
этот
класс
включены
все
ферменты,
катализирующие
взаимопревращения
оптических,
геометрических и позиционных изомеров.
21.
22.
6. Лигазы. (от лат. лигаре — связывать).Ферменты, катализирующие соединение двух молекул,
сопряженное с разрывом пирофосфатной связи АТФ
или подобного соединения.
В этот класс включены ферменты, катализирующие
реакции, в ходе которых образуются связи С—О, С—S,
С—N и С—С.
23.
24.
Применение ферментов25.
Ферментные препараты – этодействующим началом которых
ферменты.
средства,
являются
Применение
ферментных
препаратов
в
позволяет добиться высокой эффективности и
обеспечивает высокую специфичность, в том
числе и стереоспецифичность проводимых
реакций.
Ферменты позволяют проводить
реакции при умеренных температурах и
нормальном давлении.
26.
Обеспечение оптимальной активности фермента притехнологическом процессе:
1. Для каждого фермента имеется определенное
оптимальное значение pH и температуры.
2.
Нередко
для
промышленных
процессов
используются термофильные ферменты, что ускоряет
процесс,
и
обеспечивает
дополнительные
преимущества.
3. Концентрация фермента также должна быть
оптимальной.
Оптимальной
должна
быть
и
концентрация субстрата. Кроме того, если наблюдается
ингибирование продуктом, нужно позаботиться о
выведении продукта из зоны реакции.
27.
Вреакционной
смеси
необходимые кофакторы.
должны
находиться
Необходимо позаботиться о том, чтобы в реакционной
смеси не было примесей, способных ингибировать
используемый фермент.
28.
Пример: при производстве фруктозного сиропа изкрахмала используются последовательно ферменты
альфа-амилаза, глюкоамилаза и глюкозоизомераза.
Для стабилизации альфа-амилазы, при проведении
процесса при температуре около 100 градусов
Цельсия, добавляют ионы кальция, однако ионы
кальция подавляют активность глюкозоизомеразы,
поэтому после ожижения и осахаривания крахмала
ионы
кальция
удаляют
ионообменной
хроматографией.
Кроме
того,
активность
глюкозоизомеразы подавляется олигосахаридами,
поэтому при получении глюкозного сиропа добиваются
максимально полного гидролиза.
29.
30.
Методы стабилизации:1. Добавление стабилизирующих веществ.
К
общим
методам
повышения
устойчивости
ферментов
в
реакционной
смеси
относятся
добавление
веществ,
повышающих
вязкость
(глицерин,
сахароза
и
т.п.),
добавление
стабилизирующих полимеров (полиэтиленгликоль)
добавление дополнительного белка (например,
бычьего сывороточного альбумина). Однако эти
методы довольно дороги и их не всегда удается
применять в технологическом процессе.
31.
На некоторые ферменты оказывает стабилизирующеевоздействие
добавление
определенных
ионов
металлов. В частности альфа-амилаза из Bacillus
caldolytics
стабилизируется
ионами
кальция
(значительно повышается термостабильность).
Некоторые ферменты стабилизируются добавлением
небольших количеств органических растворителей
(этанол, изопропанол).
32.
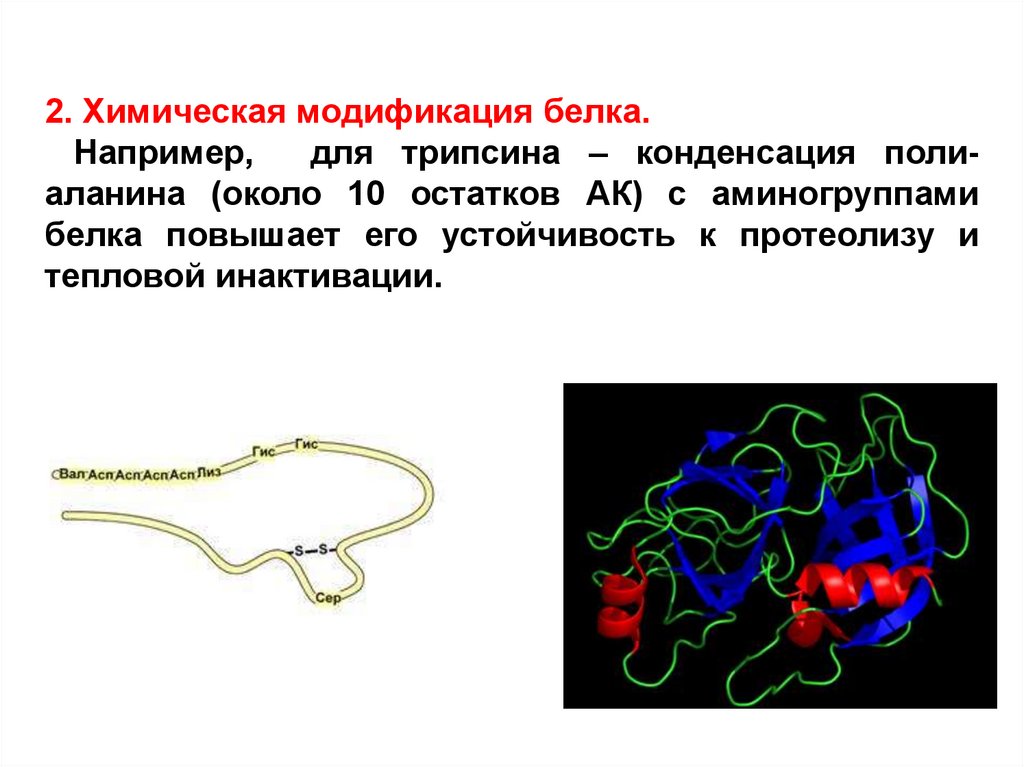
2. Химическая модификация белка.Например,
для трипсина – конденсация полиаланина (около 10 остатков АК) с аминогруппами
белка повышает его устойчивость к протеолизу и
тепловой инактивации.
33.
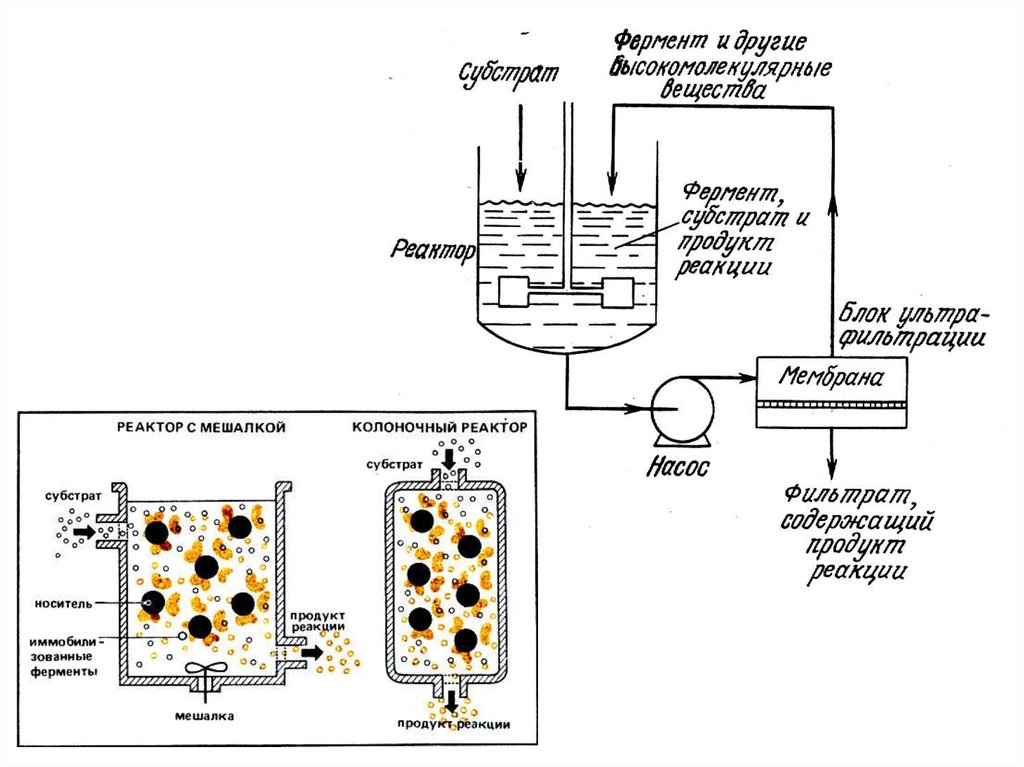
3. Иммобилизация белка.Иммобилизация – полное или частичное ограничение
свободы движения белковых молекул.
Наиболее
распространенным
вариантом
иммобилизации является связывание ферментов с
нерастворимым носителем.
34.
35.
36.
Преимущества иммобилизованных ферментов:1. Легко отделяются от реакционной среды
2. Могут использоваться многократно
3.Обеспечивают
процесса
непрерывность
технологического
4. Имеют более высокую стабильность и большее время
жизни
Например,
при
температуре
65оС
тепловая
инактивация
лактатдегидрогеназы,
иммобилизованной в 60% полиакриламидном геле,
замедлена в 3600 раз по сравнению со свободным
ферментом.
37.
38.
39.
40.
41.
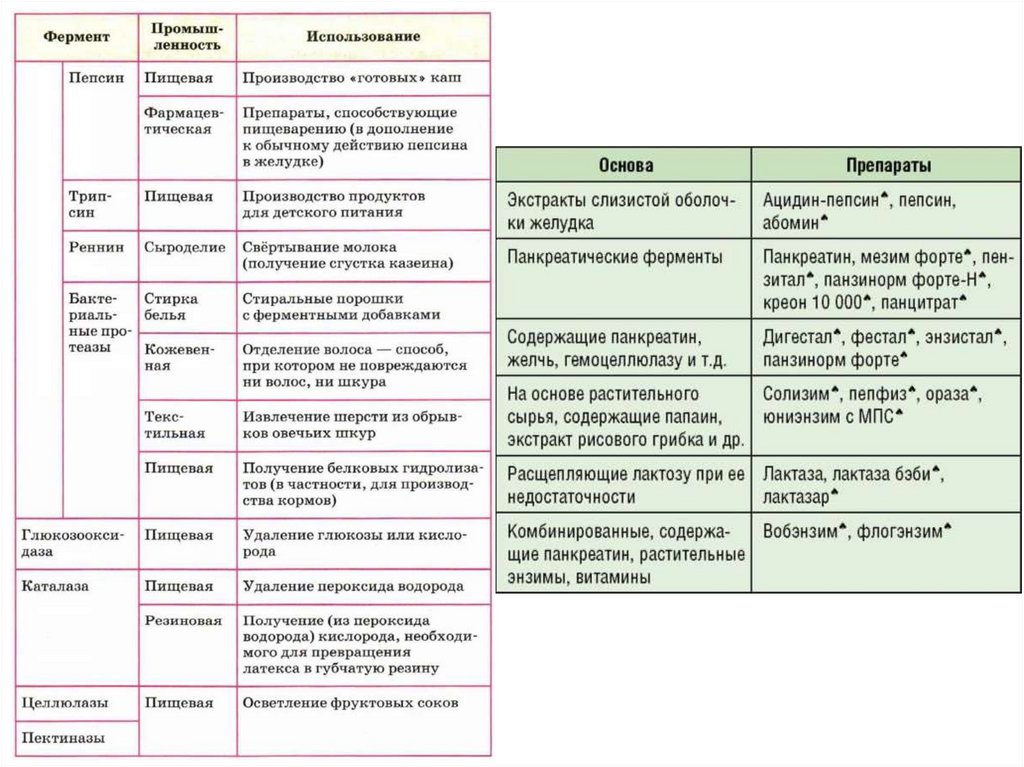
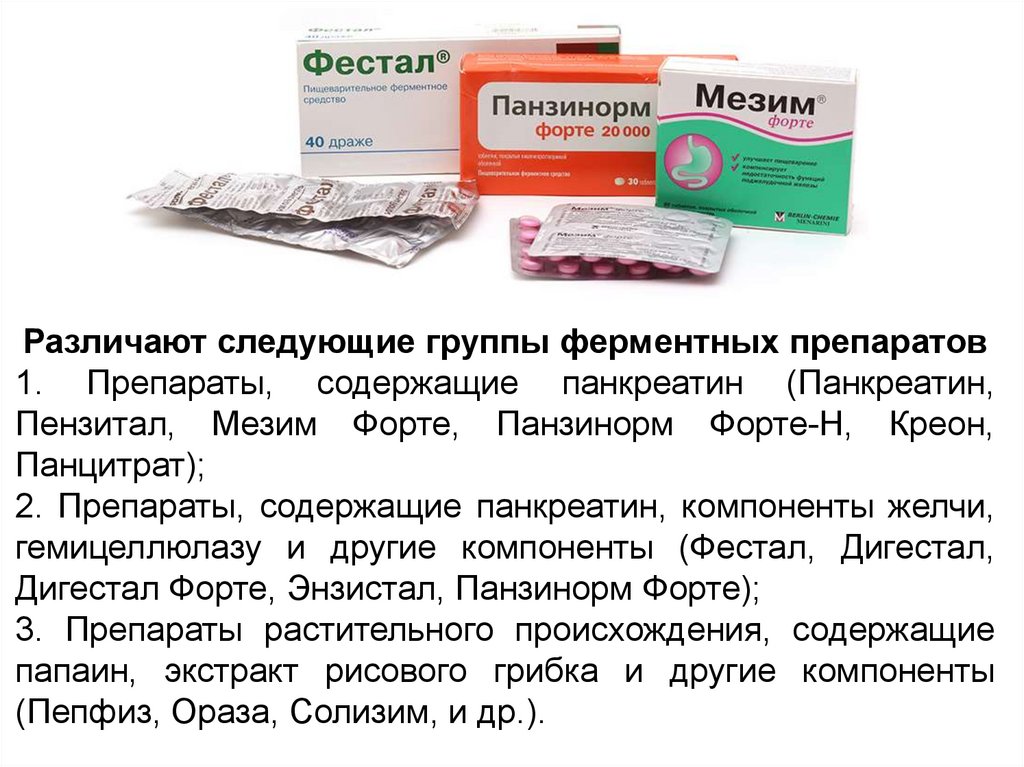
Различаютследующиеследующиегруппы
группыферментных
ферментныхпрепаратов
препаратов
Различают
1. Препараты,
Препараты, содержащие
содержащие панкреатин
панкреатин (Панкреатин,
(Панкреатин,
1.
Пензитал, Мезим
Мезим Форте,
Форте, Панзинорм
Панзинорм Форте-Н,
Форте-Н, Креон,
Креон,
Пензитал,
Панцитрат);
Панцитрат);
2. Препараты,
Препараты, содержащие
содержащие панкреатин,
панкреатин, компоненты
компоненты желчи,
желчи,
2.
гемицеллюлазу ии другие
другие компоненты
компоненты (Фестал,
(Фестал, Дигестал,
Дигестал,
гемицеллюлазу
ДигесталФорте,
Форте,Энзистал,
Энзистал,Панзинорм
ПанзинормФорте);
Форте);
Дигестал
3. Препараты
Препараты растительного
растительного происхождения,
происхождения, содержащие
содержащие
3.
папаин, экстракт рисового грибка и другие компоненты
папаин, экстракт рисового грибка и другие компоненты
(Пепфиз,Ораза,
Ораза,Солизим,
Солизим,иидр.).
др.).
(Пепфиз,

























 biology
biology








