Similar presentations:
Пептиды. Тема 3
1.
Пептиды2.
(греч. Πεπτος, peptós — сваренный, переваренный,питательный).
Термин «пептиды» был предложен известным химиком Эмилем
Фишером. Слово образовано из первых четырёх букв названия
пептоны (продукты расщепления белков пепсином) и конечных
букв названия углеводов - полисахариды.
ЭмильФишер
9 октября 1852 г. – 15 июля 1919 г.
Нобелевская премия по химии, 1902 г.
3.
Классификация пептидовВ зависимости от числа аминокислотных остатков
различают ди-, три-, тетра-, пента- и тому подобные
пептиды;
- пептиды с молекулярной массой не более
10 000 а.е.м., (т.е. содержащие не более 50-60
аминокислотных
остатков)
называют
олигопептидами,
- пептиды с молекулярной массой, большей 10 000
а.е.м. полипептидами или белками.
4.
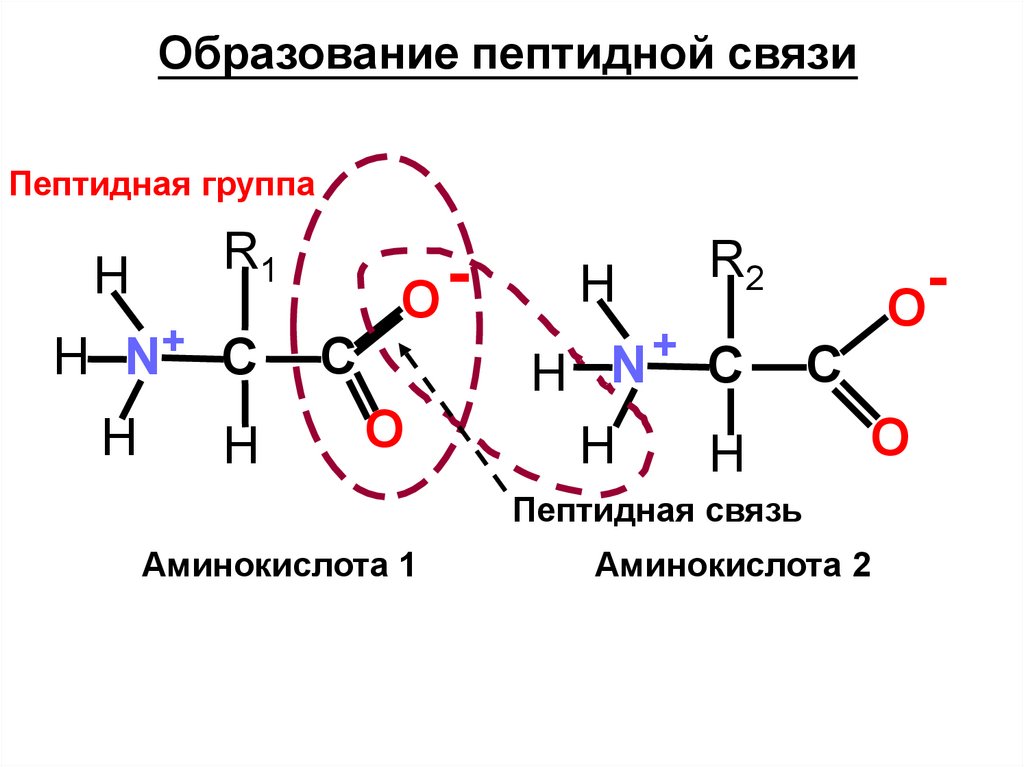
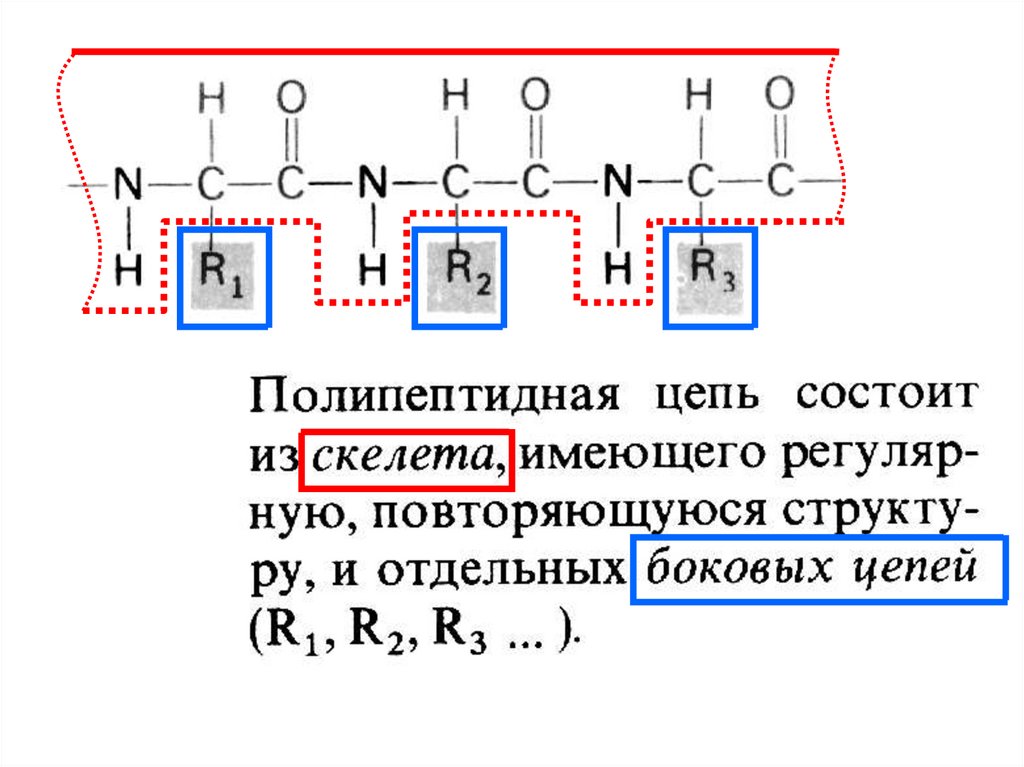
Образование пептидной связиПептидная группа
H
R1
H N+ С
H
H
O
C
O
H
R2
+
H N С
H
H
O
C
O
Пептидная связь
Аминокислота 1
Аминокислота 2
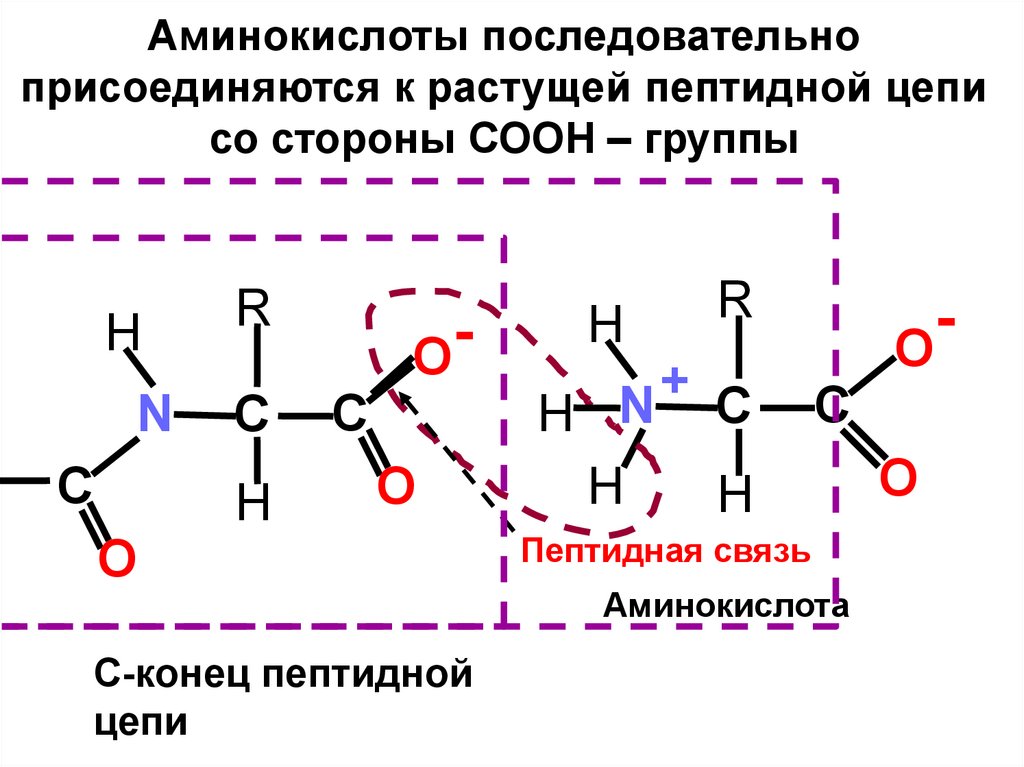
5.
Аминокислоты последовательноприсоединяются к растущей пептидной цепи
со стороны СООН – группы
H
N
C
R
С
H
O
C
O
O
С-конец пептидной
цепи
H
R
+
H N С
H
H
O
C
Пептидная связь
Аминокислота
O
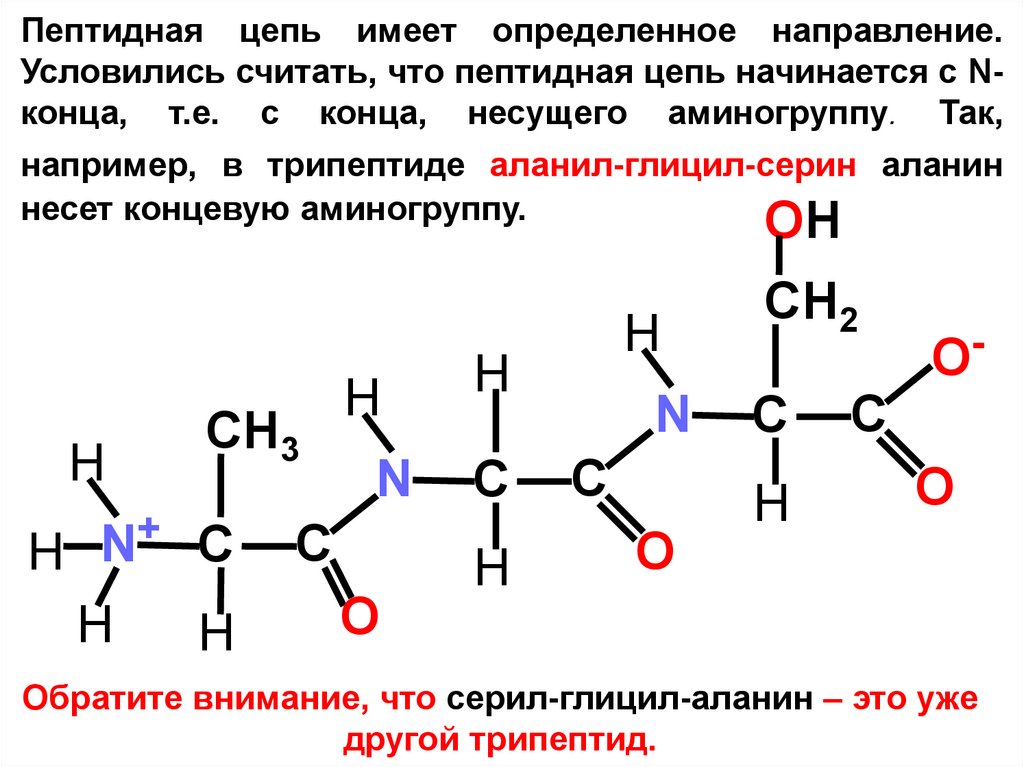
6.
Пептидная цепь имеет определенное направление.Условились считать, что пептидная цепь начинается с Nконца, т.е. с конца, несущего аминогруппу. Так,
например, в трипептиде аланил-глицил-серин аланин
несет концевую аминогруппу.
OH
H
CH3
+ С
N
H
H
H
H
N
C
H
H
С
H
N
C
CH2
С
H
O
C
O
O
O
Обратите внимание, что серил-глицил-аланин – это уже
другой трипептид.
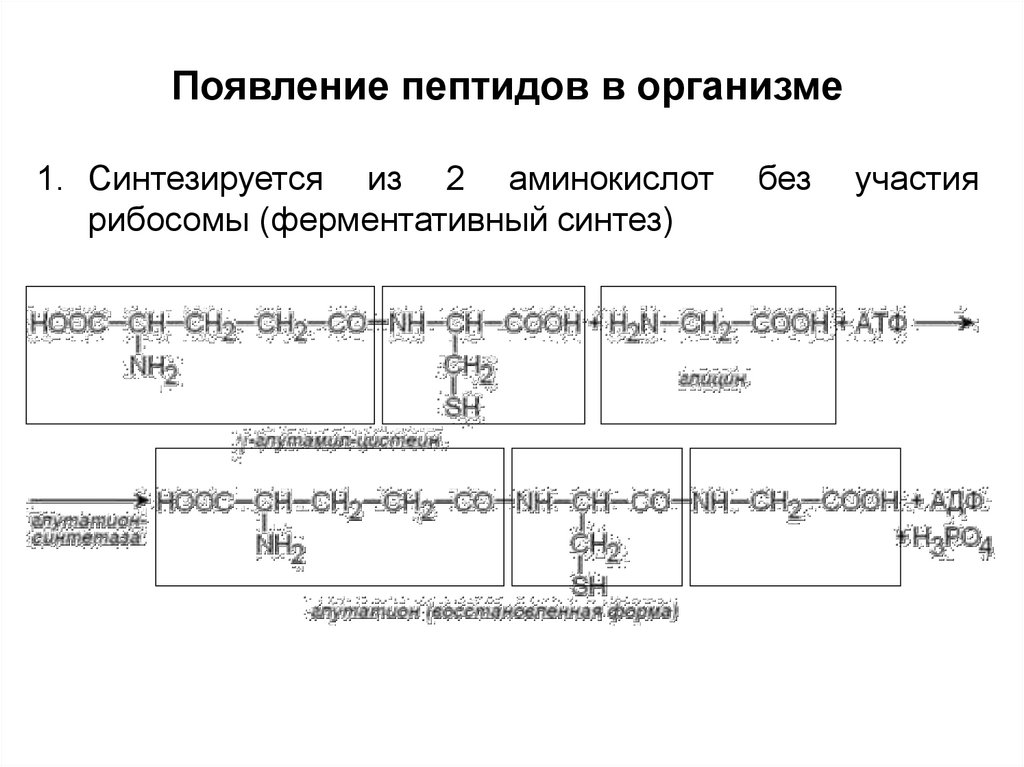
7.
Появление пептидов в организме1. Синтезируется из 2 аминокислот
рибосомы (ферментативный синтез)
без
участия
8.
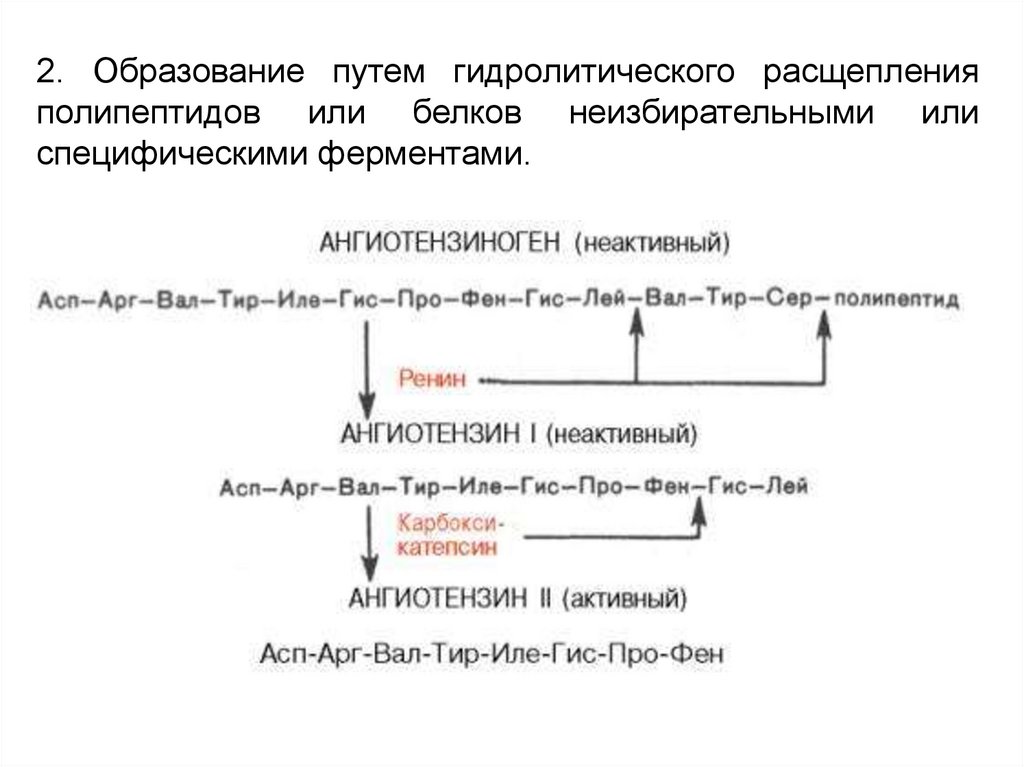
2. Образование путем гидролитического расщепленияполипептидов или белков неизбирательными или
специфическими ферментами.
9.
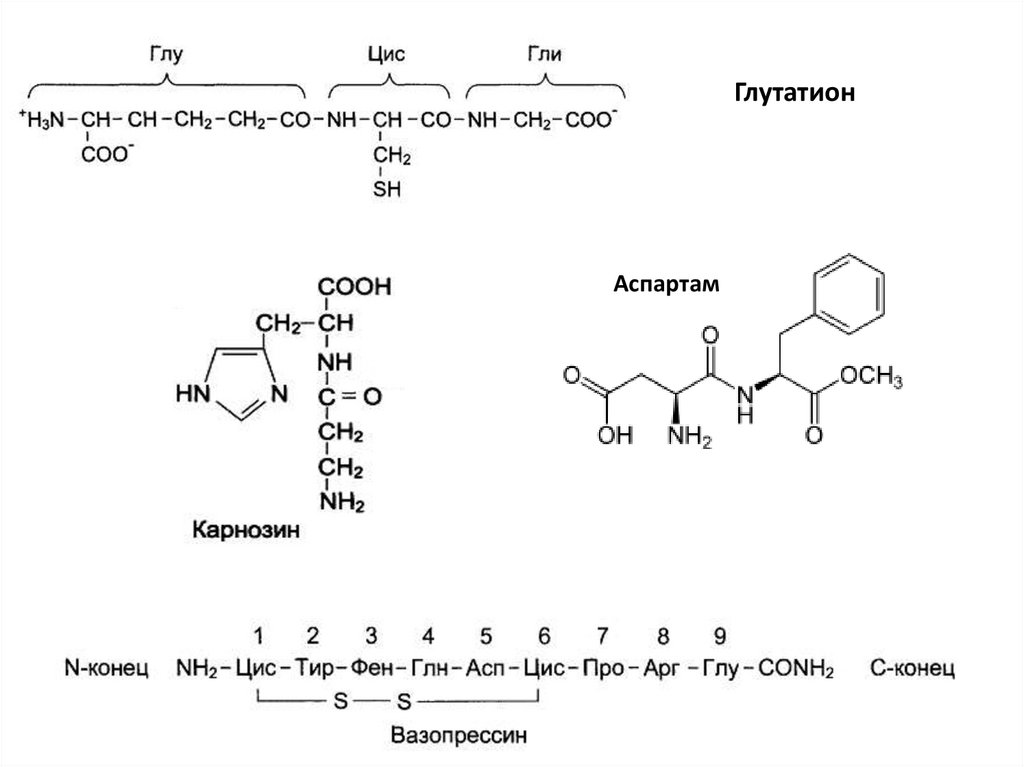
ГлутатионАспартам
10.
Белки (англ. Proteins) – одинважнейших видов биополимеров.
из
Функции белков:
1.Ферментативный катализ
2.Транспорт и накопление веществ
3.Координированное движение
4.Механическая опора
5.Иммунная защита
6.Генерирование и передача нервных
импульсов
7.Регуляторная функция
11.
Образование пептидов и биосинтез белка1.В живых организмах полипептидные (белковые) цепи
синтезируются
специальными
молекулярными
комплексами – рибосомами
2. Присоединение аминокислот к полипептидной цепи
требует затраты энергии в виде АТФ или ГТФ.
3. Аминокислоту, вошедшую в состав пептидной цепи,
называют аминокислотным остатком.
12.
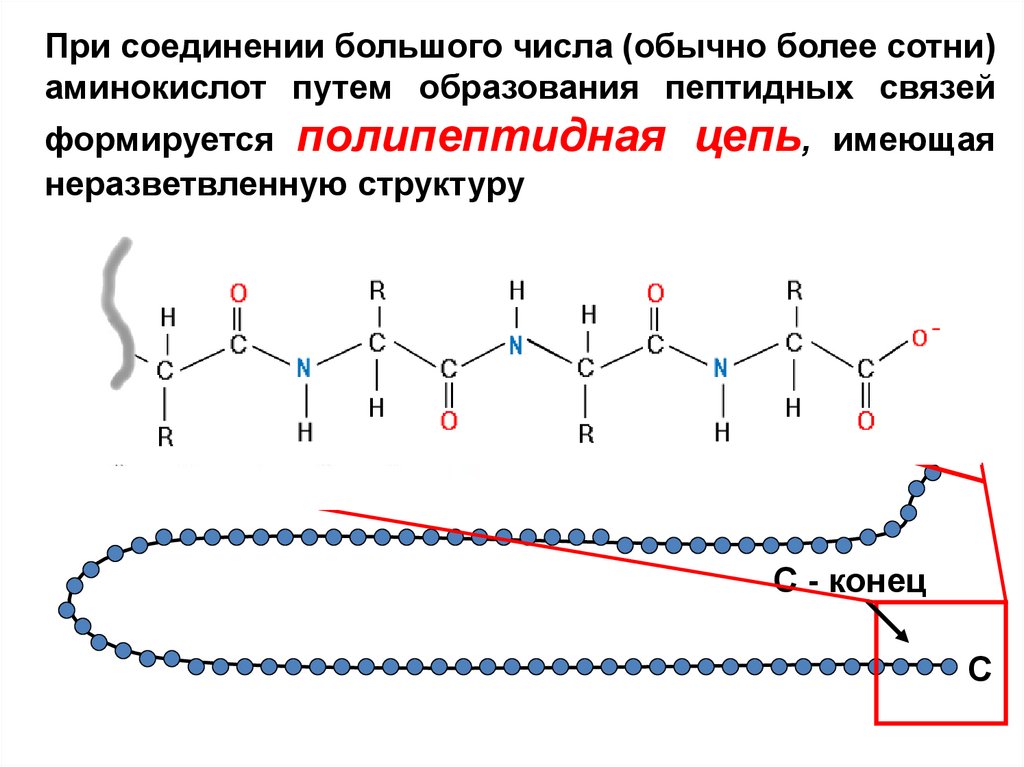
При соединении большого числа (обычно более сотни)аминокислот путем образования пептидных связей
формируется полипептидная
неразветвленную структуру
цепь,
имеющая
N
N - конец
С - конец
C
13.
14.
1. Белки состоят из одной или несколькихполипептидных цепей
2. Последовательность аминокислот в
полипептидных цепях белка уникальна и
определяется генами
3. После синтеза полипептидной цепи на
рибосоме
она
может
подвергаться
различным модификациям.
15.
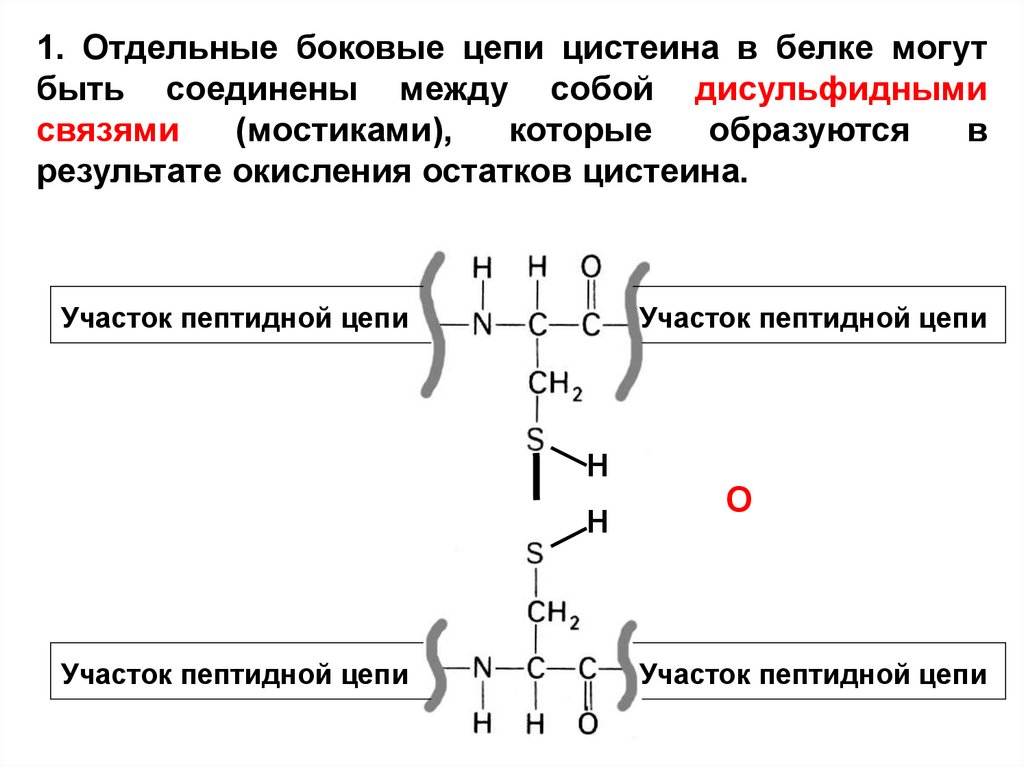
1. Отдельные боковые цепи цистеина в белке могутбыть соединены между собой дисульфидными
связями
(мостиками),
которые
образуются
в
результате окисления остатков цистеина.
Участок пептидной цепи
Участок пептидной цепи
Н
Н
Участок пептидной цепи
О
Участок пептидной цепи
16.
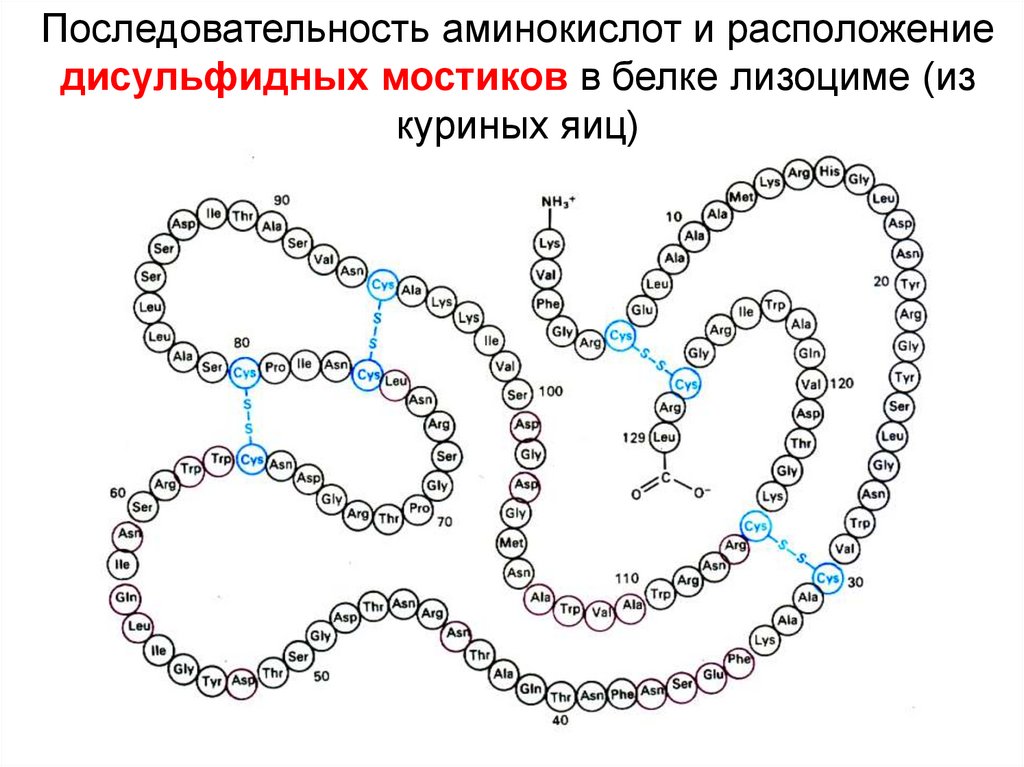
Последовательность аминокислот и расположениедисульфидных мостиков в белке лизоциме (из
куриных яиц)
17.
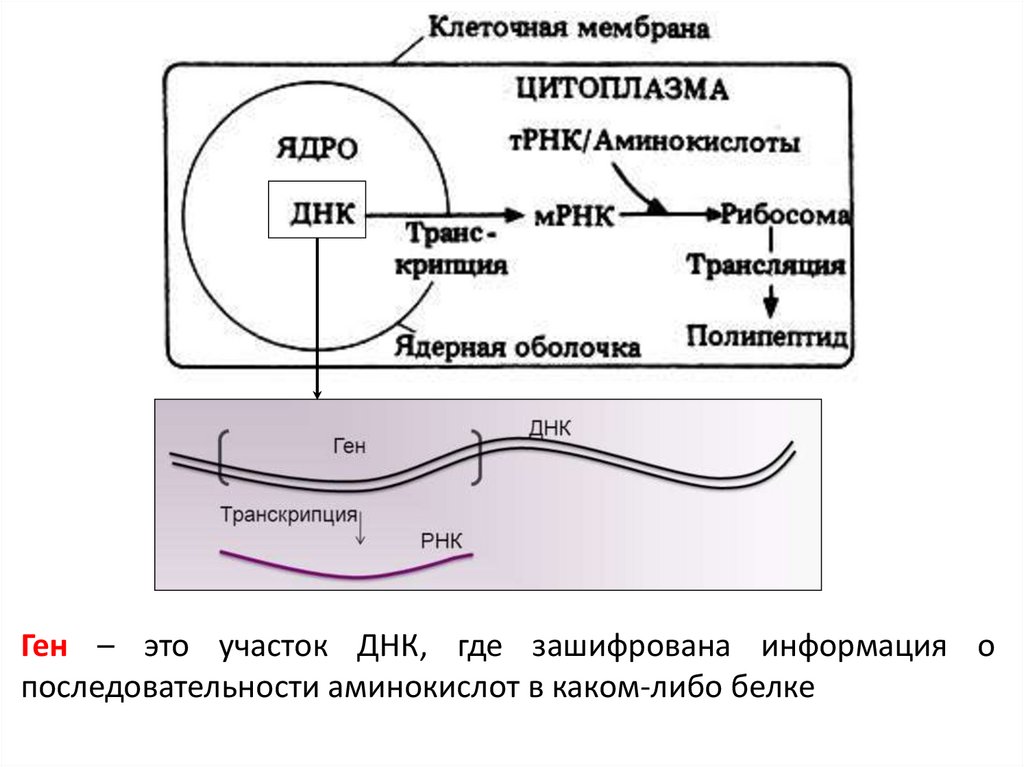
Ген – это участок ДНК, где зашифрована информация опоследовательности аминокислот в каком-либо белке
18.
3.После
синтеза
белка
некоторые
аминокислотные остатки могут подвергаться
специфической
посттрансляционной
модификации
–
к
ним
присоединяются
определенные химические группы.
19.
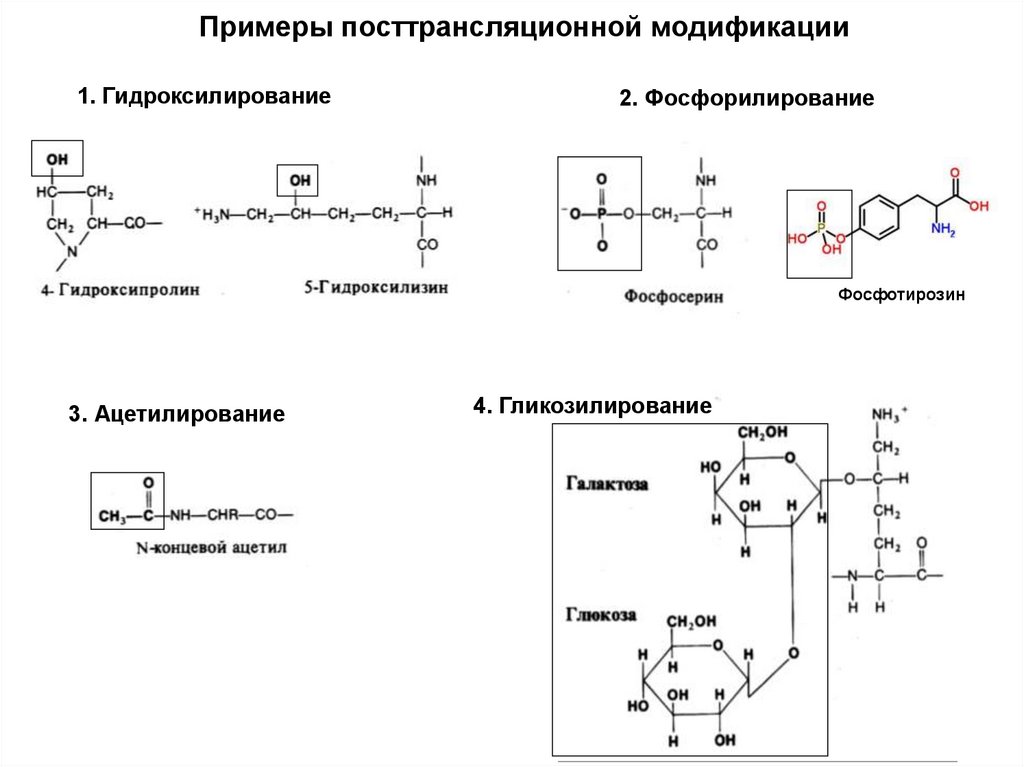
Примеры посттрансляционной модификации1. Гидроксилирование
2. Фосфорилирование
Фосфотирозин
3. Ацетилирование
4. Гликозилирование
20.
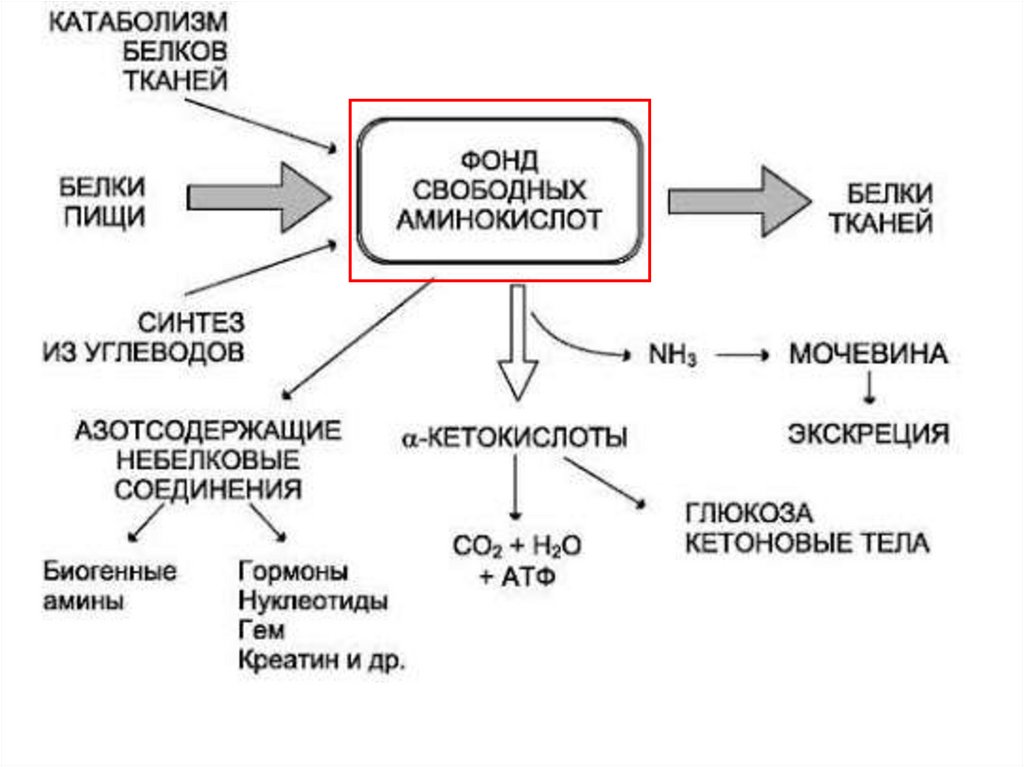
Катаболизм белков1. В нейтральной среде полипептидная цепь
является химически стабильной. В сильнокислой
среде и при нагревании,
полипептидная цепь
распадается на аминокислоты.
2. В живых организмах распад полипептидной
(белковой) цепи на аминокислоты может происходить
в
результате
каталитической
активности
соответствующих ферментов: протеаз и пептидаз.
21.
22.
23.
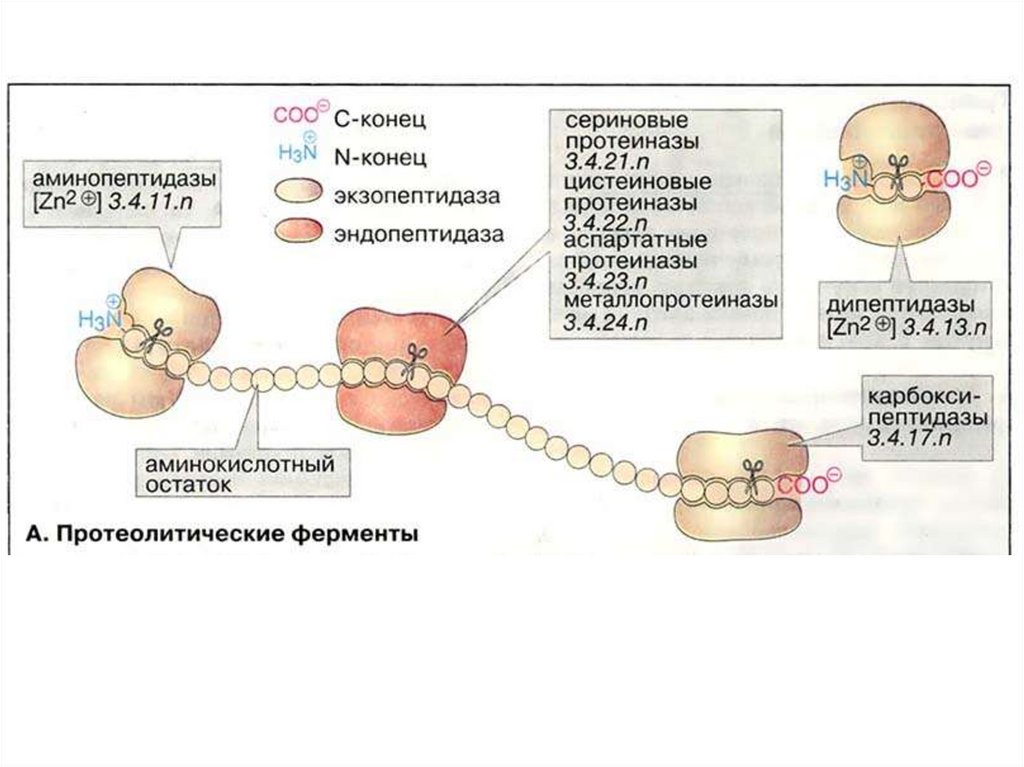
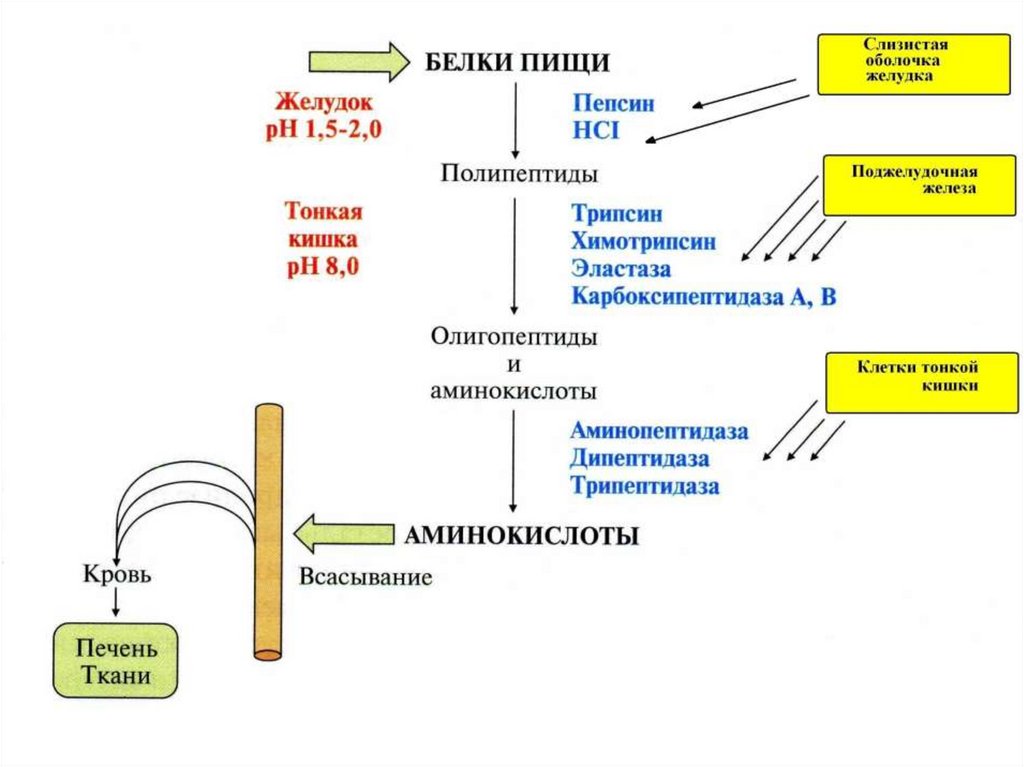
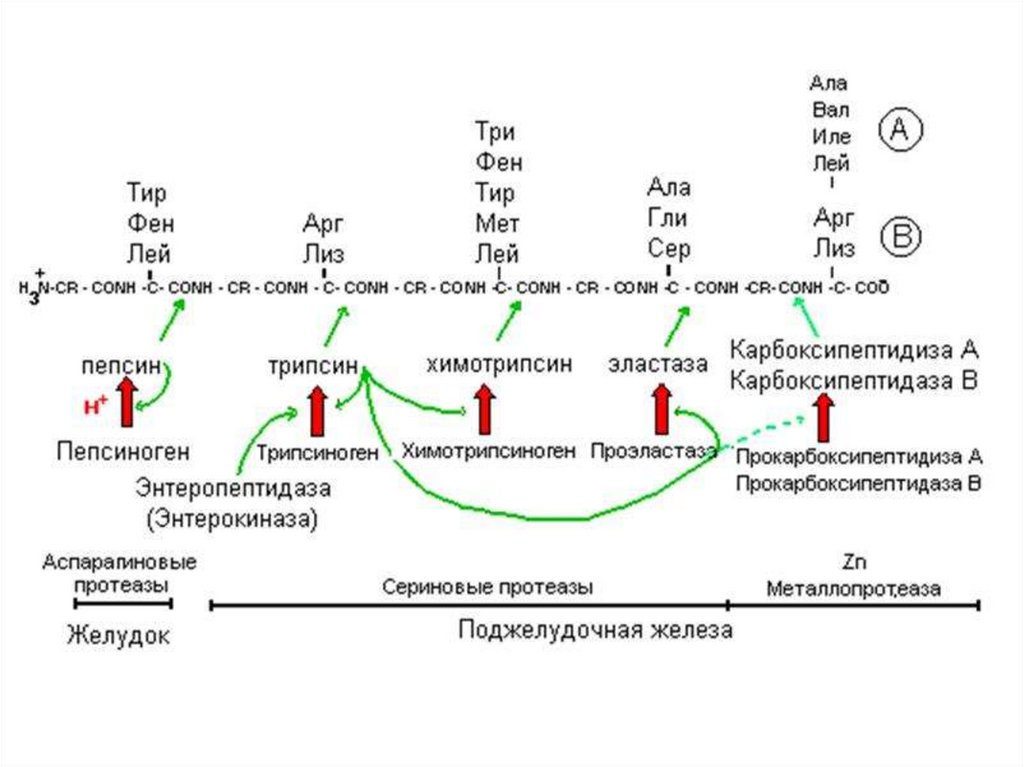
Ферменты, осуществляющие деградацию белков, называютсяпротеазами. По месту атаки молекулы субстрата протеолитические
ферменты делятся на:
1. Эндопептидазы, или протеиназы, расщепляют пептидные связи
внутри пептидной цепи. Они узнают и связывают короткие пептидные
последовательности субстратов и относительно специфично
гидролизуют связи между определёнными аминокислотными
остатками.
2.
Экзопептидазы
гидролизуют
пептиды
с
концов
цепи: аминопептидазы — с N-конца, карбоксипептидазы — с Сконца.
3. Дипептидазы расщепляют только дипептиды.
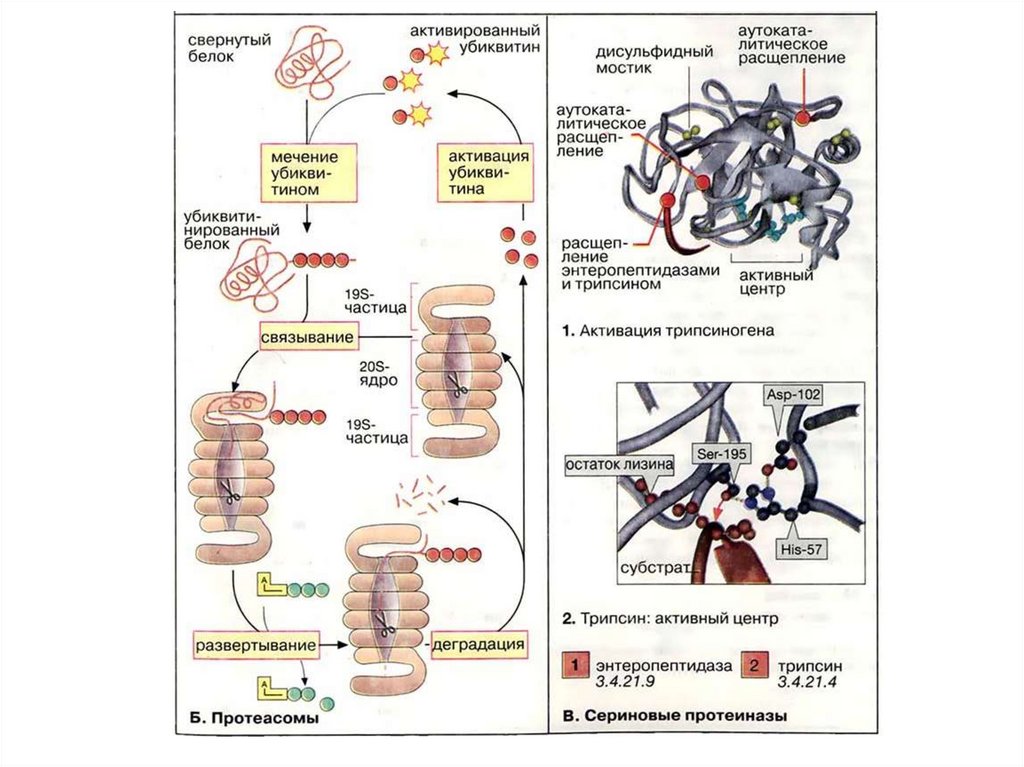
По механизму катализа Международный союз по биохимии и
молекулярной биологии выделяет несколько классов протеаз:
- сериновые протеазы
- аспарагиновые протеазы
- цистеиновые протеазы
- металлопротеазы









 chemistry
chemistry








