Similar presentations:
Металлы
1.
AuCs Hg
Li W
Л Os
О М
О Н
О Fe
С Al
О Ag
В
1.
2.
3.
4.
5.
6.
7.
8.
9.
Самый тугоплавкий.
Самый распространенный на земле.
Самый легкий.
Самый электропроводный.
Самый активный.
Самый пластичный.
Самый космический.
Самый легкоплавкий.
Самый тяжелый.
2.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ3.
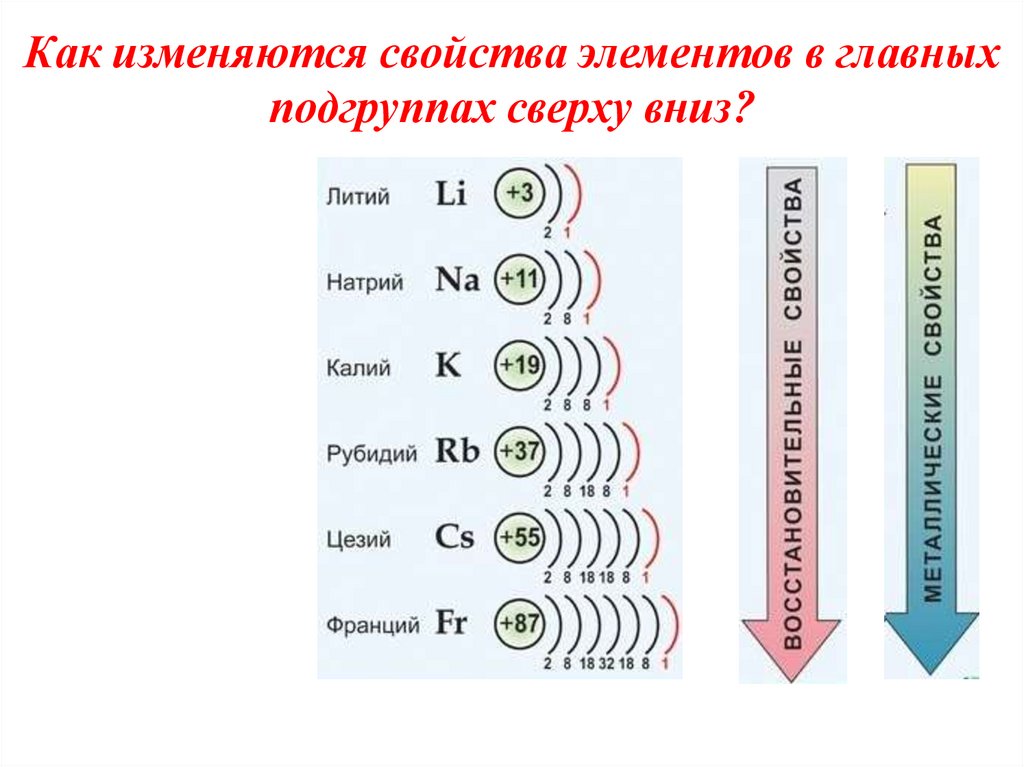
!!!4. Как изменяются свойства элементов в главных подгруппах сверху вниз?
5.
ВыводыНа внешнем энергетическом уровне
атомы этих элементов содержат по
одному электрону
В подгруппе от лития к цезию радиусы атомов увеличиваются, так как
возрастает число электронных
слоев, следовательно, усиливаются
и восстановительные свойства
Во всех своих соединениях щелочные
металлы проявляют степень
окисления +1
6. Физические свойства ЩМ:
• серебристобелые (кромецезия);
• легкие;
• легкоплавкие;
• мягкие (легко
режутся ножом)
7. I. Взаимодействие с неметаллами
1) ЩМ + O2ЩМ легко реагируют с кислородом,
• оксид образует только литий:
4Li + O2 = 2Li2O,
• натрий образует пероксид:
2Na + O2 = Na2O2,
• калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
8. 2) ЩМ + галоген = галогенид Na + Cl2 =
2) ЩМ + галоген = галогенидNa + Cl2 =
Взаимодействие с водородом, серой,
фосфором, углеродом, кремнием
протекает при нагревании:
3) ЩМ + H2 = гидрид: Na + H2 =
4) ЩМ + S = сульфид:
K+S=
9. II. Взаимодействие ЩМ с водой
ЩМ + H2O = гидроксид ЩМ + H2Na + H2O =
10. Правила ТБ для работы со щелочными металлами
работать в вытяжном шкафу
на подносе
сухими руками
брать в малых количествах
11.
1) 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются)2) 4Li + O2 = 2Li2O
оксид Li
3) 2Na + Н2 = 2NaН
2Na + O2 = Na2O2
2K + 2O2 = K2O4
2Na + Na2O2 = 2Na2O
6K + K2O4 = 4K2O
пероксид Na
надпероксид K
(при нагревании 200-400oC)
4) 6Li + N2 = 2Li3N (Li - при комнатной t, остальные щелочные Me -при нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно,
Na - энергично,
остальные – со взрывом (воспламеняется выделяющийся Н2 )
Rb и Cs реагируют не только с жидкой Н2О, но и со льдом
12.
Качественное определение щелочных металловДля распознавания соединений щелочных металлов по окраске
пламени исследуемое вещество вносится в пламя горелки на кончике
железной проволоки
Li+ - карминово-красный
Na+ - желтый
Li+
K+ - фиолетовый
Rb + - красный
Na+
Cs+ - фиолетово-синий
K+
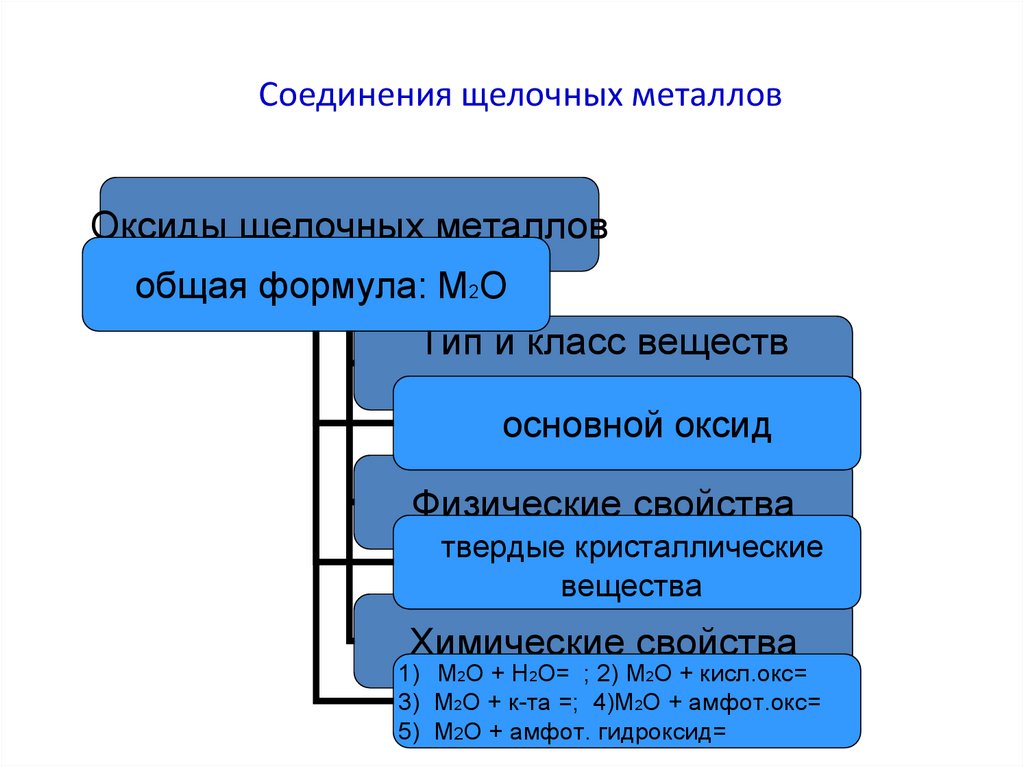
13. Соединения щелочных металлов
Оксиды щелочных металловобщая формула: М2О
Тип и класс веществ
основной оксид
Физические свойства
твердые кристаллические
вещества
Химические свойства
1) М2О + Н2О= ; 2) М2О + кисл.окс=
3) М2О + к-та =; 4)М2О + амфот.окс=
5) М2О + амфот. гидроксид=
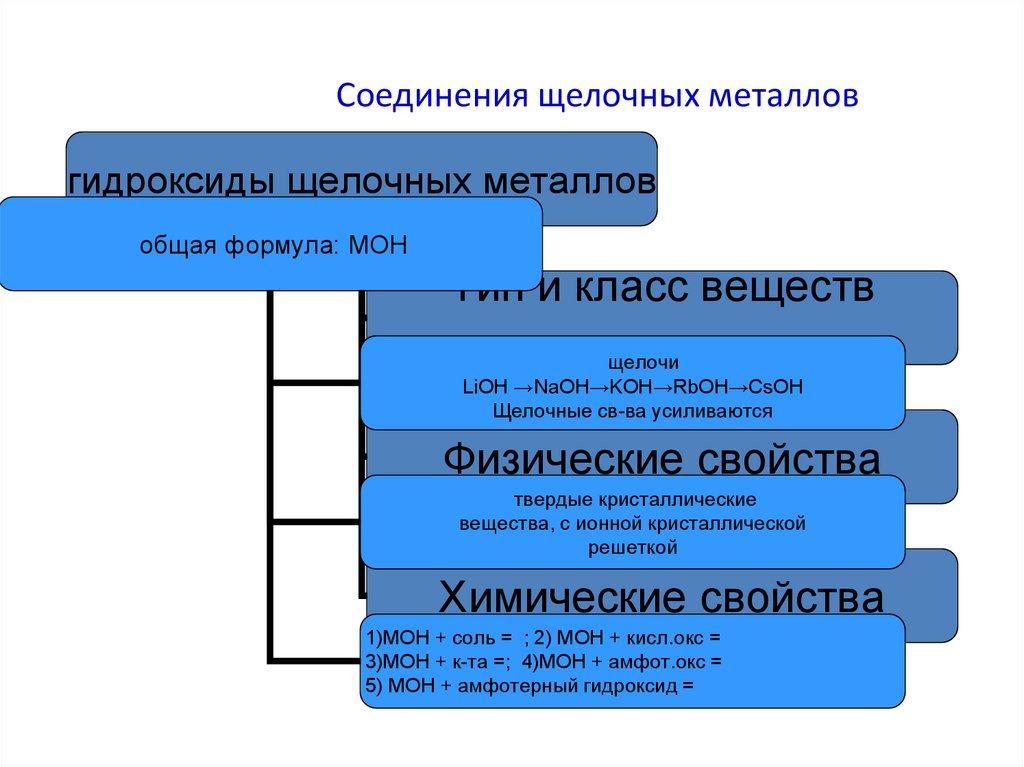
14. Соединения щелочных металлов
гидроксиды щелочных металловобщая формула: МОН
Тип и класс веществ
щелочи
LiOH →NaOH→KOH→RbOH→CsOH
Щелочные св-ва усиливаются
Физические свойства
твердые кристаллические
вещества, с ионной кристаллической
решеткой
Химические свойства
1)МОН + соль = ; 2) МОН + кисл.окс =
3)МОН + к-та =; 4)МОН + амфот.окс =
5) МОН + амфотерный гидроксид =
15.
Соли щелочных металлов — твердые кристаллическиевещества ионного строения.
Nа2СO3 — карбонат натрия, образует кристаллогидрат
Nа2СO3* 10Н2O, известный под названием кристаллическая
сода, которая применяется в производстве стекла, бумаги,
мыла.
.
Вам в быту более известна кислая соль — гидрокарбонат
натрия
NаНСO3,
она
применяется
в
пищевой
промышленности (пищевая сода) и в медицине (питьевая
сода).
К2С03 — карбонат калия, техническое название — поташ,
используется в производстве жидкого мыла.
Nа2SO4 • 10Н2O — кристаллогидратат сульфата натрия,
техническое название — глауберова соль, применяется для
производства соды и стекла и в качестве слабительного
средства.
16.
NаСl — хлорид натрия, или поваренная соль, этасоль вам хорошо известна из курса прошлого года.
Хлорид натрия является важнейшим сырьем в
химической промышленности, широко применяется
и в быту.














 chemistry
chemistry








