Similar presentations:
Кислоты и соли
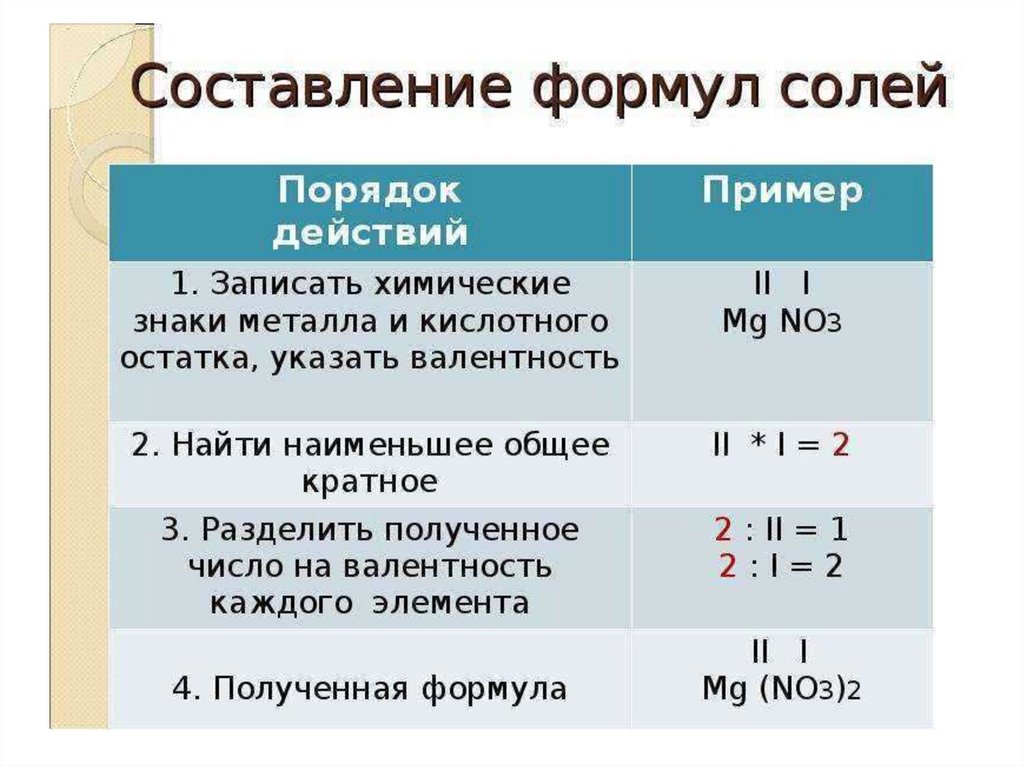
1.
2.
3.
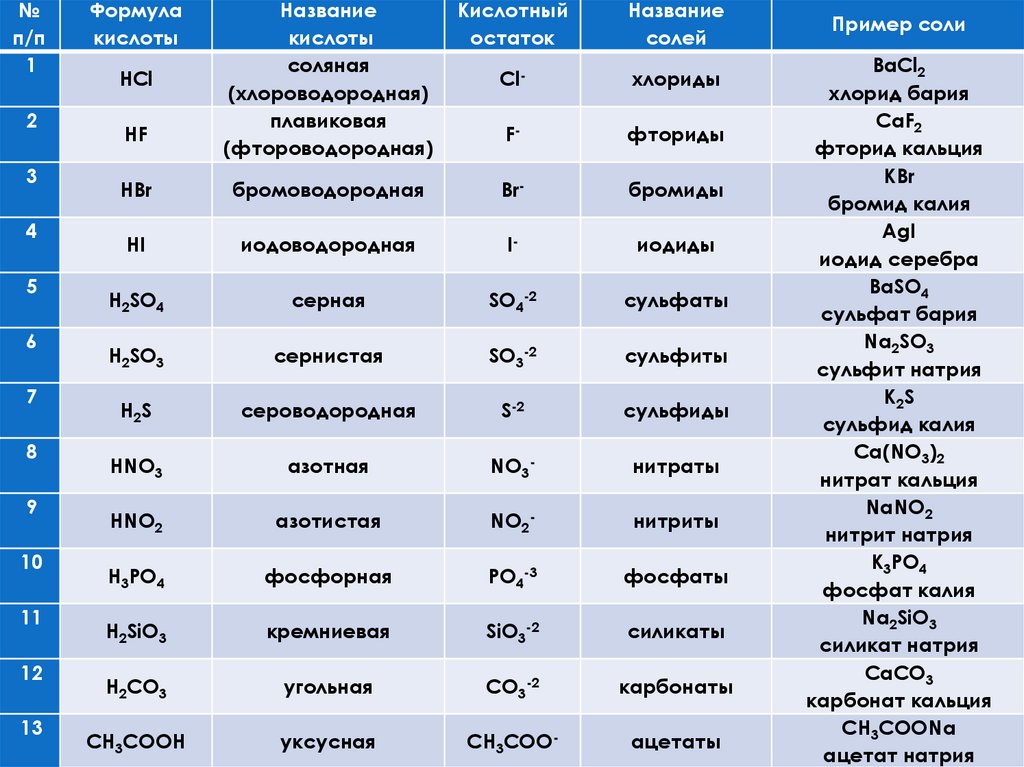
№п/п
1
2
3
4
5
6
7
8
9
10
11
12
13
Формула
кислоты
Название
кислоты
соляная
(хлороводородная)
плавиковая
(фтороводородная)
Кислотный
остаток
Название
солей
Cl-
хлориды
F-
фториды
HBr
бромоводородная
Br-
бромиды
HI
иодоводородная
I-
иодиды
H2SO4
серная
SO4-2
сульфаты
H2SO3
сернистая
SO3-2
сульфиты
H2S
сероводородная
S-2
сульфиды
HNO3
азотная
NO3-
нитраты
HNO2
азотистая
NO2-
нитриты
H3PO4
фосфорная
PO4-3
фосфаты
H2SiO3
кремниевая
SiO3-2
силикаты
H2CO3
угольная
CO3-2
карбонаты
CH3COOH
уксусная
CH3COO-
ацетаты
HCl
HF
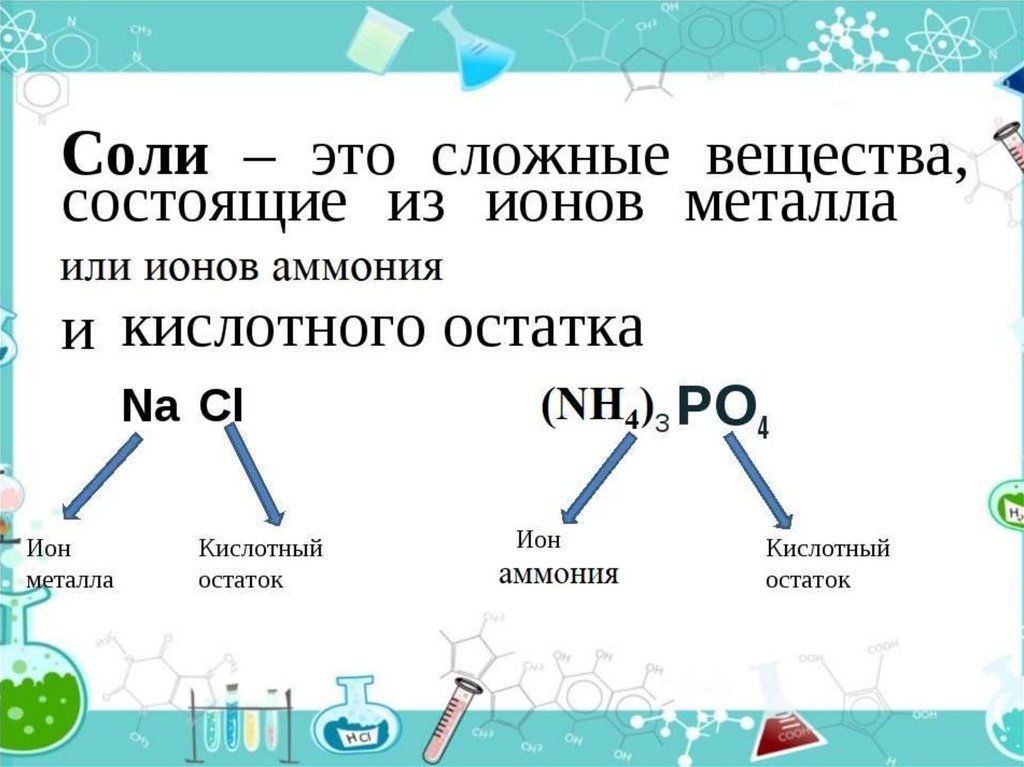
Пример соли
BaCl2
хлорид бария
CaF2
фторид кальция
KBr
бромид калия
AgI
иодид серебра
BaSO4
сульфат бария
Na2SO3
сульфит натрия
K 2S
сульфид калия
Ca(NO3)2
нитрат кальция
NaNO2
нитрит натрия
K3PO4
фосфат калия
Na2SiO3
силикат натрия
CaCO3
карбонат кальция
CH3COONa
ацетат натрия
4.
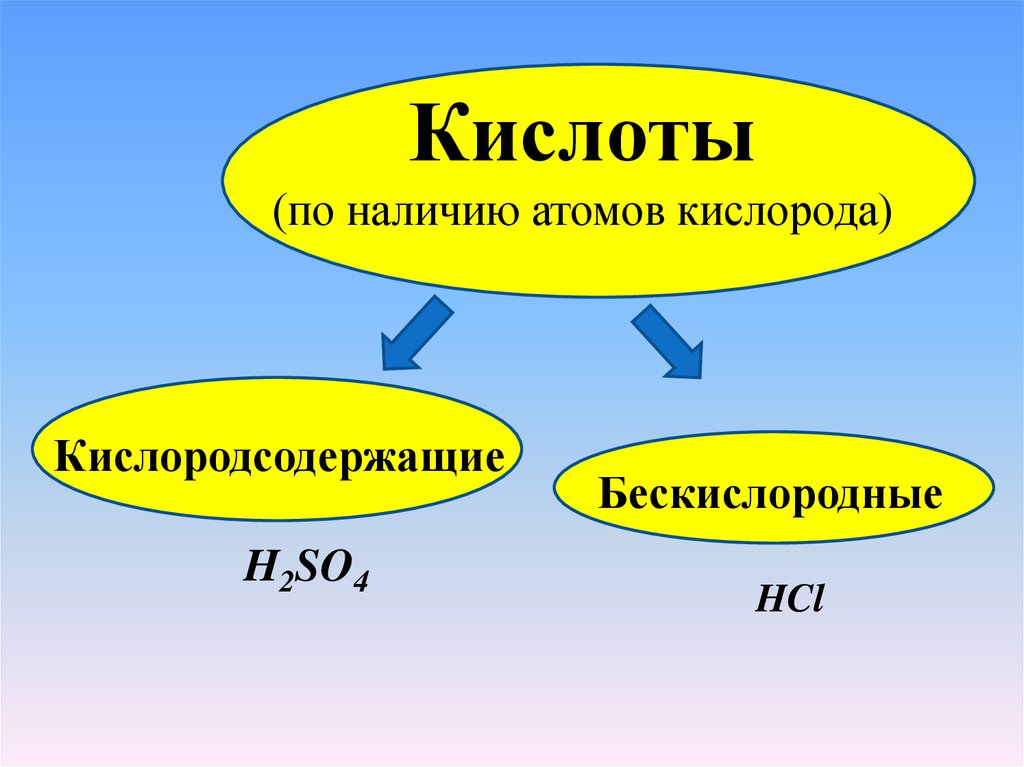
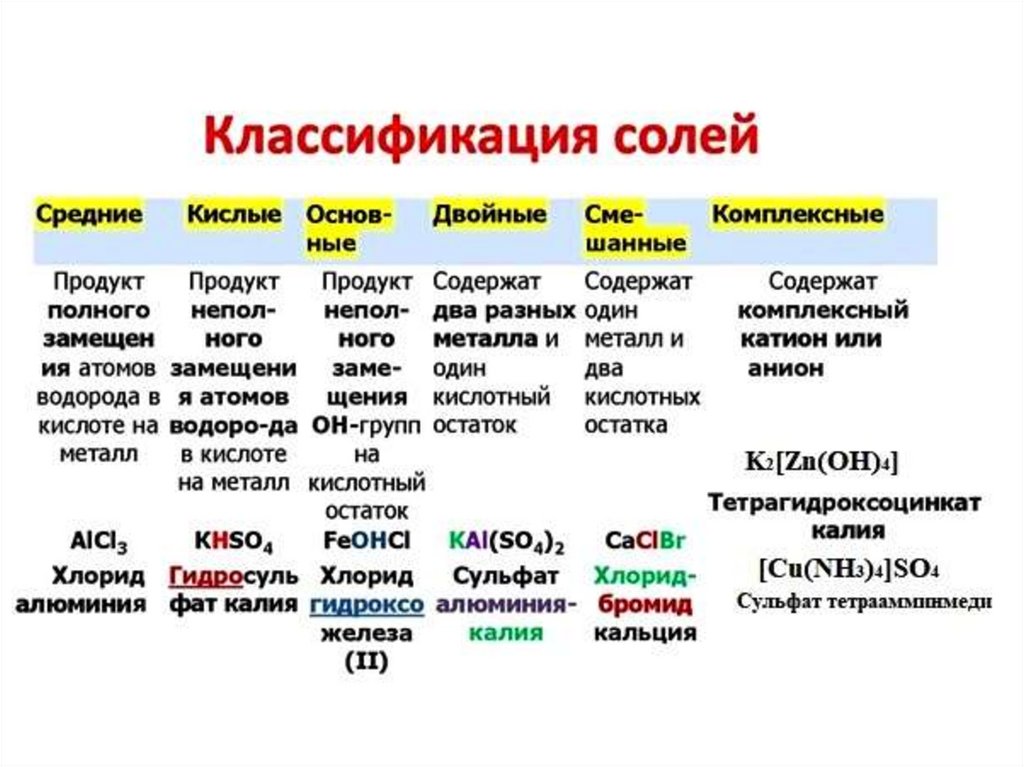
Кислоты(по наличию атомов кислорода)
Кислородсодержащие
H2SO4
Бескислородные
HCl
5.
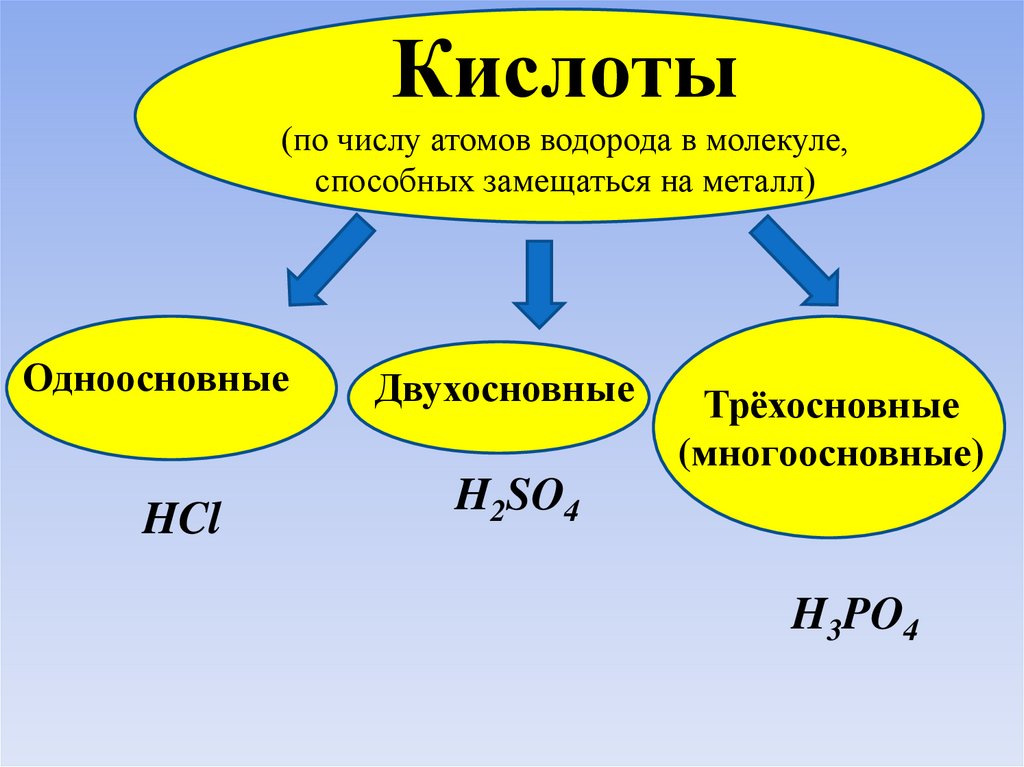
Кислоты(по числу атомов водорода в молекуле,
способных замещаться на металл)
Одноосновные
HCl
Двухосновные
Трёхосновные
(многоосновные)
H2SO4
H3PO4
6.
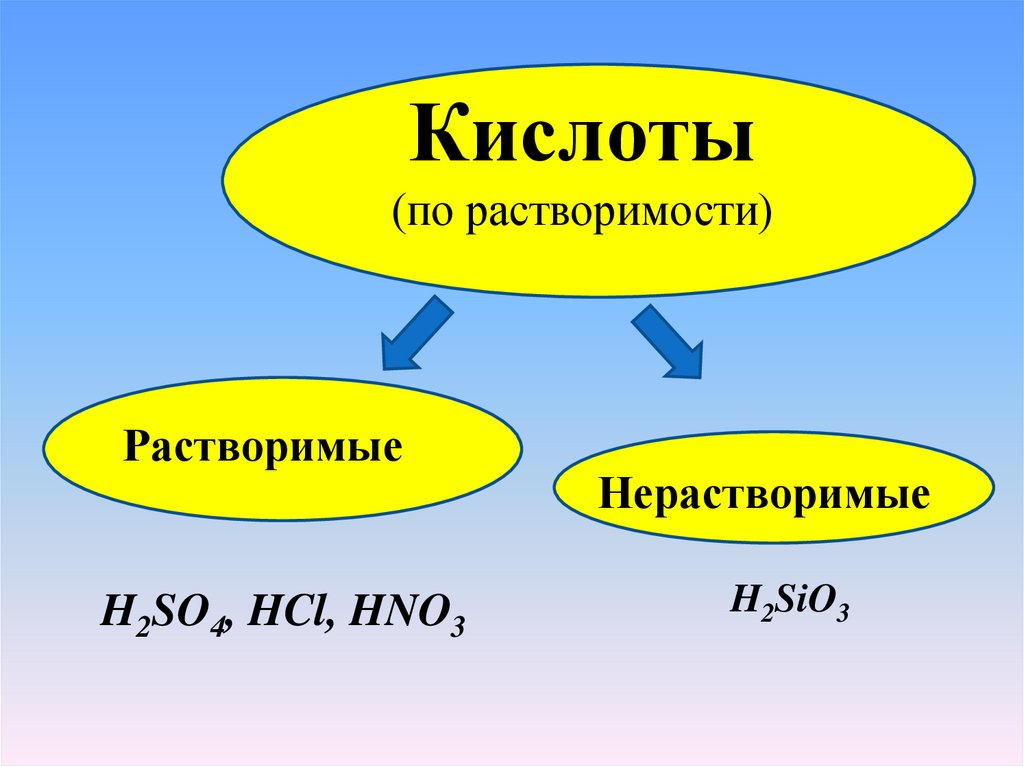
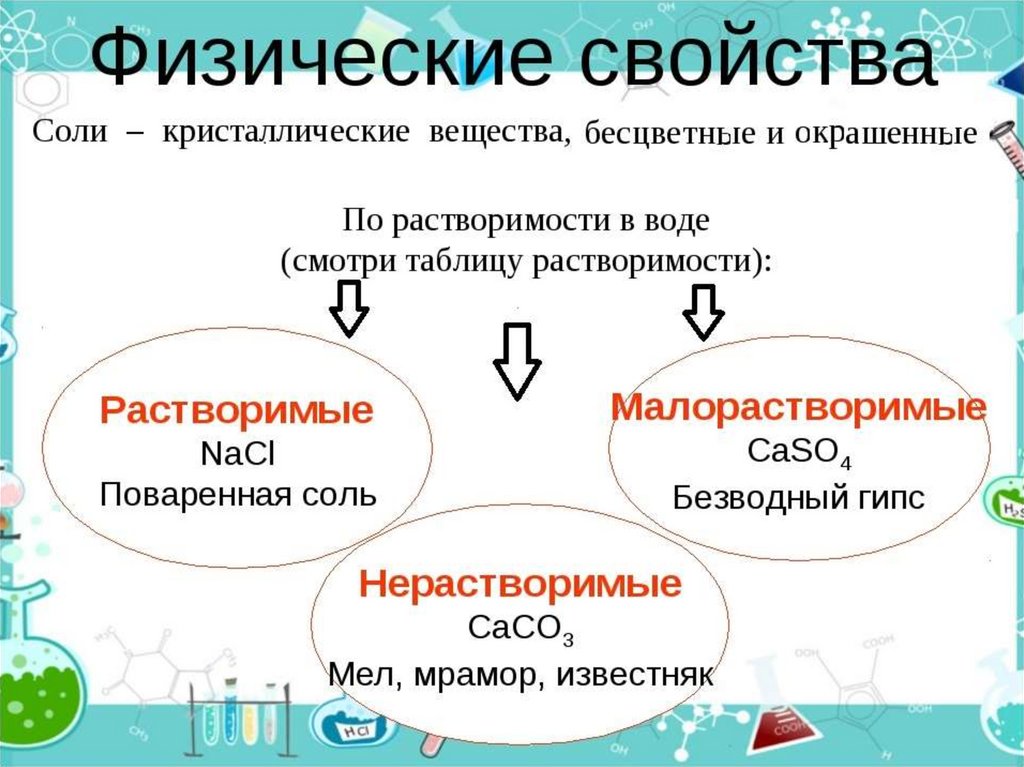
Кислоты(по растворимости)
Растворимые
H2SO4, HCl, HNO3
Нерастворимые
H2SiO3
7.
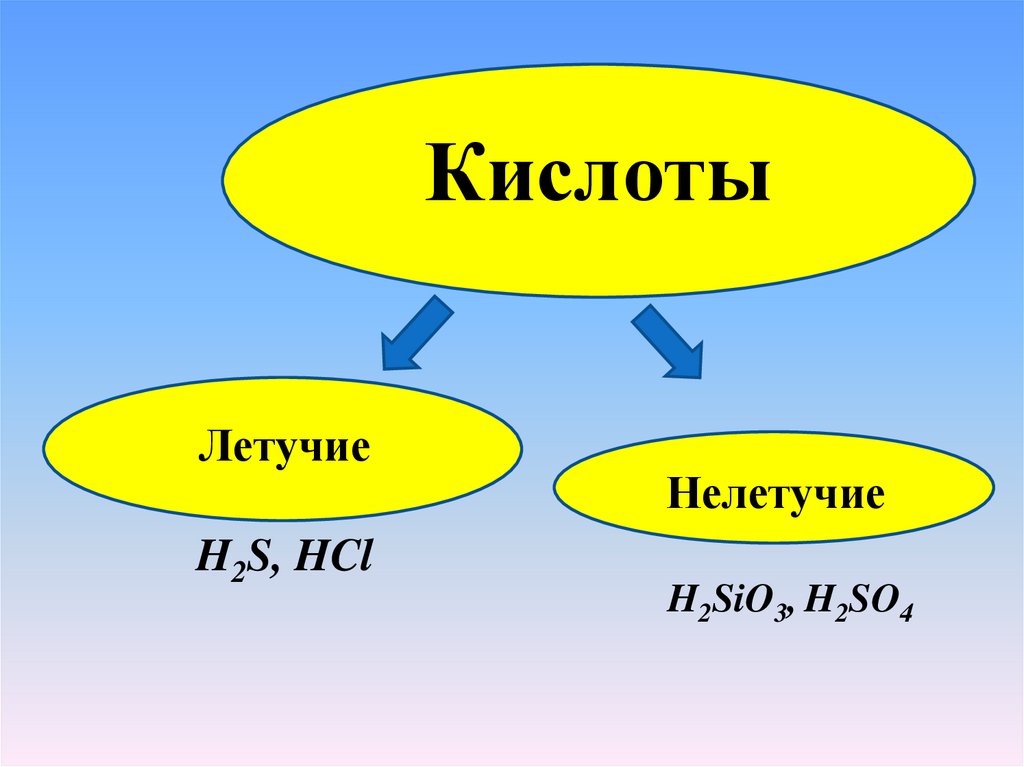
КислотыЛетучие
H2S, HCl
Нелетучие
H2SiO3, H2SO4
8.
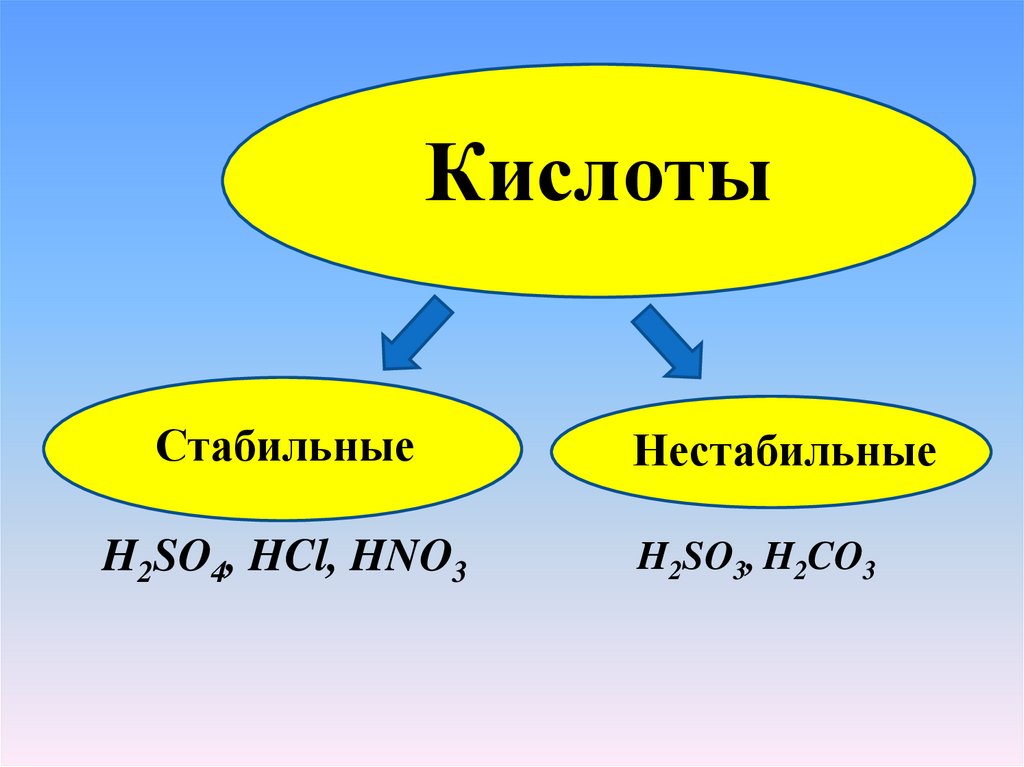
КислотыСтабильные
H2SO4, HCl, HNO3
Нестабильные
H2SO3, H2CO3
9.
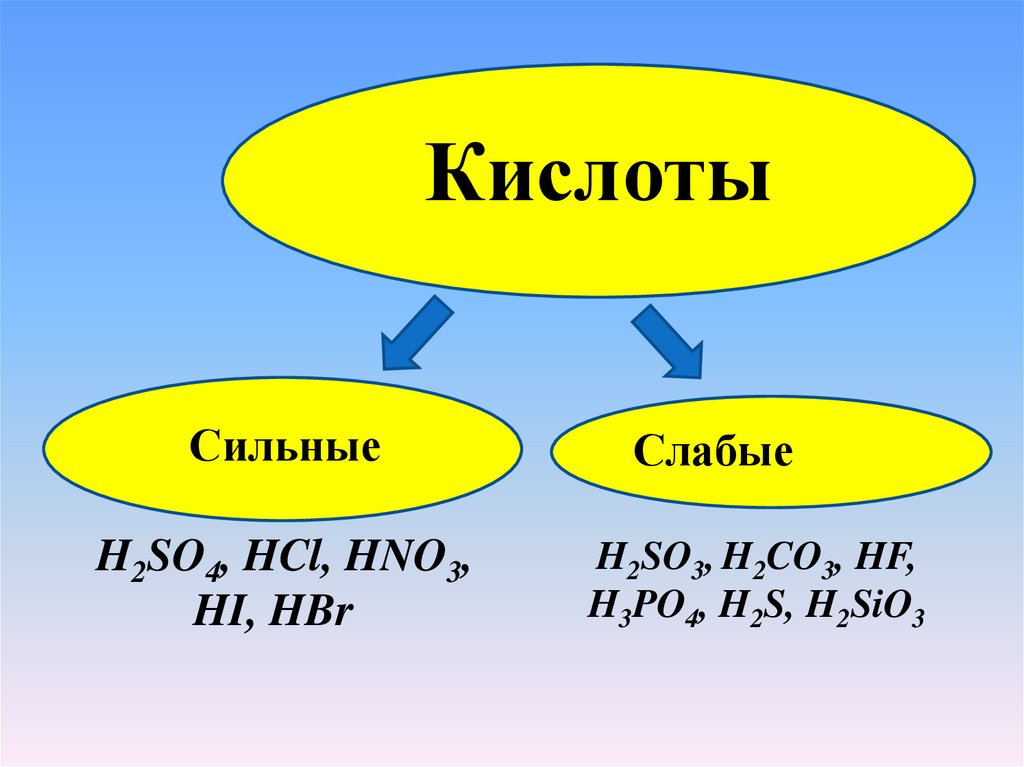
КислотыСильные
H2SO4, HCl, HNO3,
HI, HBr
Слабые
H2SO3, H2CO3, HF,
H3PO4, H2S, H2SiO3
10.
Сила кислоты - характеристика кислоты,показывающая, насколько легко кислота
отдаёт
протоны
молекулам
данного
растворителя.
Сила основания - характеристика основания,
показывающая, насколько прочно основание
связывает протоны, оторванные от молекул
данного растворителя
11.
12.
13.
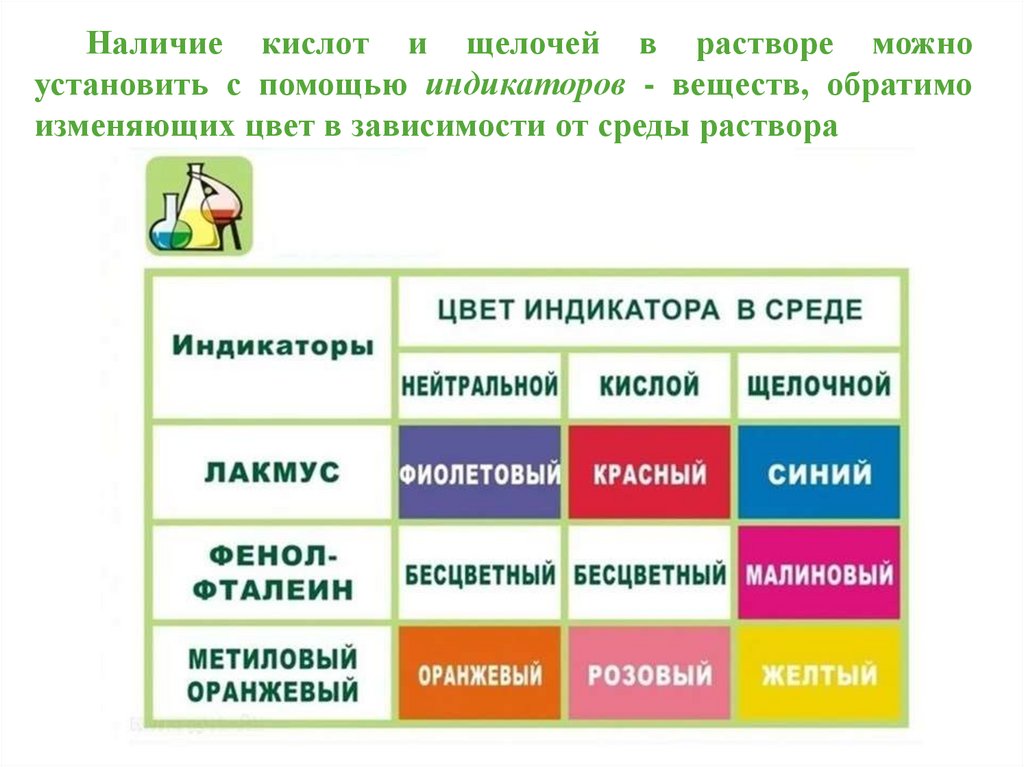
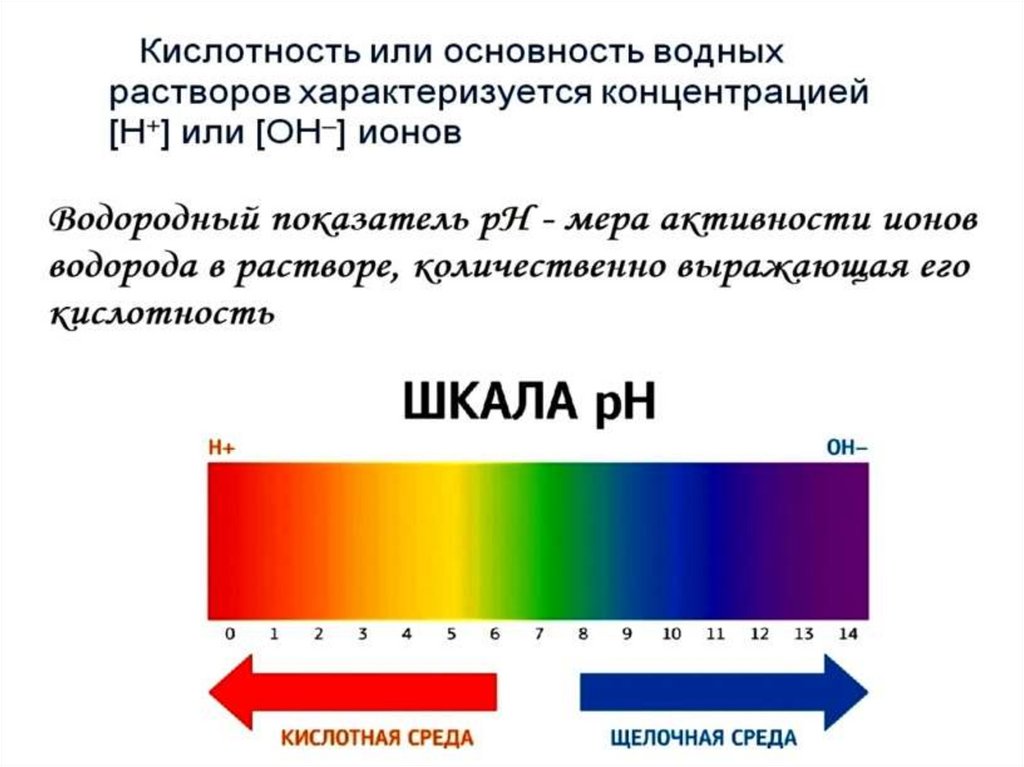
Наличие кислот и щелочей в растворе можноустановить с помощью индикаторов - веществ, обратимо
изменяющих цвет в зависимости от среды раствора





 chemistry
chemistry








