Similar presentations:
Элементы квантовой механики. Гипотеза де Бройля. Волновые свойства вещества
1.
Элементы квантовой механикиГипотеза де Бройля
Волновые свойства вещества
•Дуализм не является особенностью оптический явлений, а имеет
универсальный характер. Частицы вещества так же обладают
волновыми свойствами.
Если фотон обладает энергией и импульсом
W h
•Движение частицы
можно
рассматривать как
движение волны с
длиной
h
h
p ,
p
h
h
m
2mEk
1
2.
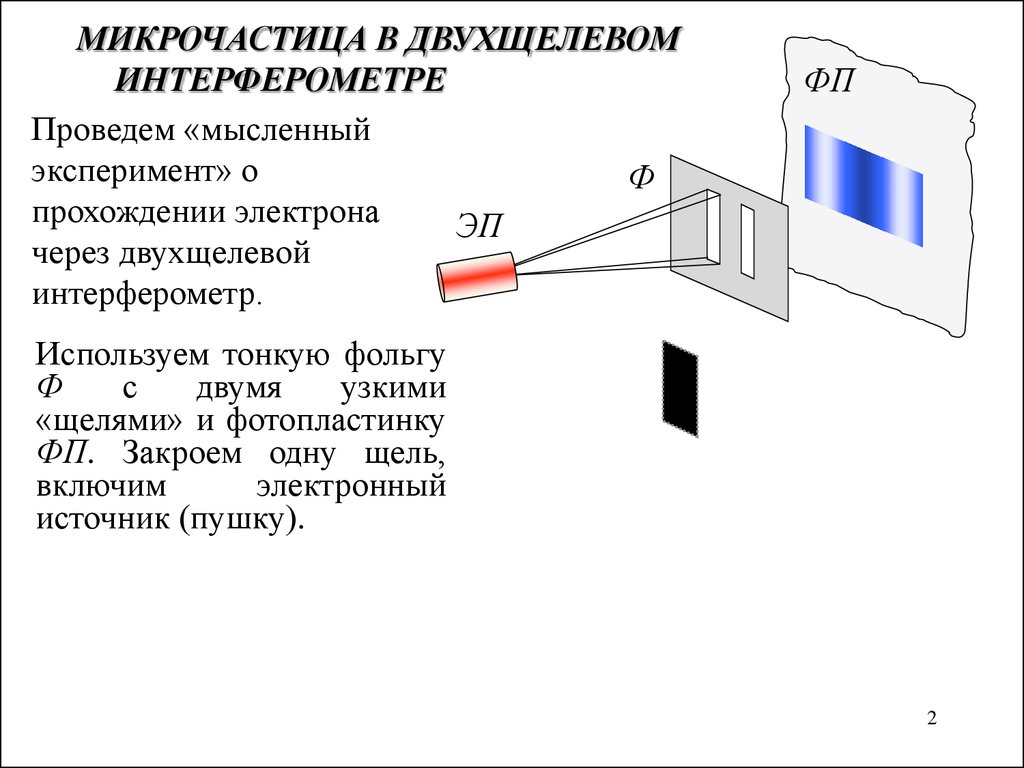
МИКРОЧАСТИЦА В ДВУХЩЕЛЕВОМИНТЕРФЕРОМЕТРЕ
Проведем «мысленный
эксперимент» о
Ф
прохождении электрона
ЭП
через двухщелевой
интерферометр.
ФП
Используем тонкую фольгу
Ф
с
двумя
узкими
«щелями» и фотопластинку
ФП. Закроем одну щель,
включим
электронный
источник (пушку).
2
3.
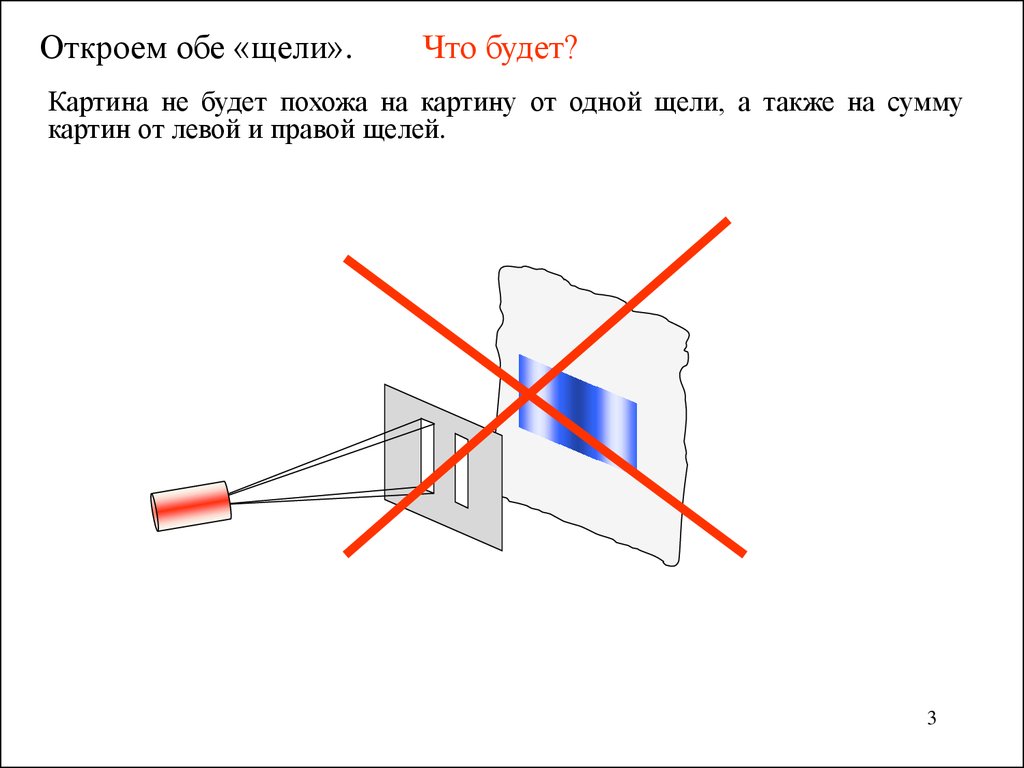
Откроем обе «щели».Что будет?
Картина не будет похожа на картину от одной щели, а также на сумму
картин от левой и правой щелей.
3
4.
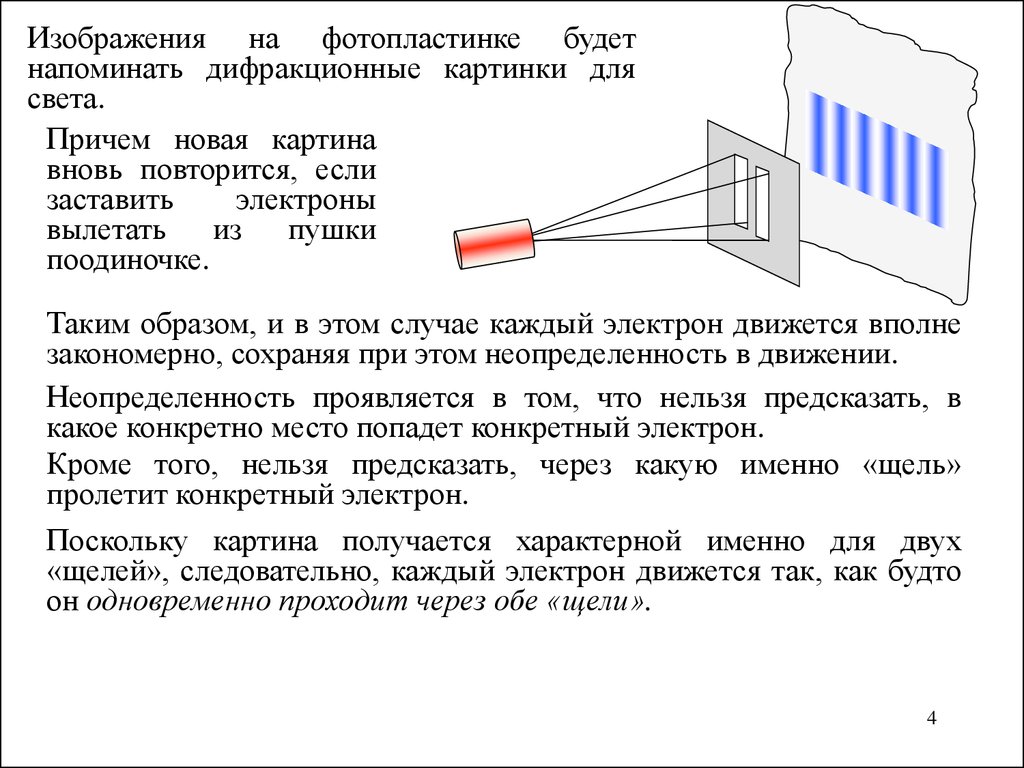
Изображения на фотопластинке будетнапоминать дифракционные картинки для
света.
Причем новая картина
вновь повторится, если
заставить
электроны
вылетать из пушки
поодиночке.
Таким образом, и в этом случае каждый электрон движется вполне
закономерно, сохраняя при этом неопределенность в движении.
Неопределенность проявляется в том, что нельзя предсказать, в
какое конкретно место попадет конкретный электрон.
Кроме того, нельзя предсказать, через какую именно «щель»
пролетит конкретный электрон.
Поскольку картина получается характерной именно для двух
«щелей», следовательно, каждый электрон движется так, как будто
он одновременно проходит через обе «щели».
4
5.
Принцип неопределённостиРазработан немецким физиков Вернером Гейзенбергом в 1927г.
В классической механике состояние материальной точки
(классической частицы) определяется заданием координат, импульса,
энергии и т.д. Перечисленные величины называются динамическими
переменными.
Микрообъекту они не могут быть приписаны.
•Микрочастица не может иметь одновременно точные значения
координаты x и компоненты импульса px. Неопределённости
значений координаты и компоненты импульса удовлетворяют
соотношению
x px .
2
y p y .
2
z pz .
2
5
6.
В классической механике такие пары величин называютсяканонически сопряжёнными. Обозначив канонически сопряжённые
величины буквами А и В, можно записать
A B
2
Это соотношение называется соотношением неопределённости для
величин А и В. Именно это и открыл Гейзенберг.
•Утверждение о том, что произведение неопределённостей значений
двух сопряжённых переменных не может быть по порядку
величины меньше постоянной Планка , называется принципом
неопределённости Гейзенберга.
Энергия и время также канонически сопряжённые величины.
E t
2
Определение энергии с точностью Е должно
занять интервал времени, t ~ / E.
6
7.
Определим значение координаты свободно летящей микрочастицы,поставив на ее пути щель шириной x , расположенную
перпендикулярно к направлению движения частицы
x p x 2
x
До прохождения частицы через щель:
px=0
Это означает, что Δpx= 0 .
Δx=∞
x
p
В момент прохождения через щель:
- появляется неопределенность x ,
- при этом Δpx≠0
x
p
x
p
p x
7
8.
x p x 2Из-за
дифракции
имеется
вероятность того, что частица
будет двигаться в пределах угла
.2 , ( - угол, соответствующий
границе
центрального
дифракционного максимума).
Таким образом,
неопределенность
x
p
x
p
p x
появляется
Центральн
ый
максимум
p x p sin
Условие первого минимума при дифракции на щели:
.
sin x
Следовательно, p x ~ p
x
2
Поскольку
, получим x p x ~ p 2 .
p
Это согласуется с принципом неопределенности.
8
9.
Модель атомаОпыт по изучению рассеяния - частиц на тонких фольгах
М
Р
Э
Ф
Узкий пучок -частиц,
испускаемый
радиоактивным веществом
Р, падает на тонкую фольгу
Ф. При прохождении через
фольгу -частицы
отклоняются от
первоначального
направления на различные
углы .
9
10.
Небольшая доля - частиц отклонялась на большие углы (до 1800).Резерфорд предположил, что в центре атома расположено тяжелое (до
99,98% массы атома) положительно заряженное ядро очень малых
размеров (10-13 - 10-12 см).
Вокруг ядра на относительно очень больших расстояниях (~10-8 см)
вращаются Z
электронов. Z - порядковый номер элемента в
периодической таблице Менделеева.
МОДЕЛЬ АТОМА РЕЗЕРФОРДА
Противоречия модели.
1. Модель не удовлетворяет условию устойчивости.
Заряженная частица, движущаяся с ускорением, в соответствии с
законами электродинамики должна тратить энергию на излучение.
Из-за потерь энергии электрон должен в итоге упасть на ядро.
2. Модель допускает испускание
излучения любой длины волны.
атомами
светового
Из опытов было известно, что конкретные атомы испускают
излучение только строго определенных длин волн.
10
11.
АТОМНЫЕ СПЕКТРЫИсследования показали: линии в спектрах атомов расположены не
беспорядочно, а объединяются в группы или серии линий.
Отчетливее всего это обнаруживается в спектре простейшего атома
– водорода.
Швейцарский физик Бальмер в 1885 году обнаружил, что длины
волн в видимой и близкой ультрафиолетовой области спектра
излучения водорода могут быть точно представлены формулой
n2
0 2
n 4
0 - константа,
n - целое число,
принимающее значения 3, 4, 5 и т.д.
Если заменить длину волны частотой, получится:
1 1
2 ,
2
2 n
R – постоянная Ридберга.
R = 2.07·1016 c-1.
Это формула Бальмера, а соответствующая серия спектральных
линий атома водорода называется серией Бальмера.
В справочниках часто приводится R =
1
1 1
7
-1
R
2 2
1,09737·10 м , входящая в формулу вида
R
(n = 3, 4, 5,…)
2
n
11
12.
СерияЛаймана
Серия Пашена
Серия Брекета
Серия Пфунда
1
1
R' ' 2 2 , (n = 2, 3, 4, …);
n
1
1
1
R' ' 2 2 , (n = 4, 5, 6 …);
n
3
1 1
R' ' 2 2 ,
4 n
(n = 5, 6, 7 …);
(n = 6, 7, 8 …).
12
13.
11
R' ' 2 2 ,
n
m
(m = 1, 2, 3, 4 …; n = m + 1).
Это обобщённая формула Бальмера.
1
1
R' 2 2 ,
n
m
1
1
R 2 2 ,
n
m
1
Энергия излучения
(m = 1, 2, 3, 4 …; n = m + 1,
R' = 3,29 1015 1/c).
(m = 1, 2, 3, 4 …; n = m + 1,
R = 1,097 107 1/м).
1
1
W
Rhc 2 2 .
n
m
hc
13










 physics
physics








