Similar presentations:
Химические свойства кислот
1.
2.
3.
I.Взаимодействие с металлами,
расположенными в электрохимическом ряду
напряжений металлов до водорода.
1
2
0
0
2 H Cl Mg Mg Cl2 H 2
2 H 2e H
0
2
Mg 0 2e Mg 2
окислитель, восстановление
восстановитель, окисление
2CH 3COOH Mg (CH 3COO ) 2 Mg H 2
ацетат магния
4.
5.
6.
7.
8.
9.
10.
11.
II. Взаимодействие с основными и амфотернымиоксидами.
CuO H 2 SO4 CuSO4 H 2O
2
CuO 2 H Cu H 2O
2CH 3COOH CuO (CH 3COO ) 2 Cu H 2O
ZnO2 HCl ZnCl2 H 2O
12.
III. Взаимодействие с растворимыми инерастворимыми основаниями.
Могут образовывать средние и кислые соли.
Это реакции нейтрализации.
H 2 SO4 NaOH NaHSO4 H 2O
(избыток)
гидросульфат
натрия
(кислая соль)
H 2 SO4 2 NaOH Na2 SO4 2H 2O
сульфат натрия (средняя
соль)
13.
IV. Взаимодействие с солямиСильная кислота способна вытеснить слабую
кислоту даже из нерастворимой соли.
2HCl Na2 S 2 NaCl H 2 S
2 H S 2 H 2 S
2 CH3COOH CaCO3 (CH3COO)2 Ca H 2O CO2
2H CaCO3 Ca 2 H 2O CO2
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
Нахождение в природеСероводород встречается в вулканических газах, а
также в воде некоторых минеральных источников —
Пятигорска и Мацесты (на Кавказе), Любеня-Великого
(Львовская область) и другие. Природные
сероводородные воды используются для лечения.
Сероводород всегда образуется при гниении остатков
растительных и животных организмов и расписании
других органических веществ, в которые входит сера.
Поэтому неприятный запах сероводорода
распространяется от выгребных ям, сточных вод и
особенно от тухлых яиц. Но в больших количествах в
природе сероводород не накапливается, потому что он
легко окисляется кислородом воздуха и разлагается.
26.
Сероводород немного тяжелее воздуха, смесь H 2 S ивоздух — взрывоопасная. Сероводород в кислороде
горит синим пламенем, с образованием SO 2 и воды. В
общем сероводород действует как восстановитель. При
высокой температуре или в присутствии катализатора
сероводород разлагается на элементарную серу и воду.
Эта реакция известна как процесс Клауса, основной
способ преобразования сероводорода в элементарную
серу. Как оксид азота, сероводород участвует в
расслабление гладких мышц. При болезни
Альцгеймера количество сероводорода в мозге сильно
снижается. В трисомии 21 (самая распространенная
форма синдрома Дауна) организм вырабатывает
избыток сероводорода. Сероводород также участвует в
процессе 1 типа диабета. Бета-клеток поджелудочной
железы при сахарном диабете 1 типа производят
избыток сероводорода, что приводит к гибели бетаклеток и снижение выработки инсулина теми, которые
остались.
27.
Интересные фактыХарактерной особенностью Черного моря является
полное (за исключением ряда анаэробных
бактерий) отсутствие жизни на глубинах свыше
150-200 м за счет насыщенности глубинных слоев
воды сероводородом.
Сероводород может использоваться для выделения
водорода из воды, с лечебной целью, в качестве
резервного топлива и др.
В энергетическом отношении (по теплоте
сгорания) 1 м3 сероводорода эквивалентен
1,49 м3 бытового газа.
28.
29.
30.
31.
32.
Соляная кислотаДля растворения окалины и ржавчины при
никелировании, хромировании, цинковании и т.п.
стальных и чугунных изделий
Для снятия накипи в паровых котлах
Плавиковая кислота HF.
Пропитывают древесину для
предохранения от термитов и других
насекомых.
33.
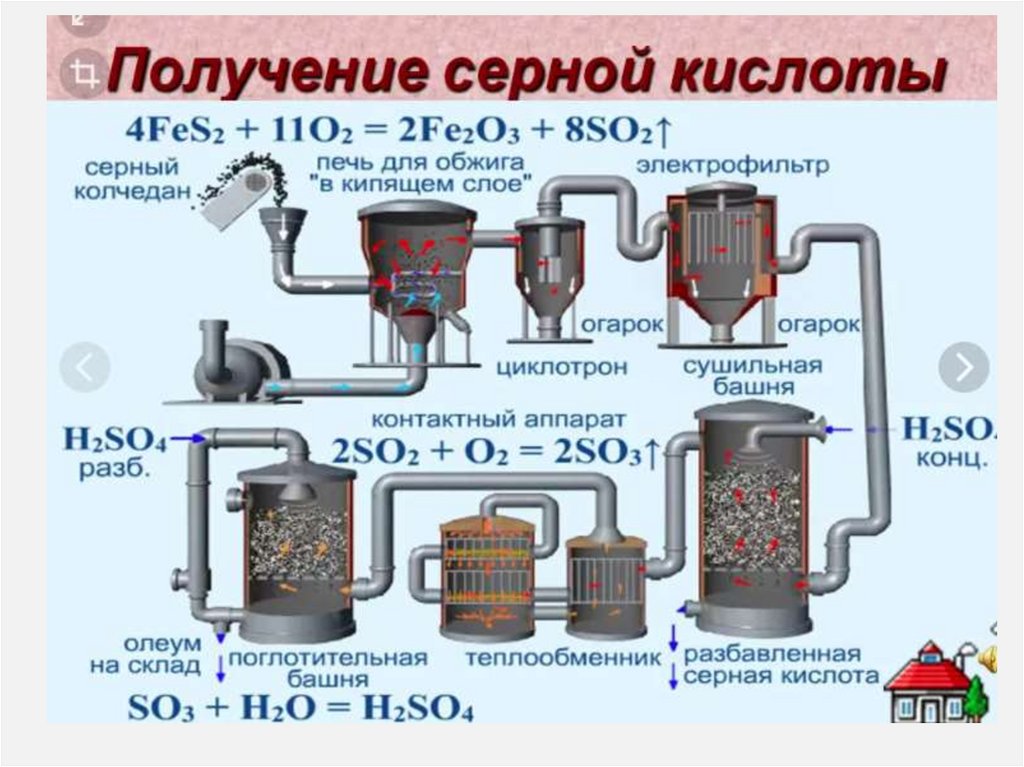
Серная кислотаДля производства фосфорных и азотных
удобрений
В производстве взрывчатых веществ
Искусственных волокон
Красителей
Пластмасс
Заливка аккумуляторов
34.
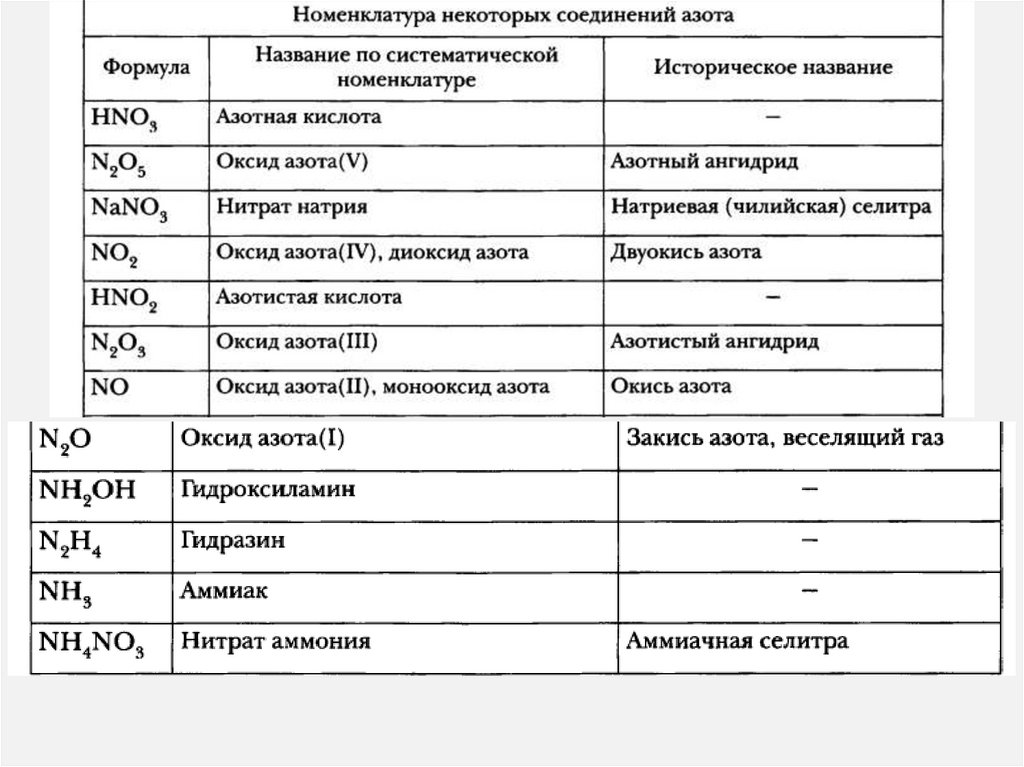
Азотная кислотаПроизводство азотных удобрений
Взрывчатых веществ
Лекарственных веществ
Красители
Пластмассы
Искусственные волокна
35.
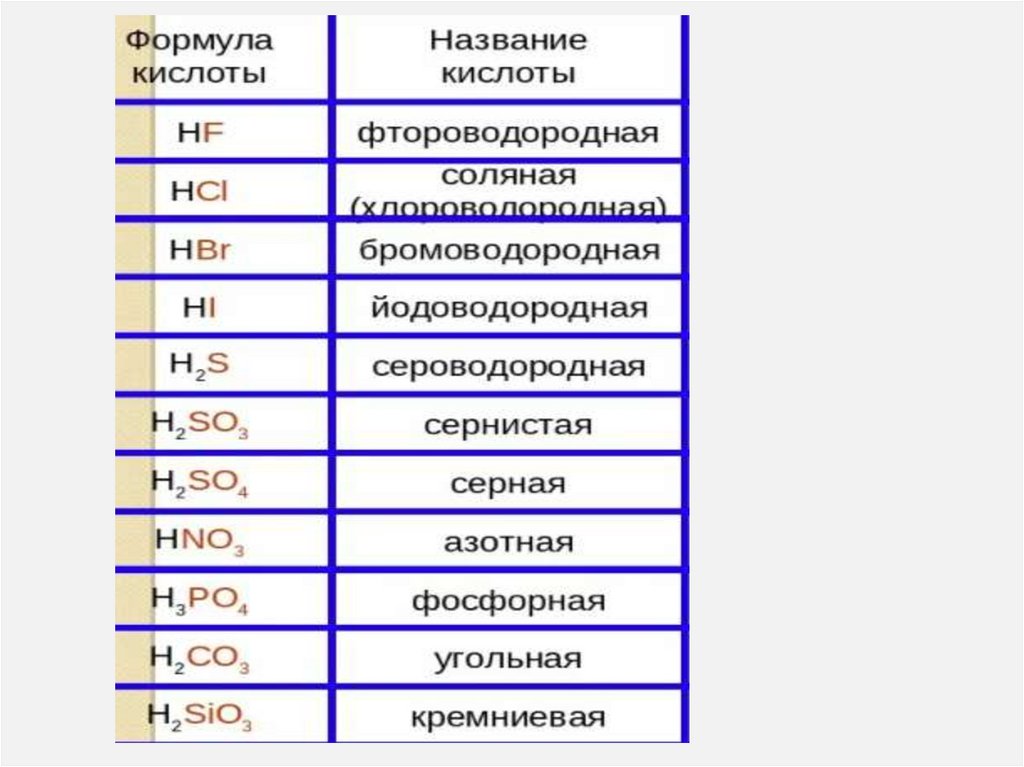
Готовиться к тесту. Примеры вопросов:1) Выберите двухосновные кислоты
1) HNO3. 2) H2S. 3) HNO2. 4) H3PO4
2) Выберите формулу сернистой кислоты
1) H2S. 2) H2SiO3 3) H2SO4 4) H2SO3
3) Выберите название кислоты, формула
которой H2SiO3
1) сернистая. 2) кремниевая 3) угольная 4) серная
4) Соотнесите названия кислот и формулы
1) серная
а) H2S
б) H2CO3
2) угольная
в) H2SO4
г) H2SO3
3) сероводородная
д) HNO2
е) HNO3
4) азотная
36.
5) Напишите уравнение реакцииNa + HNO3 (конц. 80%) =
6) Напишите уравнение реакции
Zn + H2SO4=
7) Выберите неметалл, который будет реагировать
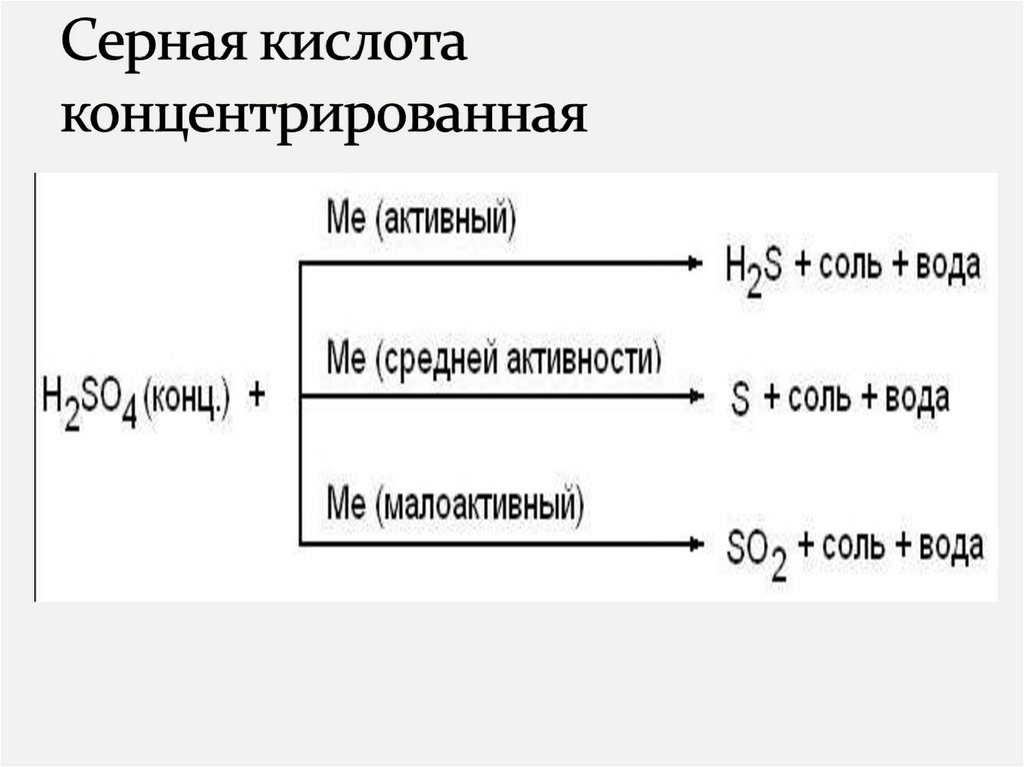
с концентрированной серной кислотой:
1) Si 2)Cl2 3)Br2
4)C
8) Соляная кислота реагирует такими веществами:
1) Na O2 HNO3.
2) К Ca Sn
3) Au Ba Mg
4) К Ag Fe
































 chemistry
chemistry








