Similar presentations:
Химические свойства серной кислоты
1.
Химические свойства серной кислотыДенисова Н.В.
МОУ СОШ №2
ПГТ.Спирово
2.
Цели урока:Знать строение и свойства серной кислоты.
Уметь составлять уравнения реакций,
отражающие свойства этих веществ.
Развивать наблюдательность, внимание,
умение работать самостоятельно и в группе,
умение анализировать.
3.
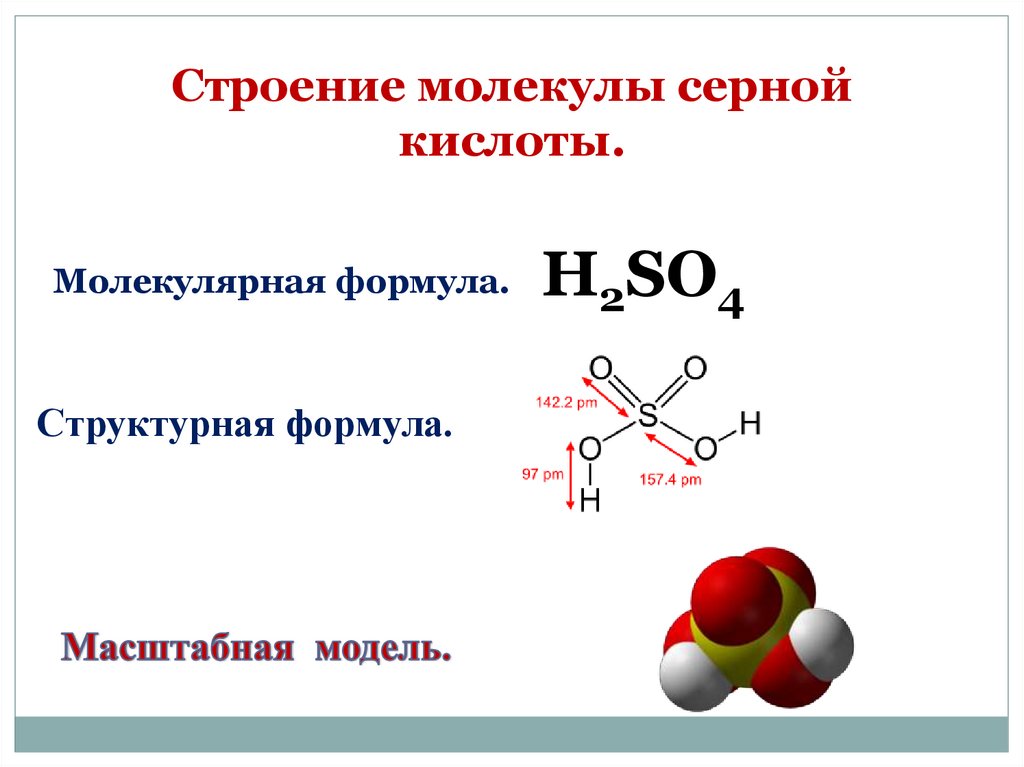
Строение молекулы сернойкислоты.
Молекулярная формула.
Структурная формула.
H2SO4
4.
Серная кислотаH2SO4, сильная
двухосновная кислота.
Безводная серная кислота
бесцветная маслянистая
жидкость, плотность
1,9203 г/см³, tпл 10,3 .С,
tкип 296,2 .С. С водой
смешивается во всех
отношениях.
5.
ПолучениеСырьем для получения серной
кислоты служат: S,сульфиды
металлов,H2S, отходящие газы
теплоэлектростанций, сульфаты
Fe, Ca и другие.
6.
Серная кислотаH2SO4
Серная кислота сильная, т.е.
в водных растворах полностью
распадается на ионы:
H2SO4 = 2H+ +SO42Растворы кислоты не имеют
запаха.
7.
8.
Химическиеразбавленной серной
кислоты
1. Кислотные свойства
А. Взаимодействие с металлами,
стоящими в ряду активности до
водорода:
H2SO4 + Zn = ZnSO4 + H2
Допишите:
H2SO4 +Mg =
9.
Б. С оксидами металлов:H2SO4 + CuO = CuSO4 + H2O
Допишите:
H2SO4 + ZnO=
(самостоятельно)
10.
В. С гидроксидами металлов:H2SO4 + NaOH →
H2SO4 + 2NaOH → Na2SO4 +
2H2O
Допишите:
H2SO4 + Сu(OH)2 →
11.
Г. С солями (при условии,если образуется осадок или
газ).
H2SO4 + BaCI2 →
H2SO4 + BaCI2 = BaSO4↓ +
2HCI
Допишите:
H2SO4 + Na2CO3 →
12.
Приготовление раствора серной кислоты.Вода легче серной кислоты. При
вливании воды в серную кислоту, при
контакте с поверхностью кислоты, она
сразу же вступает в бурную реакцию,
разогревается, вскипает,
разбрызгивается из сосуда и может
попасть в глаза, в лицо. Поэтому одно из
важнейших правил химика: "Не лей
воду в кислоту!"
13.
Правила техники безопасности приработе с серной кислотой.
•Работать в перчатках.
•При попадании кислоты на кожу
промыть проточной водой.
•Обработать 5% раствором питьевой соды.
•При разбавлении концентрированной
серной кислоты, сначала наливают воду,
затем – кислоту.
14.
Серная кислота высокойконцентрации (практически
безводная) не взаимодействует с
железом и алюминием в
результате
пассивации металлов.
15.
Концентрированная серная кислота-довольно сильный окислитель,
особенно при нагревании.; окисляет HI
и частично НВг до свободных
галогенов, углерод - до СО2, S-до SO2,
окисляет многие металлы Сu, Hg и др.).
C +2H2SO4 =2SO2 + CO2 +2H2O
16.
Продуктами восстановления кислотыобычно является оксид серы (IV), сероводород и
сера (H2S и S) образуется в реакциях кислоты с
активными металлами- магнием, кальцием,
натрием, калием и др.
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O
Mg + 2H2SO4 = MgSO4 + SO2+ 2H2O
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
17.
Качественная реакция на сернуюкислоту и ее соли.
1. Определение иона водорода
Н+
2. Определение сульфат-аниона
SO42-
индикатор
+BaCI2
Ba2+ + SO42-
BaSO4
Белый
осадок
18.
Перечислите общиесвойства раствора
серной кислоты
H2SO4
MeXOY
Соль +H2
Mex Oy
Me(OH)n
Соль
Соль
+H2O
Соль +
Кислота
19.
веществакислота Нn+1 (KO)-n
1.металл
Ме
металл + кислота = соль + водород ↑
2.основной
оксид
основный оксид + кислота = соль + вода
МеО
3.основание
Ме(ОН)n
основание + кислота = соль + вода
4.соль
соль + кислота= новая кислота + новая соль
Меn(КО)m
признаки и
условия
реакций
20.
С какими из перечисленных веществ может вступить вовзаимодействие серная кислота, находящаяся в водном растворе:
H2SO4 + MgO= MgSO4+ H2
H2SO4 +BaCI2=BaSO4+ 2HCI
H2SO4 +CO2=?
3H2SO4 +2AI= AI2(SO4)3 + 3H2
H2SO4 +KOH=K2SO4+ H2
H2SO4 +NaNO3=?
21.
Ответьте навопросы.
1.Что нового вы узнали сегодня о
кислотах?
2.Какие из изученных сегодня вопросов
вызвали наибольшие трудности при
усвоении? Как вы думаете, почему?
3.Какие задания вам выполнить не
удалось? Почему?
4.Каким баллом вы бы оценили свою
работу.
22.
Домашнеезадание
§22 стр.104-106
1.упр.4 стр.107
2.Написать уравнения реакций
–взаимодействия серной кислоты
с оксидом железа(ІІІ),
оксидом кальция,
гидпрксидом кальция,





















 chemistry
chemistry








