Similar presentations:
Лекции по биохимии
1.
Лекции побиохимии
зав. кафедрой КЛД, профессор
В.В. Алабовский
2. Биологическая химия является наукой, которая изучает химический состав и превращения веществ в организме, а также устанавливает
связь междуданными превращениями и
физиологическими процессами в
органах и тканях.
3.
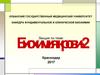
этап 3Этапы развития болезни
этап 2
этап 1
J
-ОН
Лекарства
-ОН
-ОН
J
J
J
-ОН
J
-О-
J
-ОН
J
J
J
J
-О-
J
J
-О-
J ОН
J
J
ОН
4.
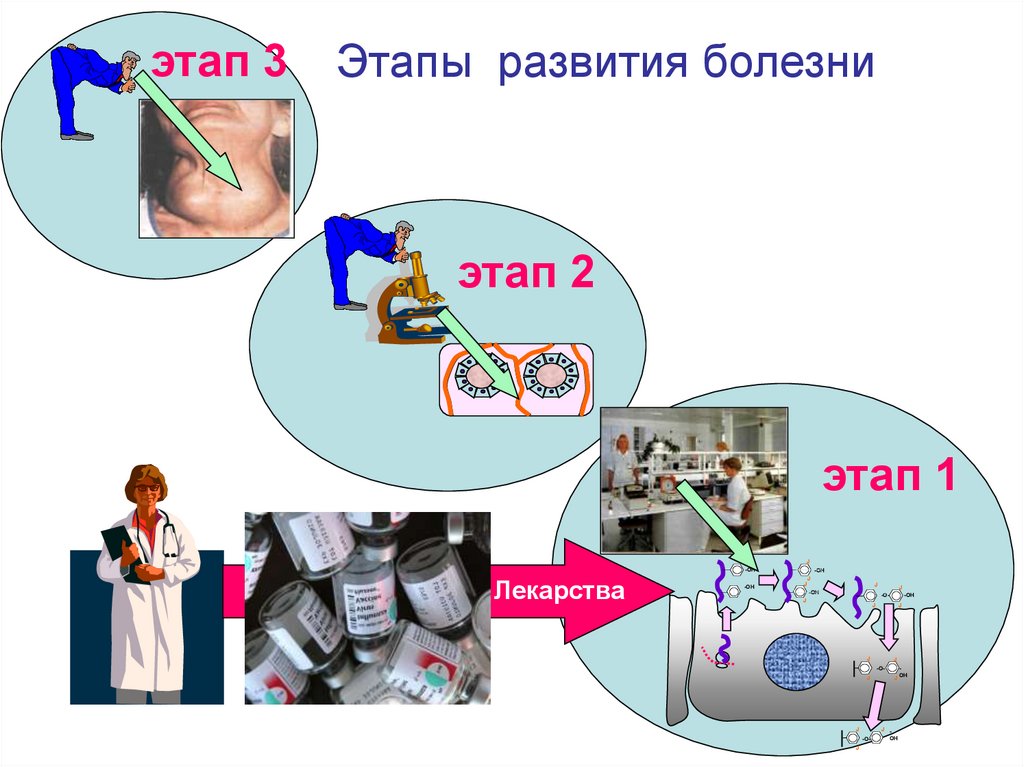
Лабораторная диагностика в лечебном процессеЛечебные действия
Визуальное и
клиническое
обследование
Предваритель
ный диагноз
Первичные
анализы
Корректировка лечения
Уточнение диагноза
Контроль качества
лечения
Специализи
рованые
анализы
Окончатель
ный
диагноз
Контроль
выздоров
ления
Контрольные
анализы
5. Роль биохимии в медицине
• Дает возможность установить причину,вызывающую болезнь;
• Позволяет понять закономерности,
лежащие в основе протекания болезни;
• Определяет конкретные места нарушений
обменных процессов, вызывающих
болезнь;
• С помощью биохимических методик можно
количественно оценить тяжесть данных
нарушений;
6. Роль биохимии в медицине
• С помощью веществ (лекарств) можноустранить нарушения и восстановить
нормальное протекание химических
процессов у больного;
• С помощью биохимических анализов
оценивается эффективность лечения и
срок завершения лечения больного.
7. Разделы биохимии: 1. Статическая биохимия 2. Динамическая биохимия 3. Функциональная биохимия
8.
• Статическая биохимия – изучаетхимический состав живых организмов;
• Динамическая биохимия – изучает
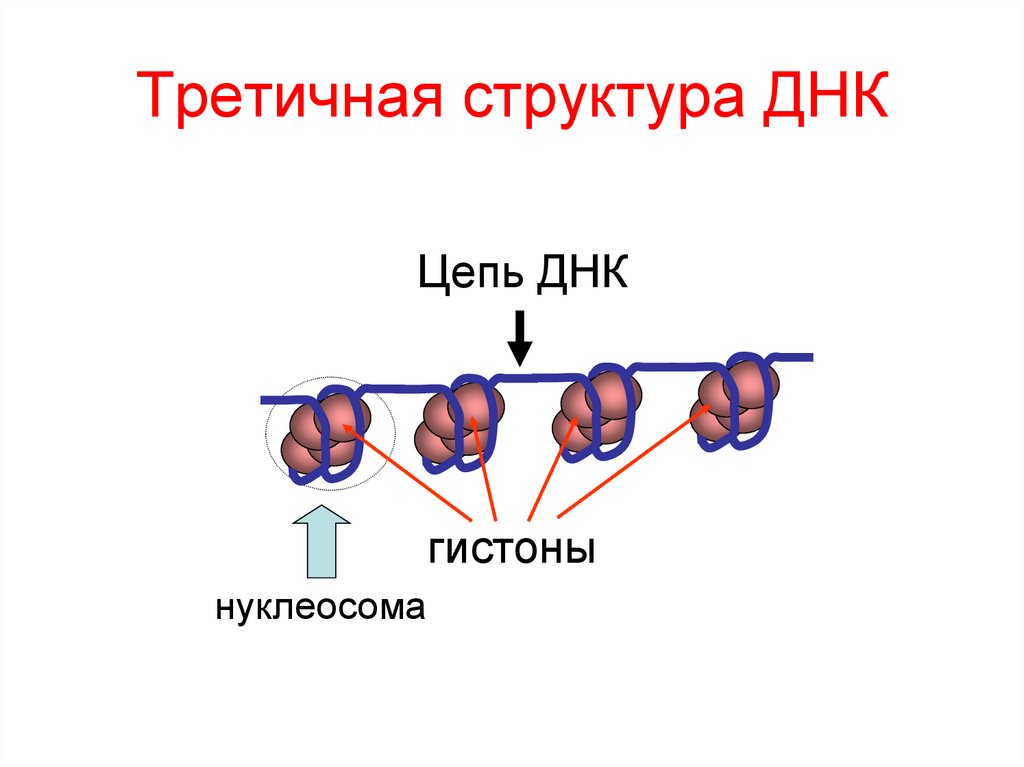
превращения химических веществ;
• Функциональная биохимия – изучает
связь между биохимическими
превращениями и физиологическими
процессами в организме.
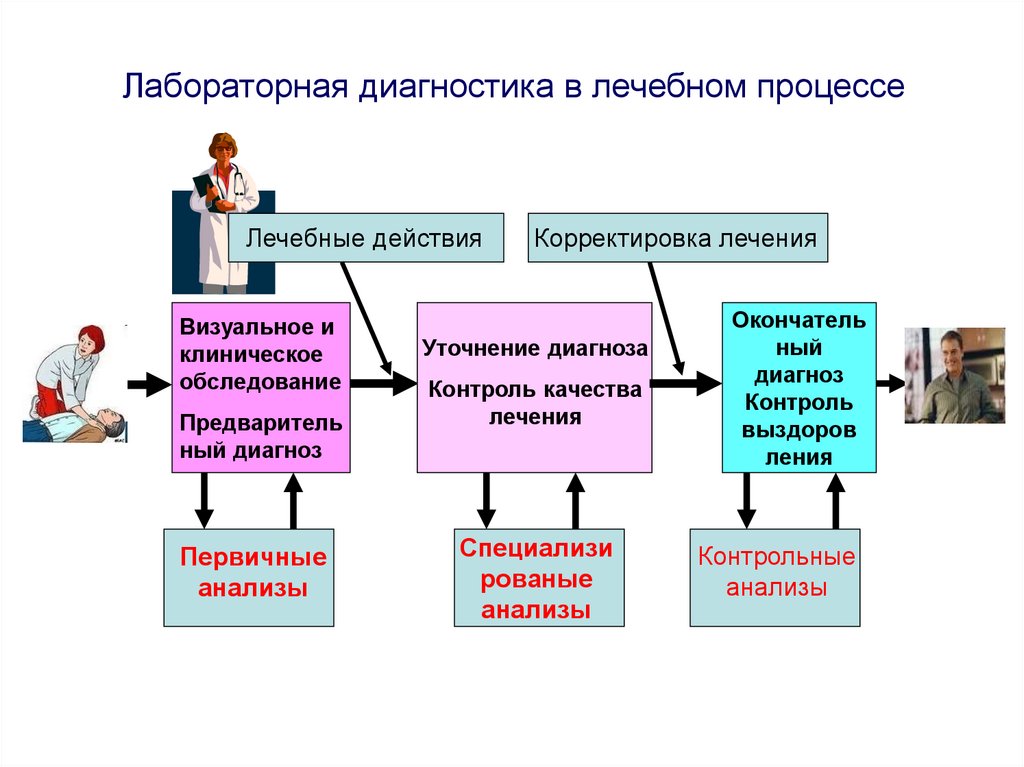
9. Разделы динамической биохимии
Обменуглеводов
Обмен
белков
Энергетический обмен
Обмен
липидов
Минеральный обмен
10. Тема № 1 Строение и свойства белков
11. Роль белков в организме
Структурная
Каталитическая
Транспортная
Регуляторная
Защитная
Гомеостатическая
Депонирующая
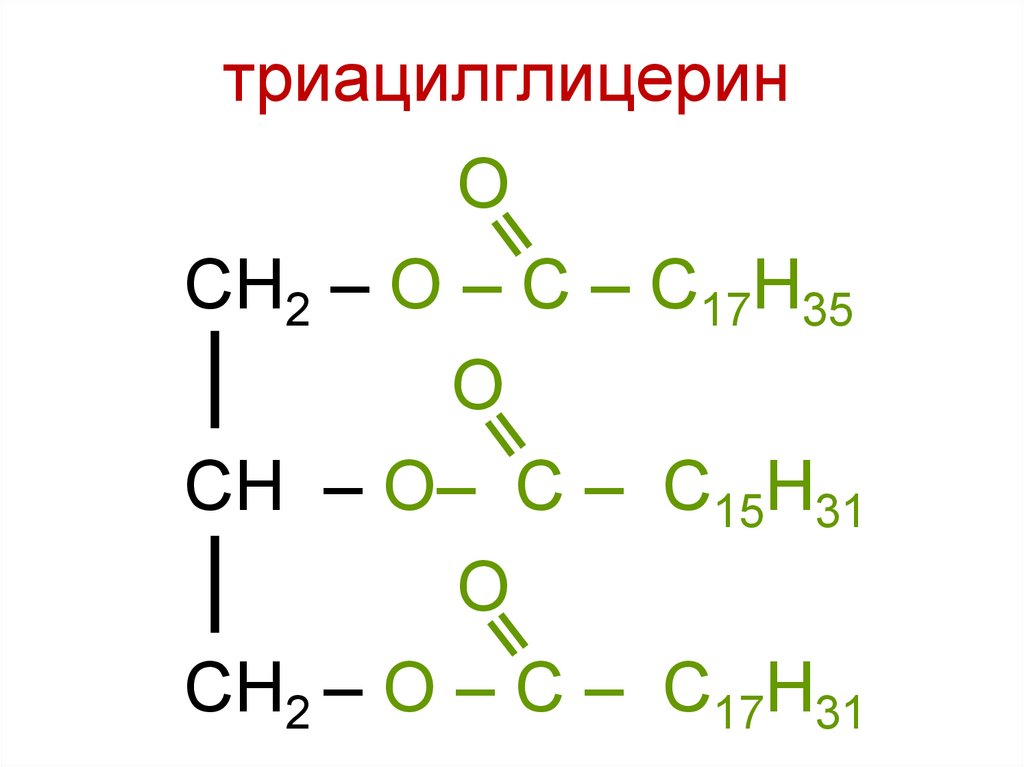
Функциональная
12. Уровни организации белковой молекулы
• Первичная структура• Вторичная структура
• Третичная структура
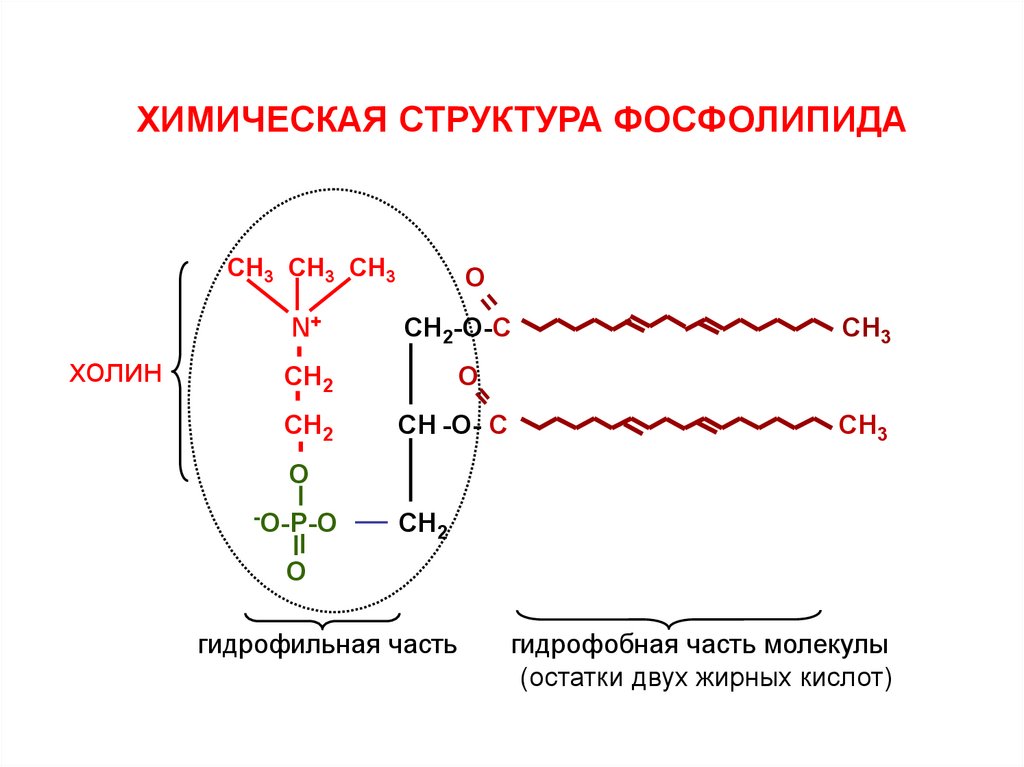
• Четвертичная структура
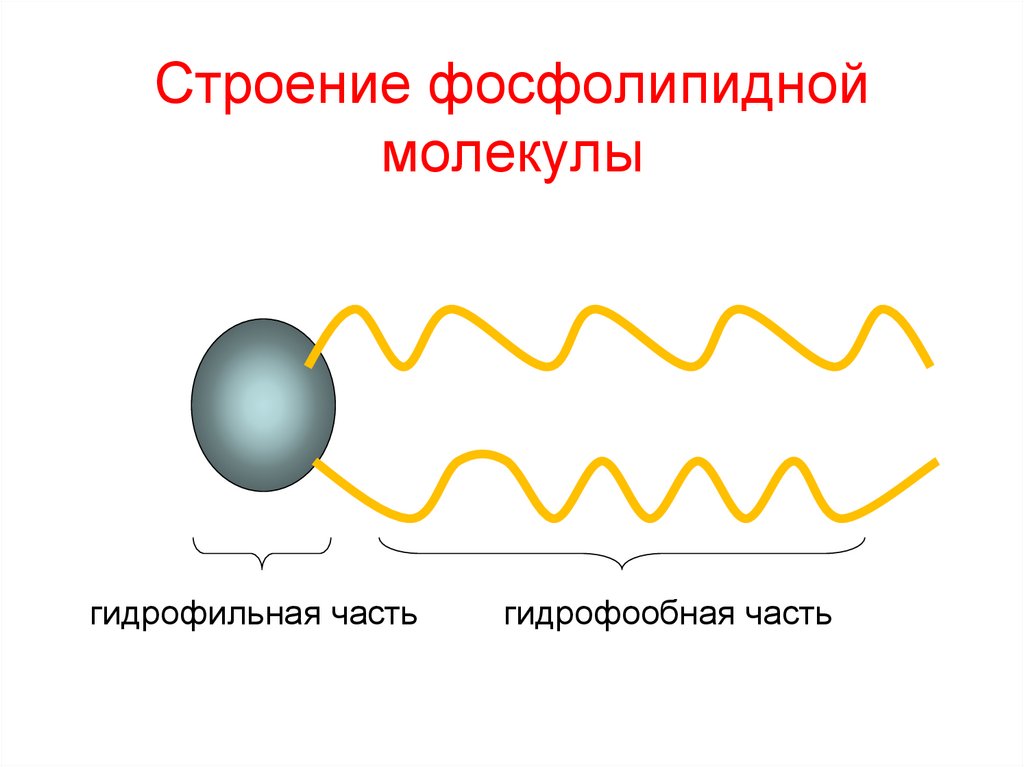
13.
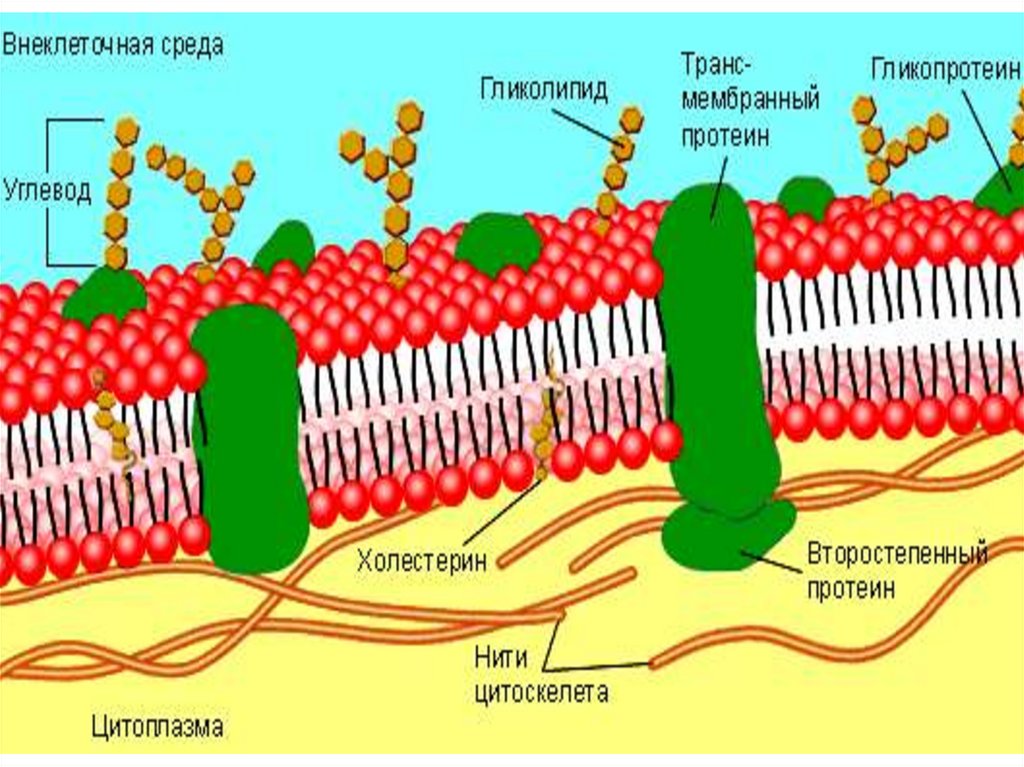
Под первичнойструктурой белка
понимают
порядок соединения
аминокислот в
полипептидной цепи
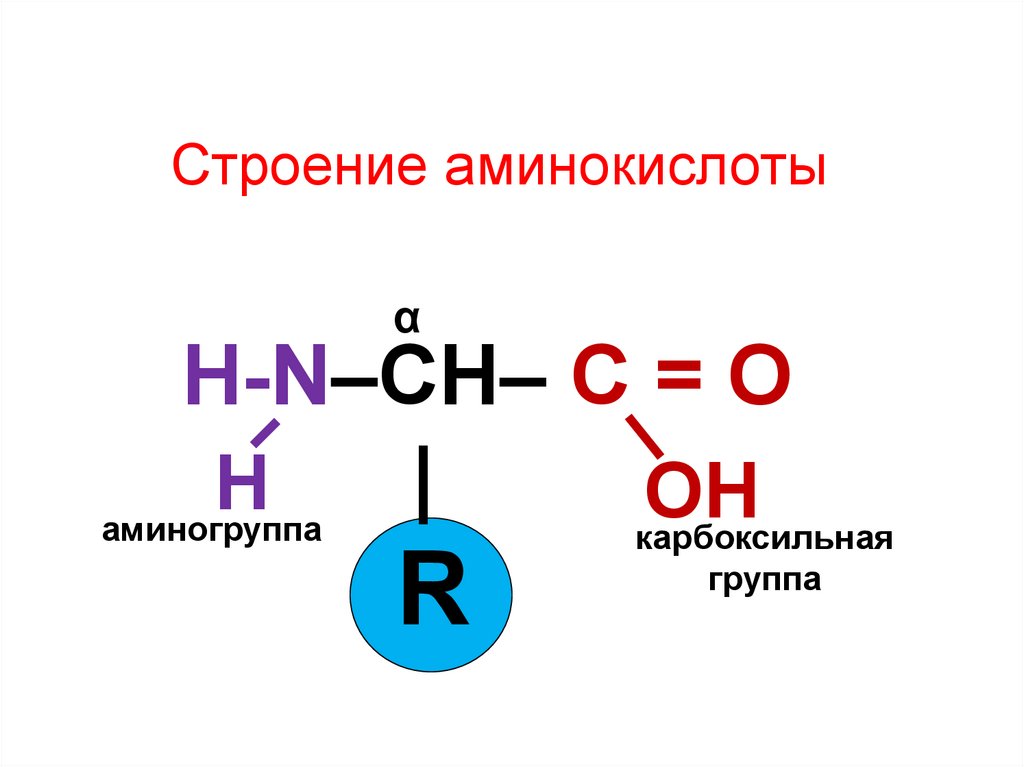
14. Строение аминокислоты
αH-N–CH– C = O
|
Н
ОН
аминогруппа
R
карбоксильная
группа
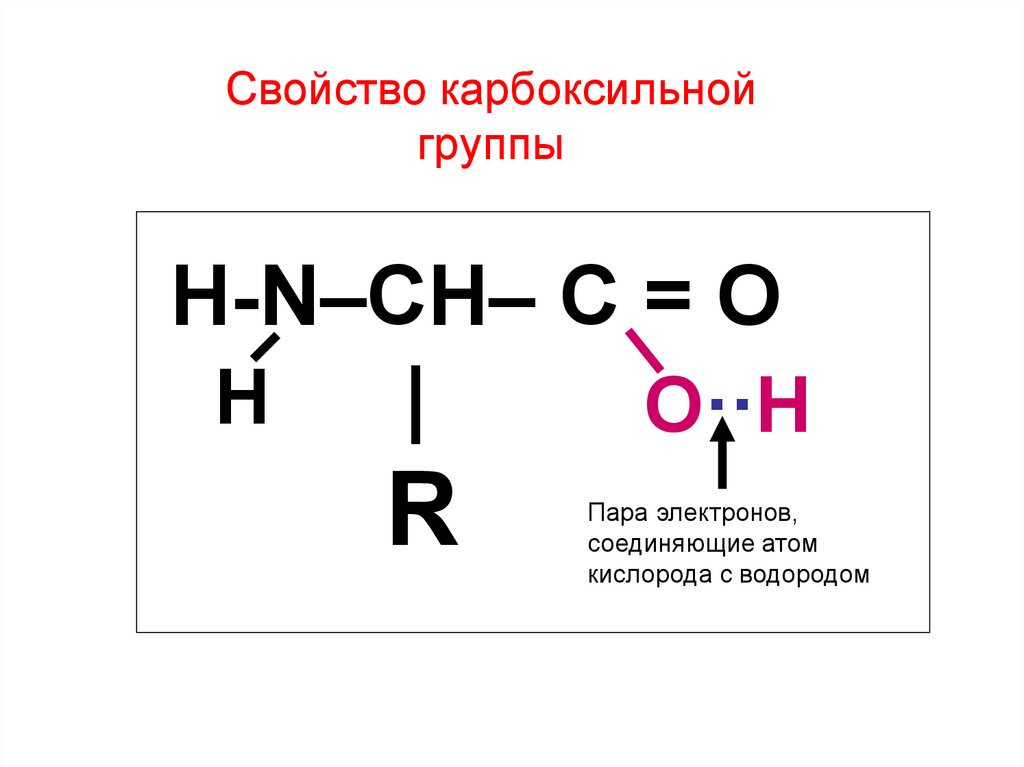
15. Свойство карбоксильной группы
H-N–CH– C = OН
|
О··Н
R
Пара электронов,
соединяющие атом
кислорода с водородом
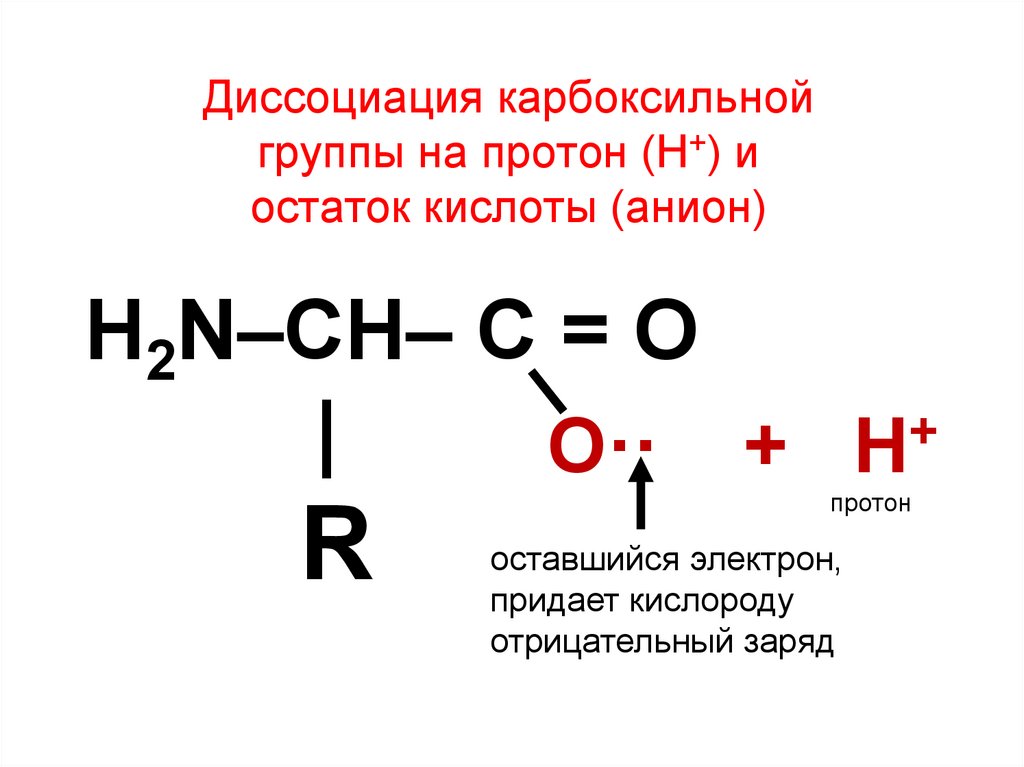
16. Диссоциация карбоксильной группы на протон (Н+) и остаток кислоты (анион)
H2N–CH– C = O+
|
О·· + Н
R
протон
оставшийся электрон,
придает кислороду
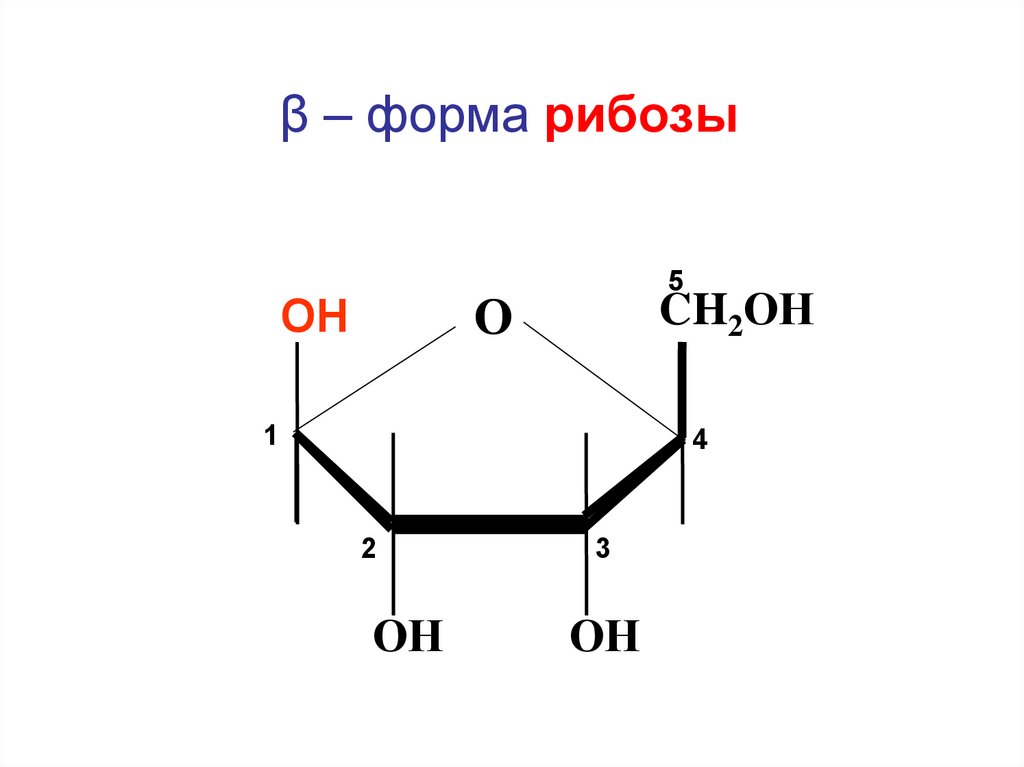
отрицательный заряд
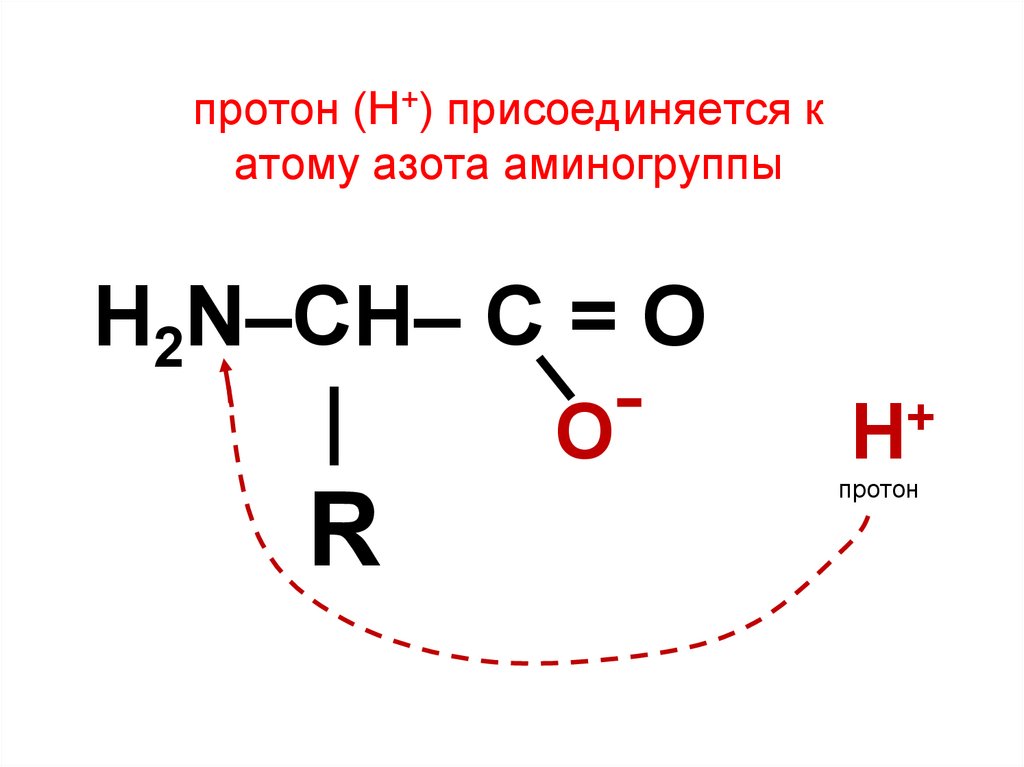
17. протон (Н+) присоединяется к атому азота аминогруппы
H2N–CH– C = O|
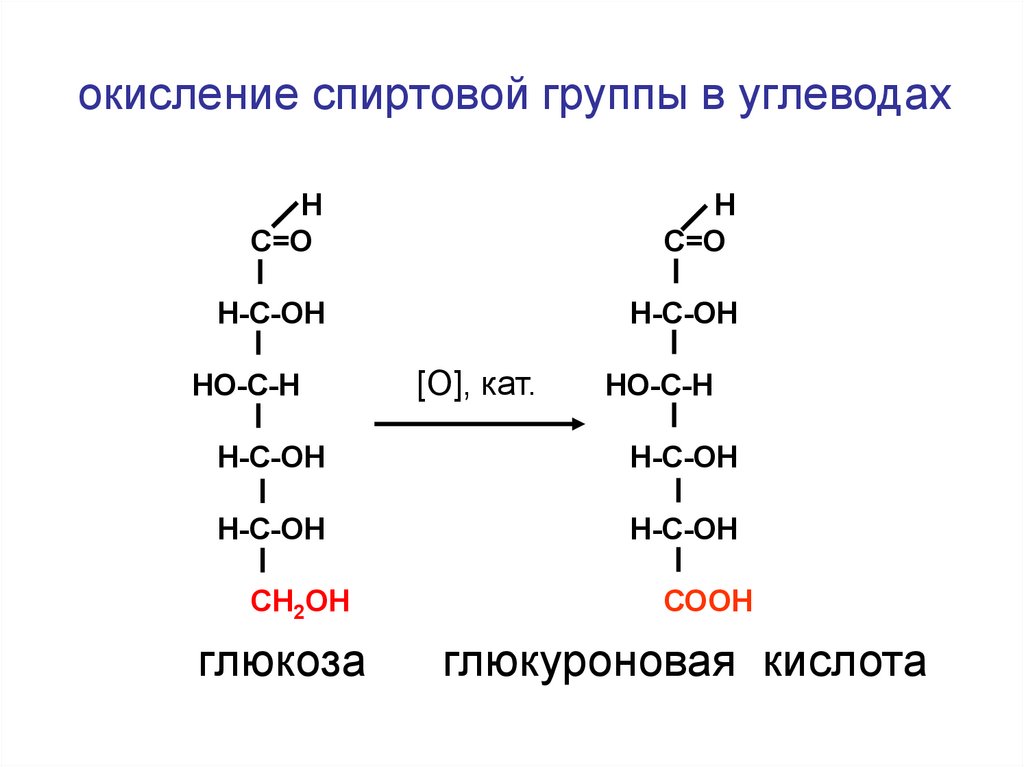
О
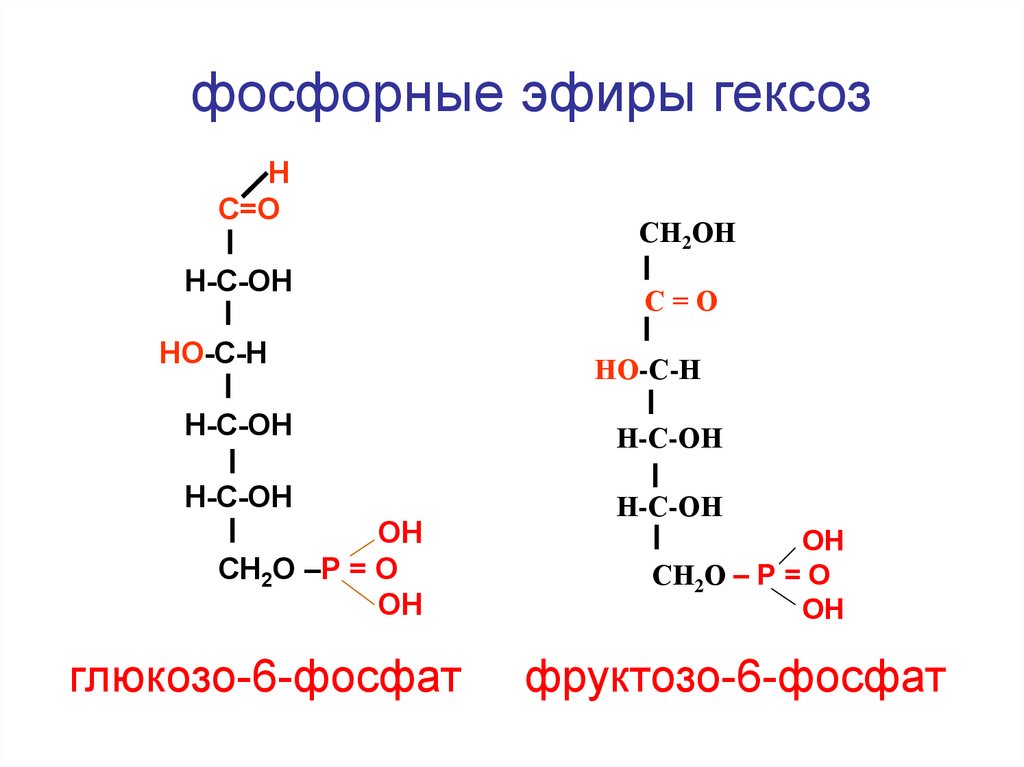
R
+
Н
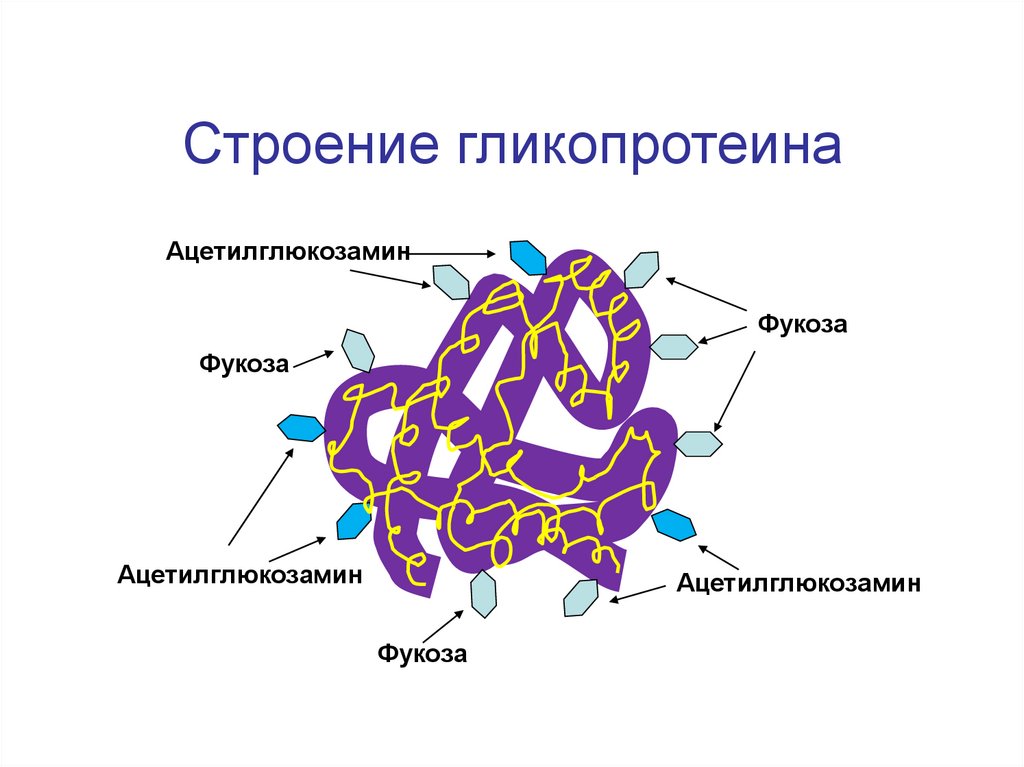
протон
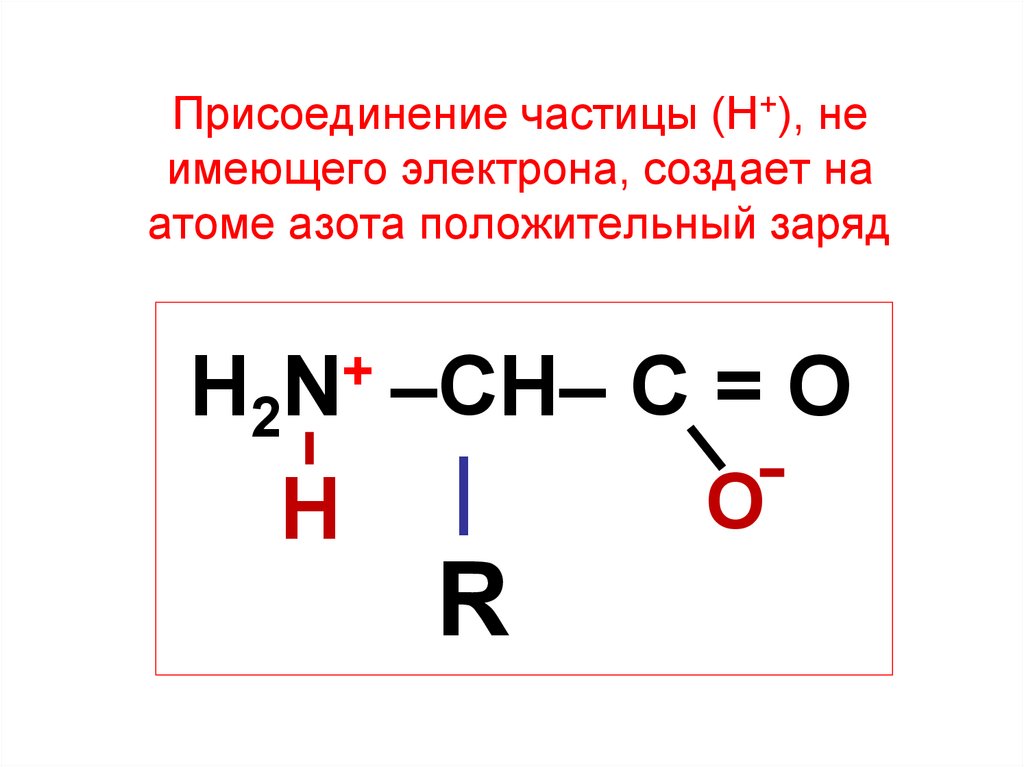
18. Присоединение частицы (Н+), не имеющего электрона, создает на атоме азота положительный заряд
+H2N –CH–
Н
|
R
C=O
О
19.
В каком состоянии находитсяаминокислота - в виде сухого
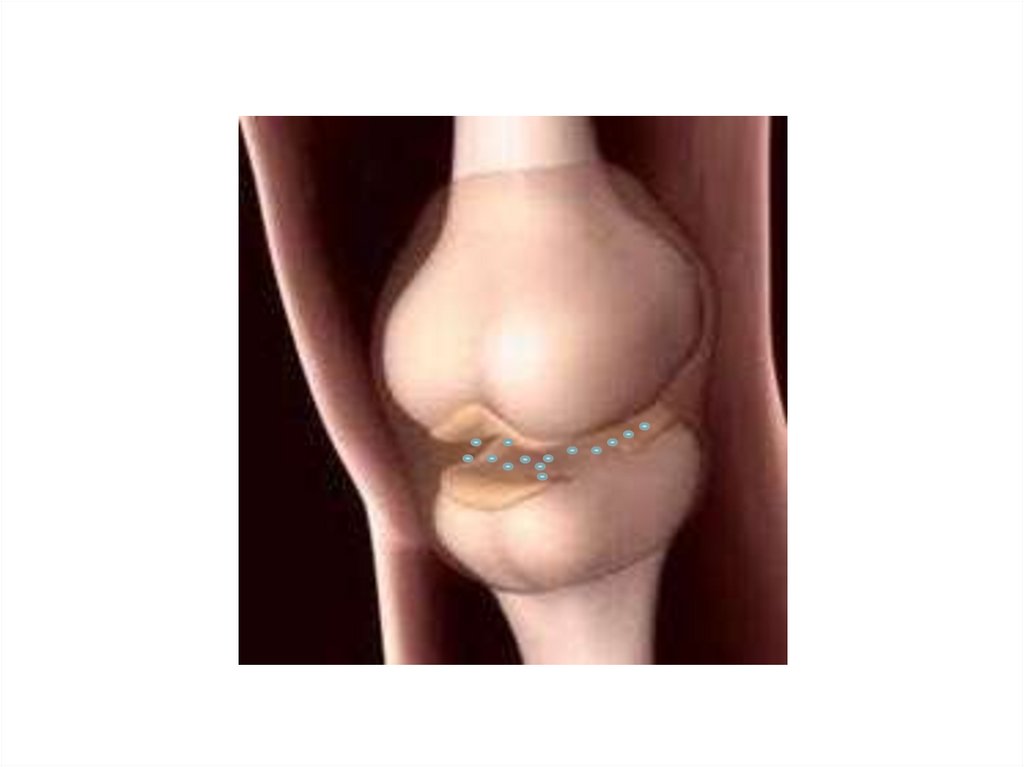
порошка или в растворе?
H2N–CH– COОН
|
R
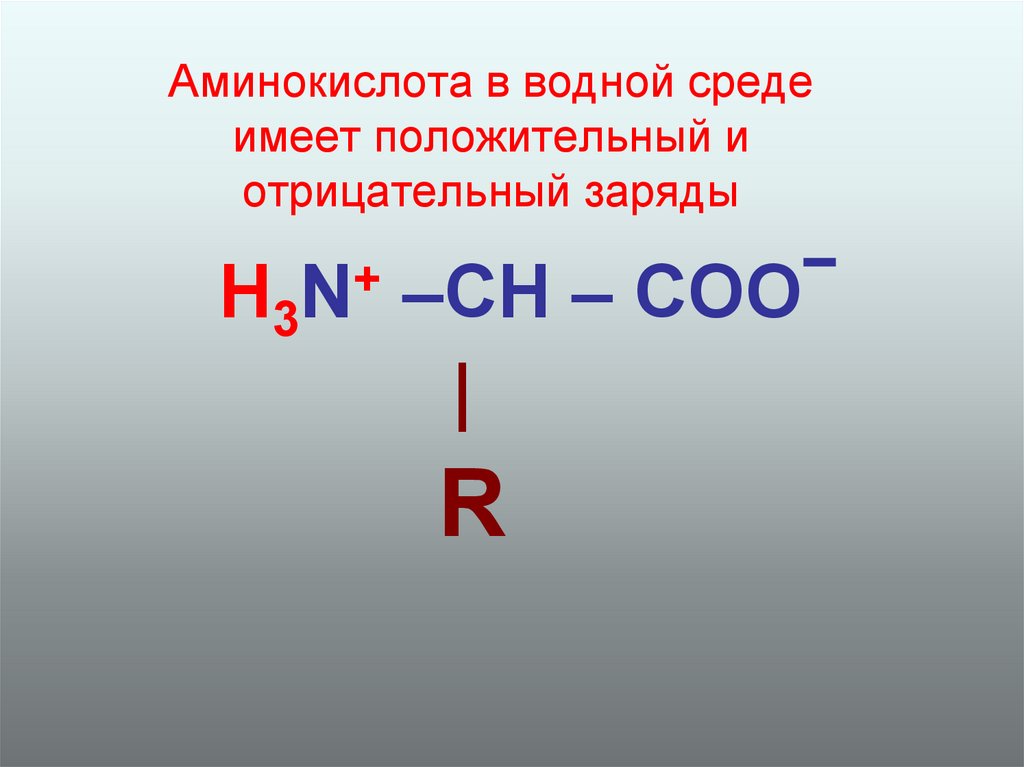
20. Аминокислота в водной среде имеет положительный и отрицательный заряды
H3N+ –CH – COО|
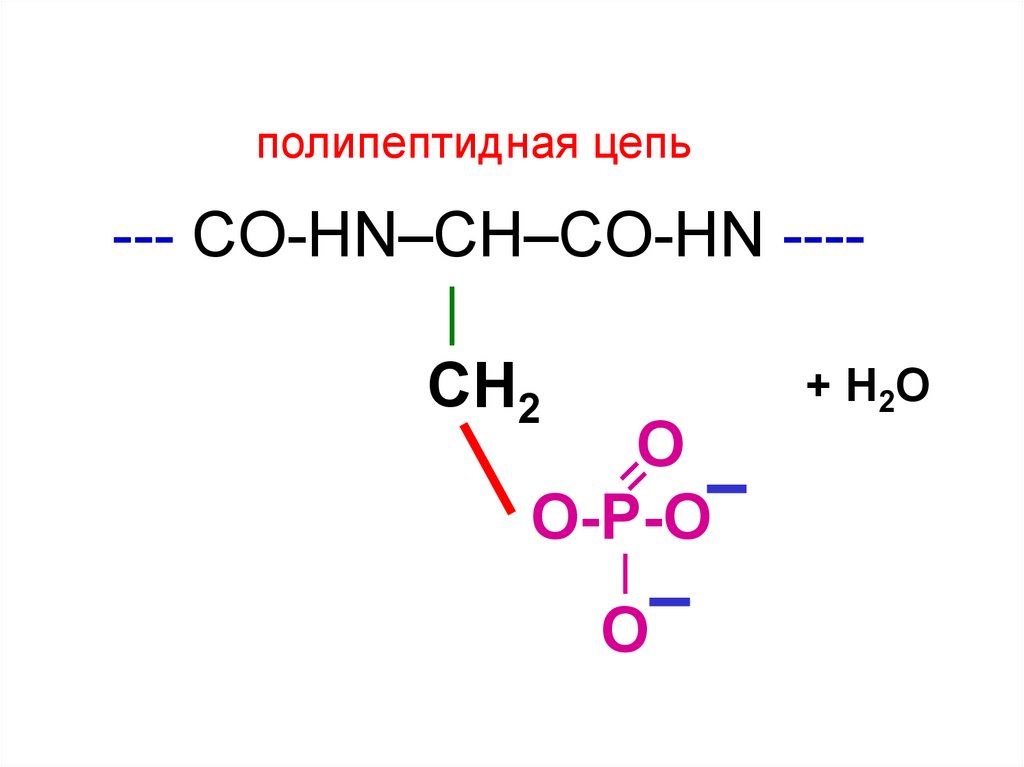
R
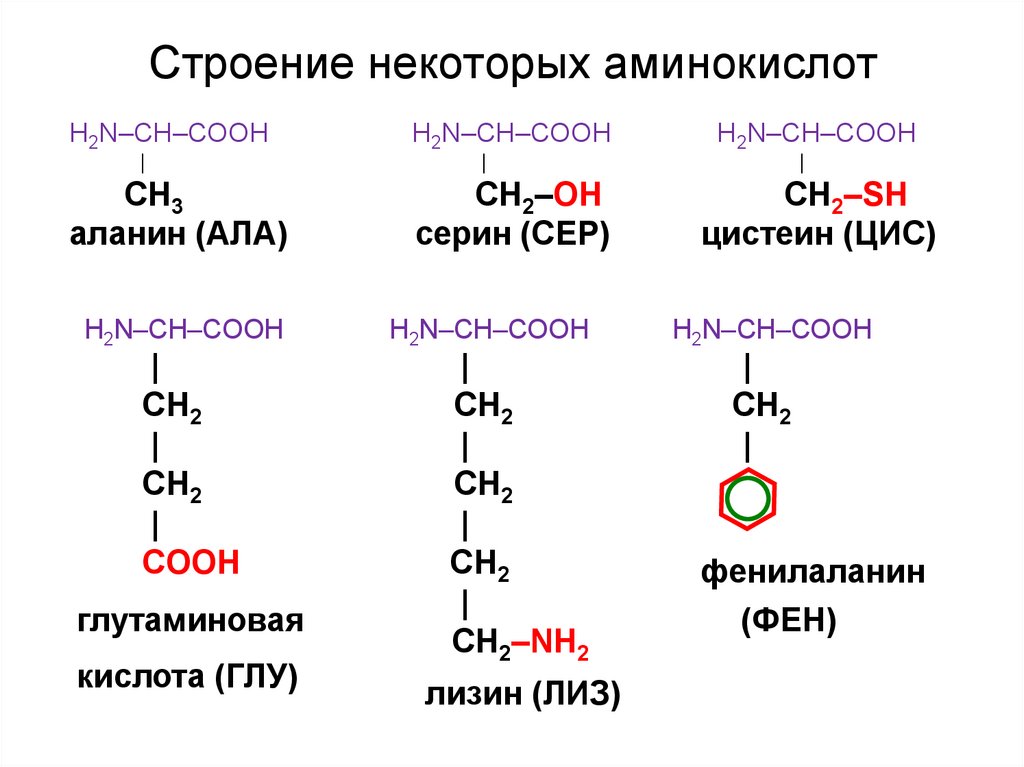
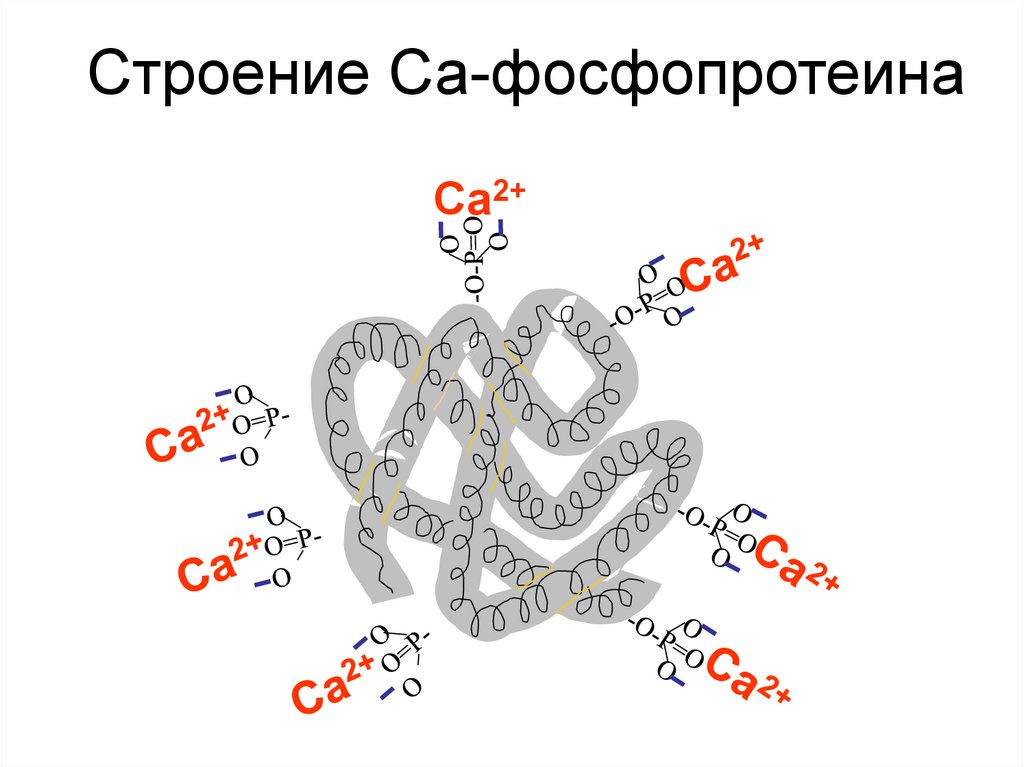
21. Строение некоторых аминокислот
H2N–CH–COOH|
СН3
аланин (АЛА)
H2N–CH–COOH
|
CH2
|
CH2
|
COOH
глутаминовая
кислота (ГЛУ)
H2N–CH–COOH
H2N–CH–COOH
|
СН2–ОН
серин (СЕР)
H2N–CH–COOH
|
CH2
|
CH2
|
CH2
|
CH2–NH2
лизин (ЛИЗ)
|
СН2–SН
цистеин (ЦИС)
H2N–CH–COOH
|
CH2
|
фенилаланин
(ФЕН)
22.
Классификация аминокислот1. Моноаминомонокарбоновые
2. Моноаминодикарбоновые
3. Диаминомонокарбоновые
4. Серусодержащие
5. Имеющие спиртовую группу
6. Циклические
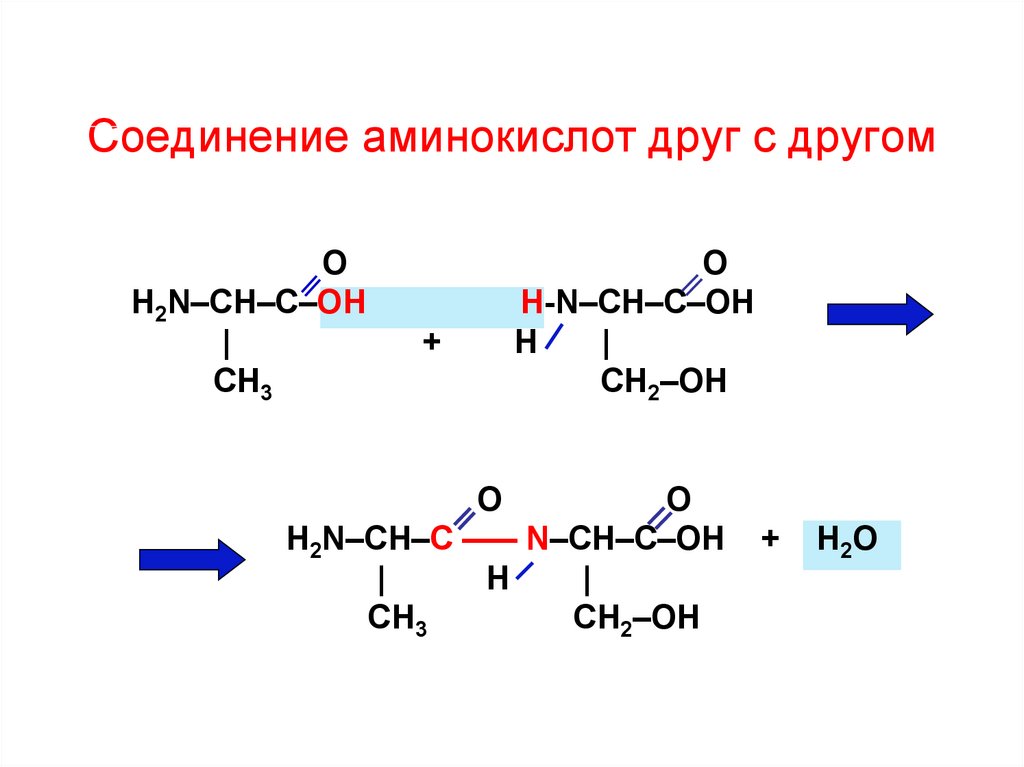
23. Соединение аминокислот друг с другом
ОH2N–CH–C–OH
|
СН3
+
О
H-N–CH–C–OH
H
|
СН2–ОН
О
О
H2N–CH–C ––– N–CH–C–OH
|
H
|
СН3
СН2–ОН
+
H2O
24.
Главное свойство аминокислот образование пептидов и полипептидовH2N–CH–CO
дипептид
HN–CH–COOH
R
R
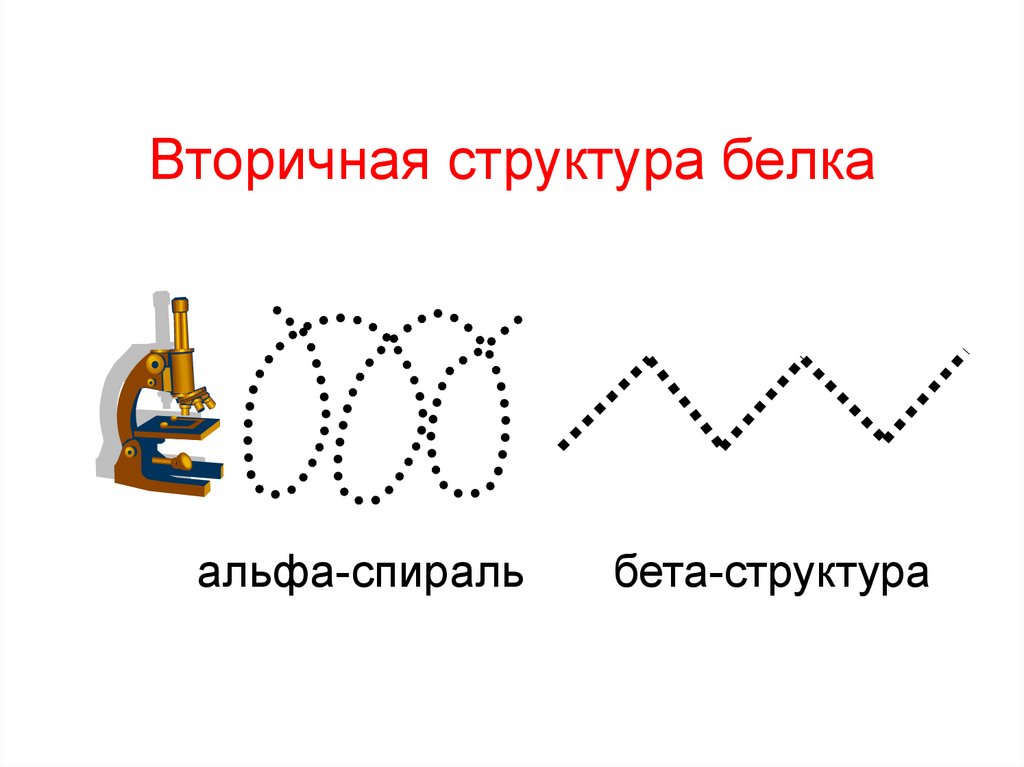
25. Вторичная структура белка
альфа-спиральбета-структура
26. Альфа- бета- структуры белка
RO
H
H
CH
C
N CH
R
N
С
O
C N
H
O
R
0,54 нм
CH
фрагмент коллагена
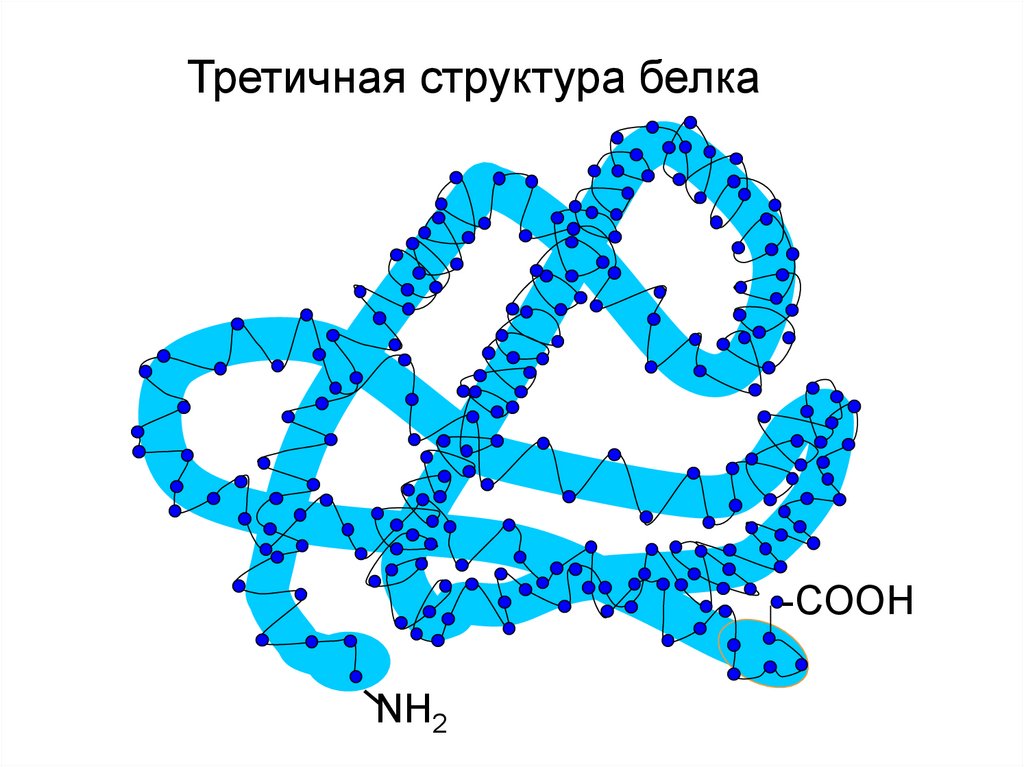
27.
Третичная структура белка-COOH
NH2
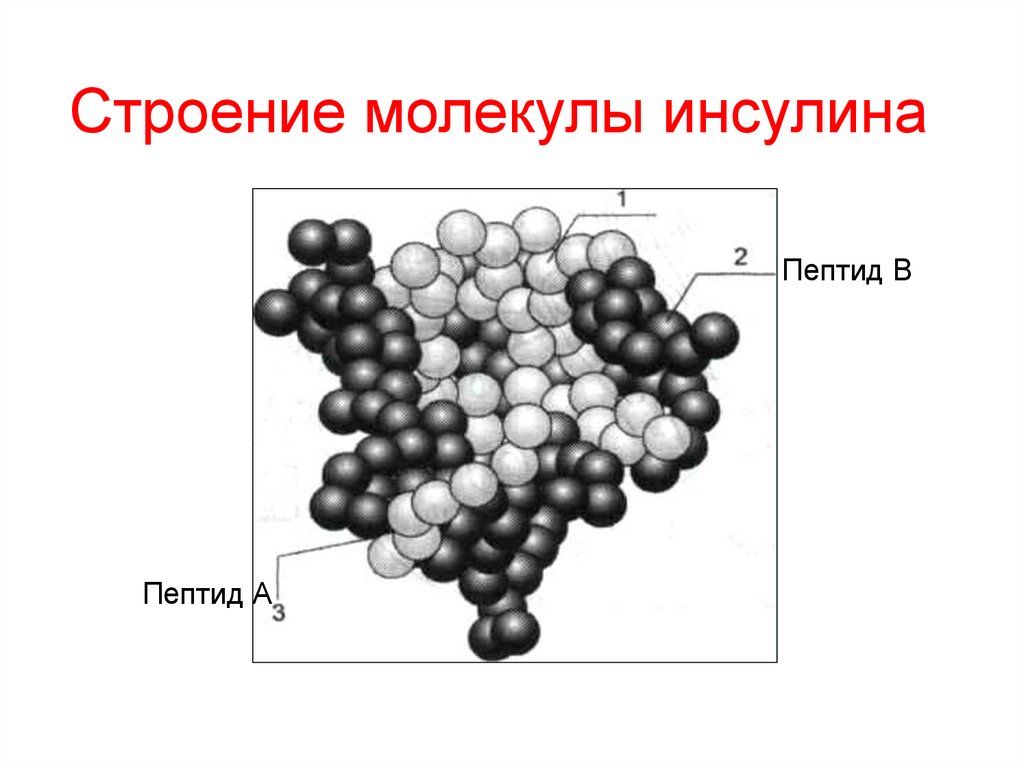
28.
Строение молекулы инсулинаПептид В
Пептид А
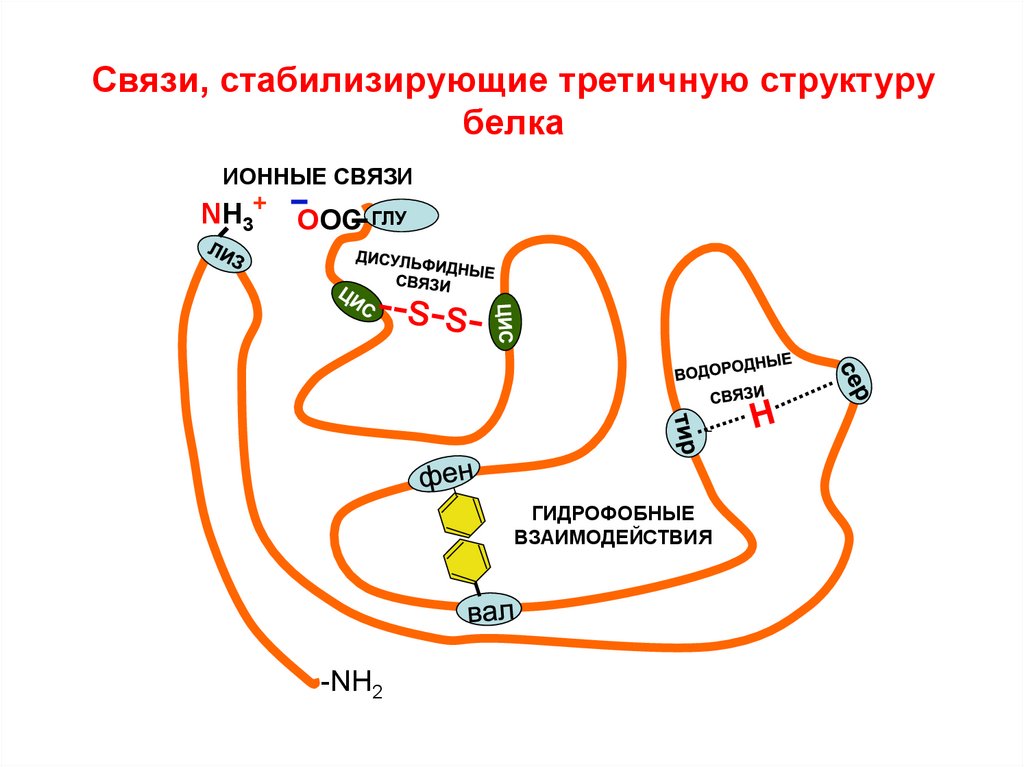
29. Связи, стабилизирующие третичную структуру белка
ИОННЫЕ СВЯЗИNH3+
ООС
ГЛУ
ГИДРОФОБНЫЕ
ВЗАИМОДЕЙСТВИЯ
-NH2
30.
Нагревание белка до 100о СNH3+
ООС
-NH2
ГЛУ
31.
Денатурация белка32. Четвертичная структура белка
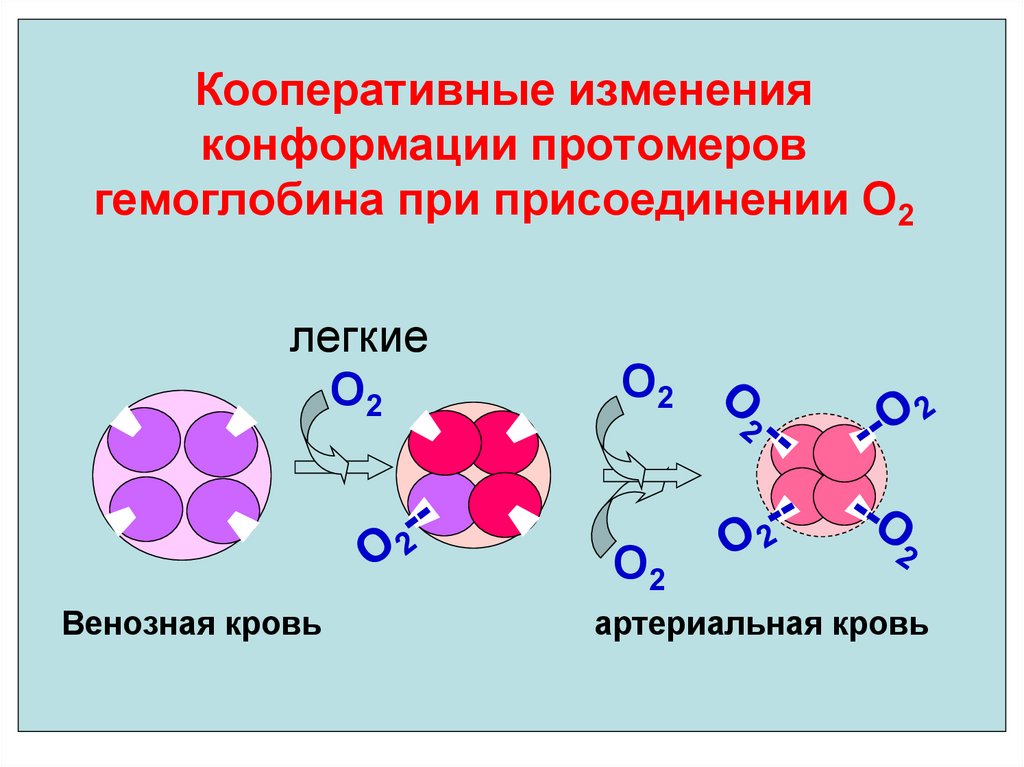
33. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2
легкиеО2
О2
О2
Венозная кровь
артериальная кровь
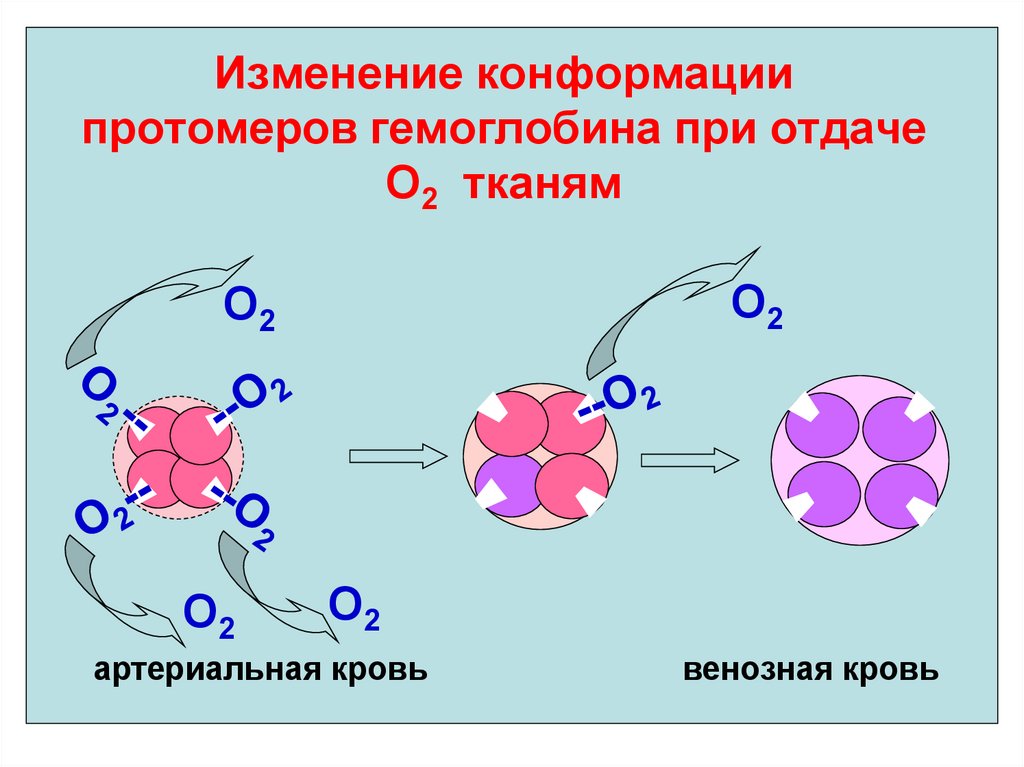
34. Изменение конформации протомеров гемоглобина при отдаче О2 тканям
О2О2
О2
О2
артериальная кровь
венозная кровь
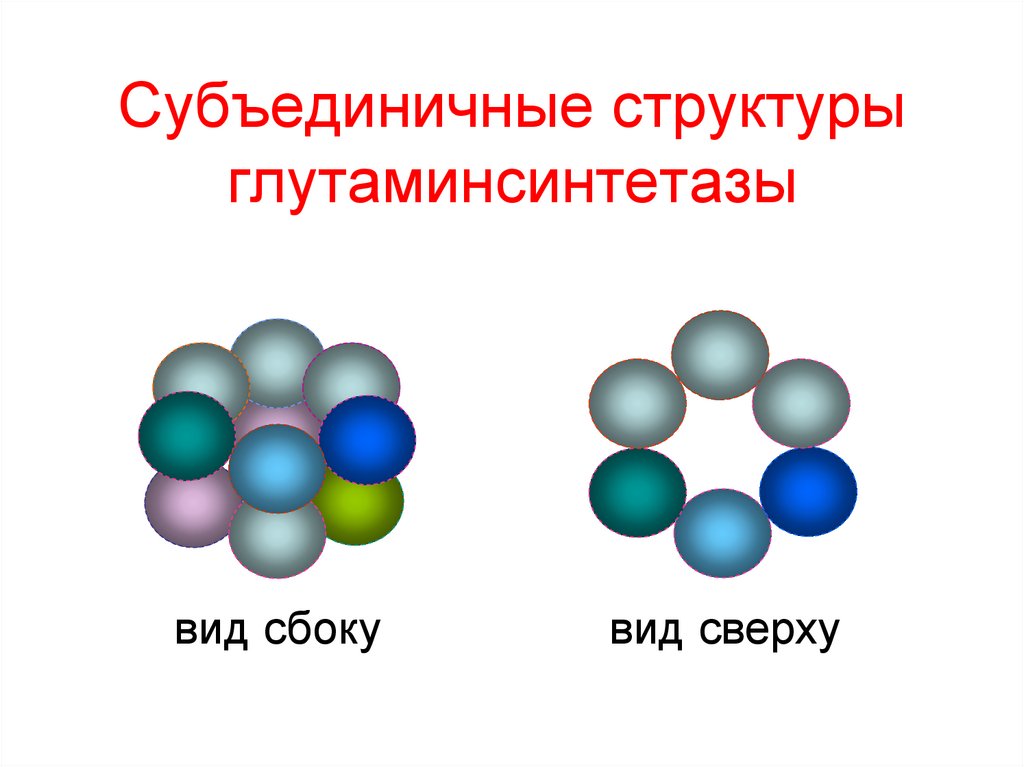
35. Субъединичные структуры глутаминсинтетазы
вид сбокувид сверху
36. Свойства белков
• Имеют заряды (положительные иотрицательные)
• Имеют разную растворимость в воде
• Способны выпадать в осадок
• Имеют гидратную оболочку
• Способны менять форму молекулы
• Способны взаимодействовать между
собой (принцип узнавания)
37.
Белки сыворотки крови38.
Белки имеют зарядОтрицательные заряды
создают глутаминовая и
аспарагиновая кислоты.
Положительные заряды
создают лизин, аргинин и
гистидин.
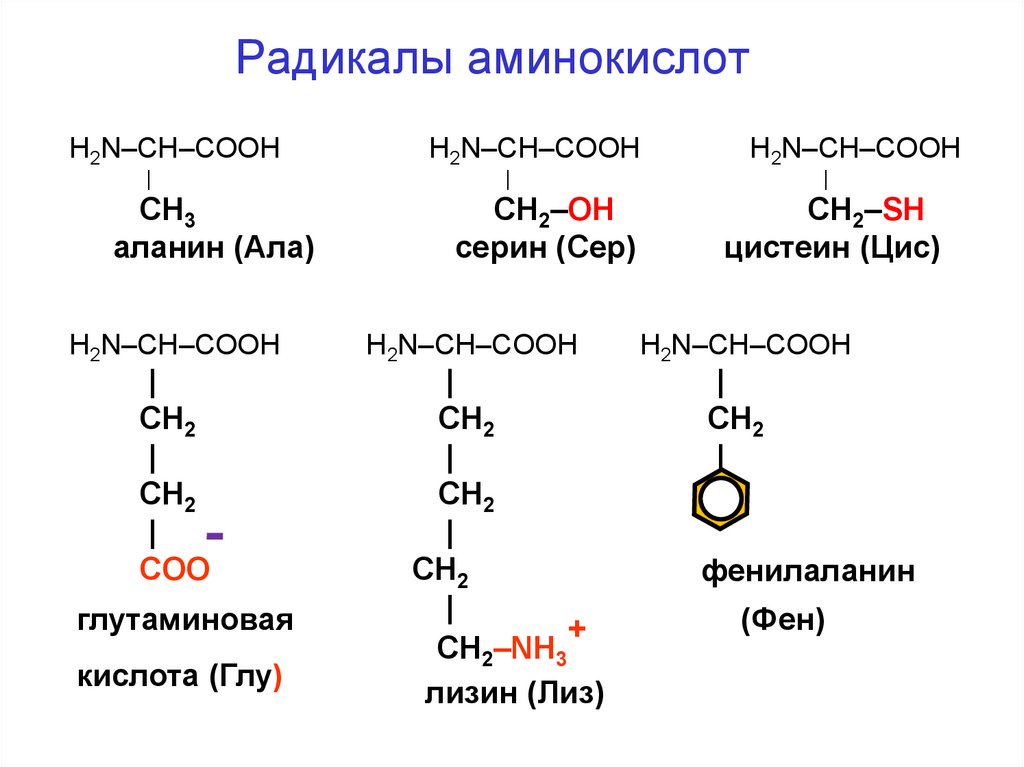
39. Радикалы аминокислот
H2N–CH–COOH|
СН3
аланин (Ала)
H2N–CH–COOH
|
CH2
|
CH2
|
COO
глутаминовая
кислота (Глу)
H2N–CH–COOH
H2N–CH–COOH
|
СН2–ОН
серин (Сер)
H2N–CH–COOH
|
CH2
|
CH2
|
CH2
|
+
CH2–NH3
лизин (Лиз)
|
СН2–SН
цистеин (Цис)
H2N–CH–COOH
|
CH2
|
фенилаланин
(Фен)
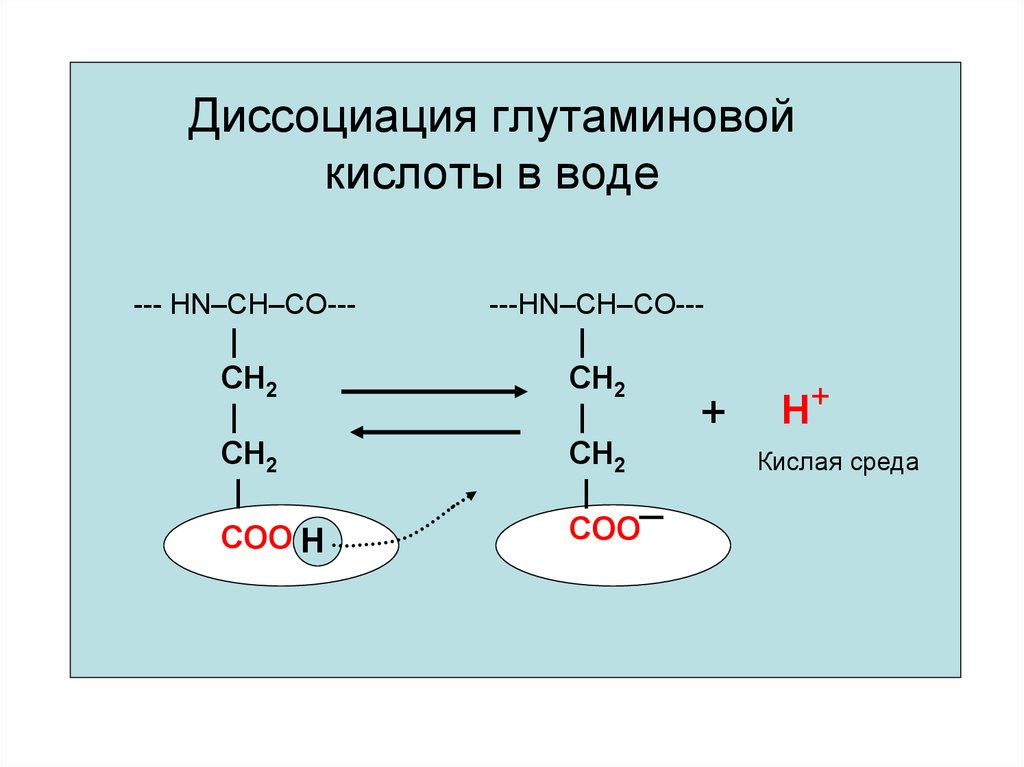
40. Диссоциация глутаминовой кислоты в воде
--- HN–CH–CO---|
CH2
|
CH2
|
COO Н
---HN–CH–CO---
|
CH2
|
CH2
|
COO
+
Н+
Кислая среда
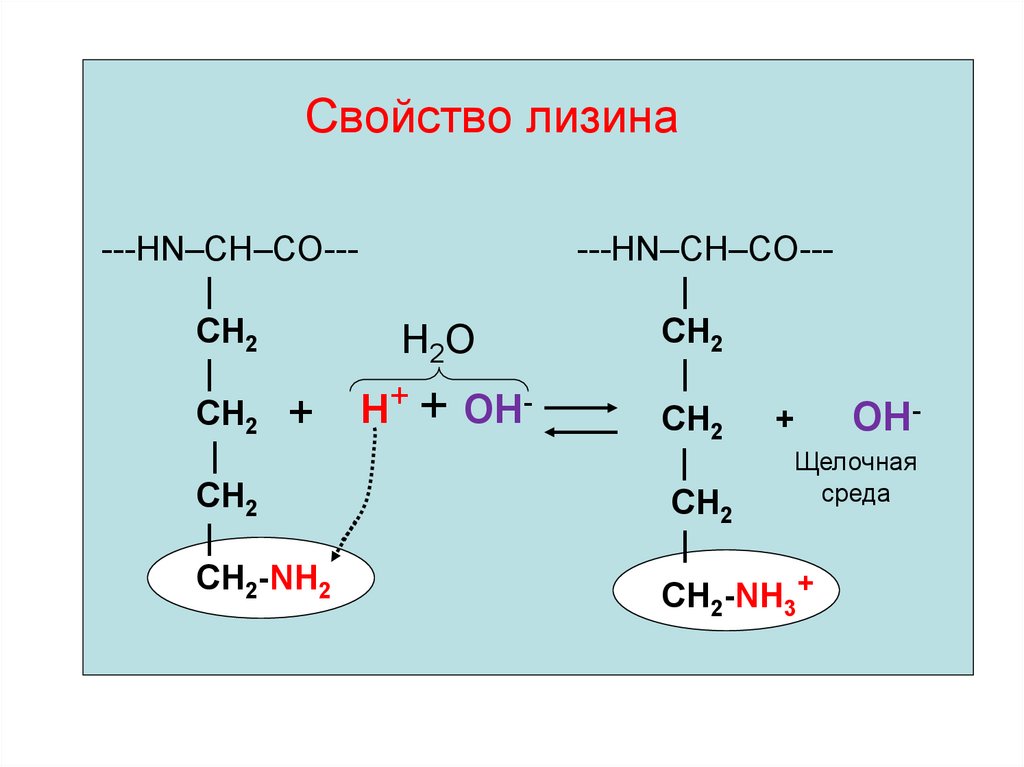
41. Свойство лизина
---HN–CH–CO--|CH2
Н2О
|
+
CH2 + Н + ОН|
СН2
|
СН2-NН2
---HN–CH–CO--|
CH2
|
CH2
+
ОНЩелочная
|
среда
СН2
|
СН2-NН3+
42.
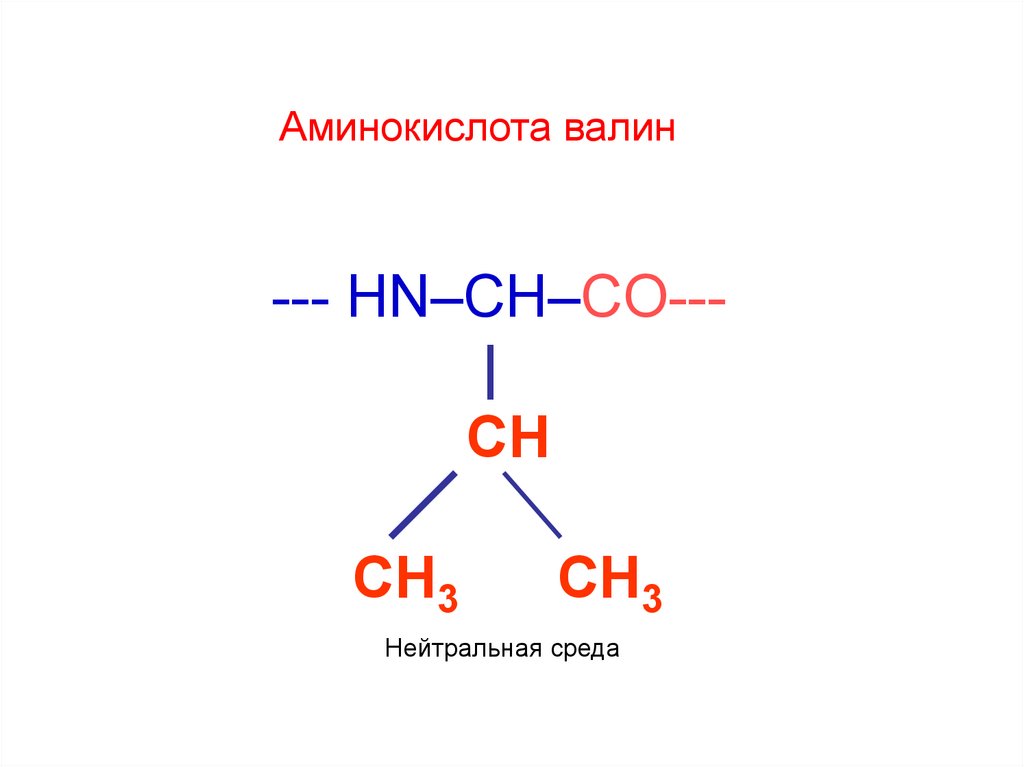
Аминокислота валин--- HN–CH–CO--|
CH
CH3
CH3
Нейтральная среда
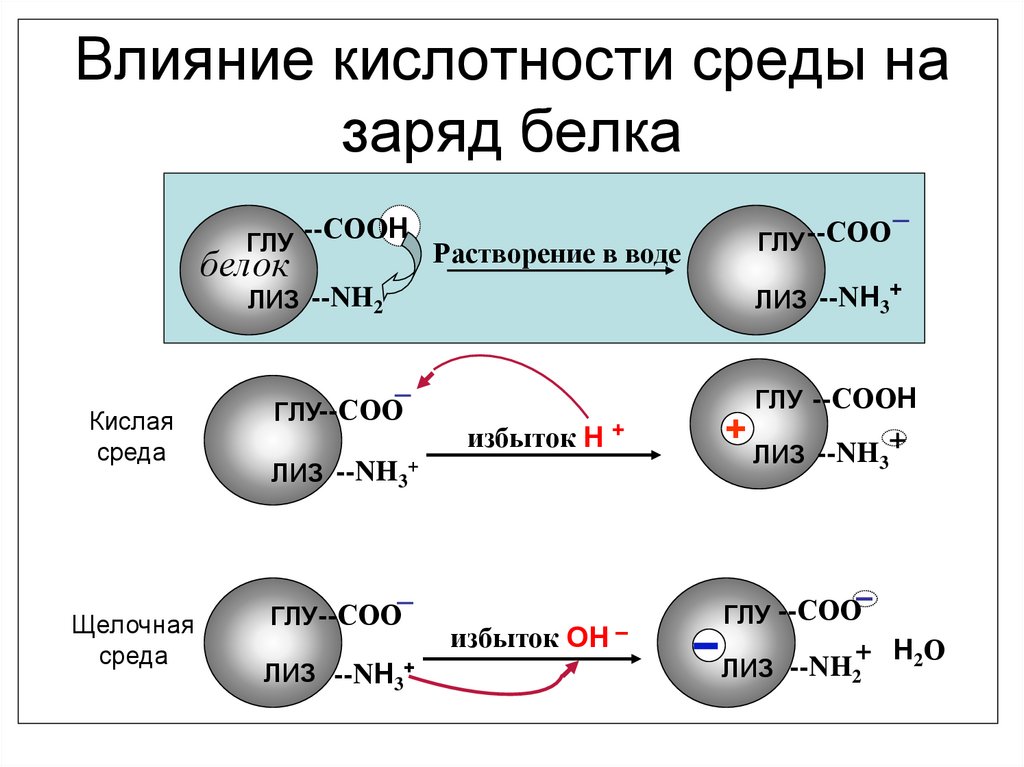
43. Влияние кислотности среды на заряд белка
ГЛУбелок
--СООН
ГЛУ --СОО
Растворение в воде
ЛИЗ --NH3+
ЛИЗ --NH2
Кислая
среда
Щелочная
среда
ГЛУ --СООН
ГЛУ--СОО
избыток Н +
ЛИЗ --NH3+
ГЛУ--СОО
ЛИЗ --NH3
избыток ОН -+
+
ЛИЗ --NH3
+
ГЛУ --СОО
+ Н2О
ЛИЗ --NH2
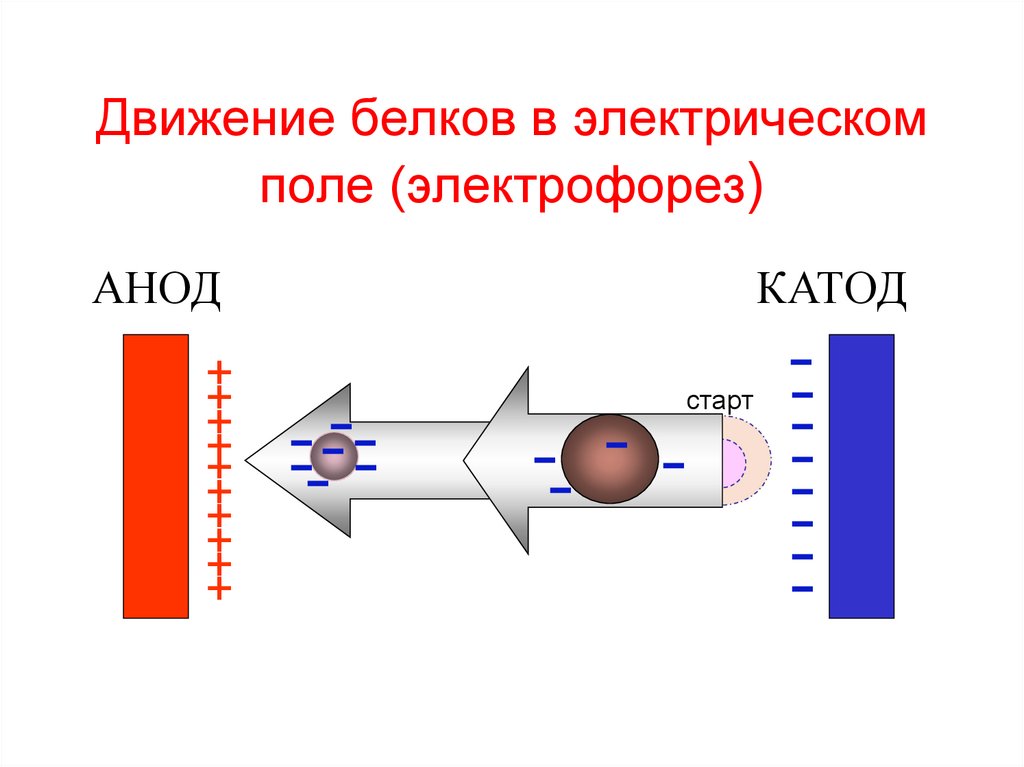
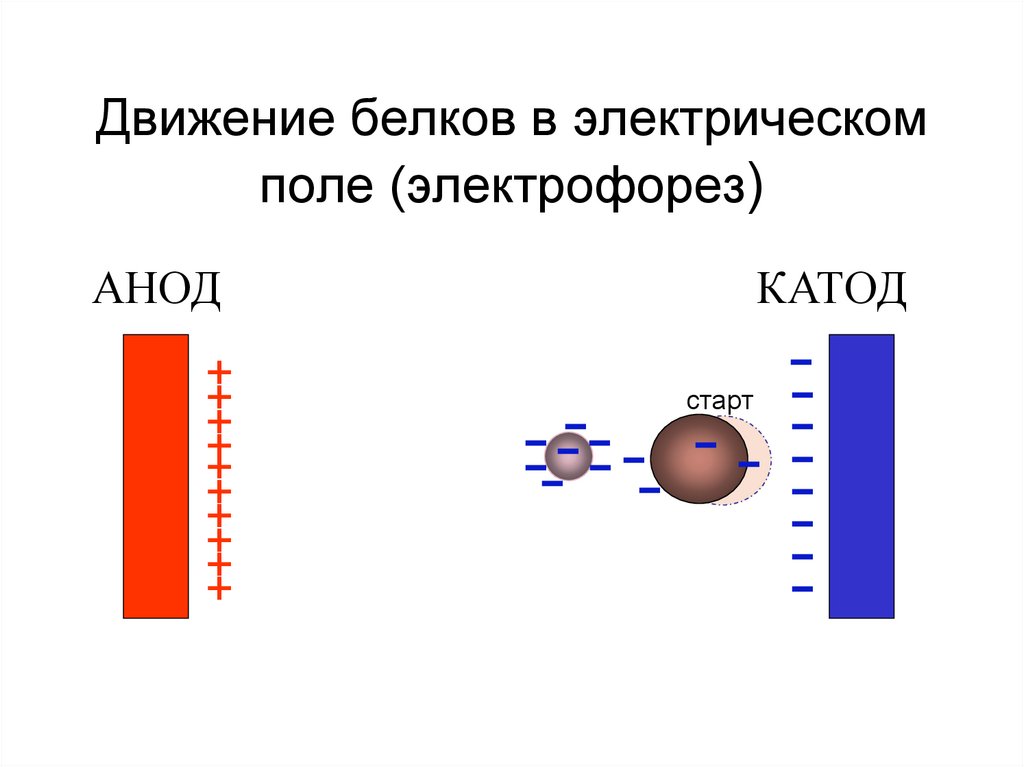
44. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------
старт
-- - -
-----
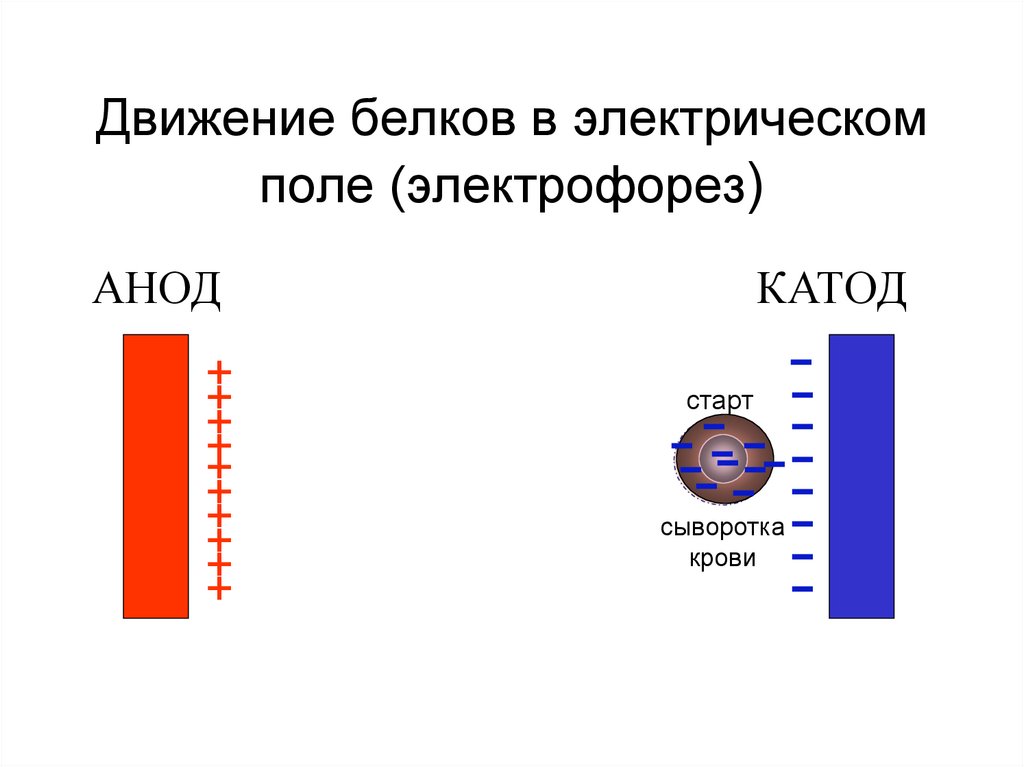
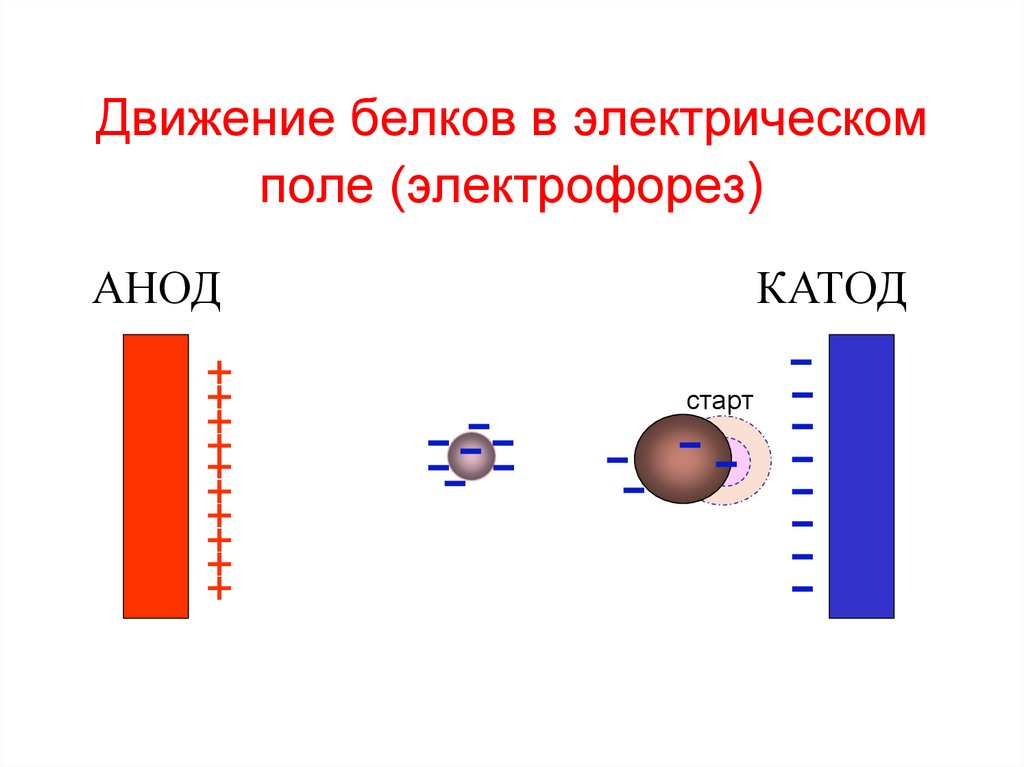
45. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
------------ --старт
сыворотка
крови
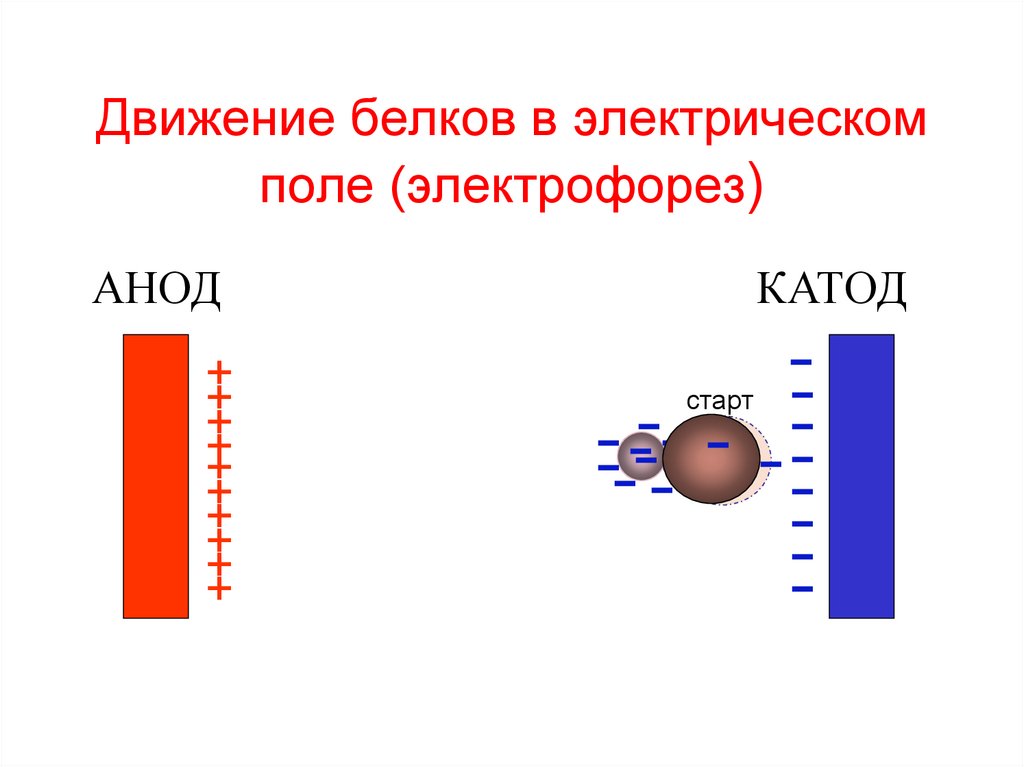
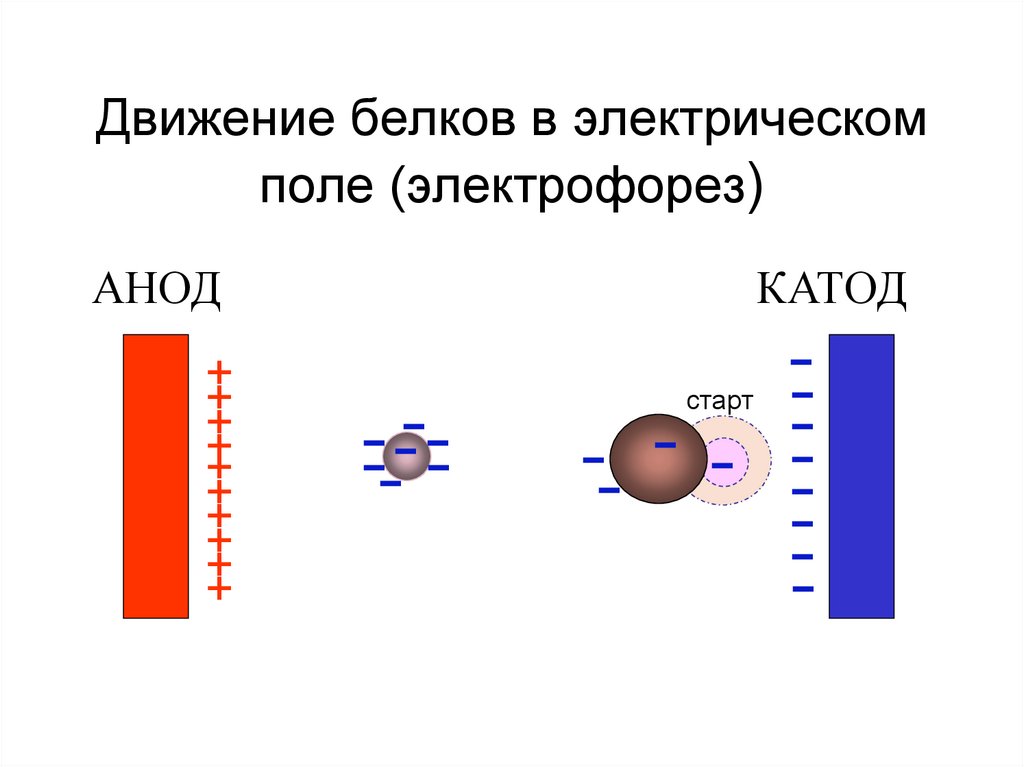
46. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------- - - -- --старт
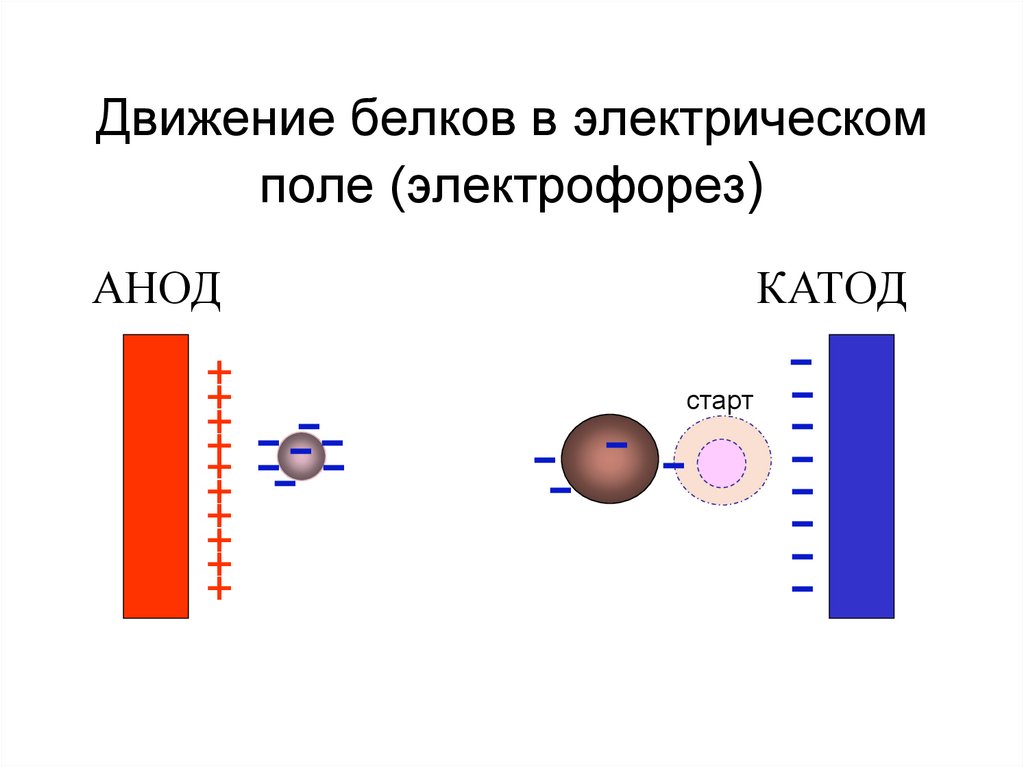
47. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
------- -
-- - ----
старт
48. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------
--- - --старт
49. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------
--- - --старт
50. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------
--- - --старт
51. Движение белков в электрическом поле (электрофорез)
АНОД+
+
+
+
+
+
+
+
+
+
КАТОД
-------
старт
-- - -
-----
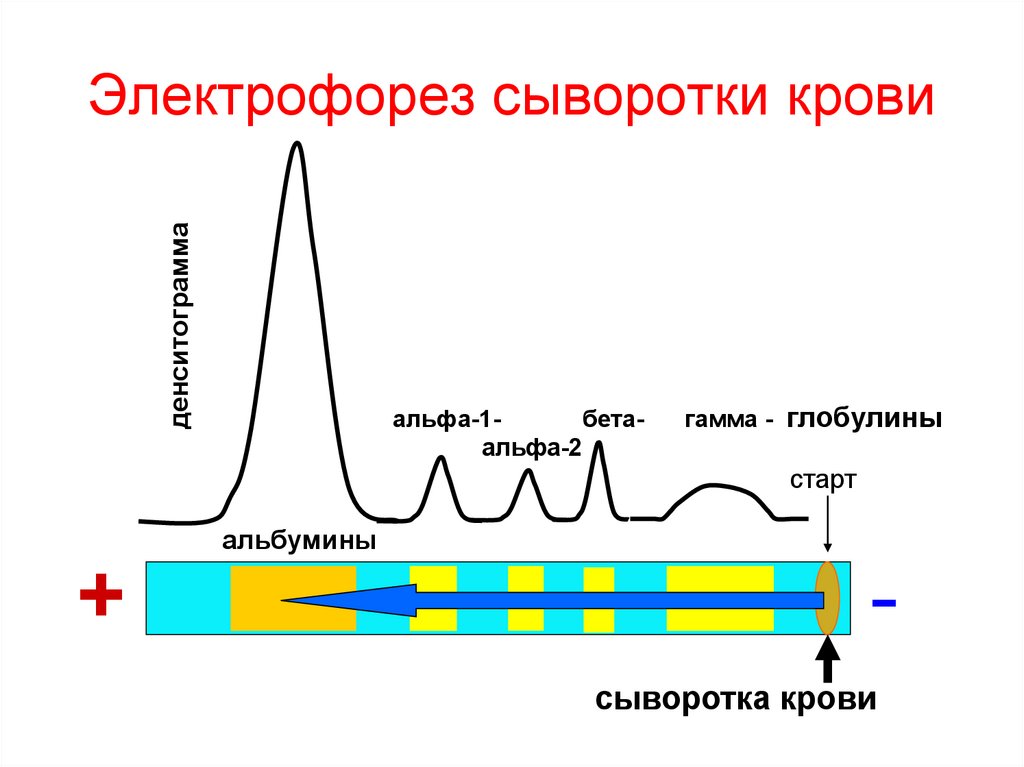
52. Электрофорез сыворотки крови
денситограммаЭлектрофорез сыворотки крови
альфа-1бетаальфа-2
гамма - глобулины
старт
альбумины
+
сыворотка крови
53.
Роль аминокислот,содержащих
гидрофобные радикалы
(аланин, валин, лейцин,
изолейцин,
фенилаланин, тирозин)
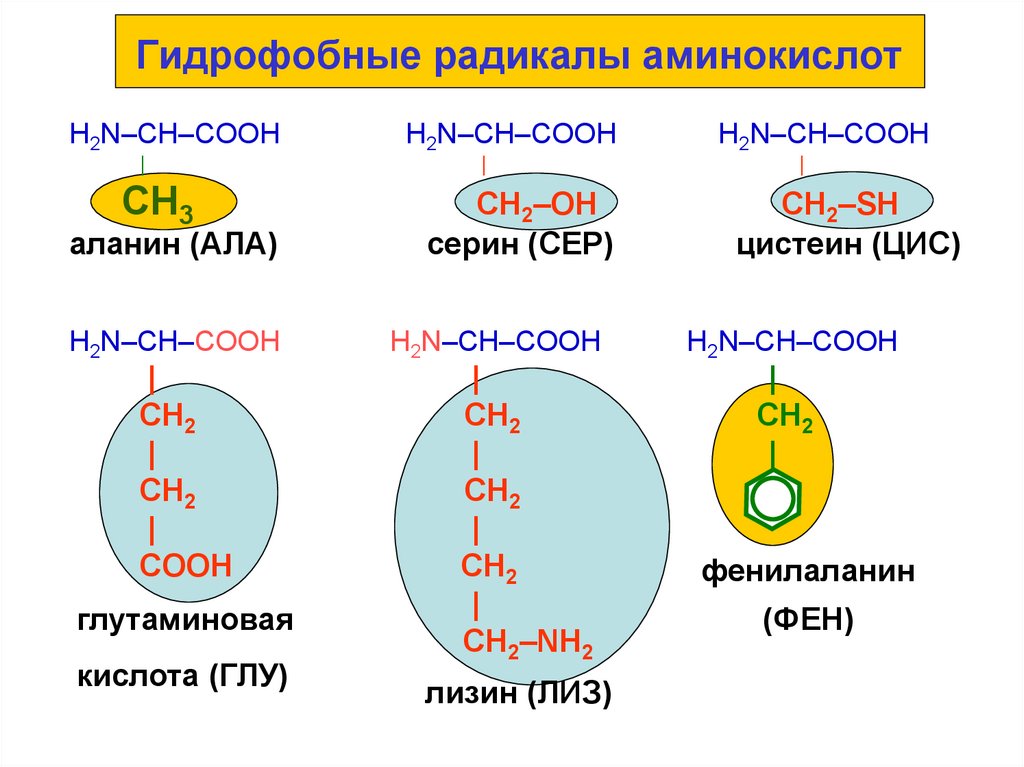
54. Гидрофобные радикалы аминокислот
H2N–CH–COOH|
СН3
аланин (АЛА)
H2N–CH–COOH
|
CH2
|
CH2
|
COOH
глутаминовая
кислота (ГЛУ)
H2N–CH–COOH
|
СН2–ОН
серин (СЕР)
H2N–CH–COOH
|
CH2
|
CH2
|
CH2
|
CH2–NH2
лизин (ЛИЗ)
H2N–CH–COOH
|
СН2–SН
цистеин (ЦИС)
H2N–CH–COOH
|
CH2
|
фенилаланин
(ФЕН)
55.
Строение гидрофильныхи гидрофобных белков
Гидрофильная поверхность белка
Н2О
Н2О
Н2О
Н2О
-СН3
-СН3 Н3С-
-
НОН2О
-
-ОН
-OOC-
Н2О
-СОО-
Н2О
-
-
Н2О
-NH2
Н2О
Н2О
Н2О
-NH2
Н2О
Н2О
Н2О
Н2О
Н2О
Н2О
Н2О
Н2О
-
Н3С-
-СН3
-
Н2О
Н2О
-СН3
Н2О
Н2О
Н2О
Н2О
мембрана
Н2О
Гидрофобная поверхность белка
56.
57.
ПротеинопатииСерповидно-клеточная анемия
нормальный эритроцит
анемия
58.
мутацияглутаминова
я кислота
валин
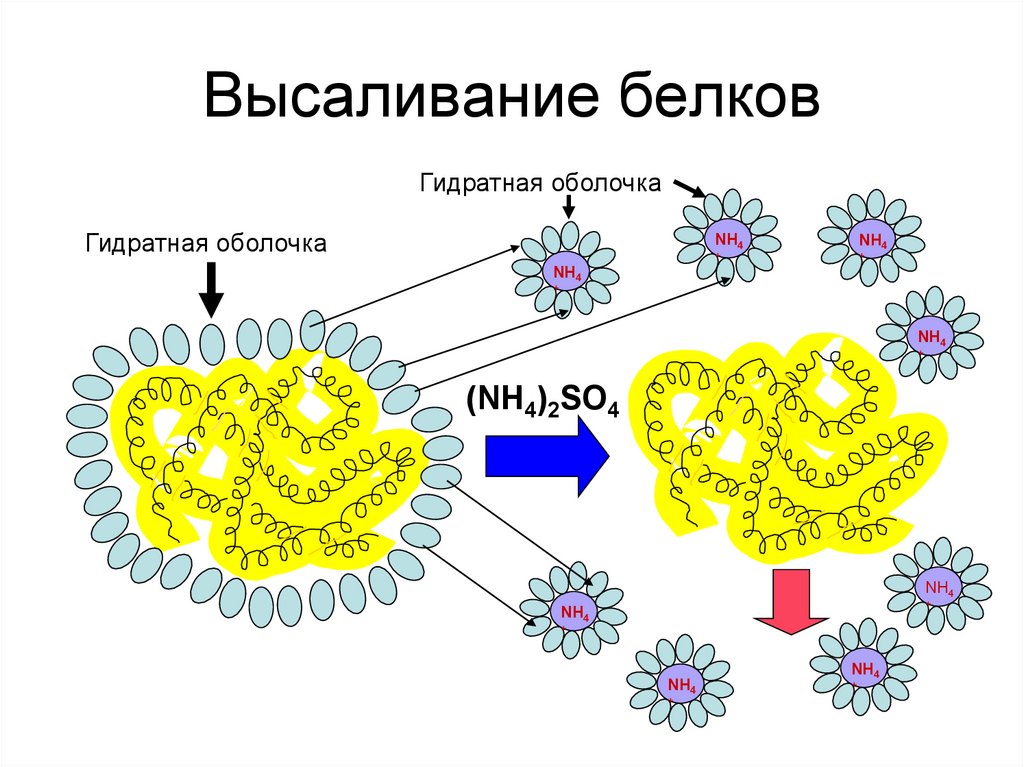
59. Высаливание белков
Гидратная оболочкаГидратная оболочка
NH4
NH4
+
+
NH4
+
NH4
+
(NH4)2SO4
NH4
+
NH4
+
NH4
+
NH4
+
60. Классификация белков
• Простые белки( состоят только из аминокислот)
• Сложные белки
(в состав белка входят различные
вещества –углеводы, липиды,
нуклеотиды, металлы, витамины и др.)
61. Простые и сложные белки
миоглобинальбумин
ГЕМ
62. Простые белки
Альбумины
Глобулины
Протамины
Гистоны
Глютелины
Проламины
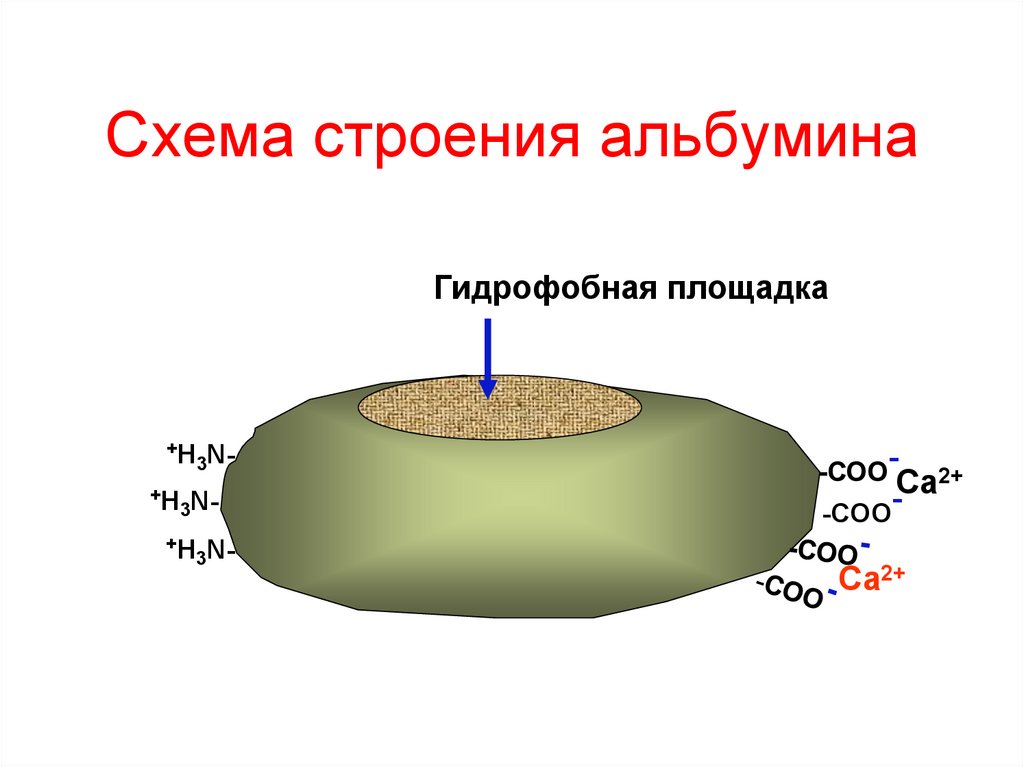
63. Схема строения альбумина
Гидрофобная площадка+Н N3
+Н N3
+Н N3
-СОО
-СОО Са2+
Са2+
64. Роль альбумина
Запасной источник аминокислот
Компонент буферной системы
Осмотически активный белок
Переносчик жирных кислот
Переносчик жирорастворимых витаминов
Переносчик жирорастворимых гормонов
Са-связывающий белок в сыворотке крови
65.
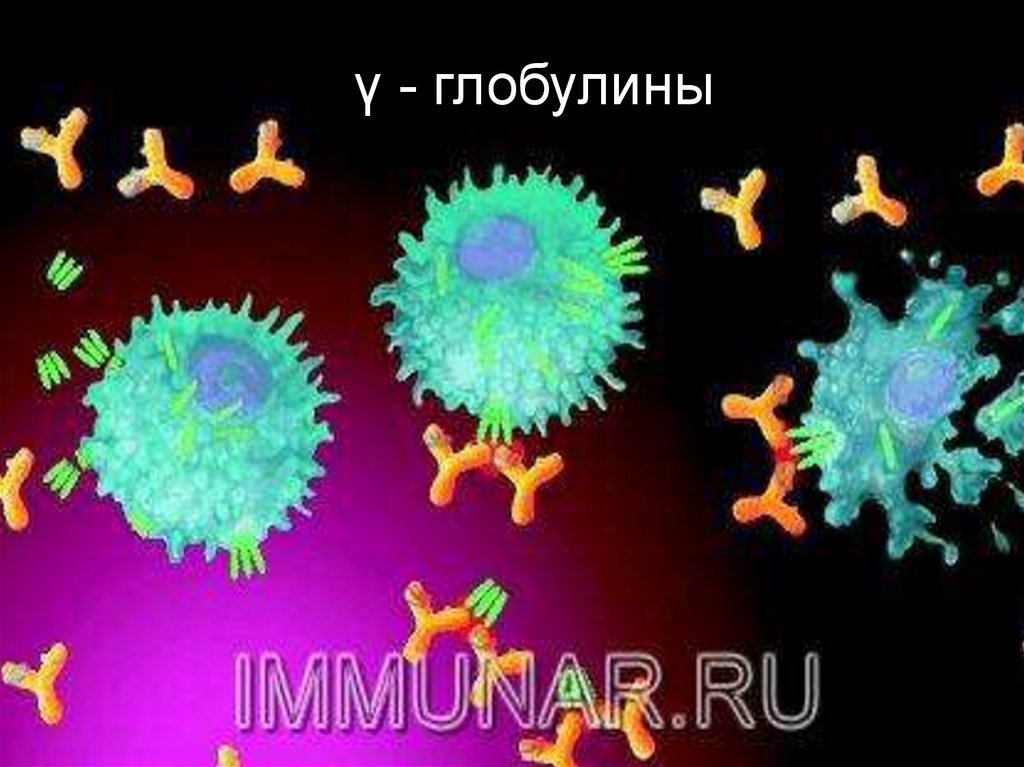
глобулины66.
γ - глобулиновая фракциясыворотки крови
Содержит иммунные
глобулины (IgA; IgЕ;
IgМ; IgD; IgG).
67.
α1-глобулиныα2-глобулины
β - глобулины
γ - глобулины
68. Основной функцией сывороточного IgA является обеспечение местного иммунитета, защита дыхательных, мочеполовых путей и
Основной функцией сывороточного IgA является обеспечениеместного иммунитета, защита дыхательных, мочеполовых
γ - глобулины
путей и желудочно-кишечного тракта от инфекций.
69.
Протаминыи гистоны
70. Роль гистонов в структуре ДНК
Цепь ДНКгистоны
нуклеосома
71.
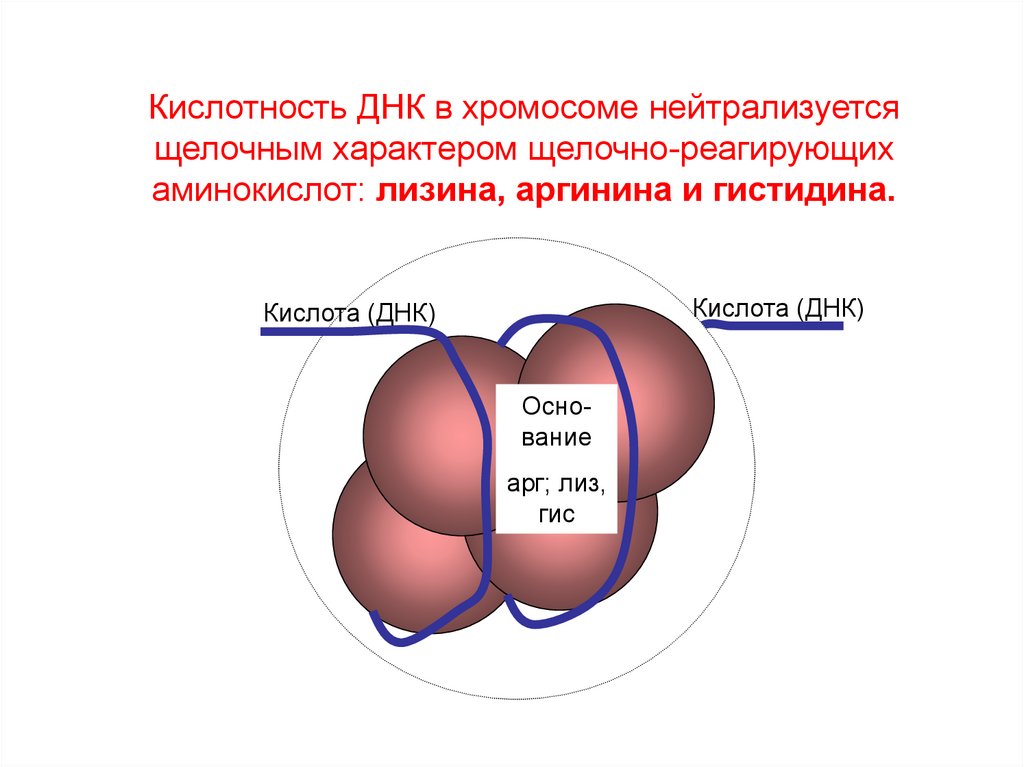
Кислотность ДНК в хромосоме нейтрализуетсящелочным характером щелочно-реагирующих
аминокислот: лизина, аргинина и гистидина.
Кислота (ДНК)
Кислота (ДНК)
Основание
арг; лиз,
гис
72. Роль протаминов и гистонов
• Факторы укорочения полинуклеотиднойцепи
• Нейтрализуют кислотность ДНК
• Являются регуляторами транскрипции
(места нуклеосом являются
заблокированными)
73.
Проламины иглютелины
– белки растительного
происхождения
74.
75. Сложные белки
• Нуклеопротеины• Липопротеины
• Хромопротеины
• Фосфопротеины
• Гликопротеины
• Белки-ферменты
76.
Строениенуклеопротеинов
77.
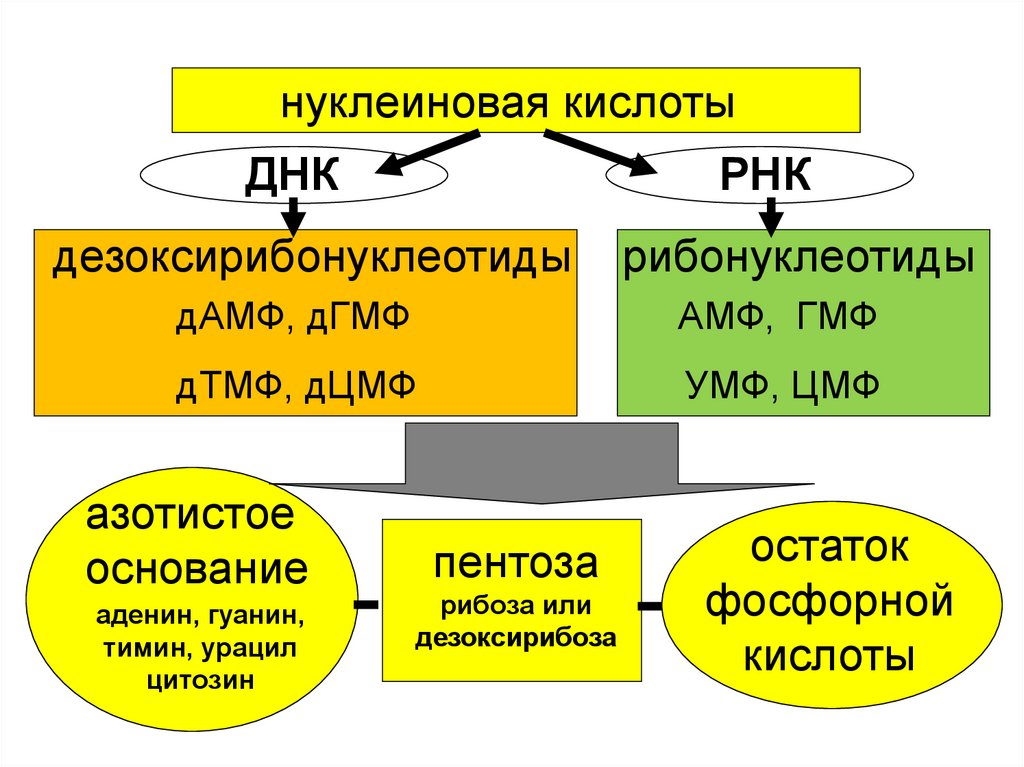
нуклеиновая кислотыДНК
РНК
дезоксирибонуклеотиды
рибонуклеотиды
дАМФ, дГМФ
АМФ, ГМФ
дТМФ, дЦМФ
УМФ, ЦМФ
азотистое
основание
аденин, гуанин,
тимин, урацил
цитозин
пентоза
рибоза или
дезоксирибоза
остаток
фосфорной
кислоты
78.
NН2А
О
Р
нуклеотид
он он
NН2
А
О
он
он он
нуклеозид
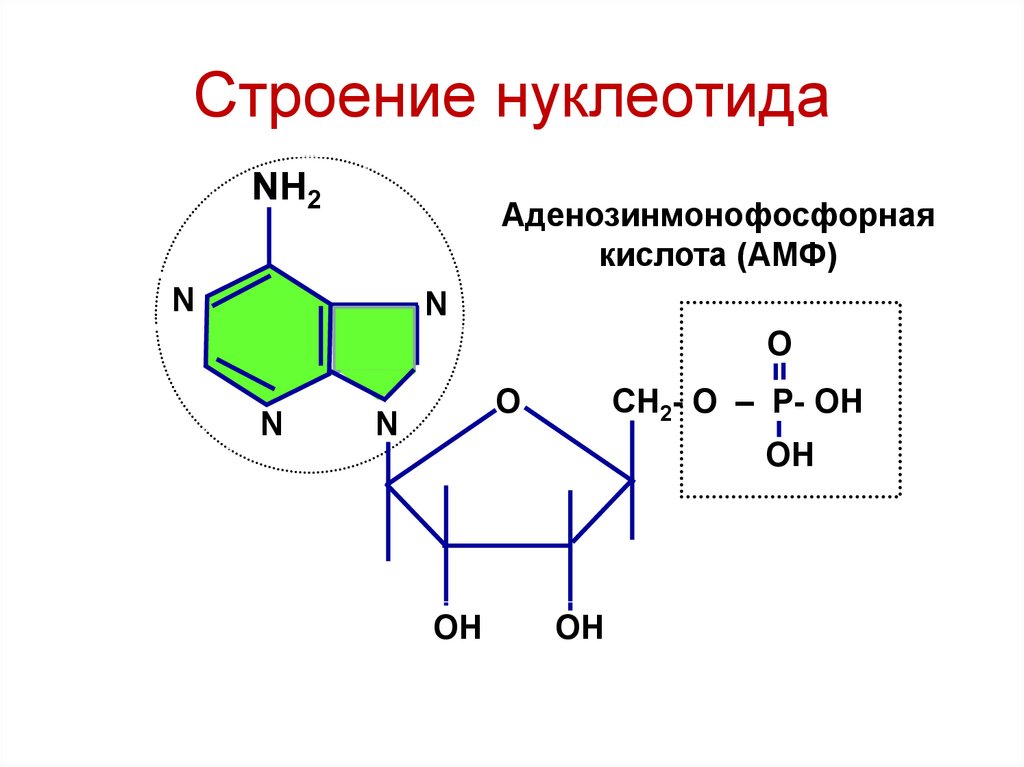
79. Строение нуклеотида
NH2Аденозинмонофосфорная
кислота (АМФ)
N
N
О
N
О
N
СН2- О – Р- ОН
ОН
ОH
ОН
80.
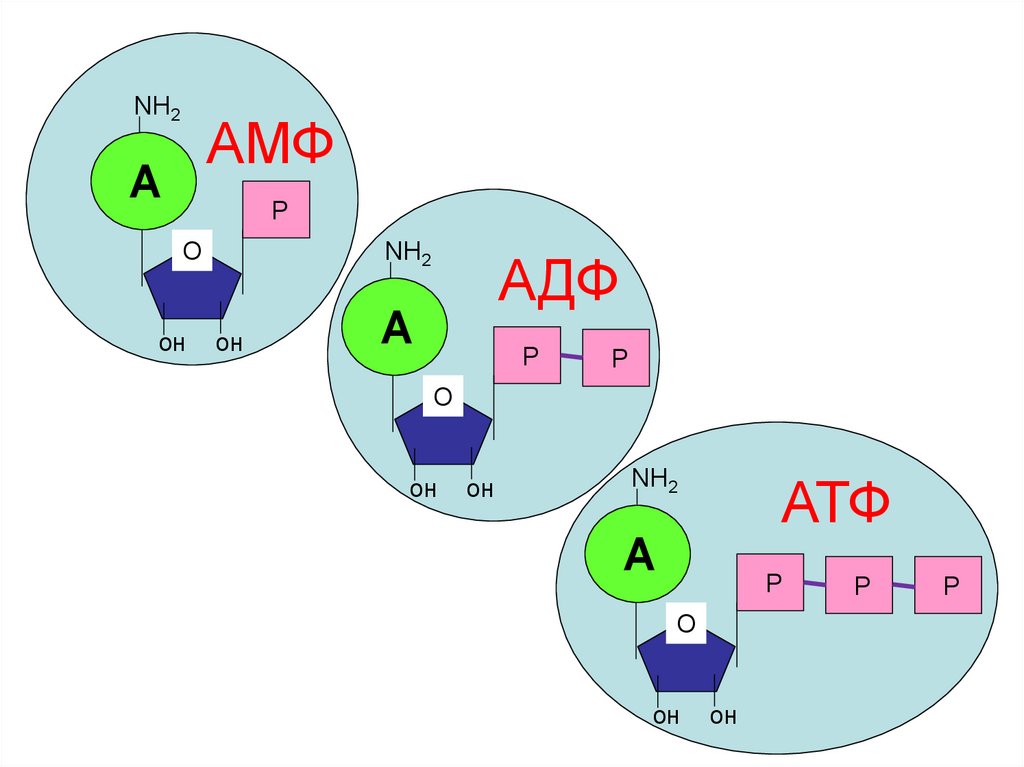
NН2АМФ
А
Р
О
он
NН2
он
АДФ
А
Р
Р
О
он
он
NН2
АТФ
А
Р
О
он
он
Р
Р
81.
Правила названия нуклеотидовазотистое
название
основание
нуклеозида
Аденин
аденозин
аденозин монофосфат
Гуанин
гуанозин
гуанозин моно фосфат
Тимин
тимидин
тимидин моно фосфат
Урацил
уридин
уридин моно фосфат
Цитозин
цитидин
цитидин моно фосфат
Название нуклеотида
82.
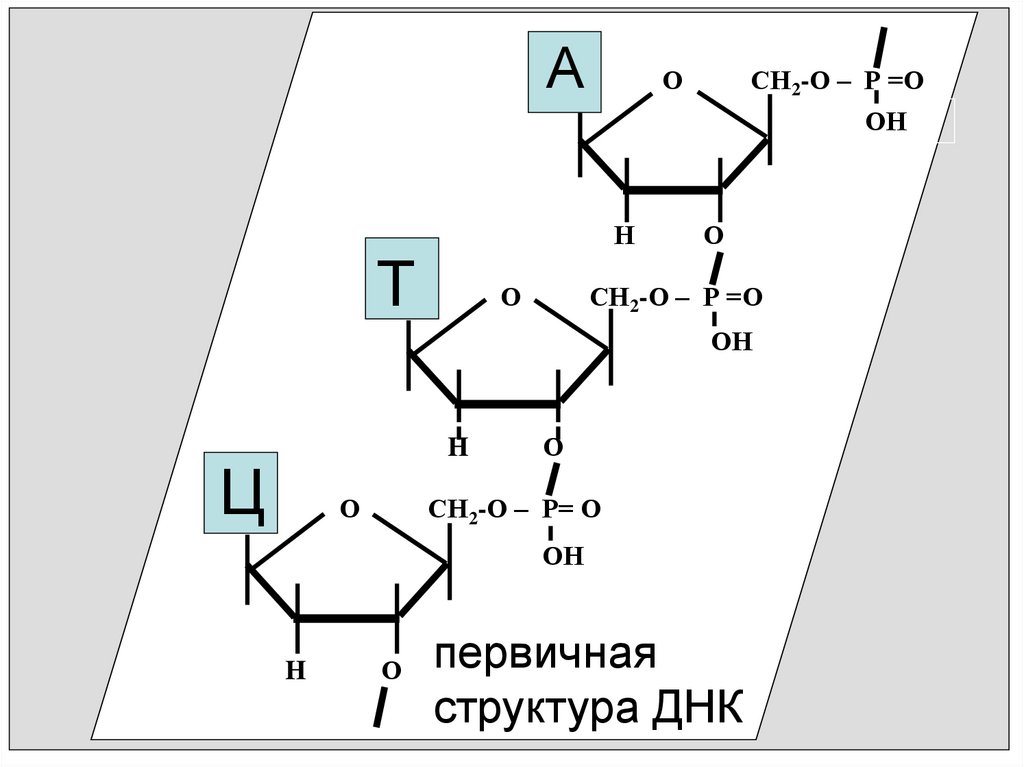
АО
СН2-О – Р =О
ОН
Н
Т
О
О
СН2-О – Р =О
ОН
H
Ц
О
О
СН2-О – Р= О
ОН
H
О
первичная
структура ДНК
83. Двойная спираль ДНК (вторичная структура)
84. Третичная структура ДНК
Цепь ДНКгистоны
нуклеосома
85.
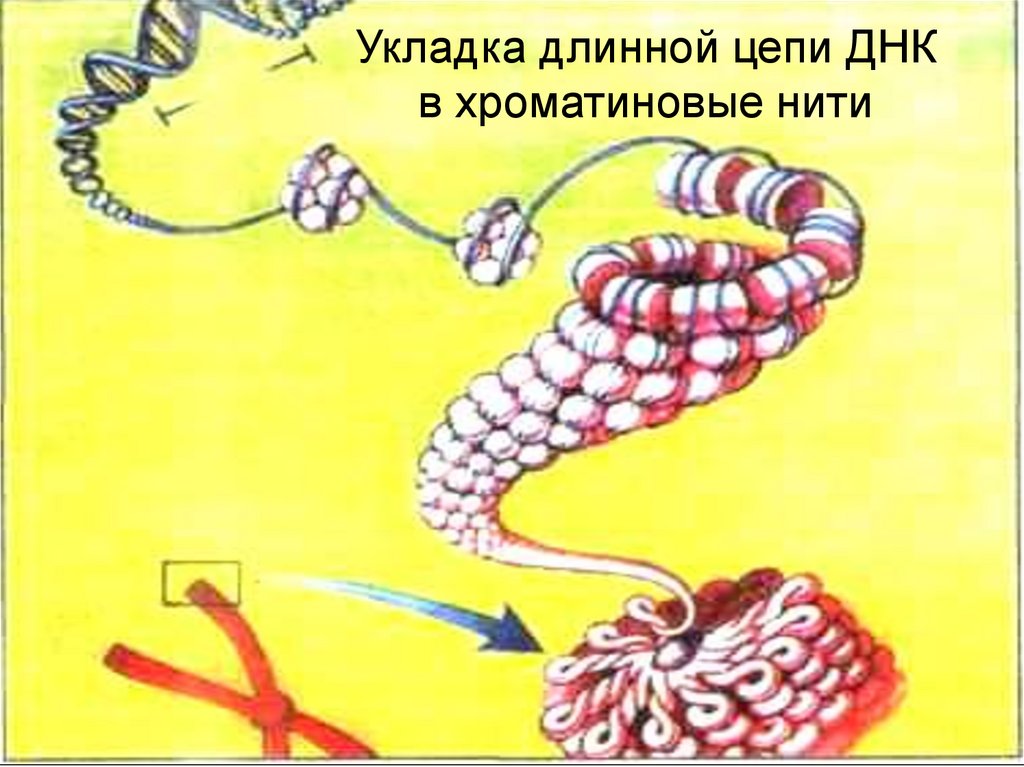
Укладка длинной цепи ДНКв хроматиновые нити
86. Регуляторные участки ДНК
полимераза (необходима для синтеза копии ДНК или и-РНК)репрессор (блокирует синтез ДНК или и-РНК)
содержит информацию о строении белка
промотор оператор
структурный ген
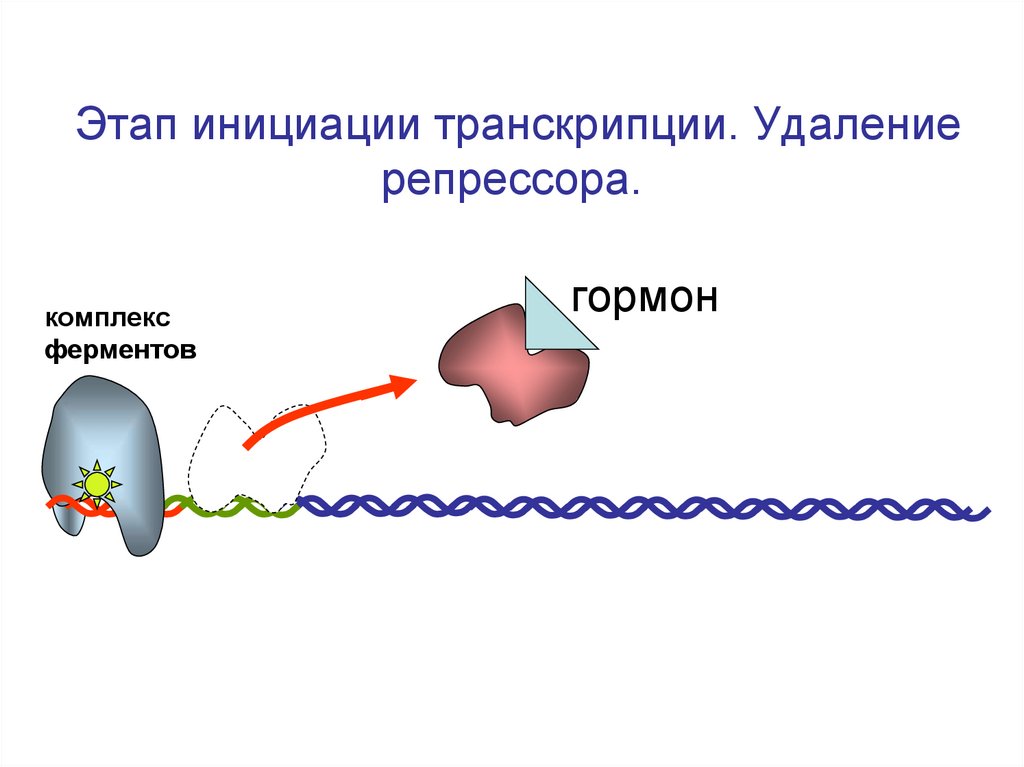
87. Этап инициации транскрипции. Удаление репрессора.
комплексферментов
гормон
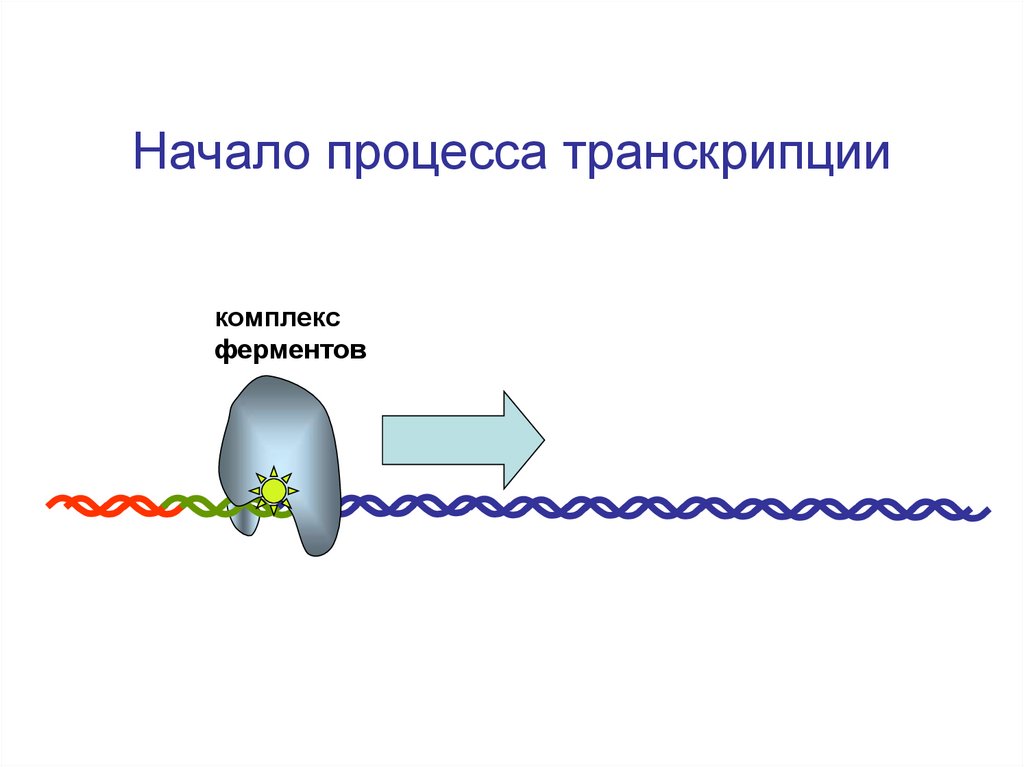
88. Начало процесса транскрипции
комплексферментов
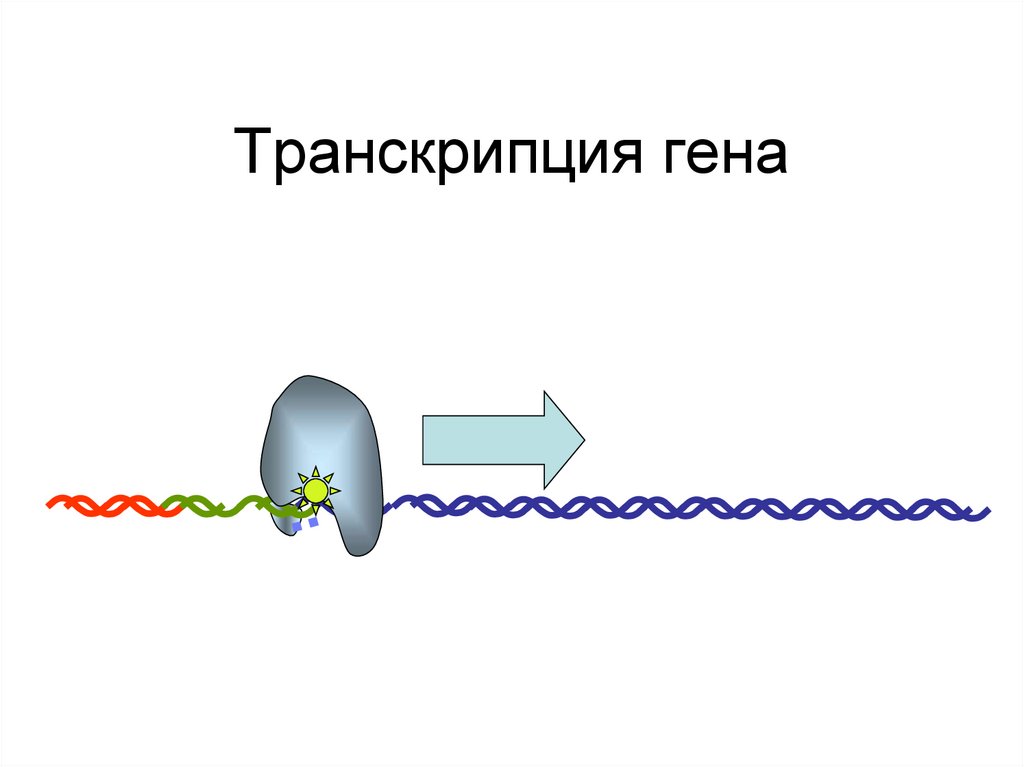
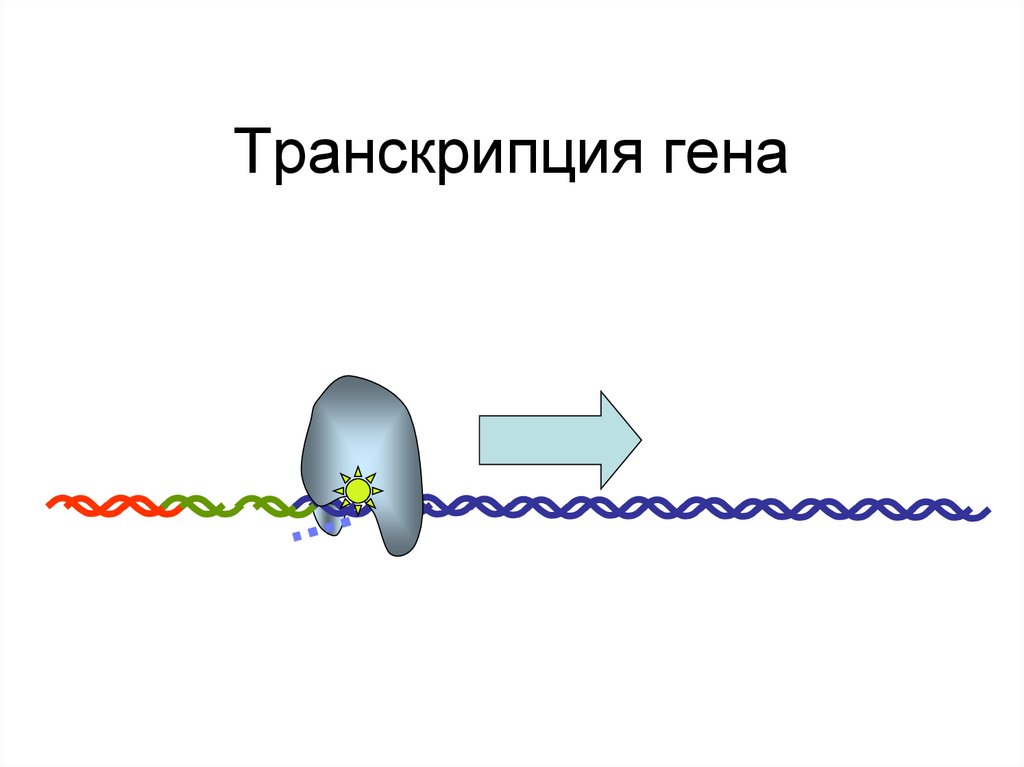
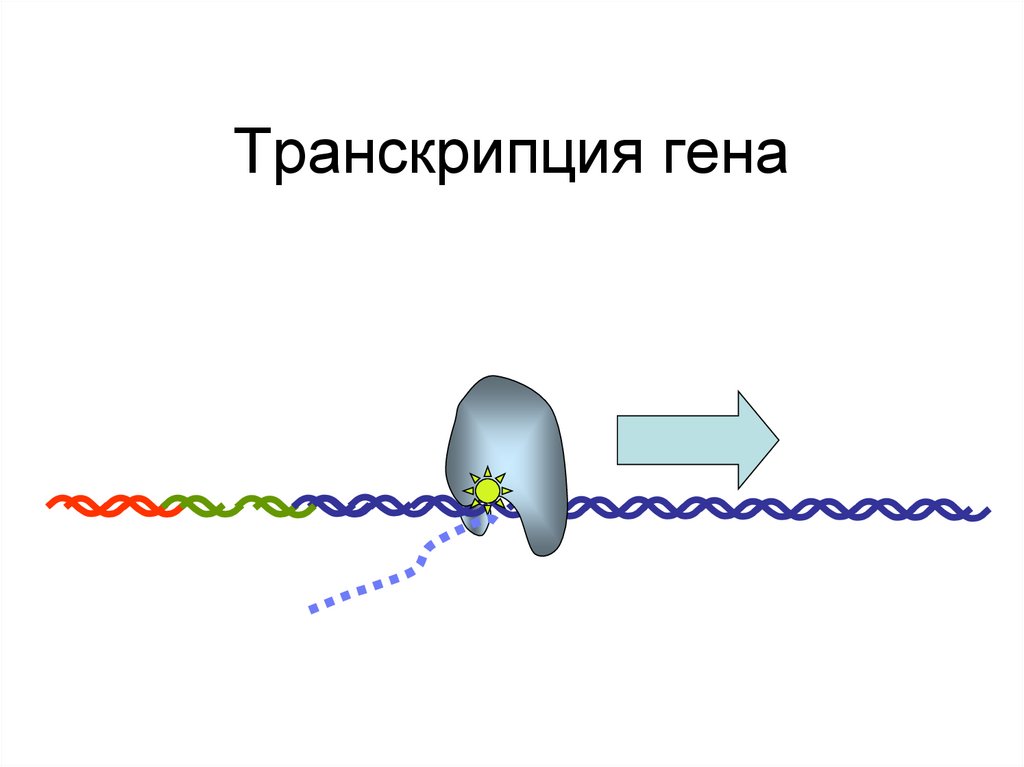
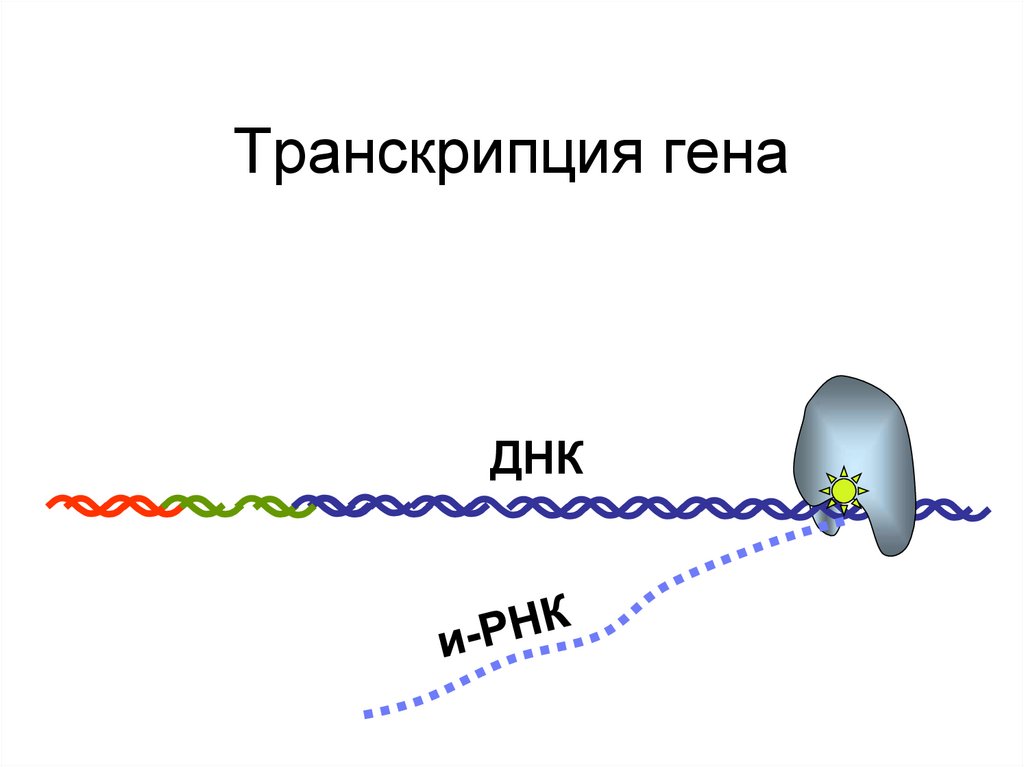
89. Транскрипция гена
90. Транскрипция гена
91. Транскрипция гена
92. Транскрипция гена
93. Транскрипция гена
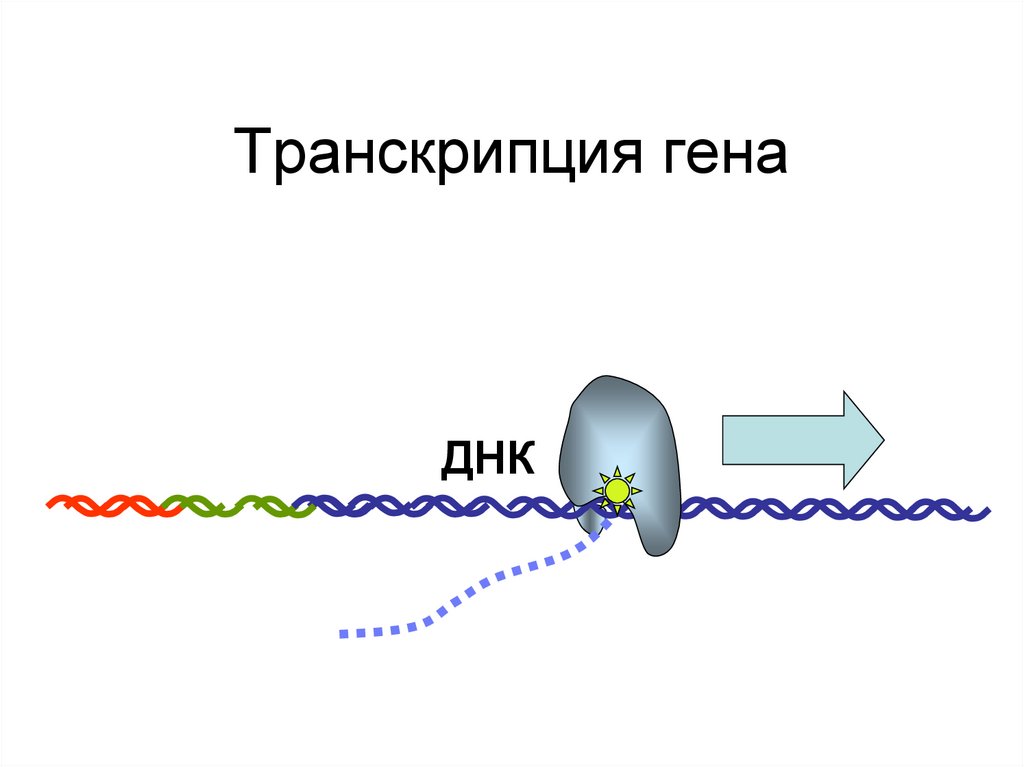
ДНК94. Транскрипция гена
ДНК95. Транскрипция гена
ДНК96.
Присоединение к информативнойчасти и-РНК контактного участка
«сар» и «полиаденилового хвоста».
сар
А-А-А-А- - -А-А-А-А
полиадениловый
«хвост»
97.
Завершение синтеза и-РНКсар
А-А-А-А- - -А-А-А-А
98.
АО
СН2-О – Р=О
ОН
ОН
У
О
О
СН2-О – Р=О
ОН
ОH
Ц
О
О
СН2-О – Р= О
ОН
ОH
О
первичная
структура РНК
99.
Задача -1Сколько нуклеотидов
содержит
информативная часть
и-РНК, кодирующая
белок, состоящий из
100 аминокислот?
100.
Задача-2Кто читает
информацию,
заключенную
в и-РНК?
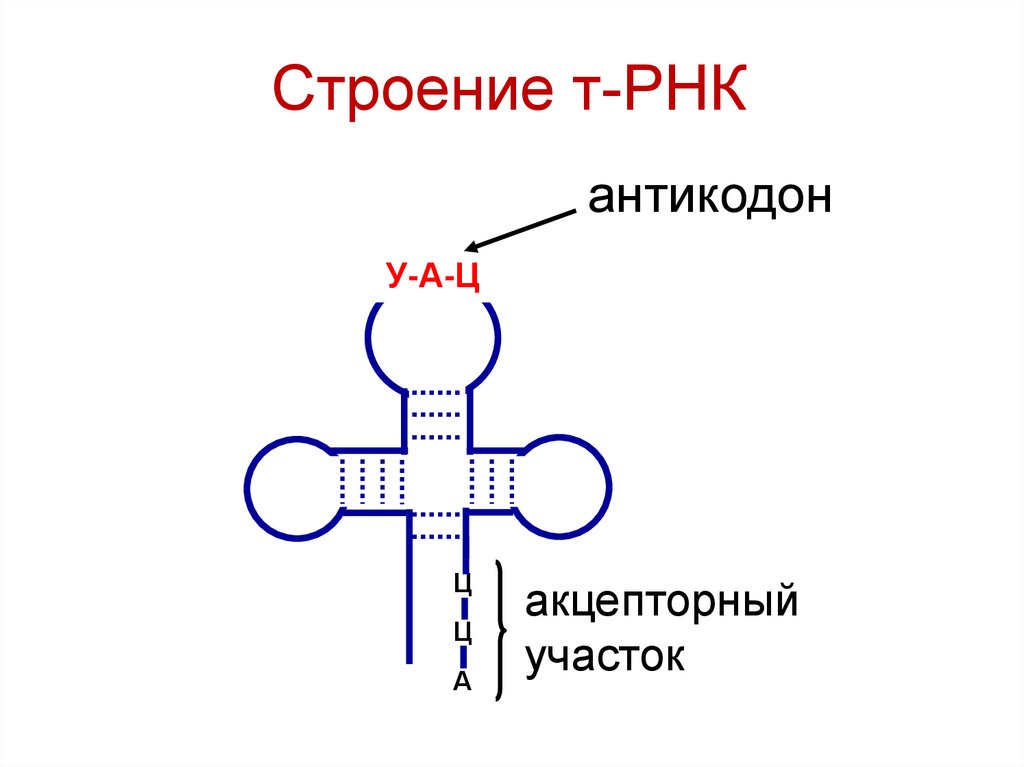
101. Строение т-РНК
антикодонУ-А-Ц
Ц
Ц
А
акцепторный
участок
102.
Взаимодействие кодона с антикодономкодон кодон кодон кодон
-А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г- - - - - и-РНК
У-А-Ц
рибосома
Ц
Ц
А -аминокислота
103.
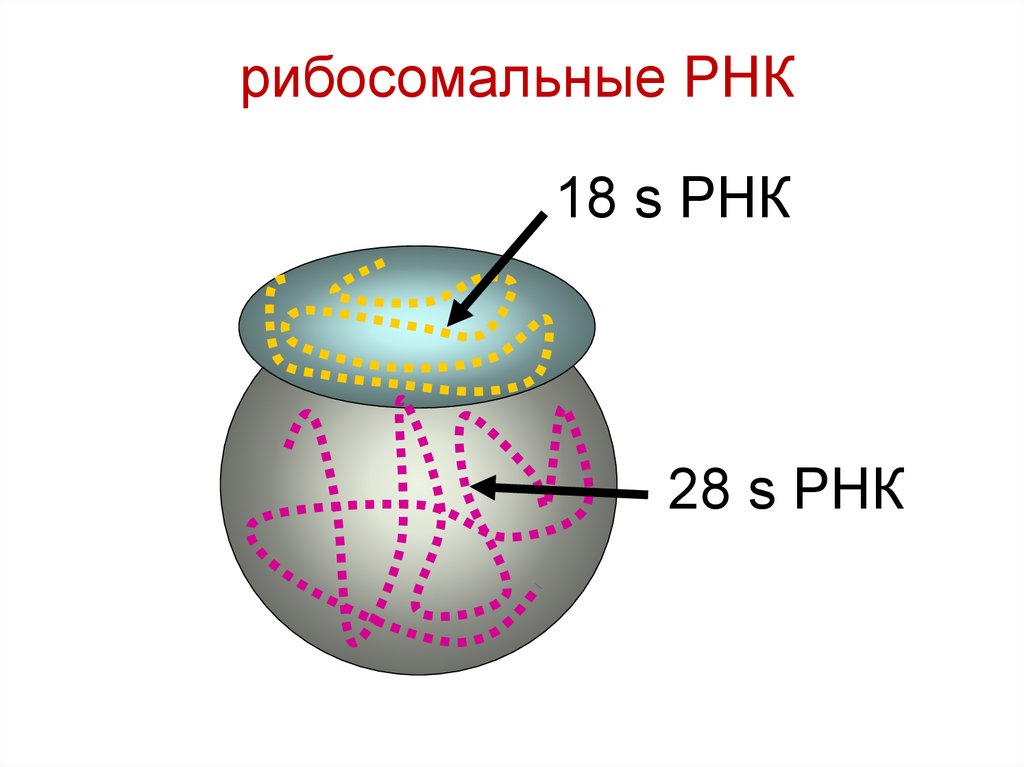
рибосомальные РНК18 s РНК
28 s РНК
104.
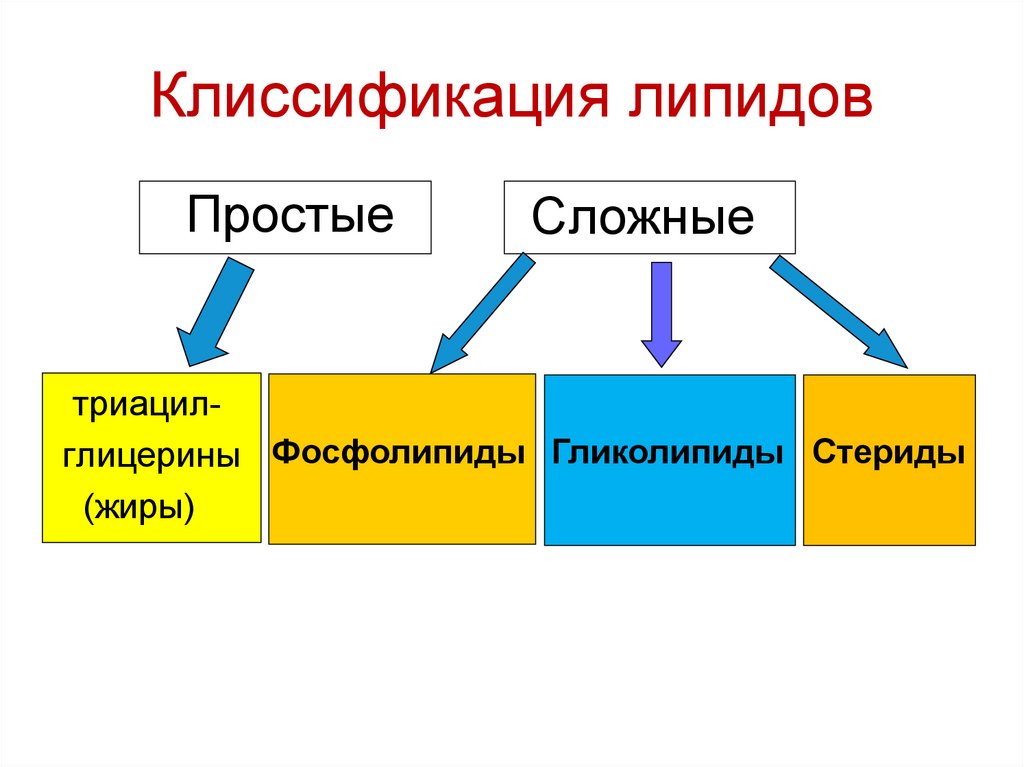
Строениелипопротеинов
105. Клиссификация липидов
ПростыеСложные
триацилглицерины Фосфолипиды Гликолипиды Стериды
(жиры)
106.
триацилглицеринО
СН2 – О – С – С17Н35
О
СН – О– С – С15Н31
О
СН2 – О – С – С17Н31
107. С15Н31 СООН – пальмитиновая кислота С17Н35 СООН – стеариновая кислота С17Н33 СООН – олеиновая кислота С17Н31 СООН – линолевая
Формулы высших жирных кислотС15Н31 СООН – пальмитиновая кислота
С17Н35 СООН – стеариновая кислота
С17Н33 СООН – олеиновая кислота
С17Н31 СООН – линолевая кислота
С17Н29 СООН – линоленовая кислота
С19Н31 СООН – арахидоновая кислота
108.
Двойные связи в линолевойкислоте
16 15 14
13
12
11
10
9
8
7
6
5
4
3
2
1
Н3С- СН2-СН2-СН2= СН2-СН2-СН2= СН2-СН2-СН2- СН2-СН2-СН2- СН2-СН2-СООН
С17Н35 СООН стеариновая предельная кислота
С17Н31 СООН линолевая непредельная кислота
109.
Непредельные высшие кислотыне синтезируются в организме
человека. Поэтому люди
испытывают необходимость
ежедневного приема
ненасыщенных жирных кислот
с продуктами питания
(жидкие масла)
110.
ХИМИЧЕСКАЯ СТРУКТУРА ФОСФОЛИПИДАСН3 СН3 СН3
N+
холин
О
СН2-О-С
СН2
СН2
СН3
О
СН -О- С
СН3
О
-О-Р-О
СН2
О
гидрофильная часть
гидрофобная часть молекулы
(остатки двух жирных кислот)
111. Строение фосфолипидной молекулы
гидрофильная частьгидрофообная часть
112. Гидрофобные белки мембран клеток
113.
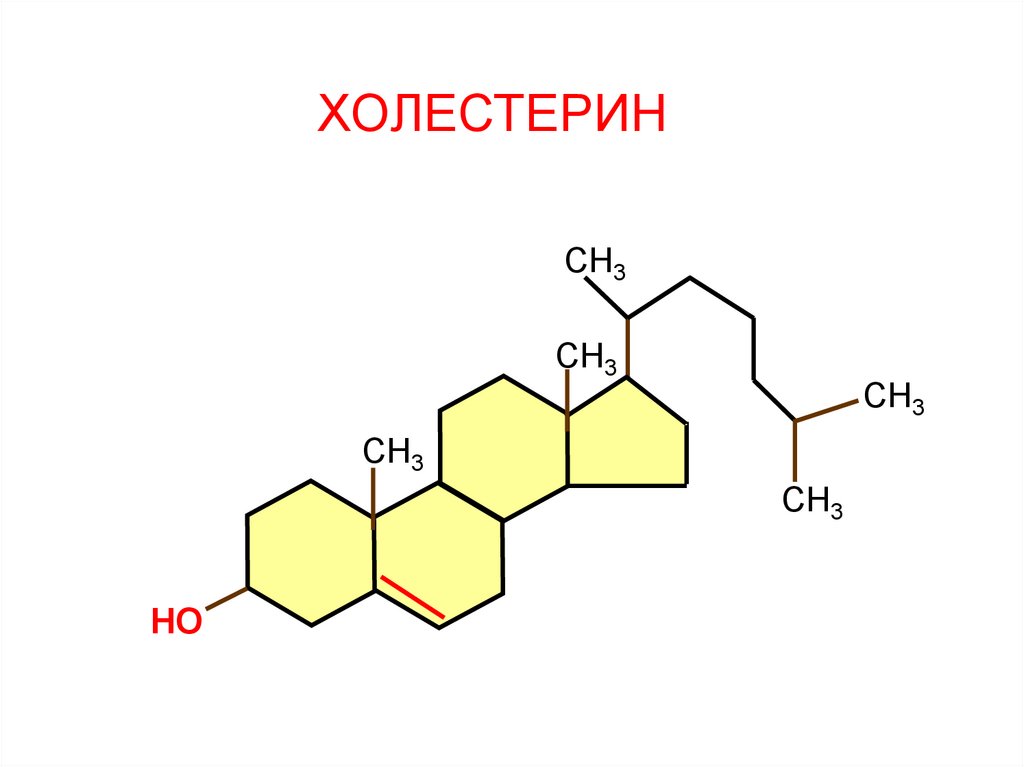
ХОЛЕСТЕРИНСН3
СН3
СН3
СН3
СН3
НО
114.
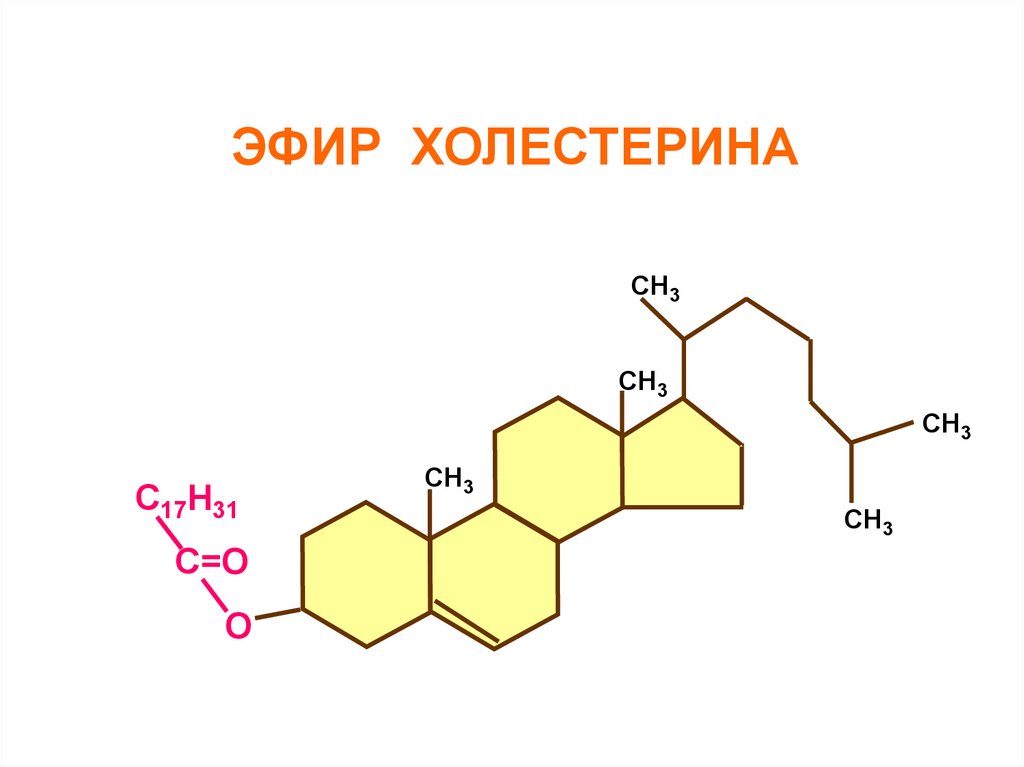
ЭФИР ХОЛЕСТЕРИНАСН3
СН3
СН3
С17Н31
С=О
О
СН3
СН3
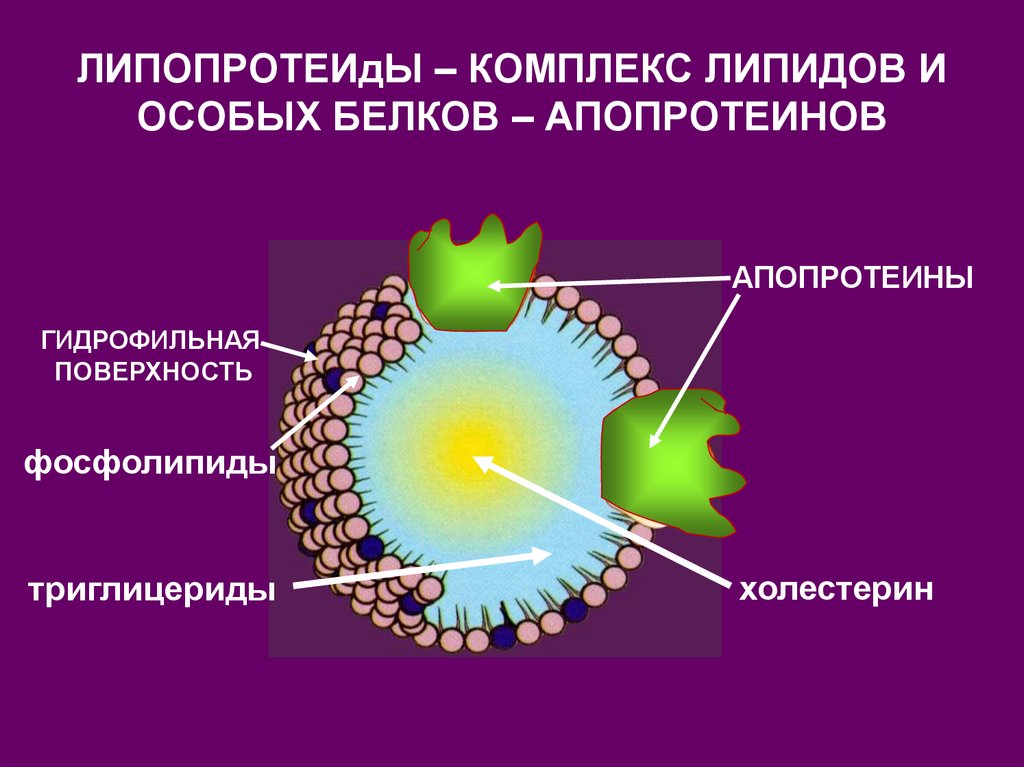
115. ЛИПОПРОТЕИдЫ – КОМПЛЕКС ЛИПИДОВ И ОСОБЫХ БЕЛКОВ – АПОПРОТЕИНОВ
АПОПРОТЕИНЫГИДРОФИЛЬНАЯ
ПОВЕРХНОСТЬ
фосфолипиды
триглицериды
холестерин
116.
Сравнительные размеры липопротеидов кровирассеивают
свет
Хиломикроны
(состоят из
триглицеридов)
ЛПОНП (состоят из
холестерина и
триглицеридов)
не
рассеивают
свет
ЛПНП (состоят из холестерина)
ЛПВП (состоят из холестерина)
117.
Липопротеиды крови118.
Строениехромопротеинов
119.
Примеры белков хромопротеиновмиоглобин
гемоглобин
цитохромы
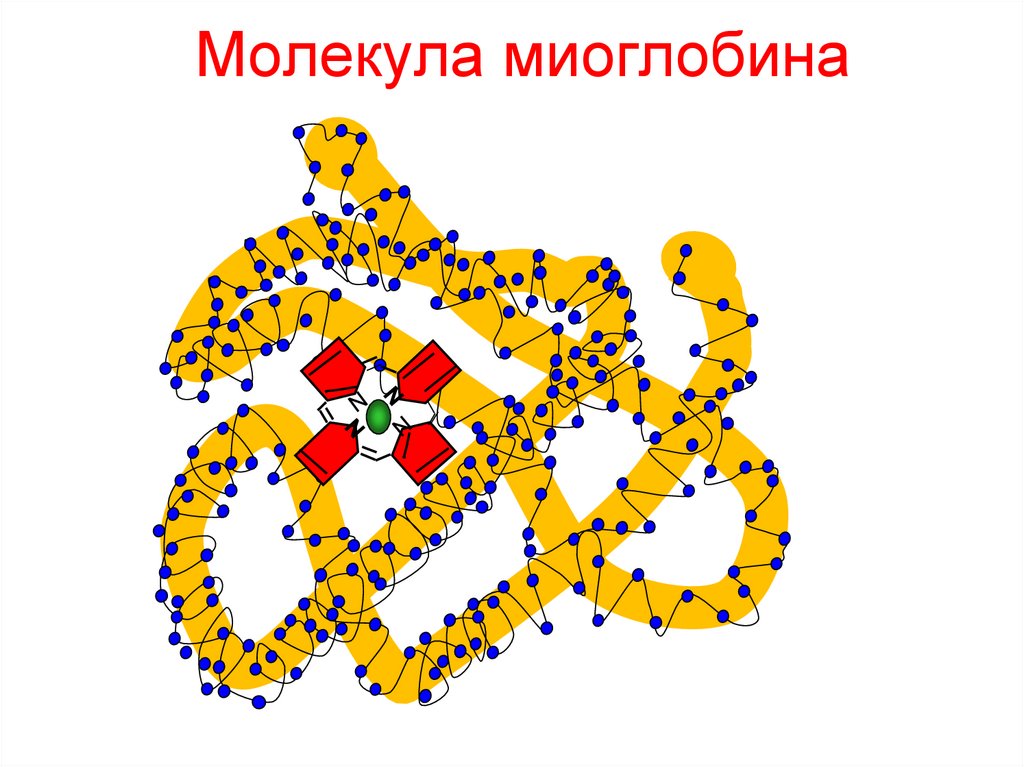
120. Молекула миоглобина
121. Молекула гемоглобина
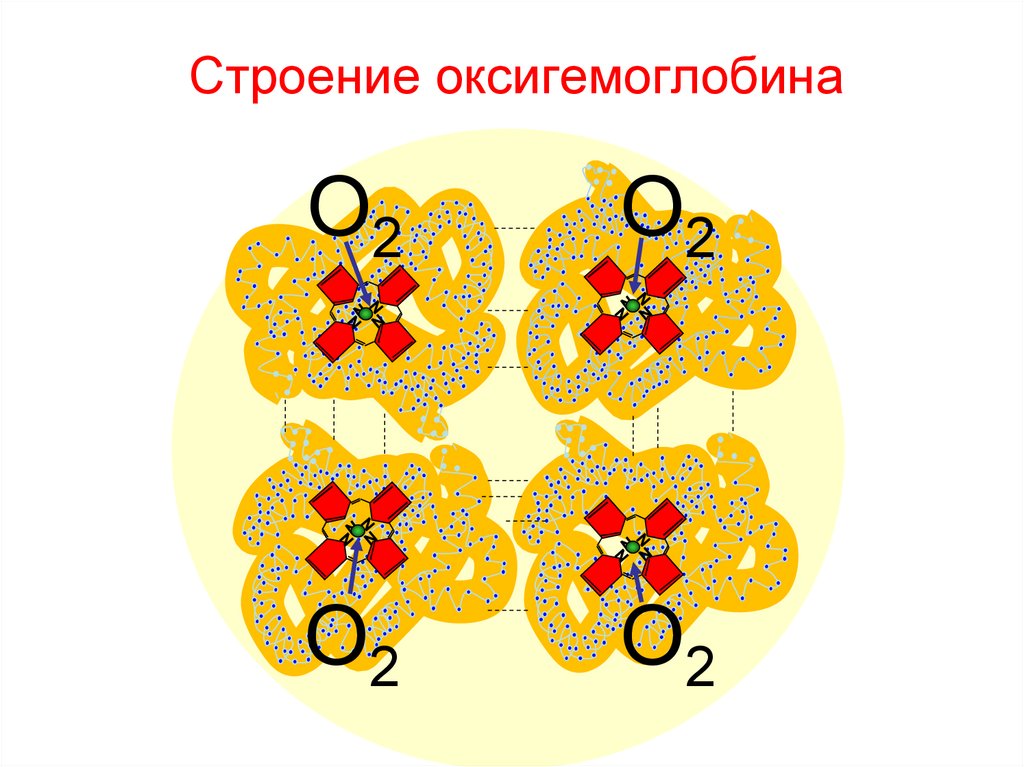
122. Строение оксигемоглобина
О2О2
О2
О2
123. Присоединение гема к глобину
ГИСFe2+
ГИС
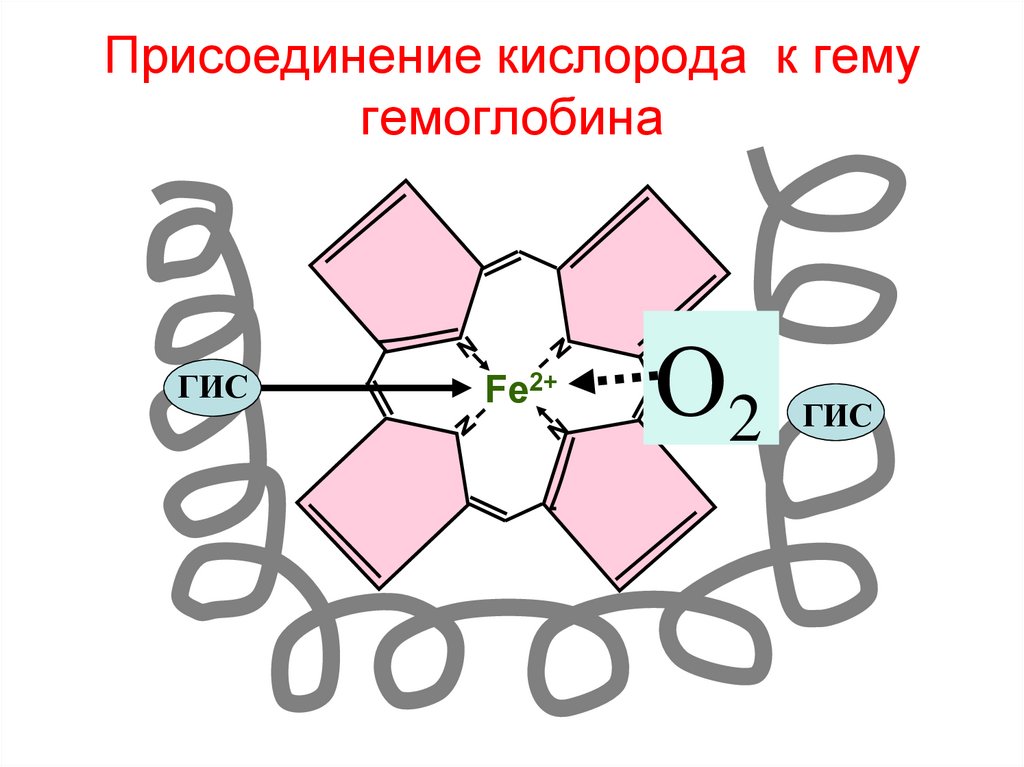
124. Присоединение кислорода к гему гемоглобина
ГИСFe2+
О2
ГИС
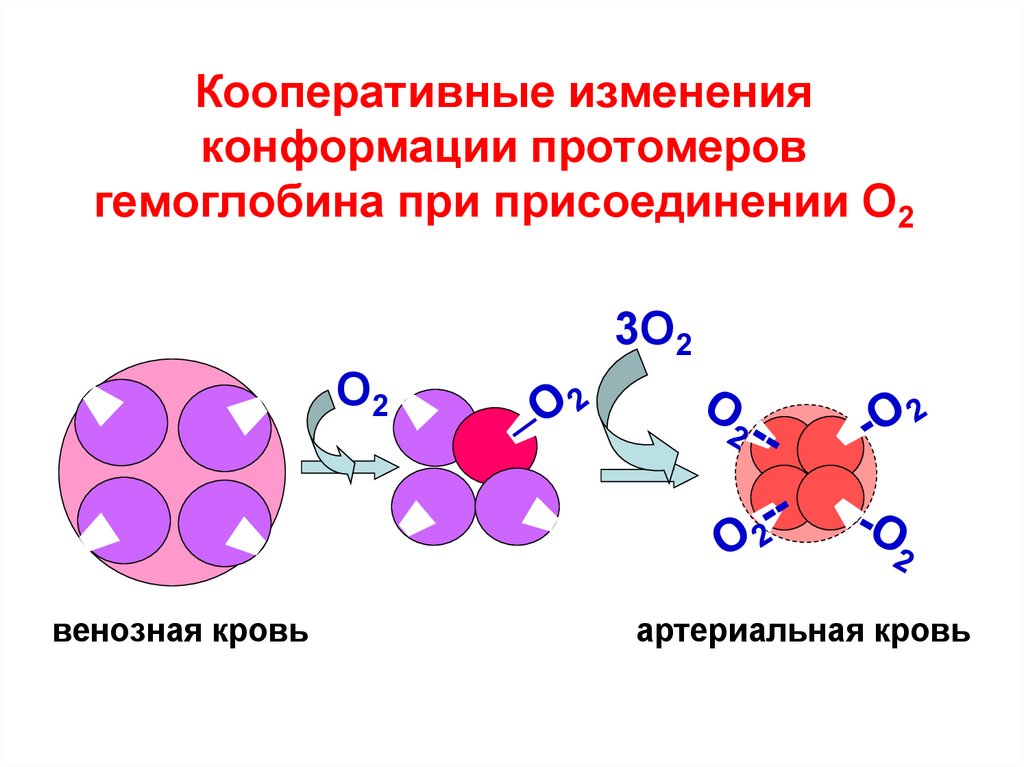
125. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2
3О2О2
венозная кровь
артериальная кровь
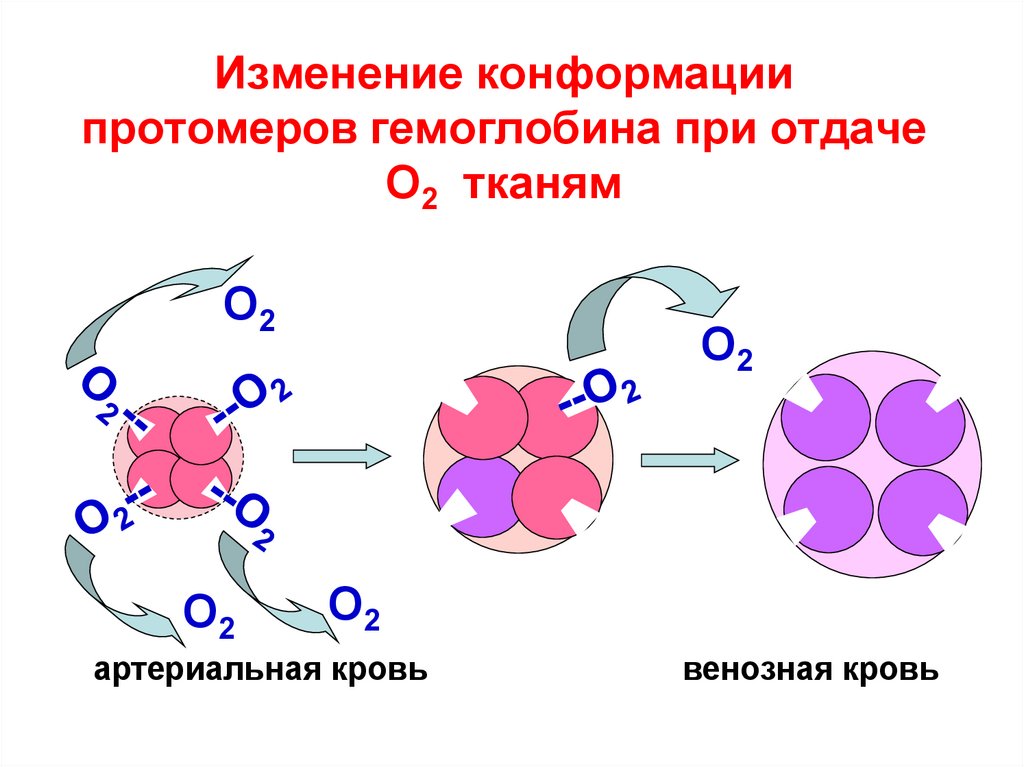
126. Изменение конформации протомеров гемоглобина при отдаче О2 тканям
О2О2
О2
О2
артериальная кровь
венозная кровь
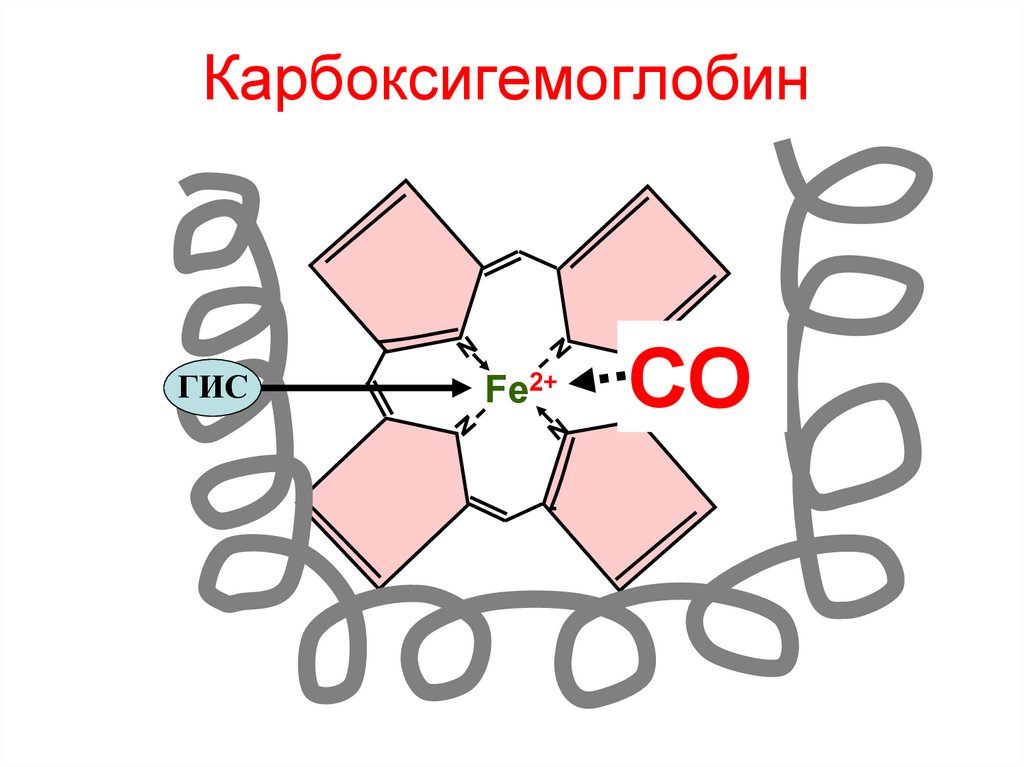
127. Карбоксигемоглобин
ГИСFe2+
СО
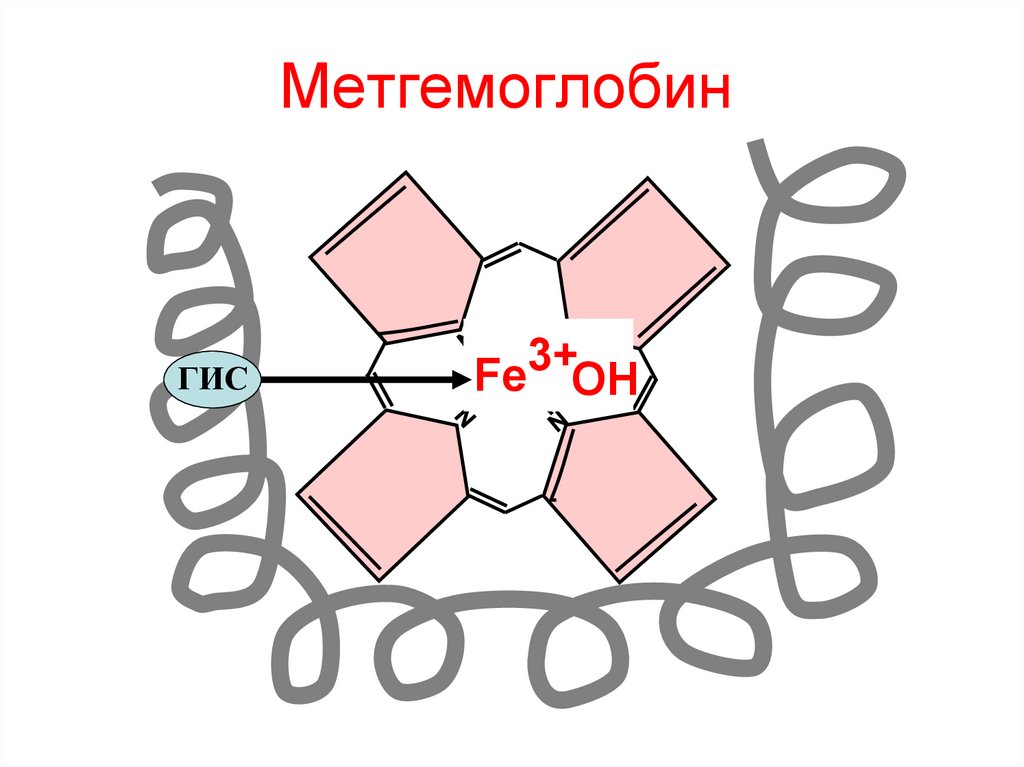
128. Метгемоглобин
ГИСFe3+ОН
129.
Гликопротеины(преобладает белковая часть)
Протеогликаны
(преобладает углеводный компонент)
130.
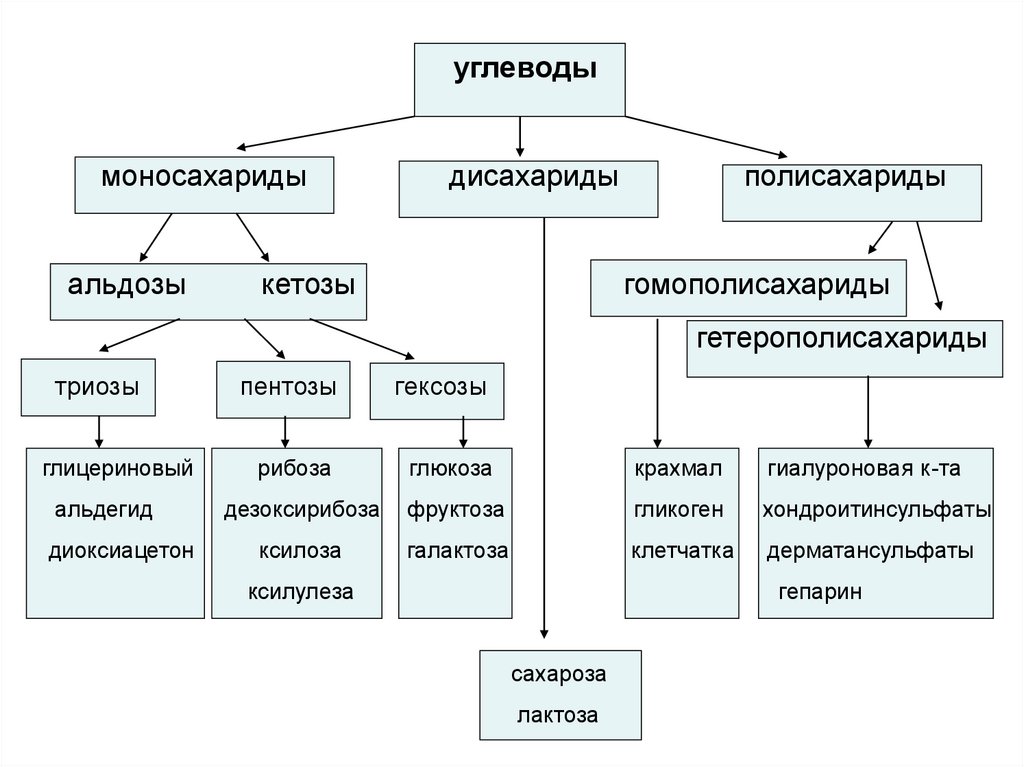
углеводымоносахариды
альдозы
дисахариды
кетозы
полисахариды
гомополисахариды
гетерополисахариды
триозы
глицериновый
альдегид
диоксиацетон
пентозы
гексозы
рибоза
глюкоза
крахмал
гиалуроновая к-та
дезоксирибоза
фруктоза
гликоген
хондроитинсульфаты
ксилоза
галактоза
клетчатка
дерматансульфаты
ксилулеза
гепарин
сахароза
лактоза
131.
Есть ли среди представленныхвеществ углеводы ?
СН3
СН2ОН
С=О
С=О
СН2ОН
СН2ОН
Н
С=О
Н-С-ОН
СН2ОН
Н
С=О
Н-С-Н
СН2ОН
132.
формулы триозСН2ОН
С=О
СН2ОН
диоксиацетон
Н
С=О
Н-С-ОН
СН2ОН
глицериновый
альдегид
133.
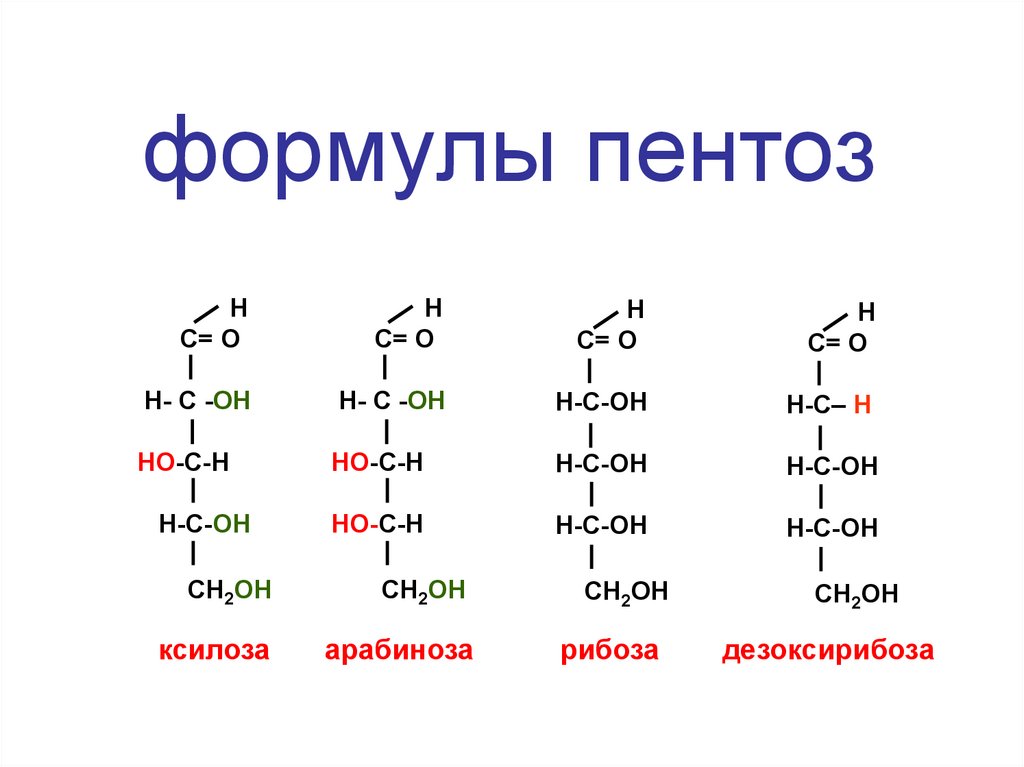
формулы пентозН
С= О
Н
С= О
Н
С= О
Н
С= О
Н- С -ОН
Н- С -ОН
Н-С-ОН
Н-С– Н
НО-С-Н
НО-С-Н
Н-С-ОН
Н-С-ОН
HО-C-Н
H-C-ОН
H-C-ОН
H-C-ОН
СН2ОН
СН2ОН
ксилоза
арабиноза
СН2ОН
рибоза
СН2ОН
дезоксирибоза
134.
Представители гексозН
С=О
Н-С-ОН
HO-С-Н
СН2ОН
С=О
НО-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
Н-С-ОН
СН2ОН
глюкоза
СН2ОН
фруктоза
Н
С=О
Н-С-ОН
HO-С-Н
НО-С-Н
H-C-OH
СН2ОН
галактоза
135.
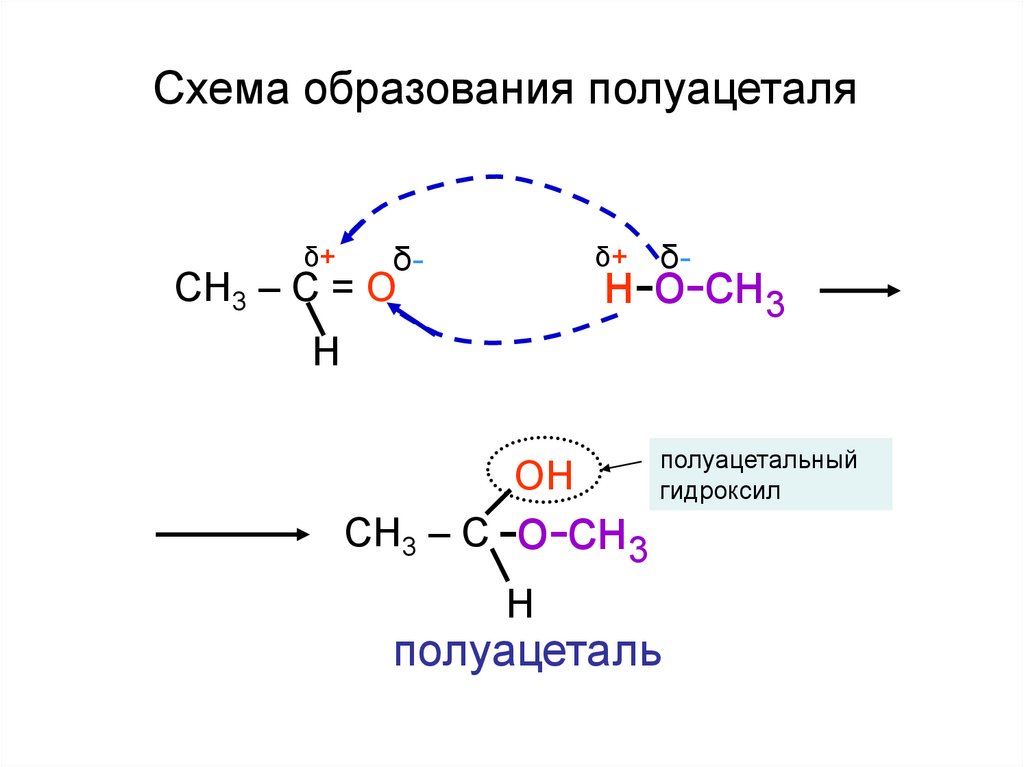
Схема образования полуацеталяδ+
δ-
δ+
δ-
н-о-сн3
СН3 – С = О
Н
ОН
полуацетальный
гидроксил
СН3 – С -о-сн3
Н
полуацеталь
136.
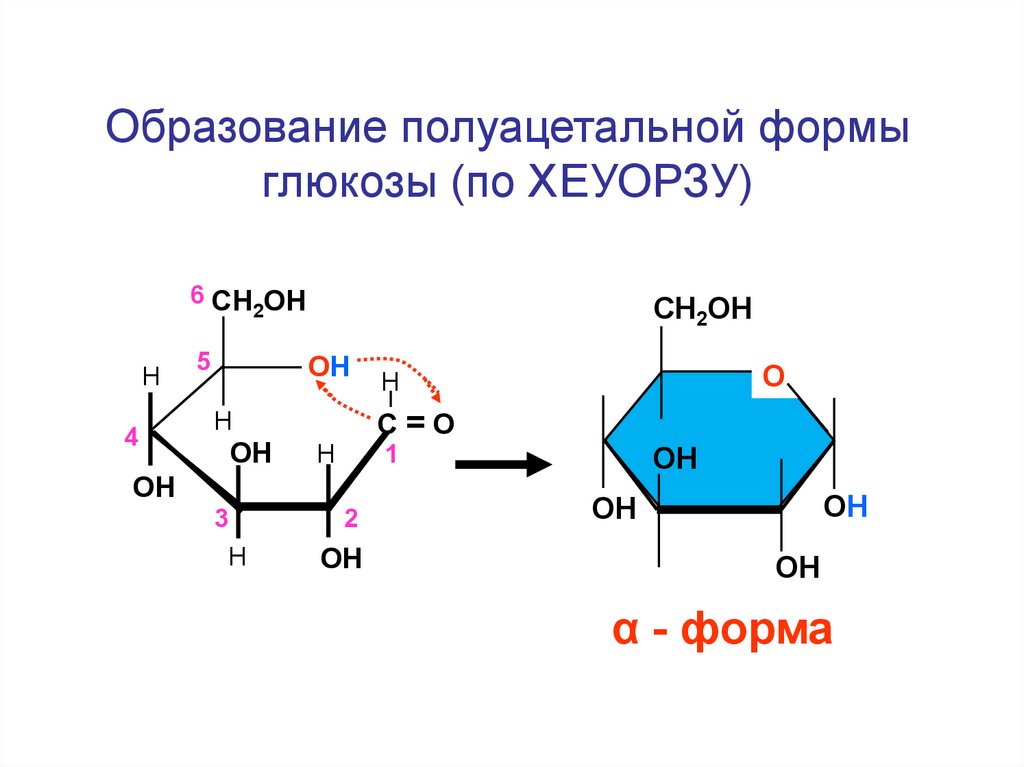
Образование полуацетальной формыглюкозы (по ХЕУОРЗУ)
6 СН ОН
2
Н
4
СН2ОН
ОН
5
Н
ОН
С=О
Н
ОН
1
ОН
3
Н
О
Н
2
ОН
ОН
ОН
ОН
α - форма
137.
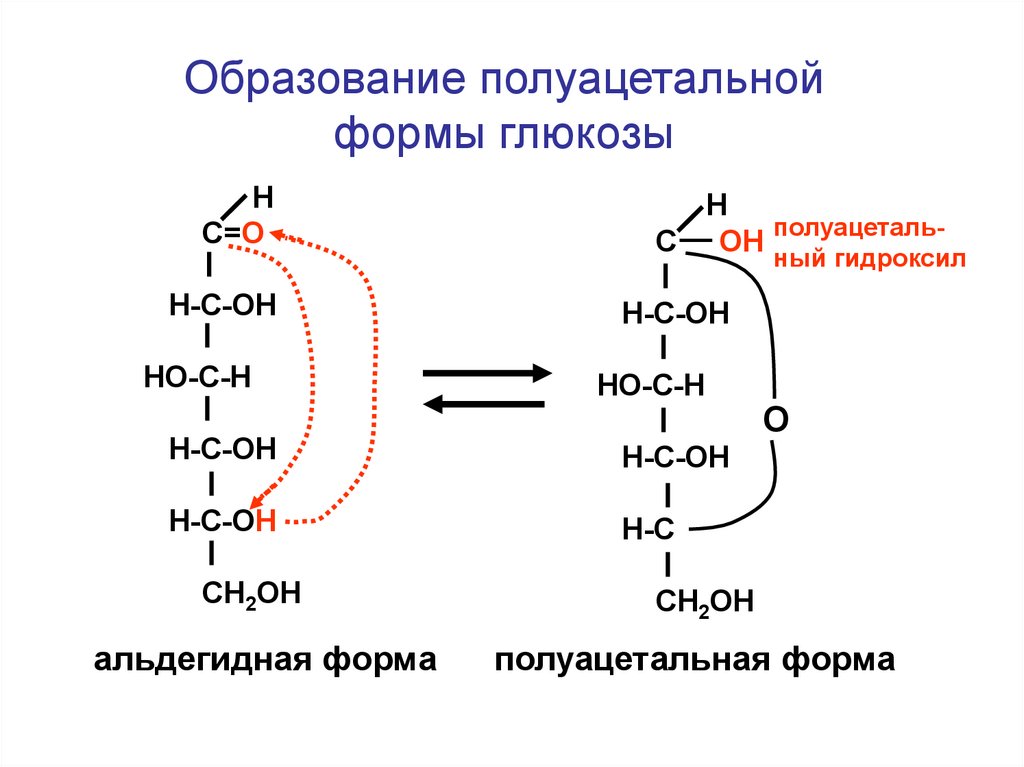
Образование полуацетальнойформы глюкозы
Н
С=О
Н-С-ОН
HO-С-Н
Н
полуацетальС ОН
ный гидроксил
Н-С-ОН
HO-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
H-C
СН2ОН
альдегидная форма
О
СН2ОН
полуацетальная форма
138.
СН2ОНСН2ОН
О
О ОН
ОН
ОН
ОН
ОН
ОН
α - форма
ОН
ОН
β – форма глюкозы
139.
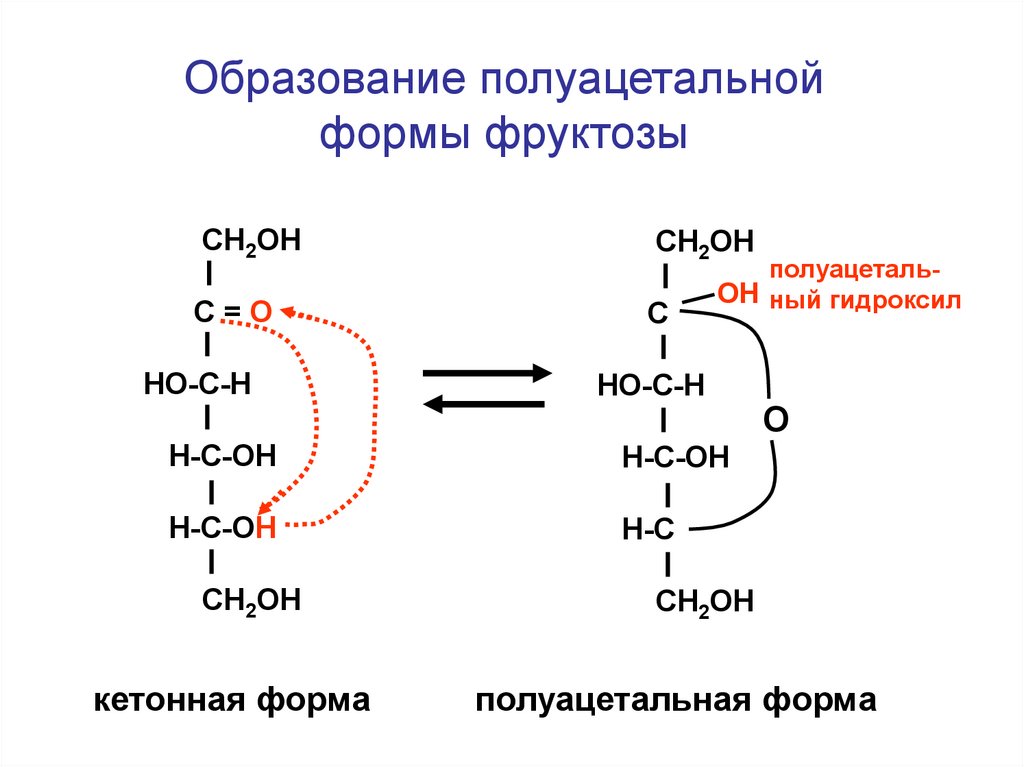
Образование полуацетальнойформы фруктозы
СН2ОН
СН2ОН
С=О
С
HO-С-Н
полуацетальОН ный гидроксил
HO-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
H-C
СН2ОН
кетонная форма
О
СН2ОН
полуацетальная форма
140.
полуацетальная форма фруктозы поХЕУОРЗУ
CH2ОН
CH2ОН
О
ОН
ОН
ОН
ОН
α - форма
141.
полуацетальная форма фруктозы поХЕУОРЗУ
CH2ОН
ОН
О
ОН
ОН
CH2ОН
ОН
β - форма
142.
β – форма рибозы5
CH2ОН
О
ОН
1
4
2
ОН
3
ОН
143.
β – форма дезоксирибозы5
CH2ОН
О
ОН
1
4
2
Н
3
ОН
144.
окисление альдегидной группы в углеводахН
С=О
СООН
Н-С-ОН
Н-С-ОН
HO-С-Н
Аg2O, t
HO-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
H-C-OH
СН2ОН
глюкоза
+ Ag
СН2ОН
глюконовая кислота
145.
окисление спиртовой группы в углеводахН
С=О
Н
С=О
Н-С-ОН
Н-С-ОН
HO-С-Н
[О], кат.
HO-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
H-C-OH
СН2ОН
глюкоза
СООН
глюкуроновая кислота
146.
фосфорные эфиры гексозН
С=О
Н-С-ОН
HO-С-Н
СН2ОН
С=О
НО-С-Н
Н-С-ОН
Н-С-ОН
H-C-OH
Н-С-ОН
ОН
СН2О –Р = О
ОН
глюкозо-6-фосфат
ОН
СН2О – Р = О
ОН
фруктозо-6-фосфат
147.
Углеводы гликопротеиновСН2ОН
СН2ОН
СН3
О
О
ОН
О
ОН
ОН
ОН
ОН
глюкоза
ОН
ОН
ОН
ОН
фукоза
ОН
ОН
NH
С=О
сн3
Ацетил-глюкоз-амин
148.
Углеводы гликопротеидовСООН
Н-С
СН2
Н-С-ОН
СН3-С-НN - С-Н О
Н-С
О
Н-С-ОН
Н-С-ОН
СН2ОН
сиаловая кислота
149.
Строение гликопротеинаАцетилглюкозамин
Фукоза
Фукоза
Ацетилглюкозамин
Ацетилглюкозамин
Фукоза
150.
Роль углеводного компонента вгликопротеинах
1.Стабилизирует молекулу белка;
2.Защищает белок от протеолиза
(расщепления ферментами);
151.
ПротеогликаныПреобладает углеводный
компонент
Состоит из белка и
гетерополисахарида
152.
фрагмент крахмала(гомополисахарид)
сн2он
сн2он
О.
О.
он
он
о
о
он
остаток α-глюкозы
о n
он
остаток α-глюкозы
153.
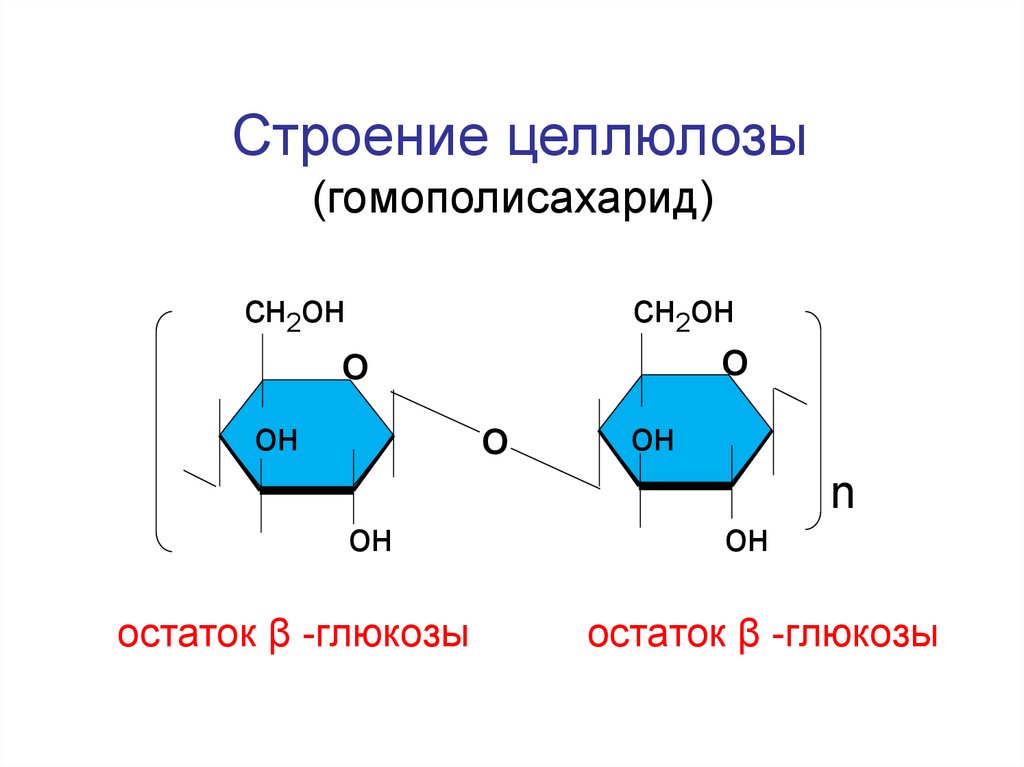
Строение целлюлозы(гомополисахарид)
сн2он
сн2он
О
О
он
О
он
остаток β -глюкозы
он
он
n
остаток β -глюкозы
154.
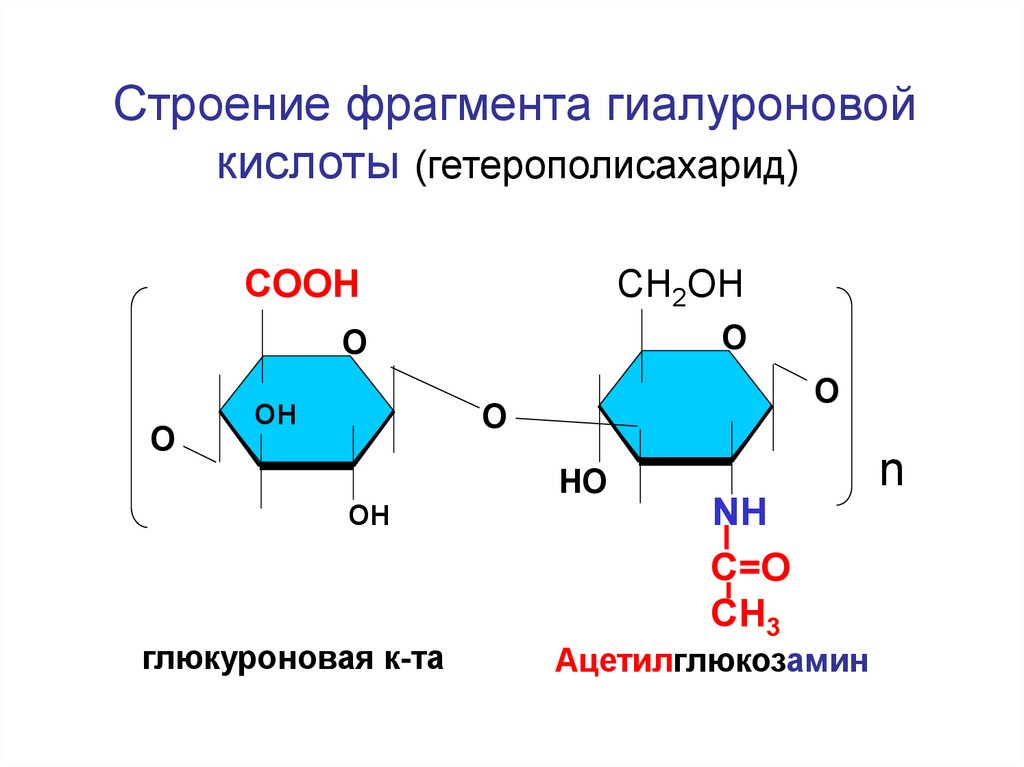
Строение фрагмента гиалуроновойкислоты (гетерополисахарид)
О
COOH
СН2ОН
О
О
он
О
О
он
глюкуроновая к-та
НО
n
NH
C=O
CH3
Ацетилглюкозамин
155.
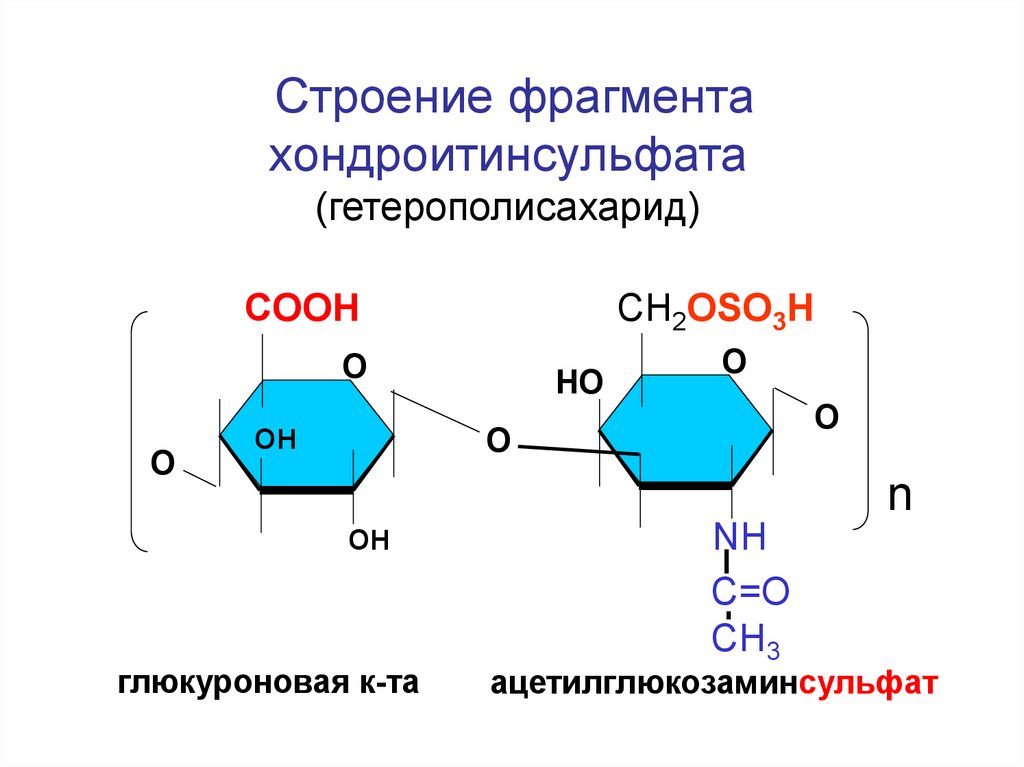
Строение фрагментахондроитинсульфата
(гетерополисахарид)
СН2OSO3H
COOH
О
О
он
НО
О
О
О
он
глюкуроновая к-та
n
NH
C=O
CH3
ацетилглюкозаминсульфат
156. Строение протеогликана
гиалуроновая кислотасвязывающие белки
хондроитинсульфат
сердцевинный белок
157.
Роль протеогликанов в организме человека1. Повышает прочность оболочек клеток
(плазматической мембраны);
2. Проявляет свойство универсального клея. В
виде аморфного вещества упрочняет костную
и соединительную ткань;
3. Является главным смазочным материалом
суставных поверхностей;
4. В виде слизей покрывает поверхность
эпителия желудка и кишечника от
разрушения протеолитическими
ферментами.
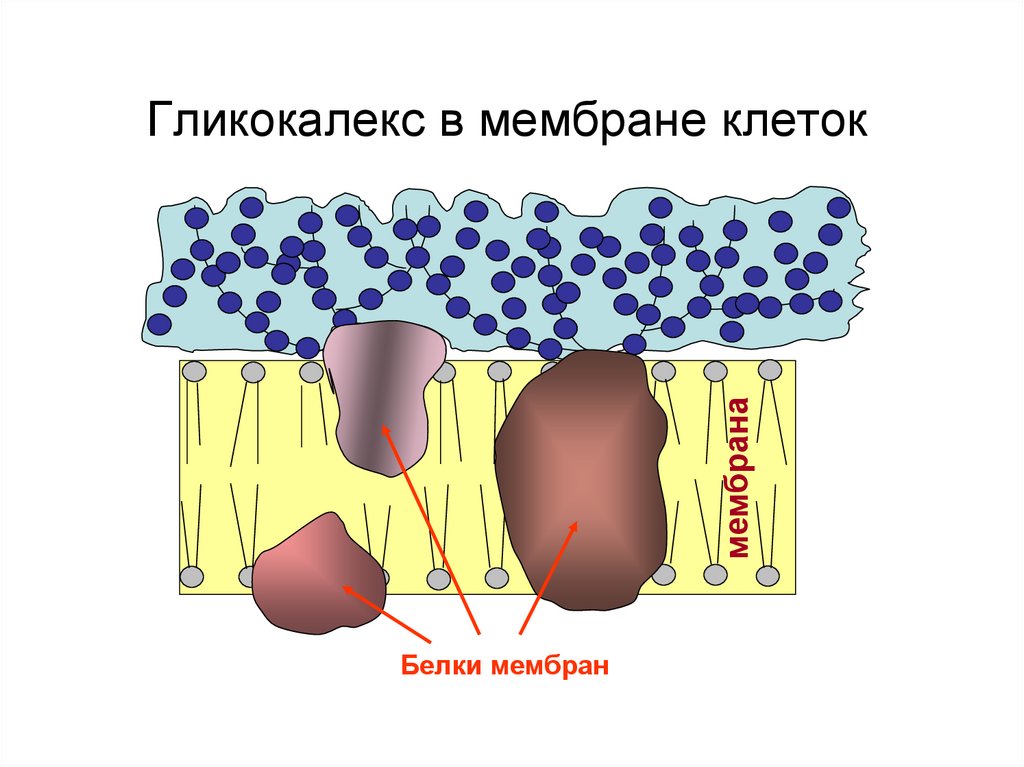
158. Гликокалекс в мембране клеток
мембранаГликокалекс в мембране клеток
Белки мембран
159.
Защита эпителиальных клетокполисахаридным слоем
Слизистая оболочка
стенки желудка
160.
Дефект слизистой оболочки приязвенной болезни желудка
161.
162.
Фосфопротеины163.
Строение фосфопротеина164.
полипептидная цепь--- CO-HN–CH–CO-НN ---серин
|
СН2–ОН
О
НО-Р-О
О
165.
полипептидная цепь--- CO-HN–CH–CO-НN ---|
+ Н 2О
СН2
О
О-Р-О
О
166.
Строение Са-фосфопротеинаСа2+
167.
Биологические значениефосфорилирования белков.
1.Является главной реакцией активации
ферментов;
2.Фосфопротеины обладают свойством
присоединять к молекуле ионы кальция.
Фосфопротеины молока (казеиногены)
являются основным источником Са и Р
для растущего организма.

















































































 biology
biology chemistry
chemistry