Similar presentations:
Обмен белков
1.
2.
Главные научныеоткрытия в области
обмена белков
принадлежат
Российским ученым
3.
Академик Опарин Александр Иванович(Лауреат Ленинской премии 1974 г.; Премии им. А.Н.
Баха, Награжден Золотой медалью им. М.В. Ломоносова
4.
Академик Баев Александр Александрович.(Лауреат Государственной премии 1969 г)
5.
Академик Спирин Александр Сергеевич (лауреатЛенинской премии 1976 г. Награжден медалью им. Ганса
Кребса федерации Европейского биохимического общества)
6. Роль белков в организме
Структурная
Каталитическая
Транспортная
Регуляторная
Защитная
Гомеостатическая
Депонирующая
Функциональная
7.
Динамика обновления белковЗа сутки распадается белков ~ 400 г
Из них распадается полностью до СО 2;
NН3 и Н2О ~ 100 г
В сутки синтезируется белков ~ 400 г
Суточная потребность в белках ~ 100 г
Период полуобновления белков ~ 80 дней
8.
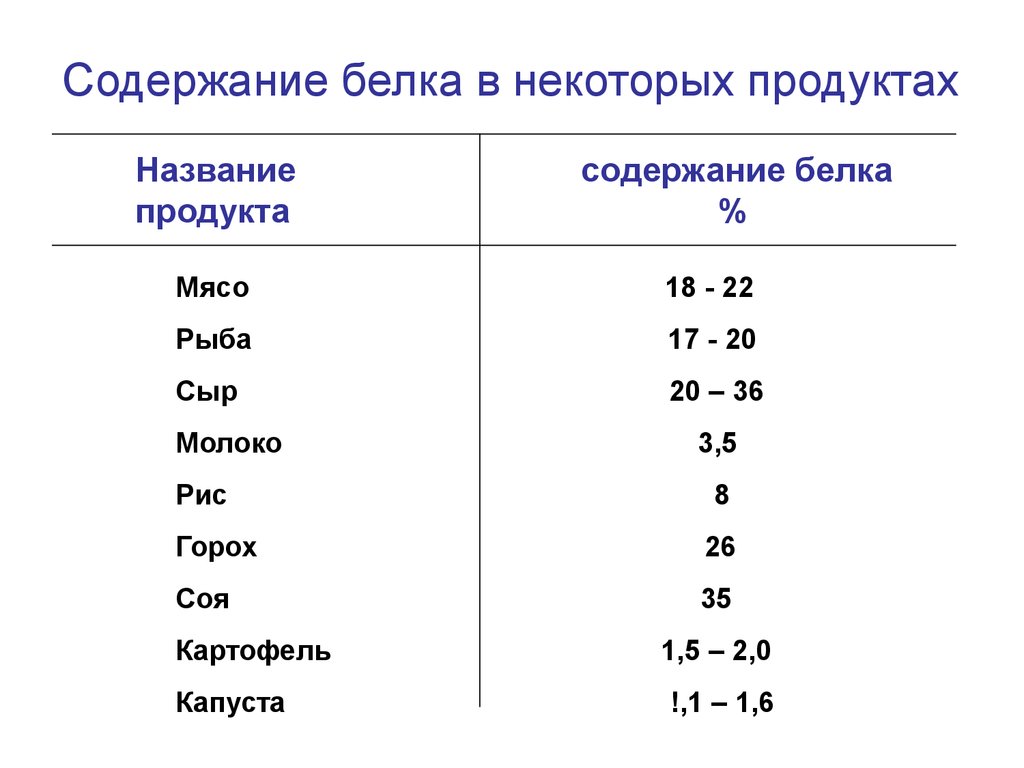
Содержание белка в некоторых продуктахНазвание
продукта
содержание белка
%
Мясо
18 - 22
Рыба
17 - 20
Сыр
20 – 36
Молоко
Рис
3,5
8
Горох
26
Соя
35
Картофель
Капуста
1,5 – 2,0
!,1 – 1,6
9.
Биологическая ценность аминокислотзаменимые
незаменимые
пируват ----------------------→ аланин
треонин
глицерин- ---------------------→ серин
метионин
серин -------------------------→ глицин
валин
аланин-----------------------→ цистеин
лейцин
щук ---------------→ аспарагиновая к-та
изолейцин
оксоглутаровая → глутаминовая к-та
лизин
глутаминовая к-та -----→ пролин
фенилаланин
глутаминовая к-та ----→ гистидин
триптофан
фенилаланин --------------→ тирозин
аргинин
10.
примеры продуктов, содержащиенеполноценные белки
название продукта
1. белки растительных
продуктов
2. белки кукурузы
3. белки соевых бобов
отсутствующая
аминокислота
несбалансированный
аминокислотный состав
лизин
триптофан
11.
Перевариваниебелков в
желудочнокишечном
12.
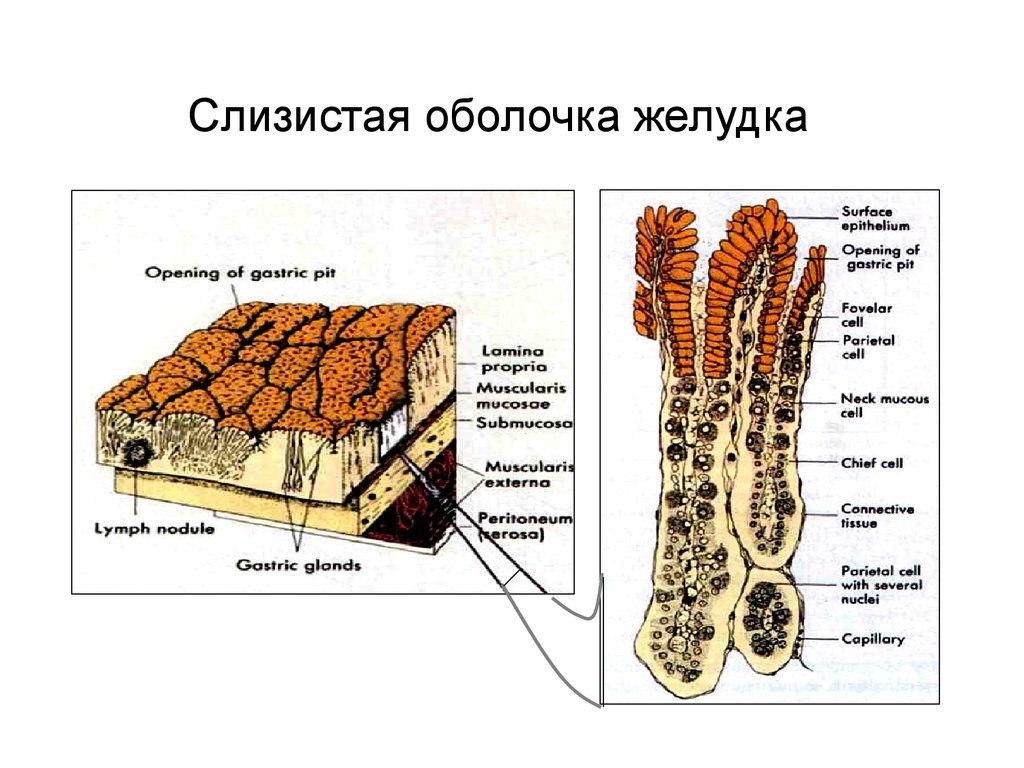
Слизистая оболочка желудка13.
Секреторные клетки желудкаглавные
пепсиноген
обкладочные
НCI
добавочные
мукополисахариды
14.
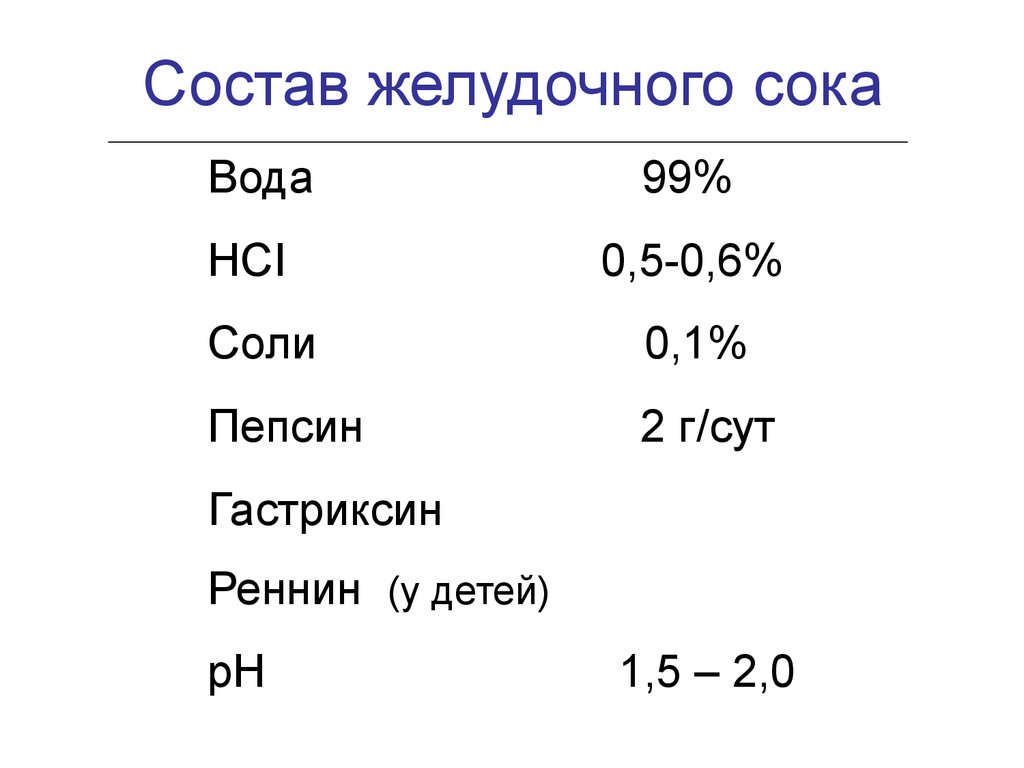
Состав желудочного сокаВода
НСI
99%
0,5-0,6%
Соли
0,1%
Пепсин
2 г/сут
Гастриксин
Реннин (у детей)
рН
1,5 – 2,0
15.
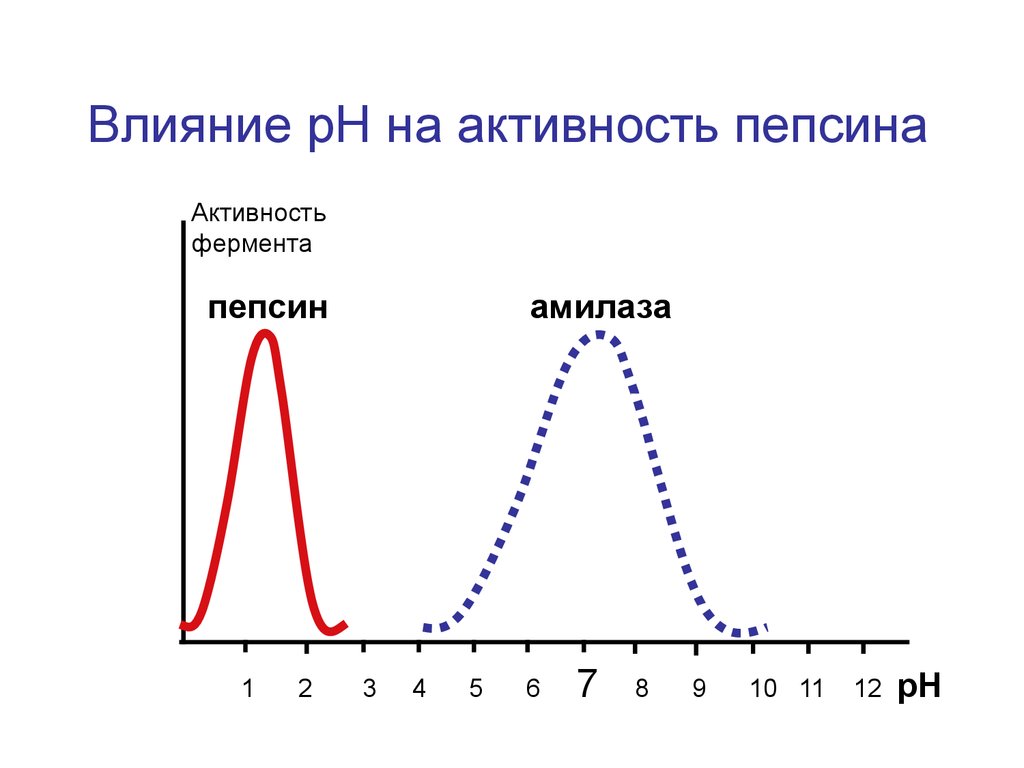
Роль НСI в переваривании белков1. Создает оптимум рН для активности пепсина;
2. Обладает бактерицидным действием;
3. Разрушая водородные связи в молекуле белка,
способствует его разрыхлению и улучшению
взаимодействия пепсина с пептидными связями
белка;
4. В пилорическом отделе желудка НСI
стимулирует образование местных гормонов –
секретина и панкреозимина, которые, в свою
очередь, стимулируют секрецию сока
поджелудочной железы.
16.
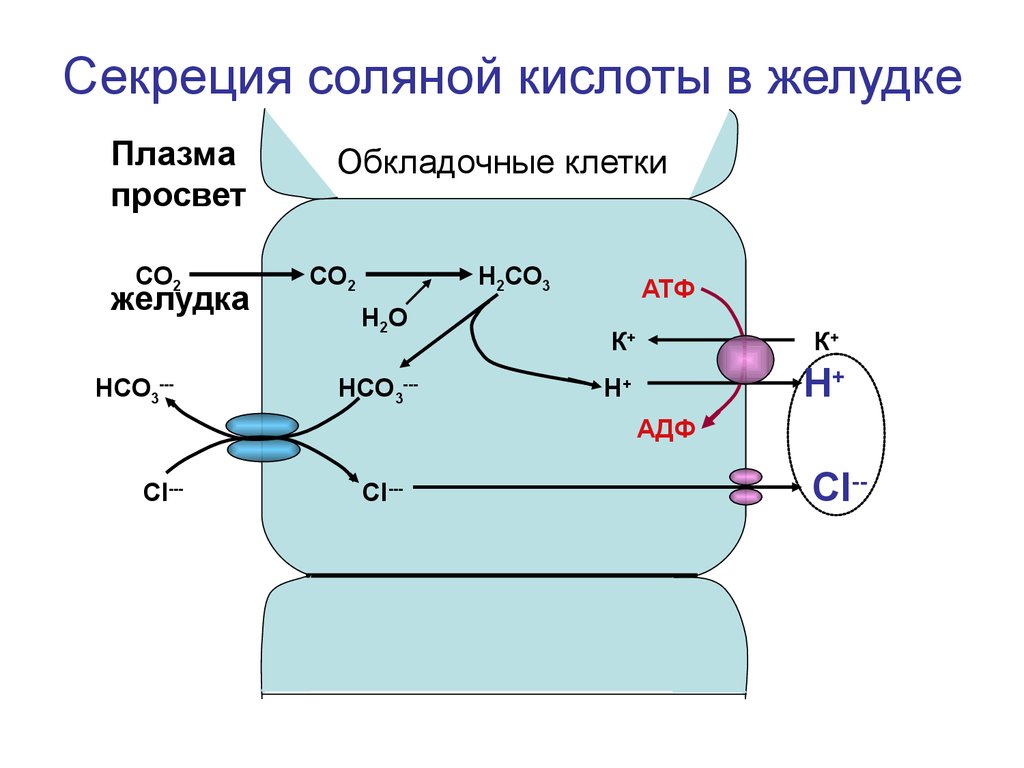
Секреция соляной кислоты в желудкеПлазма
просвет
СО2
желудка
НСО3---
Обкладочные клетки
СО2
Н2СО3
Н2О
НСО3---
АТФ
К+
К+
Н+
Н+
АДФ
СI---
CI ---
CI--
17.
Медицинские названия нарушенийкислотности желудочного сока
Повышенная кислотность
гиперхлоргидрия
Пониженная кислотность
гипохлоргидрия
Прекращение образования
соляной кислоты
ахлоргидрия
Нарушение секреции НСI
и секреции пепсина
ахилия
18.
Титрование желудочного сокаNaOH 0,1 N
NaOH 0,1 N
NaOH 0,1 N
NaOH 0,1 N
димети
ламиноаз
обензол
+
фенолфталеи
н
0
пункт 1
пункт 3
пункт 2
19.
Расчет результатов титрования1.Пункт 1. нейтрализация
свободной НСI. (мл 10 =
Т.Е.)
х
2.Пункт 3. нейтрализация всех
кислот желудочного сока.
Общая кислотность (мл 10 =
Т.Е.)
=
2
3.Пункт 2 и 3. расчет
Т.E. общей
HСI
(мл п. 2 + мл. п 3)
10
х
х
20.
Показатели кислотностижелудочного сока в норме
(после стимуляции секреции отваром капусты)
Общая кислотность - 40 - 60 Т.Е.
Общая НСI
- 25 - 50 Т.Е.
Свободная НСI
- 20 - 40 Т.Е.
Связанная НСI
- 5 - 10 Т.Е.
21.
Показатели кислотностижелудочного сока в норме
(после стимуляции секреции гистамином)
Общая кислотность - 100 - 120 Т.Е.
Свободная НСI
- 90 - 110 Т.Е.
22.
Влияние рН на активность пепсинаАктивность
фермента
пепсин
1
2
амилаза
3
4
5
6
7
8
9
10 11
12
рН
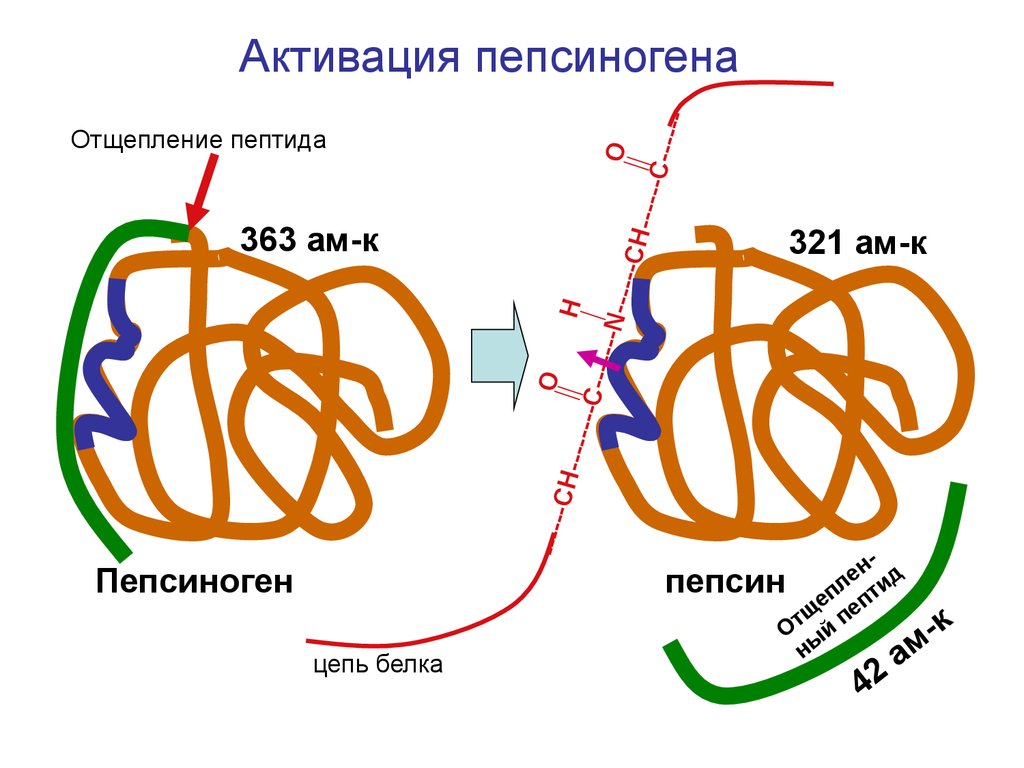
23.
H----H-----С------N-----C
321 ам-к
------
CH--
O
363 ам-к
O
Отщепление пептида
C-----
Активация пепсиногена
Пепсиноген
цепь белка
н- д
е
пепсин епл пти
щ пе
т
О й
ны
42
к
ам
24.
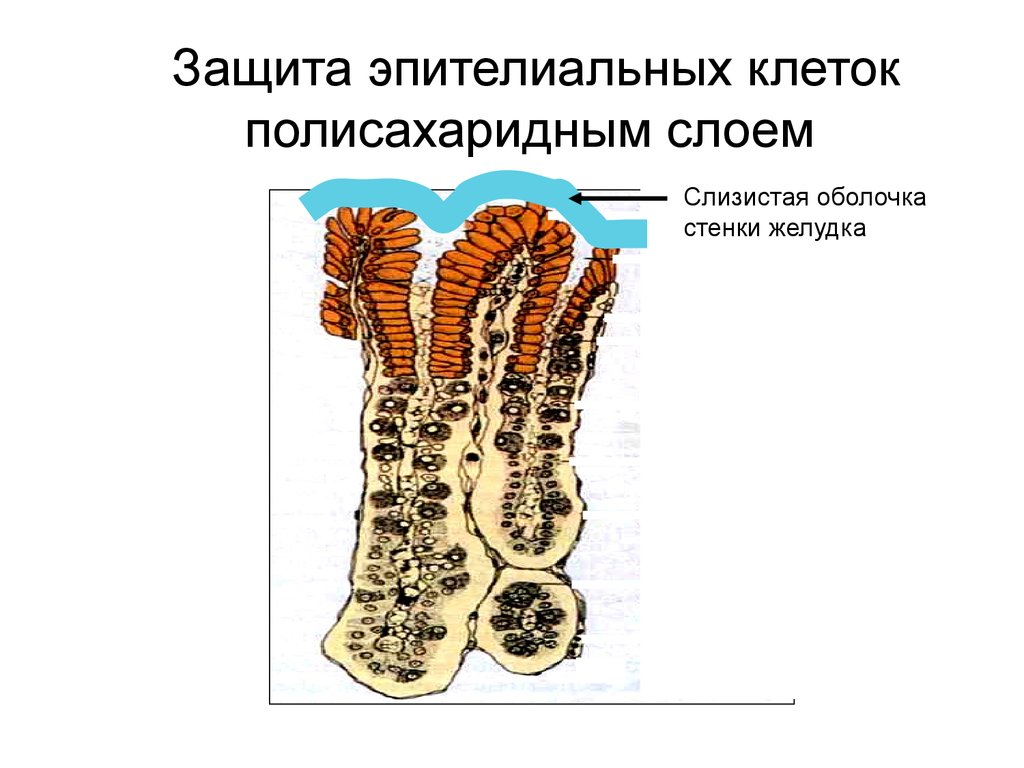
Защита эпителиальных клетокполисахаридным слоем
Слизистая оболочка
стенки желудка
25.
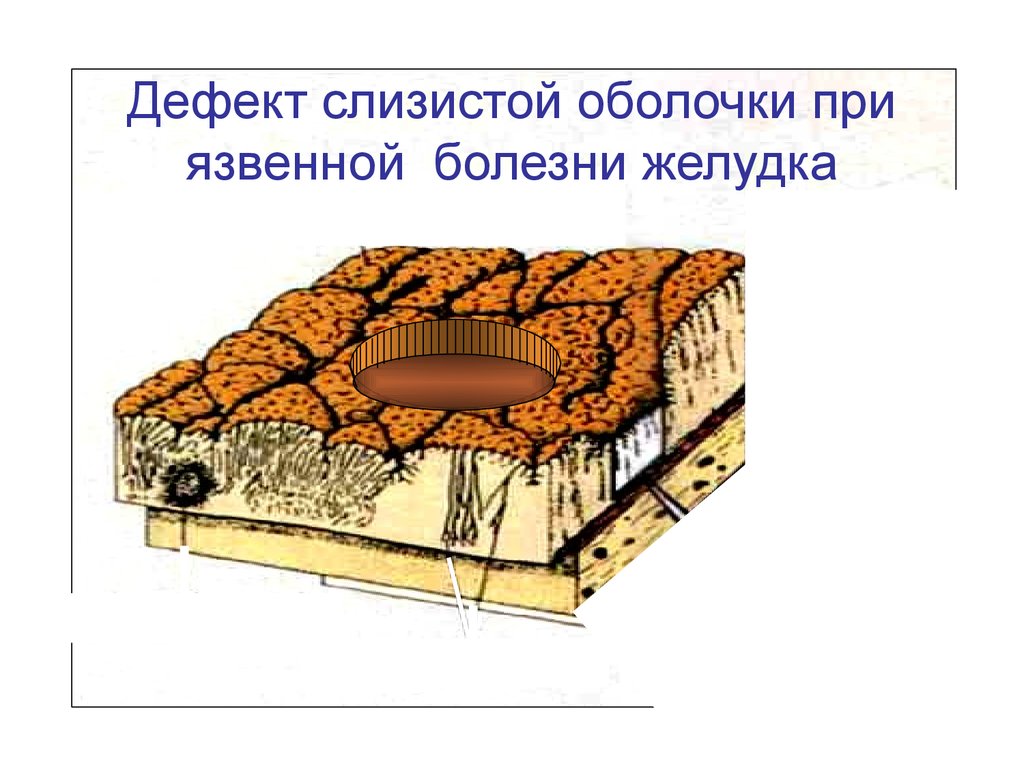
Дефект слизистой оболочки приязвенной болезни желудка
26.
Протеолитические проферменты и ферменты,образующиеся в поджелудочной железе и
механизм их активации
229 ам-к
трипсиноген
245 ам-к
энтерокиназа (кишечная)
химотрипсиноген
трипсин
223 ам-к
трипсин
химотрипсин
карбоксипептидазы
аминопептидазы
дипептидазы
230 ам-к
27.
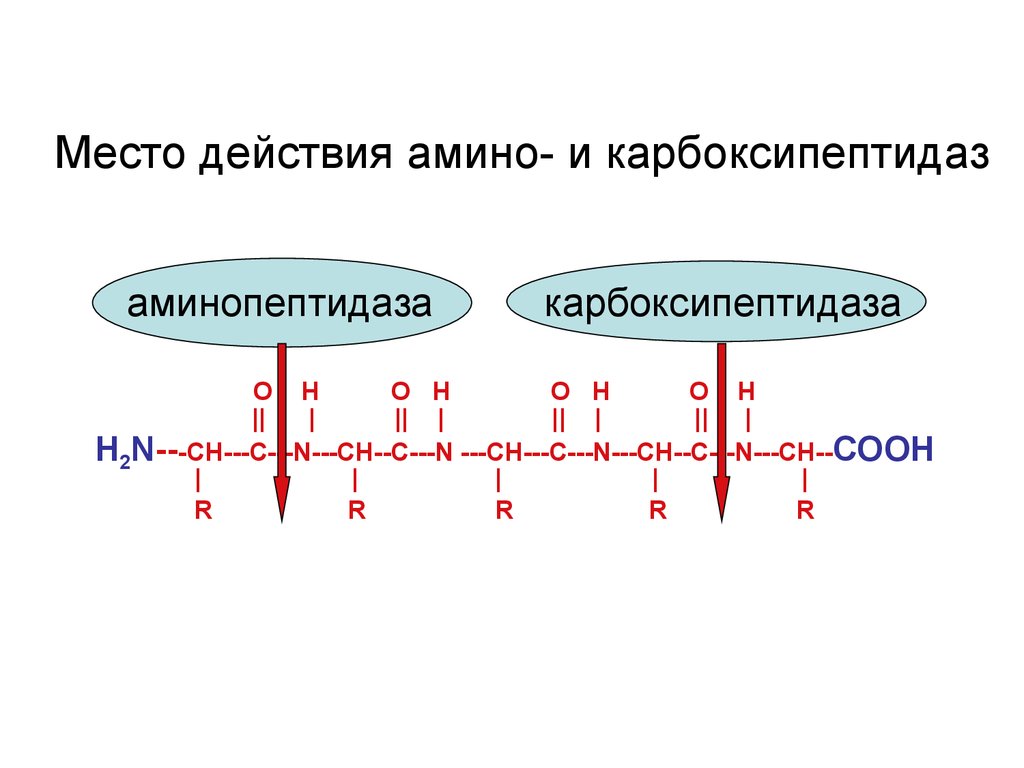
Место действия амино- и карбоксипептидазаминопептидаза
карбоксипептидаза
O H
O H
O H
O H
||
|
|| |
|| |
|| |
Н2N---CH---С---N---CH--C---N ---CH---С---N---CH--C---N---CH--COOH
|
|
|
|
|
R
R
R
R
R
28.
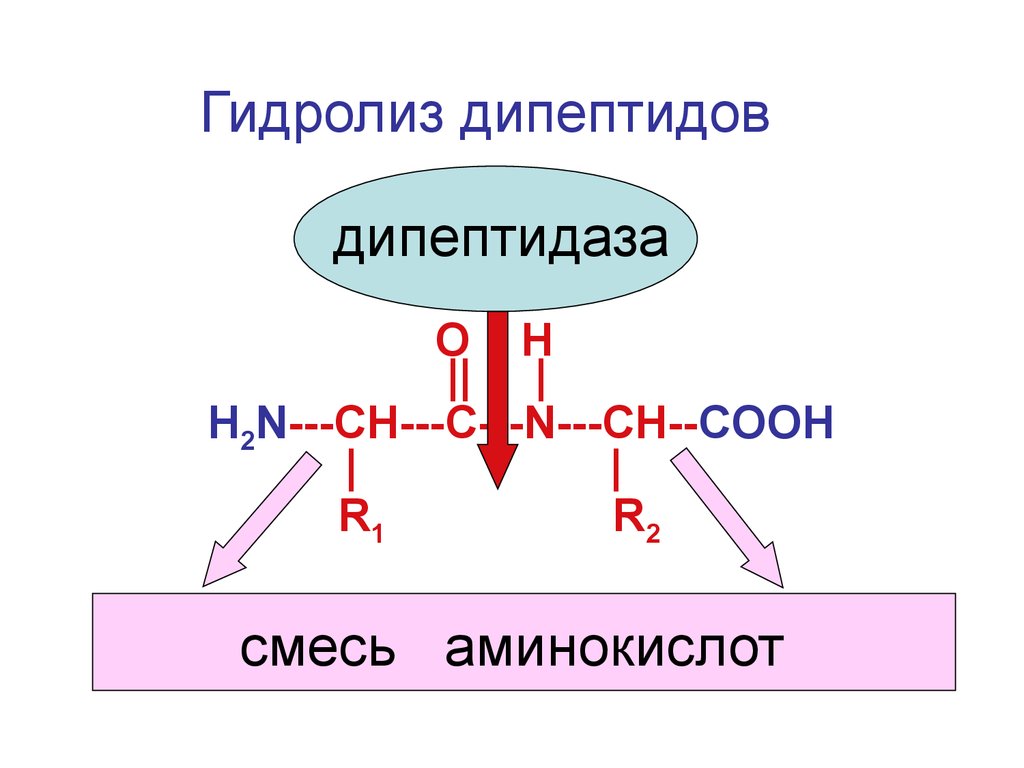
Гидролиз дипептидовдипептидаза
O H
|| |
Н2N---CH---С---N---CH--COOH
|
|
R1
R2
смесь аминокислот
29.
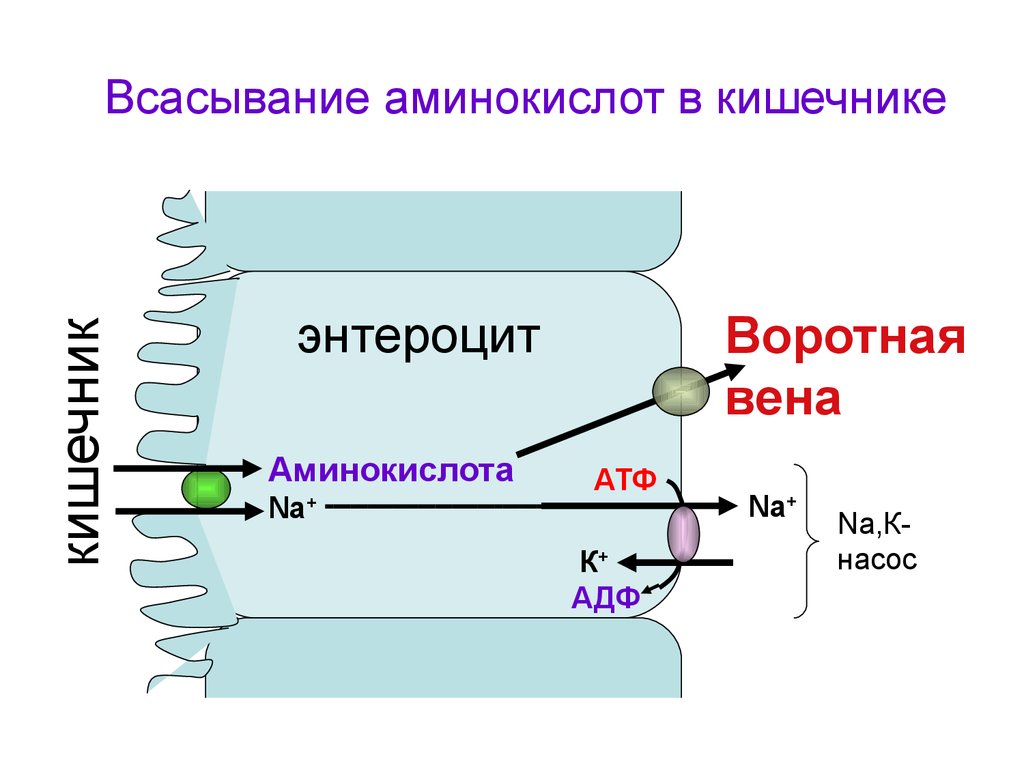
кишечникВсасывание аминокислот в кишечнике
энтероцит
Аминокислота
Na
+
Воротная
вена
АТФ
К+
АДФ
Nа+
Na,Кнасос
30.
Образованиетоксичных веществ
из аминокислот в
кишечнике под
влиянием бактерий
31.
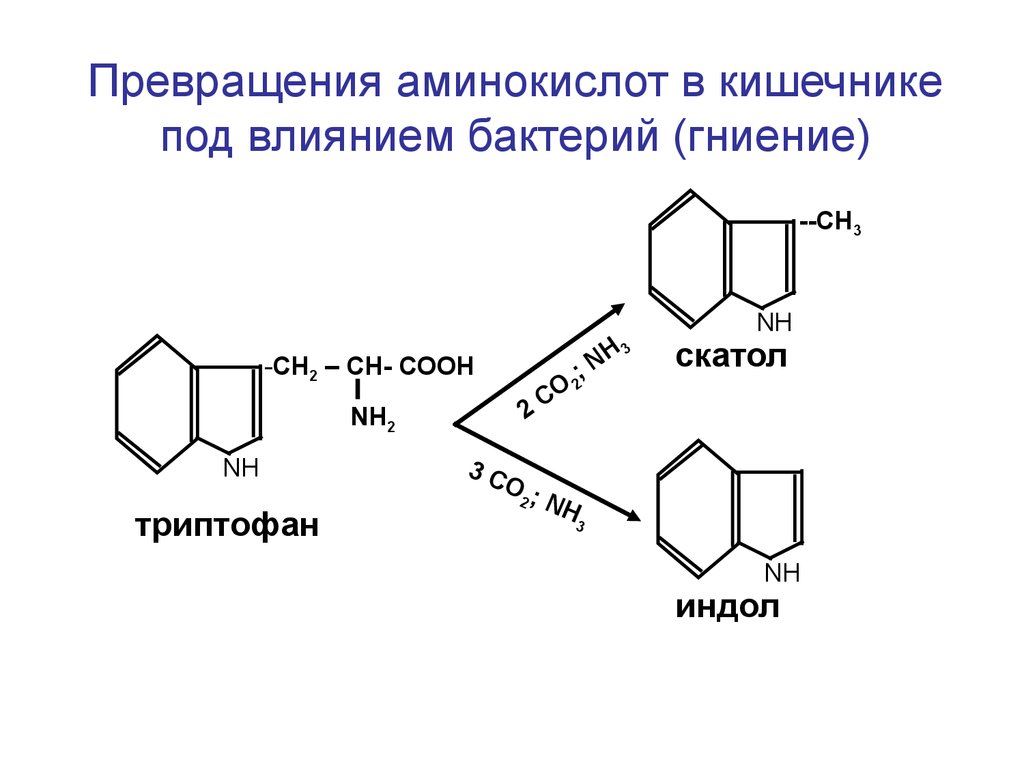
Превращения аминокислот в кишечникепод влиянием бактерий (гниение)
--СН3
NН
-СН2 – СН- СООН
NН2
NН
триптофан
H3
N
;
О2
С
2
скатол
3С
О;
2 N
H
3
NН
индол
32.
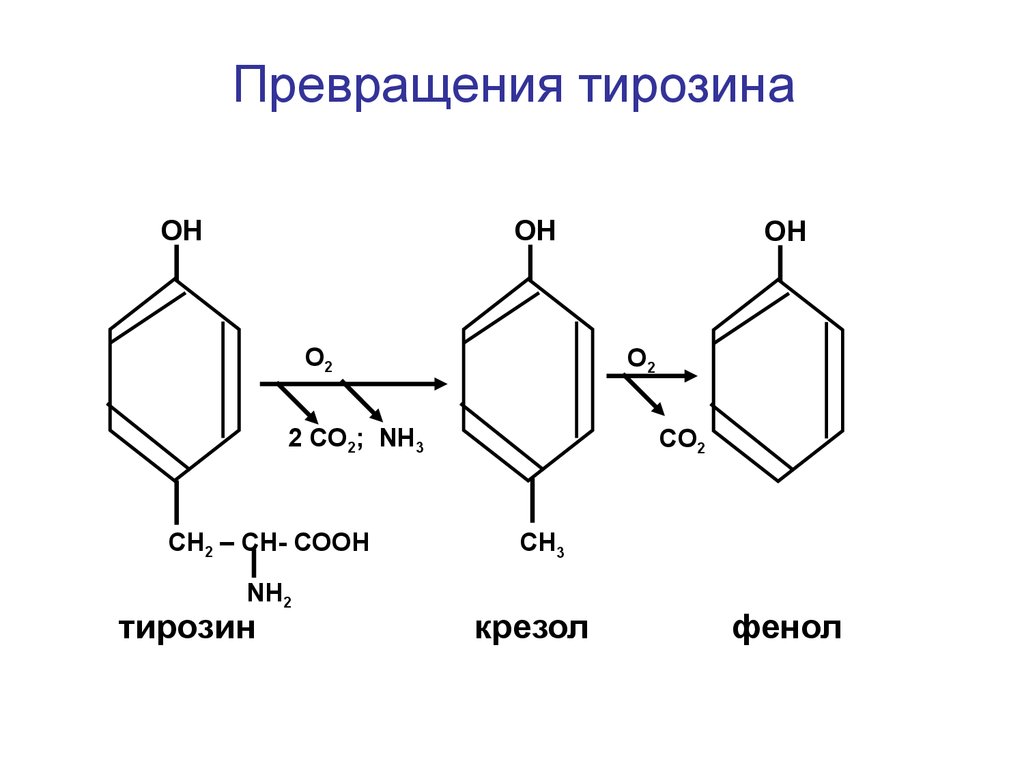
Превращения тирозинаОН
ОН
O2
O2
2 СО2; NH3
СН2 – СН- СООН
NН2
тирозин
ОН
CO2
СН3
крезол
фенол
33.
Превращения фенилаланинаO2
2 СО2; NH3
СН2 – СН- СООН
NН2
фенилаланин
СООН
бензойная кислота
34.
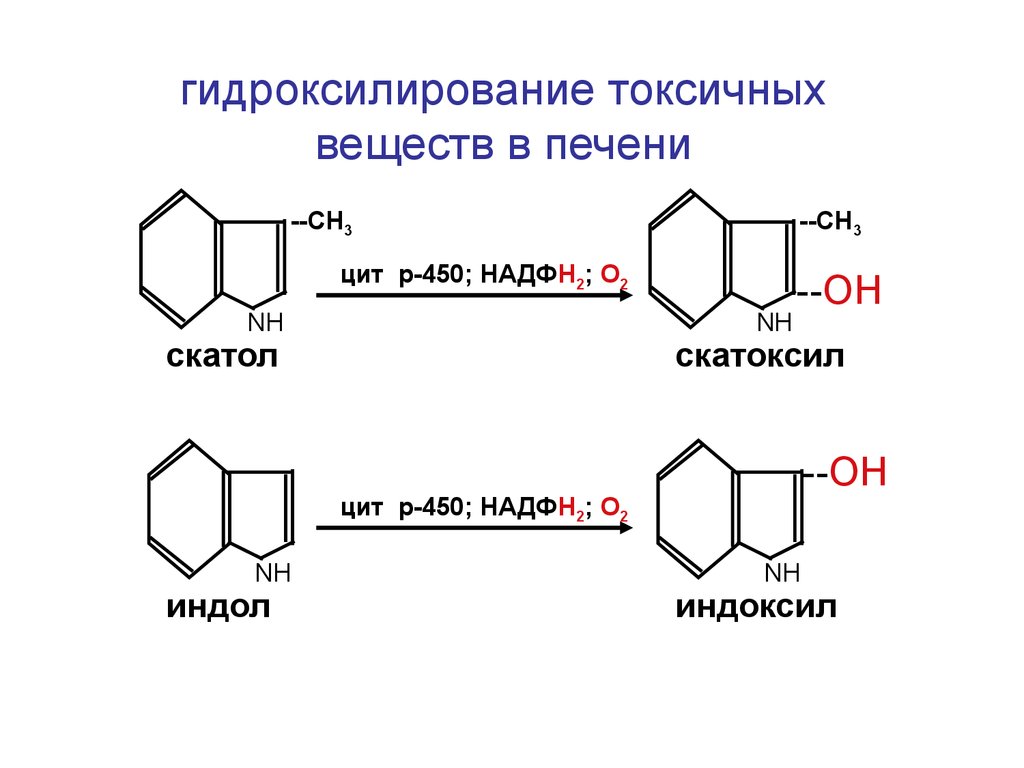
гидроксилирование токсичныхвеществ в печени
--СН3
--СН3
цит р-450; НАДФН2; О2
NН
NН
скатол
--ОН
скатоксил
--ОН
цит р-450; НАДФН2; О2
NН
индол
NН
индоксил
35.
инактивация глюкуроновой кислотойСООН
О
СООН
О
ОН
ОН
О
ОН
ОН
- Н2 О
ОН
ОН
УДФ
О
ОН
УДФ
фенилглюкуронид
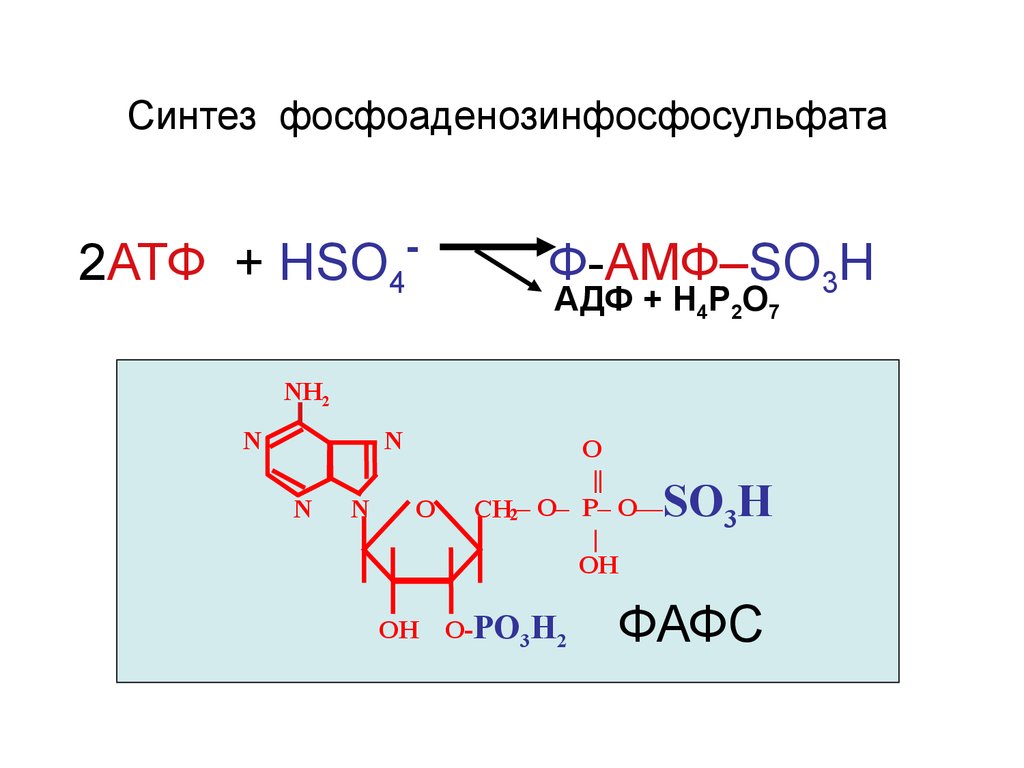
36.
Синтез фосфоаденозинфосфосульфата2АТФ + НSO4
-
Ф-АМФ–SO3H
АДФ + Н4Р2О7
NH2
N
N
N
N
O
ОН
О
||
CH2– O– P– O—
|
ОН
О-PO3H2
SO3H
ФАФС
37.
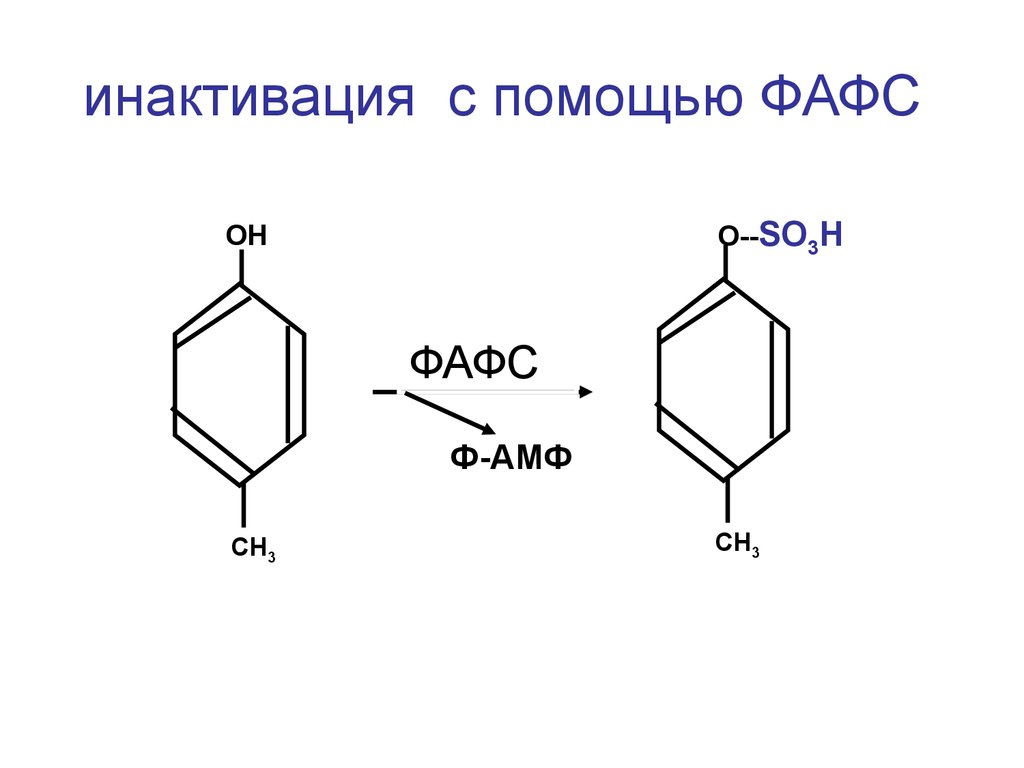
инактивация с помощью ФАФСО--SO3H
ОН
ФАФС
Ф-АМФ
СН3
СН3
38.
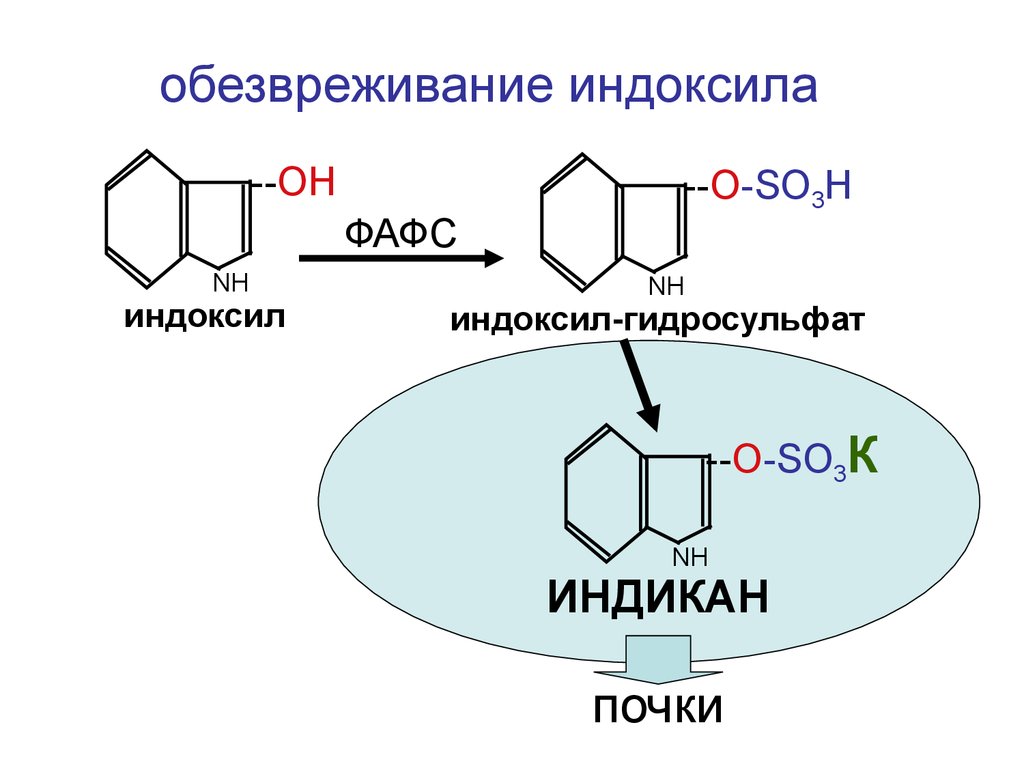
обезвреживание индоксила--ОН
ФАФС
NН
индоксил
--О-SO3H
NН
индоксил-гидросульфат
--О-SO3К
NН
ИНДИКАН
почки
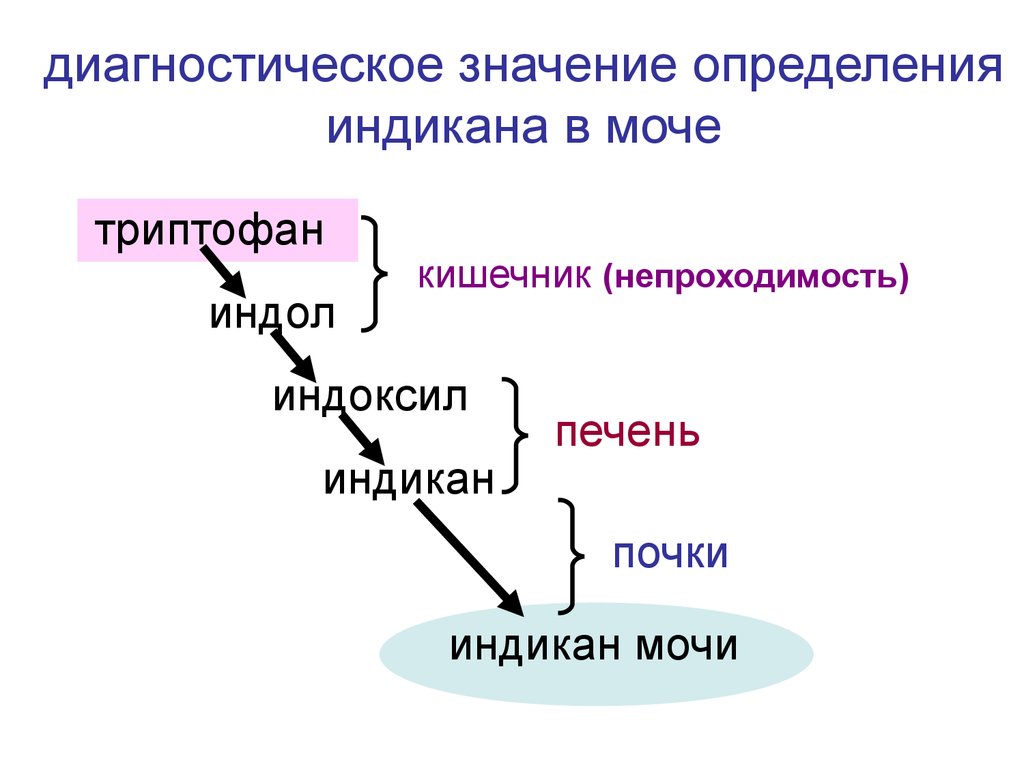
39.
диагностическое значение определенияиндикана в моче
триптофан
индол
кишечник (непроходимость)
индоксил
индикан
печень
почки
индикан мочи
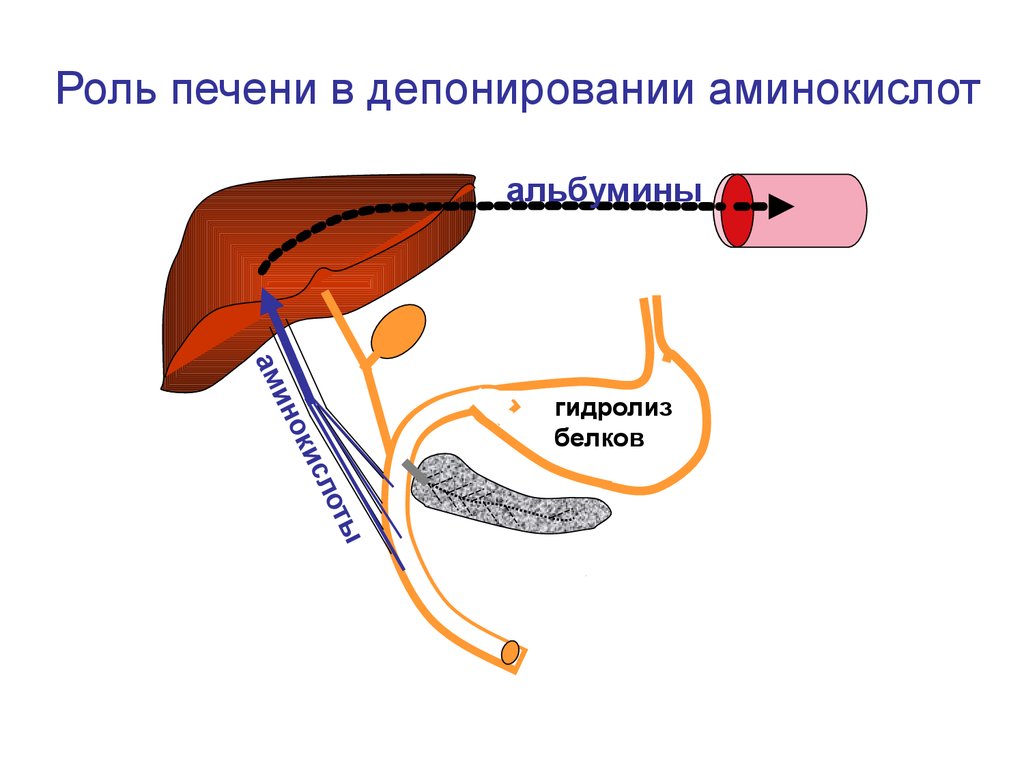
40.
Роль печени в депонировании аминокислотальбумины
и
ок
ин
ам
гидролиз
белков
оты
сл
41. Роль альбумина
• Запасной источник аминокислотКомпонент буферной системы
Осмотически активный белок
Переносчик жирных кислот
Переносчик жирорастворимых витаминов
Переносчик жирорастворимых гормонов
Са-связывающий белок в сыворотке крови
42.
Какому больному можно сделать операцию?Больной № 1
Больной № 2
Общий белок – 65 г/л Общий белок – 68 г/л
Альбумины - 40 г/л
- глобулины – 18 г/л
Альбумины - 60 г/л
- глобулины – 11 г/л
43.
Многие белки требуютдостраивания.
В аппарат
Гольджи
44.
Образование функционально-активныхмолекул белков
Удаление “лишних”
аминокислот или
участков белка
НАД (ФАД)
Модифицированные углеводы
Образование
олигомерных белков
металлы
Фосфорилирование
45.
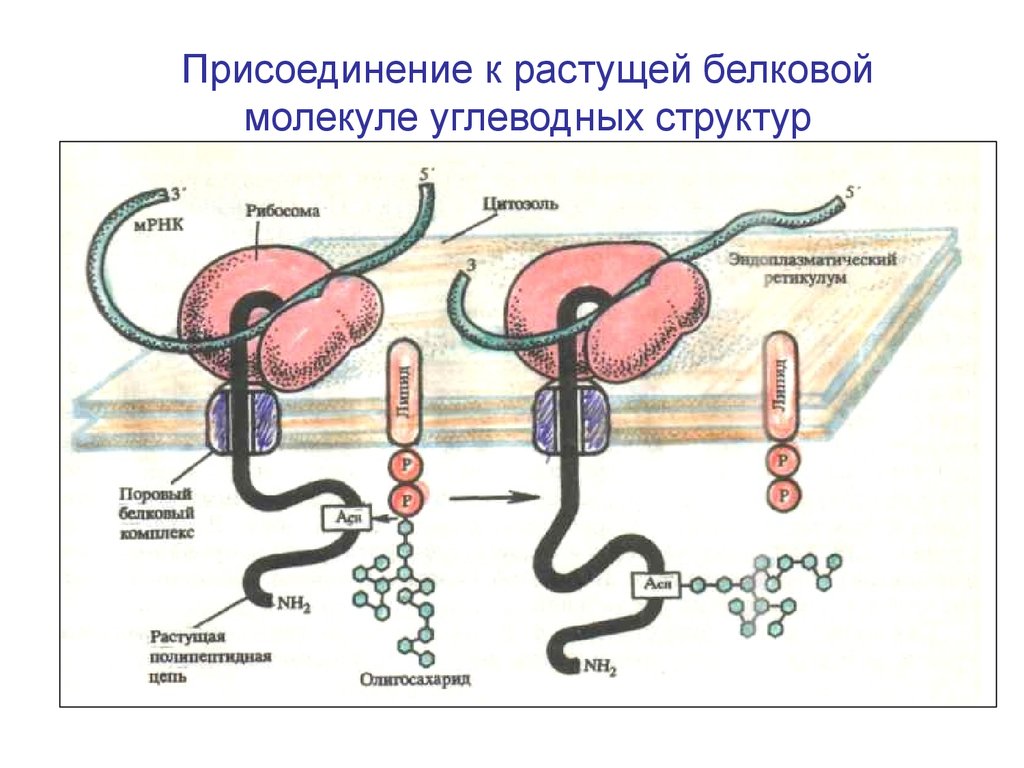
Присоединение к растущей белковоймолекуле углеводных структур
46.
Ингибиторы биосинтеза белковПуромицин
Связывается с аминоацильным центром.
Актиномицин Д
Доксорубицин
Внедряются между парами оснований ДНК и
нарушают репликацию и транскрипцию
Тетрациклин
связывается с малой субъединицей
рибосомы и блокирует А-центр
Левомицетин
ингибитор пептидилтрансферазы в большой
субъединице рибосомы
Эритромицин
ингибитор транслокации
Стрептомицин
ингибитор стадии инициации
Пенициллин
нарушает образование поперечных связей в
белках бактерий
47.
Пути превращений аминокислот в клетке1.Реакции поликонденсации
2.Реакции трансаминирования
3.Реакции декарбоксилирования
4.Реакции окислительного
дезаминирования
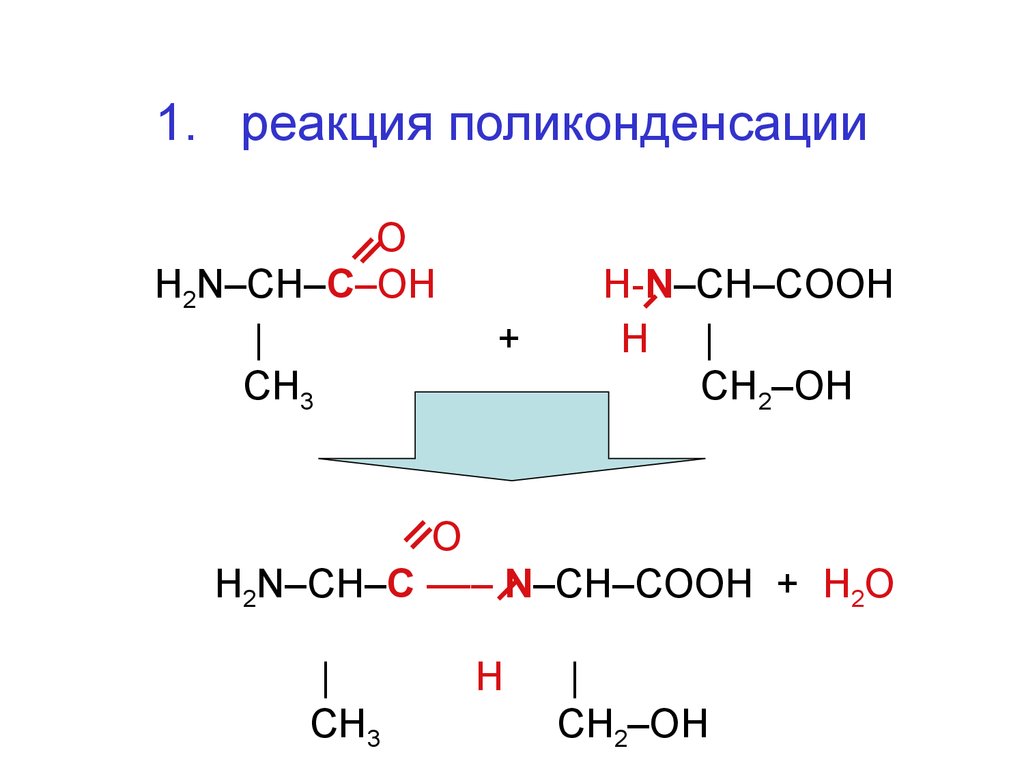
48. 1. реакция поликонденсации
ОH2N–CH–C–OH
|
СН3
+
H-N–CH–CООH
H |
СН2–ОН
О
H2N–CH–C ––– N–CH–CОOH + Н2О
|
СН3
H
|
СН2–ОН
49.
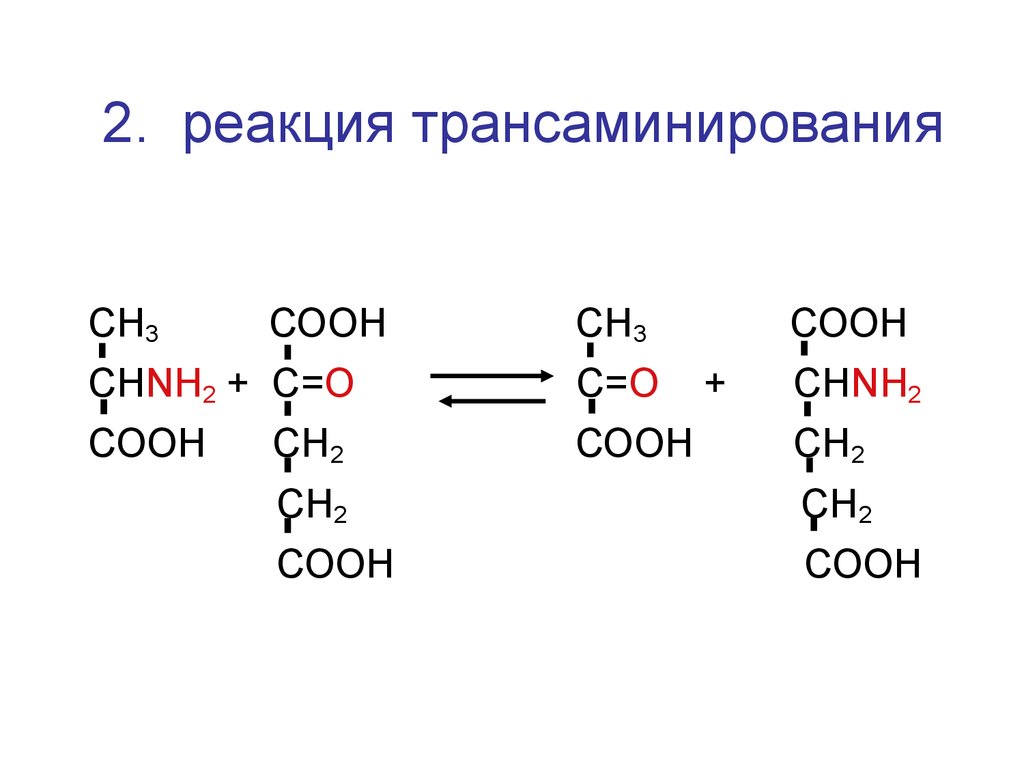
2. реакция трансаминированияСН3
СООН
СН3
СНNH2 + C=О
С=О
СООН
СООН
СН2
СООН
+
СНNH2
СН2
СН2
СН2
СООН
СООН
50.
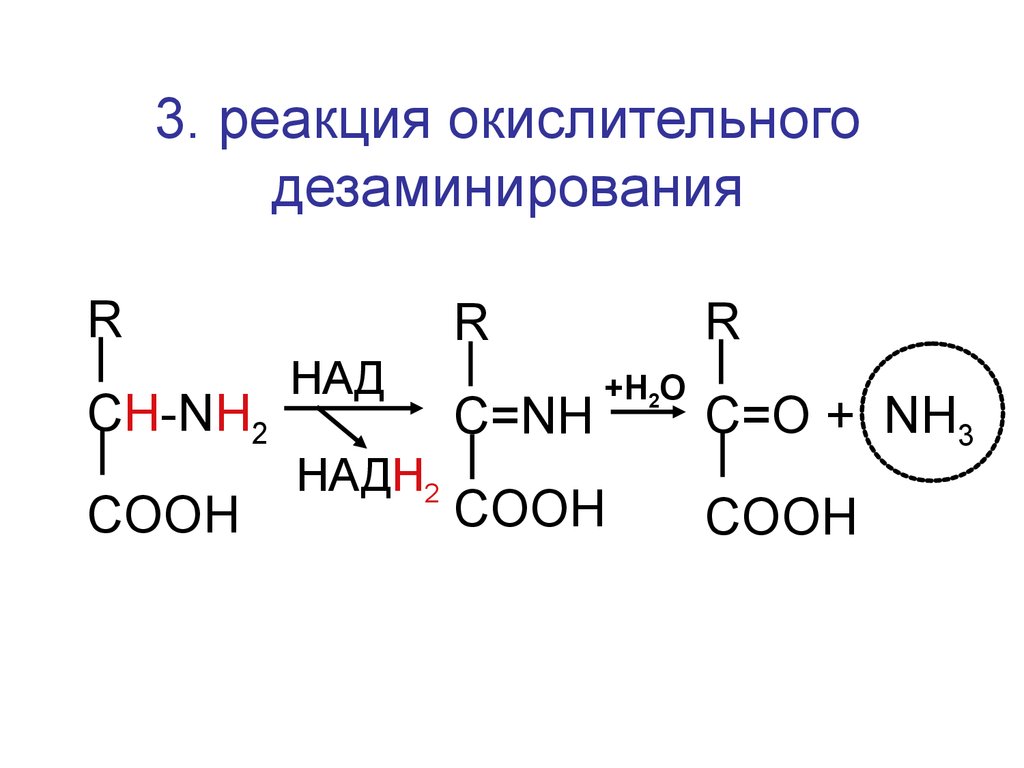
3. реакция окислительногодезаминирования
R
CH-NH2
COOH
R
R
HАД
HАДН2
C=NH
+Н2О
COOH
C=O + NH3
COOH
51.
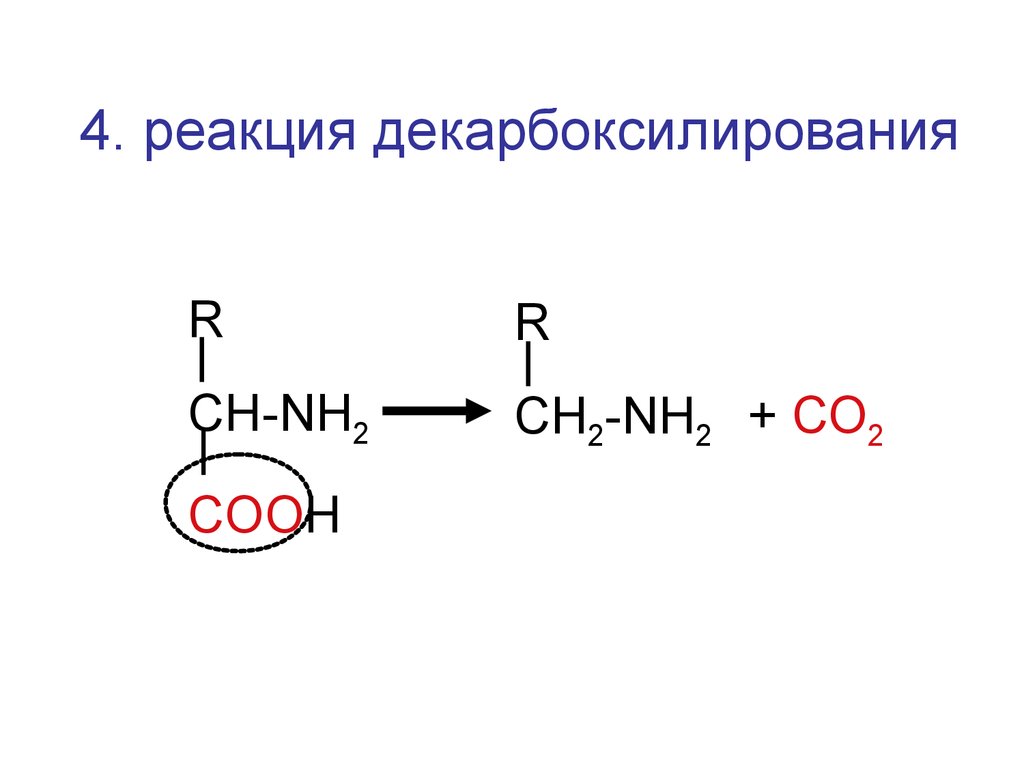
4. реакция декарбоксилированияR
R
CH-NH2
CН2-NH2 + СО2
COOH
52.
Биосинтезбелка в
клетке
53.
Перечень веществ, необходимых длясинтеза белка
1. и-РНК (зрелая)
2. т-РНК ( 61)
3. 20 аминокислот
4. АТФ, ГТФ
5. Ферменты
6. Небелковые компоненты
7. Рибосомы
54.
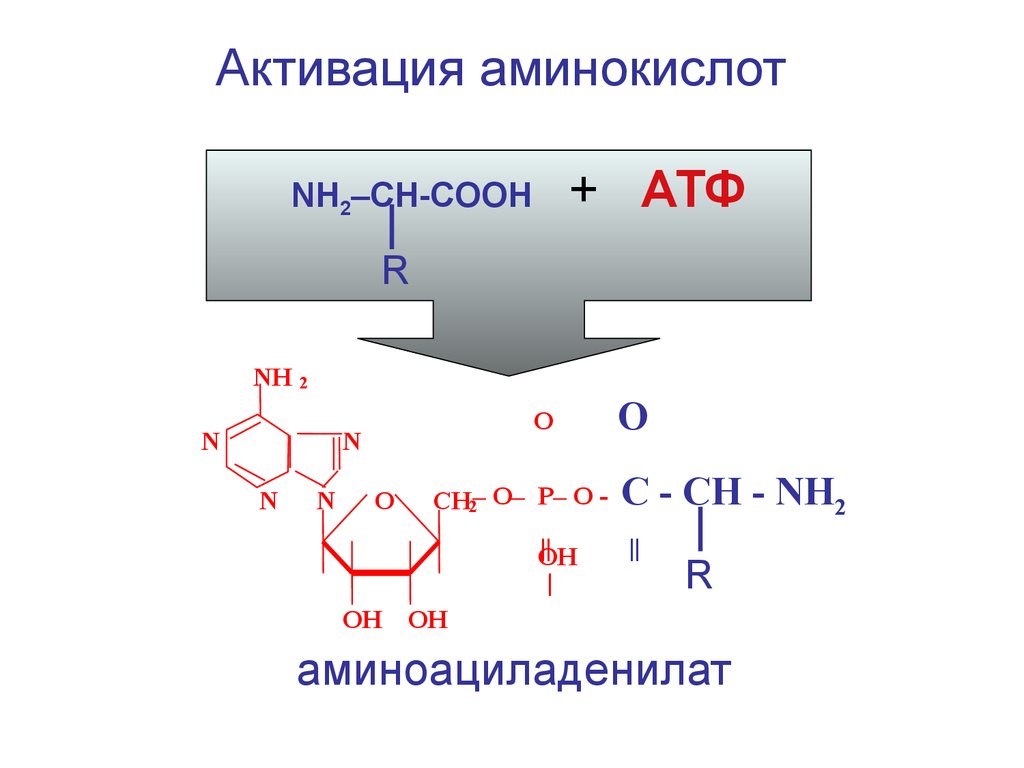
Активация аминокислот+ АТФ
NH2–CH-COOH
R
NH
2
N
O
N
N
N
O
CH2– O– P– O ||
ОН
|
ОН
O
C - CH - NH2
||
R
ОН
аминоациладенилат
55.
роль АРС-азы (аминоацил-тРНК-синтетазы) в“узнавании” аминокислот своей т-РНК
H2N – CH – CO-O-АМФ
R
НS
Ц-Ц-А
т-РНК
HS
АРС-аза
56.
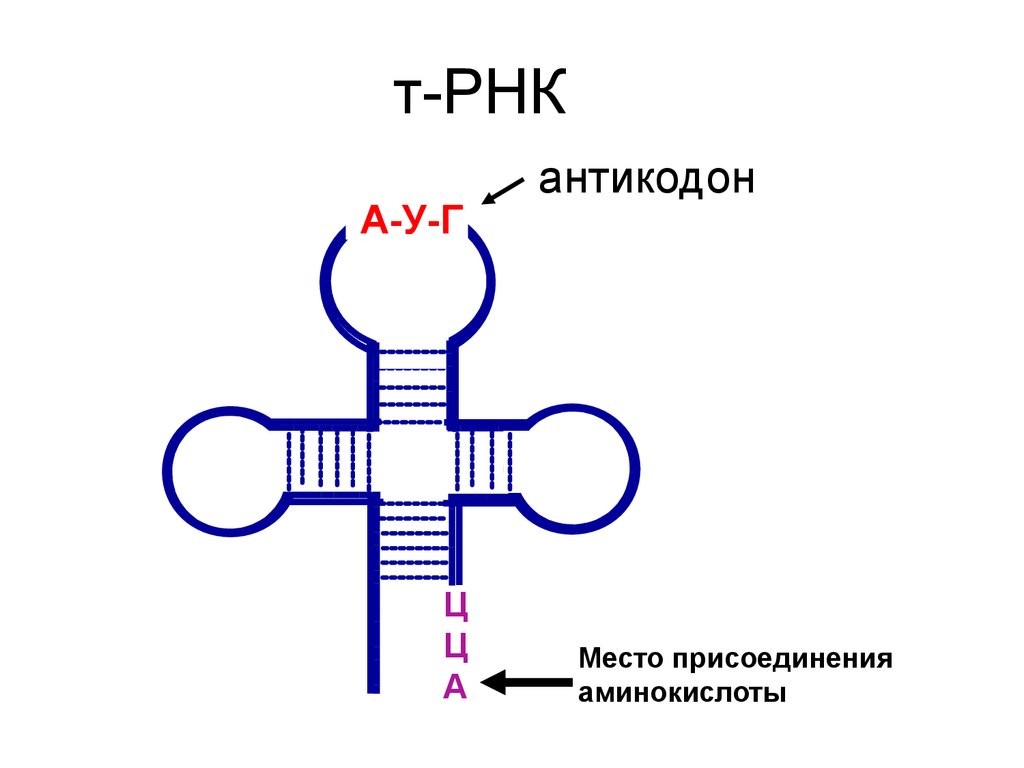
т-РНКА-У-Г
Ц
Ц
А
антикодон
Место присоединения
аминокислоты
57.
Образование комплексатРНК-аминоацил - РСА-аза
H2N – CH – CO
R
Ц-Ц-А
S
S
58.
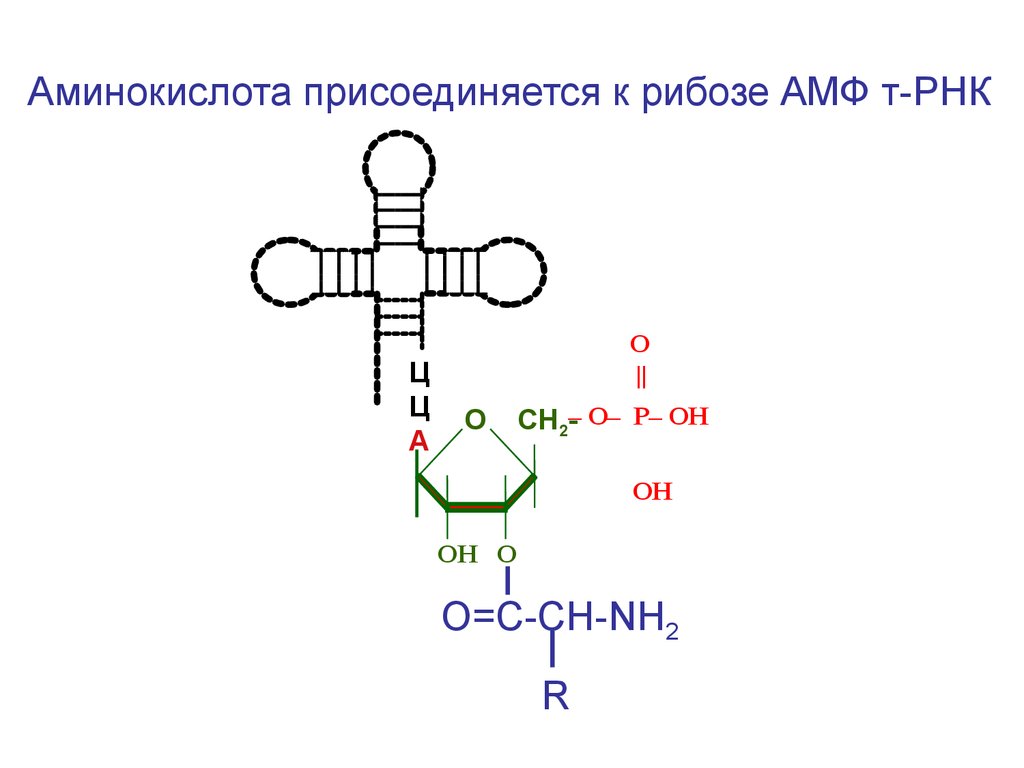
Аминокислота присоединяется к рибозе АМФ т-РНКЦ
Ц
А
O
||
О
СН2-– O– P– OН
ОН
ОН О
О=С-СН-NH2
R
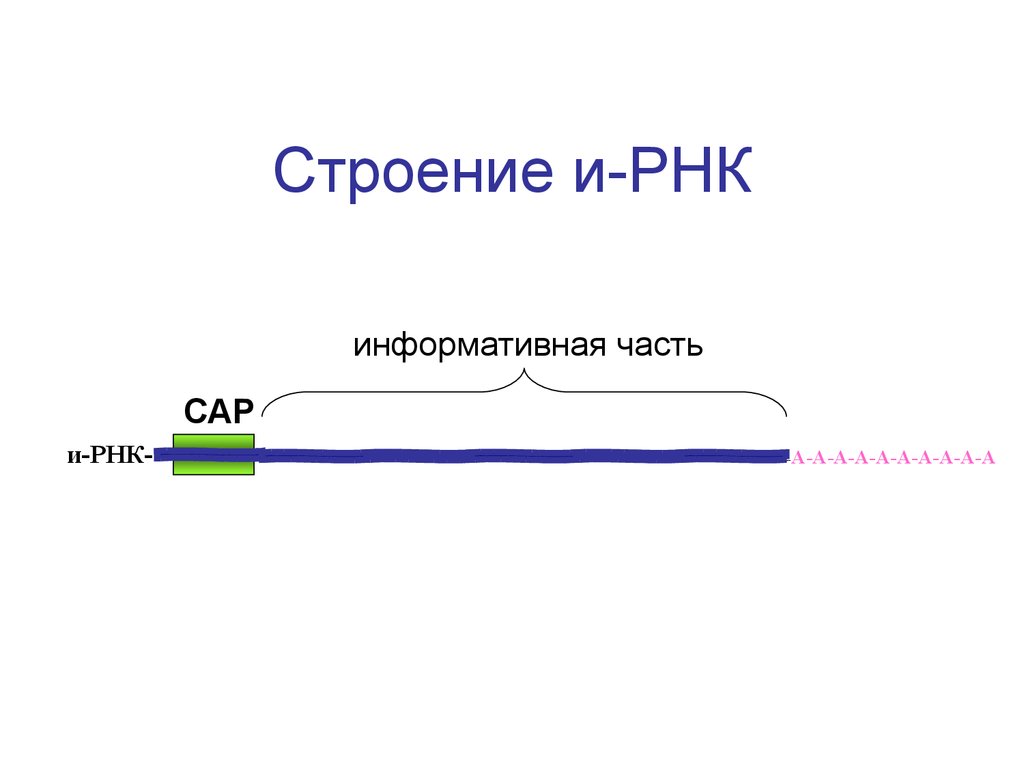
59. Строение и-РНК
информативная частьСАР
и-РНК-
-А-А-А-А-А-А-А-А-А-А
60.
Стадии синтеза белка1.образование инициирующего
комплекса;
2.элонгация (удлинение
полипептидной цепи);
3.терминация (завершение синтеза);
4.процессинг (окончательное
достраивание молекулы белка).
61.
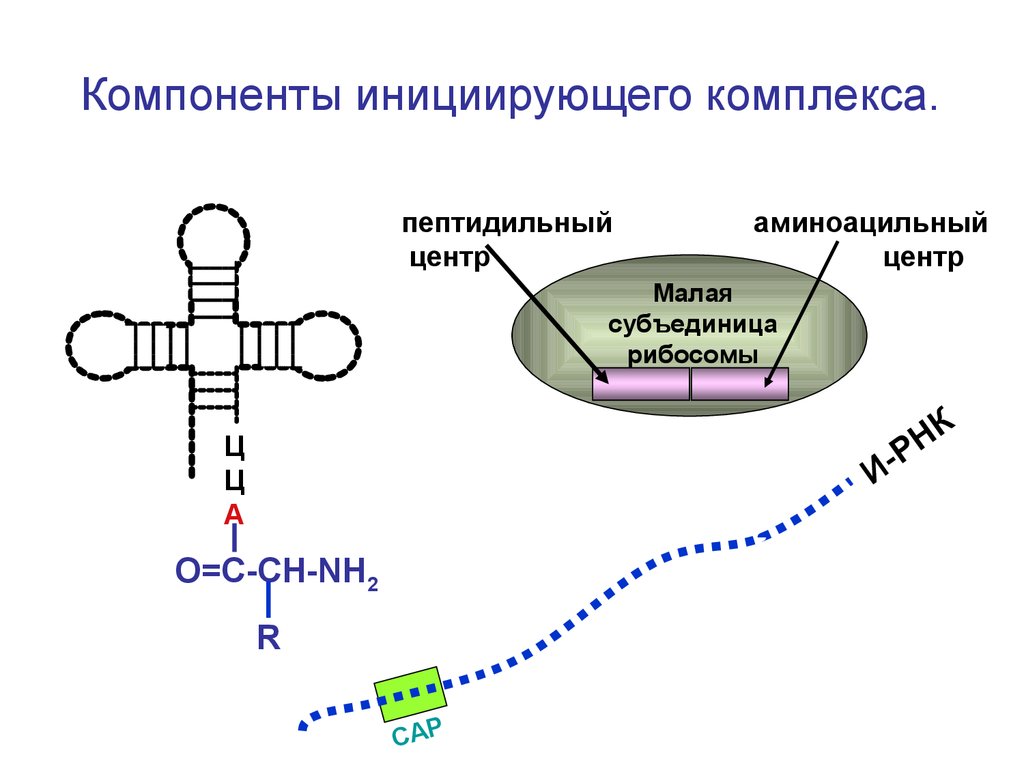
Компоненты инициирующего комплекса.пептидильный
центр
аминоацильный
центр
Малая
субъединица
рибосомы
К
Н
Р
И
Ц
Ц
А
О=С-СН-NH2
R
СAP
62.
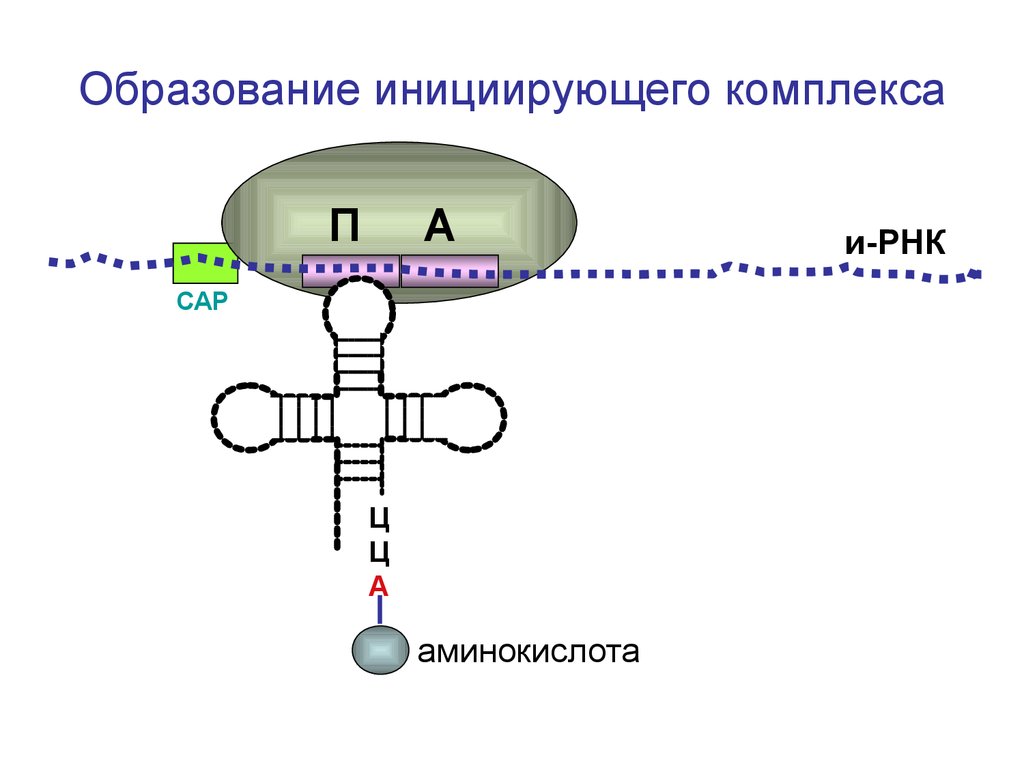
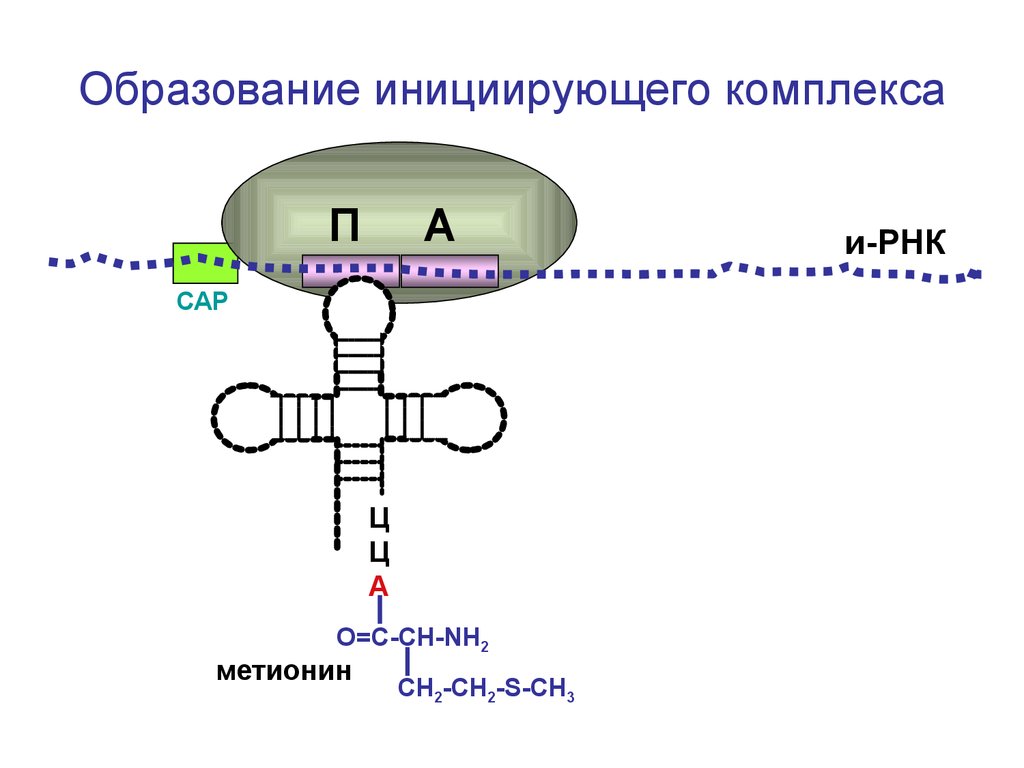
Образование инициирующего комплексаП
А
СAP
Ц
Ц
А
О=С-СН-NH2
метионин
СН2-СН2-S-CH3
и-РНК
63.
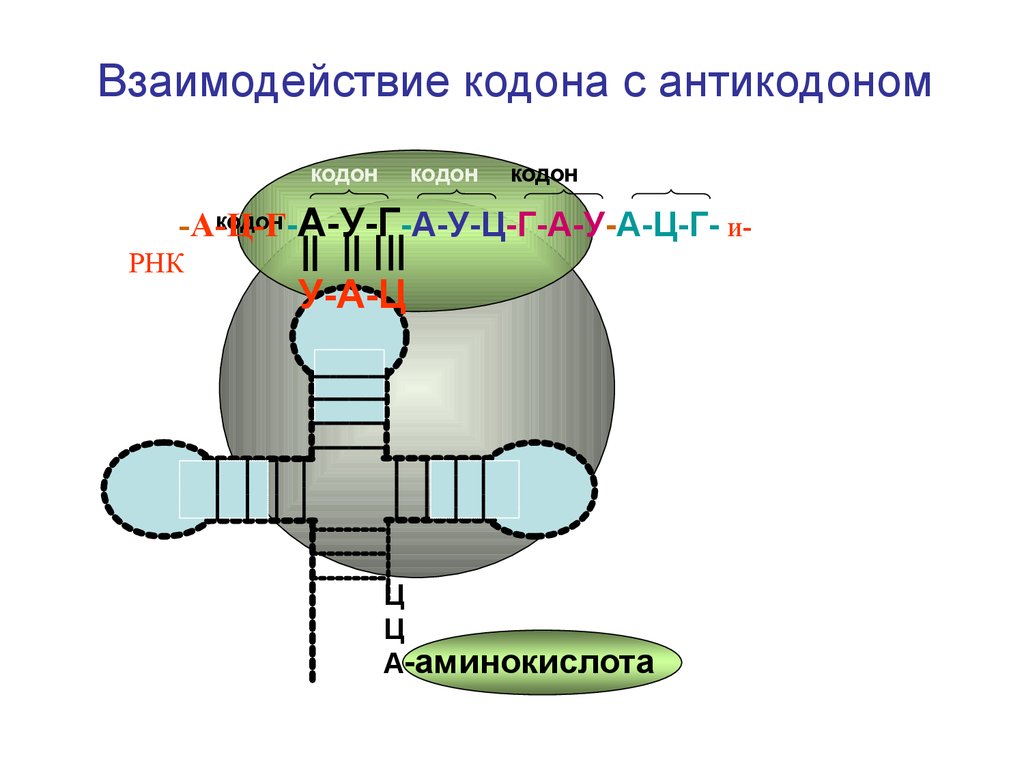
Взаимодействие кодона с антикодономкодон
кодон
кодон
кодон А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г- и-А-Ц-Г-
РНК
У-А-Ц
Ц
Ц
А-аминокислота
64.
Биосинтезбелка
65.
Образование инициирующего комплексаП
А
СAP
Ц
Ц
А
аминокислота
и-РНК
66.
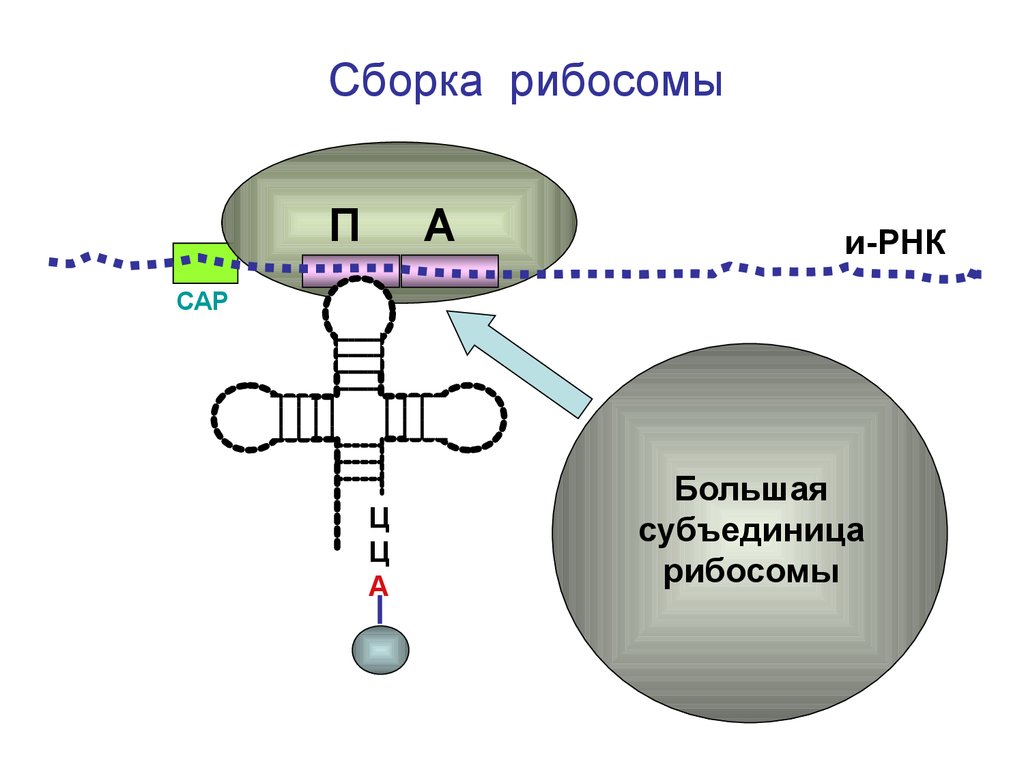
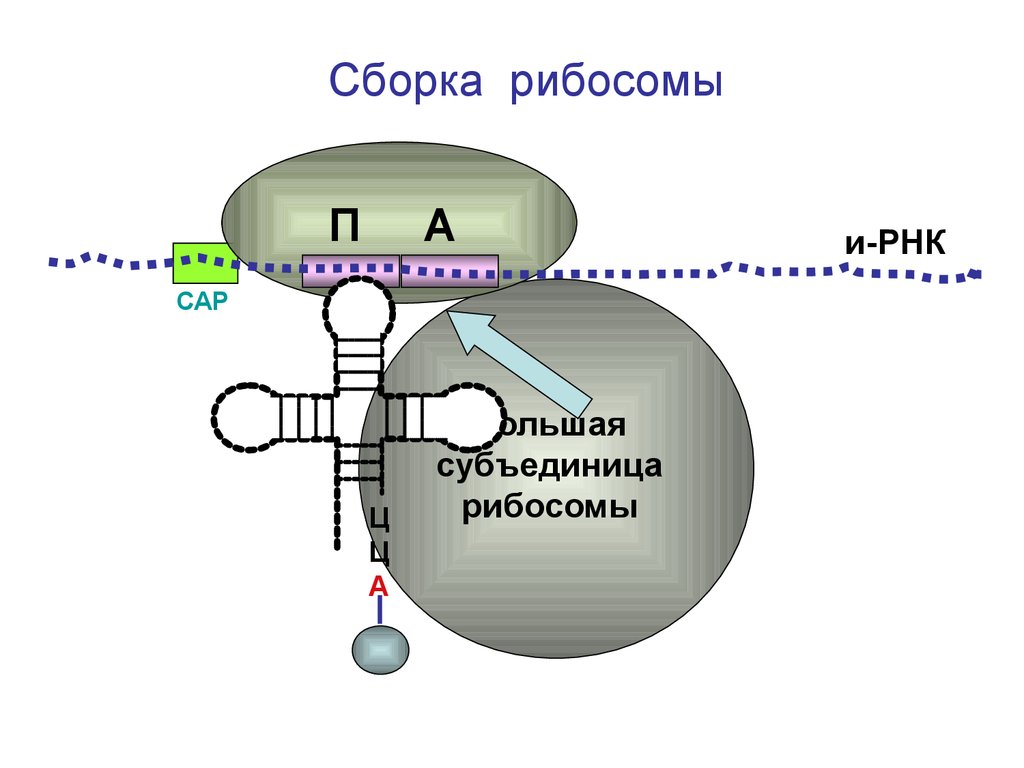
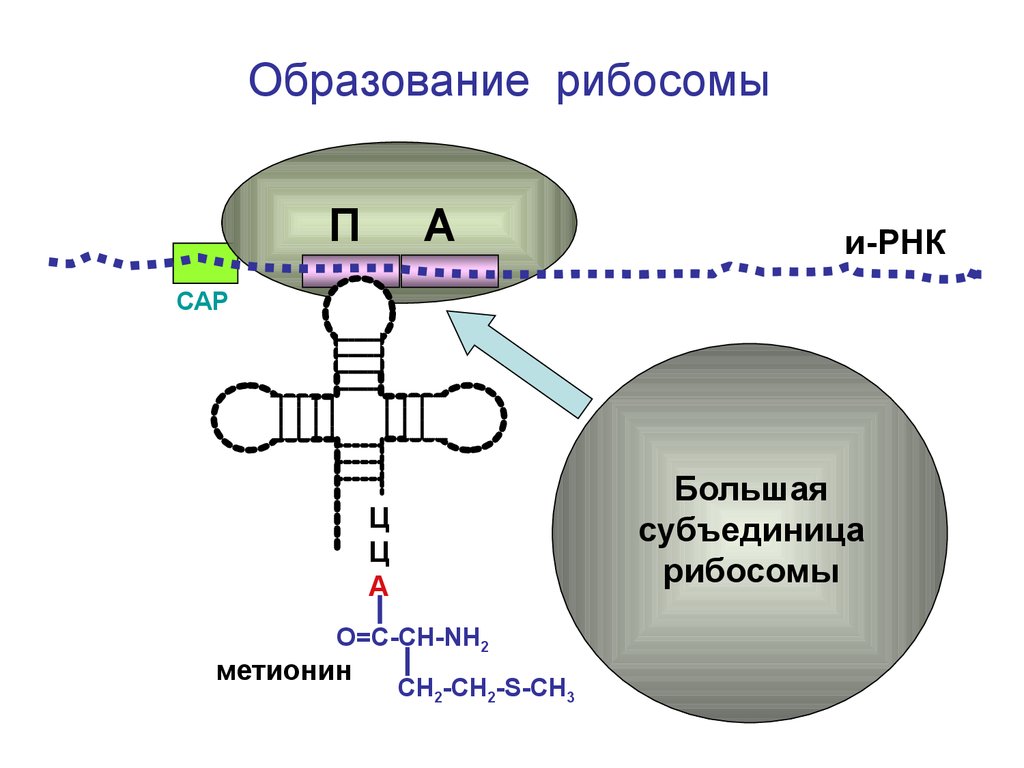
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
67.
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
68.
Сборка рибосомыП
А
и-РНК
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
69.
Сборка рибосомыП
А
СAP
Ц
Ц
А
Большая
субъединица
рибосомы
и-РНК
70.
Сборка рибосомыП
А
СAP
Большая
субъединица
рибосомы
Ц
Ц
А
и-РНК
71.
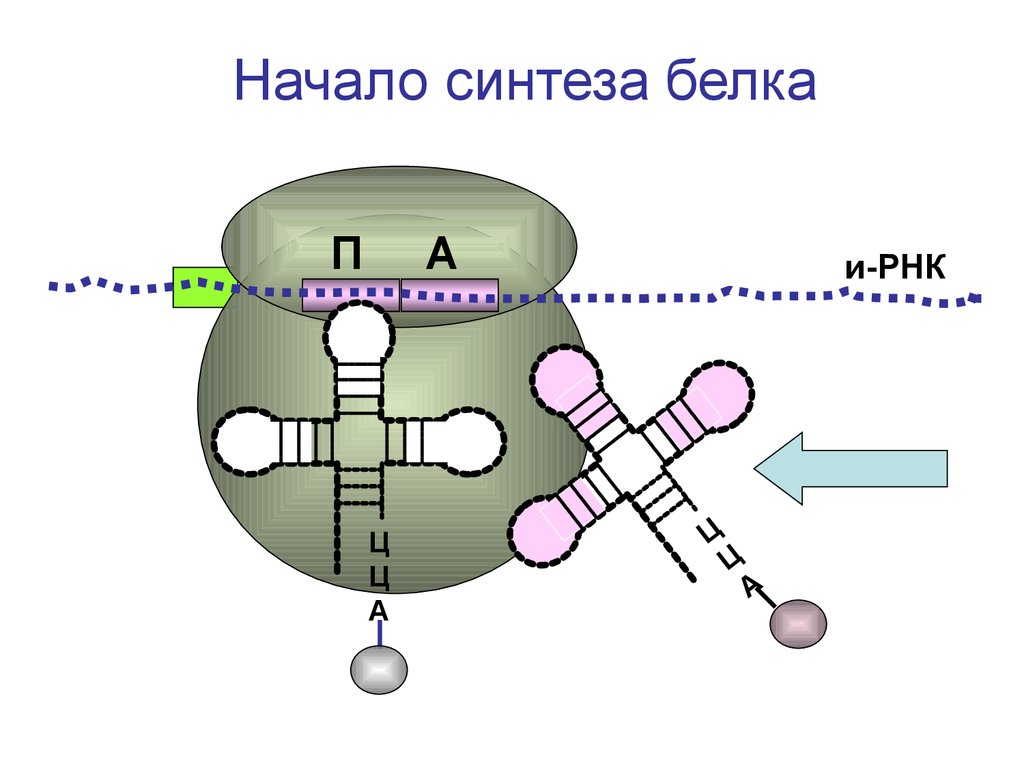
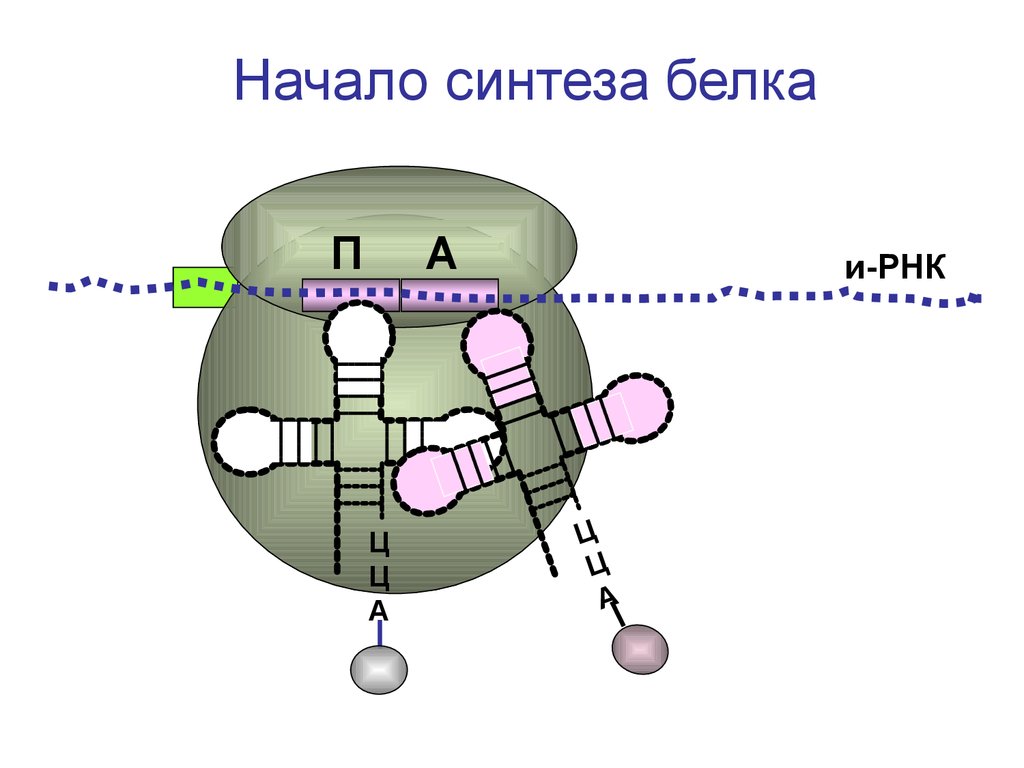
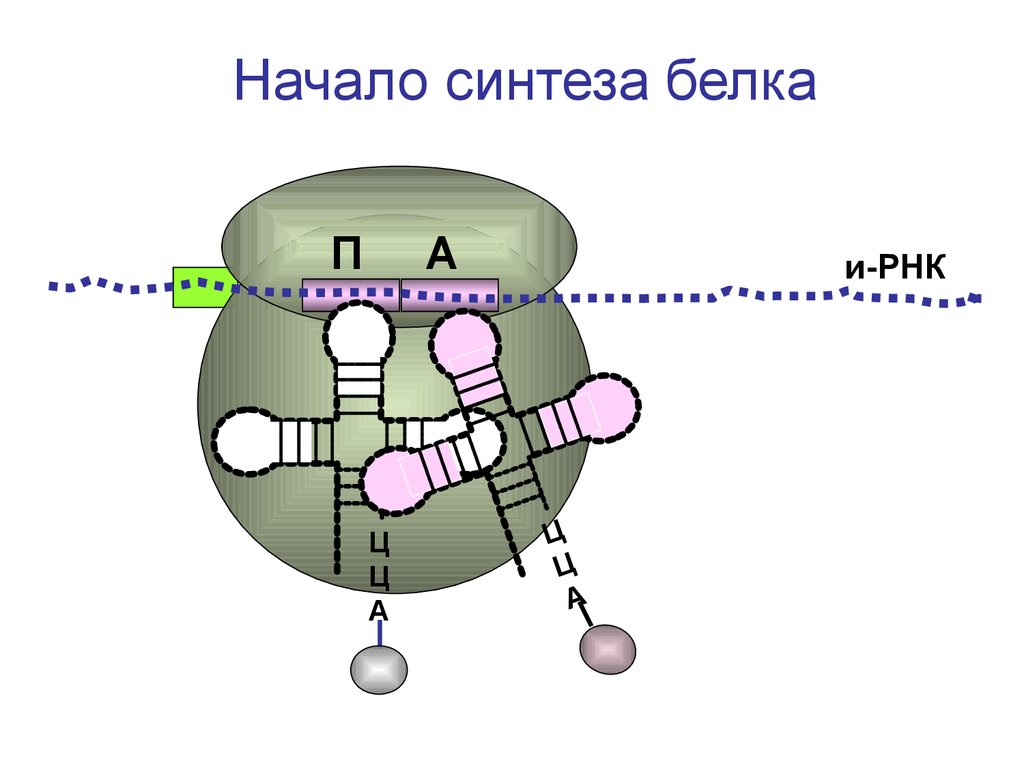
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
72.
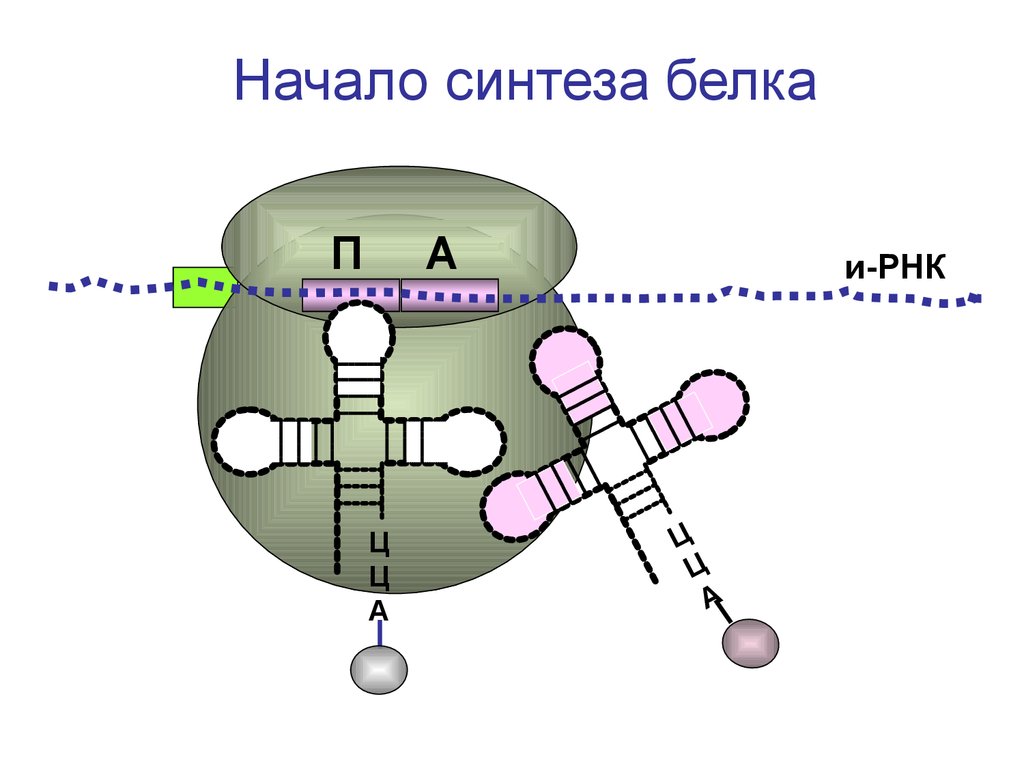
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
73.
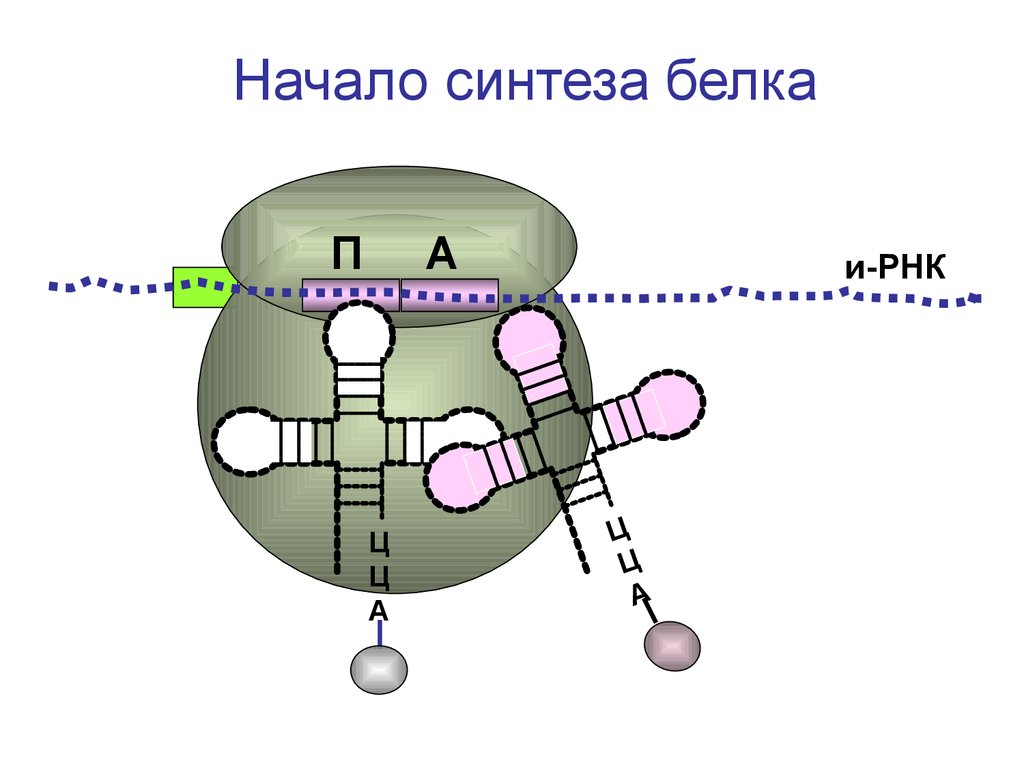
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
74.
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
75.
Начало синтеза белкаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
76.
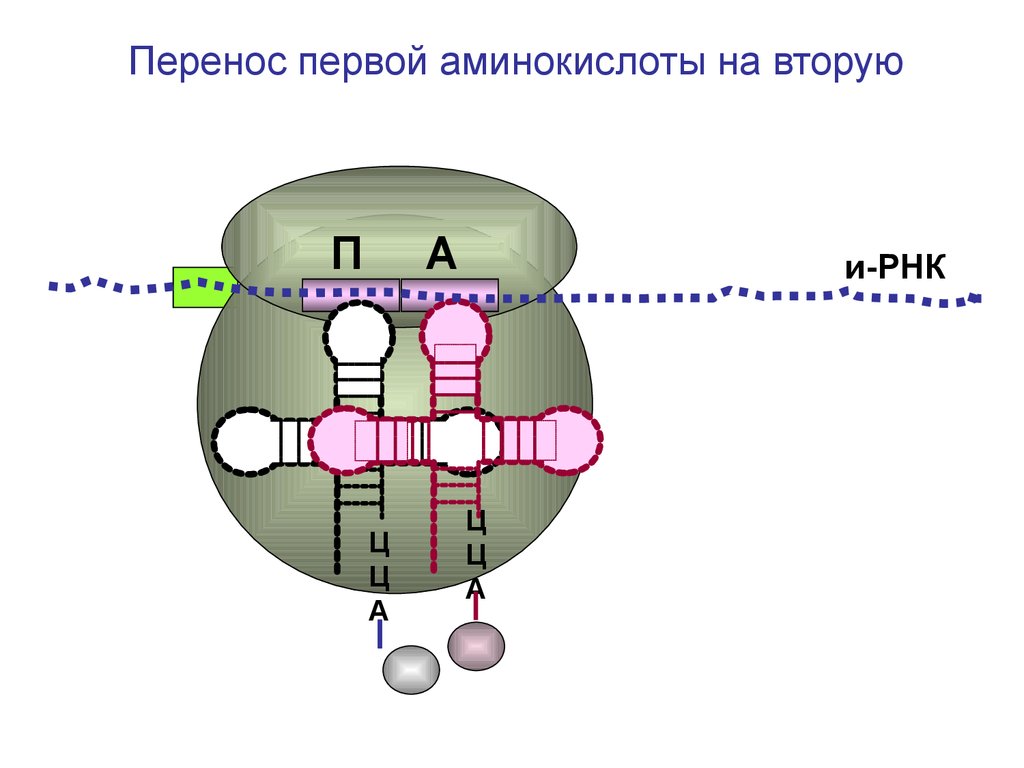
Перенос первой аминокислоты на вторуюП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
77.
Перенос первой аминокислоты на вторуюП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
78.
Образование дипептидаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
79.
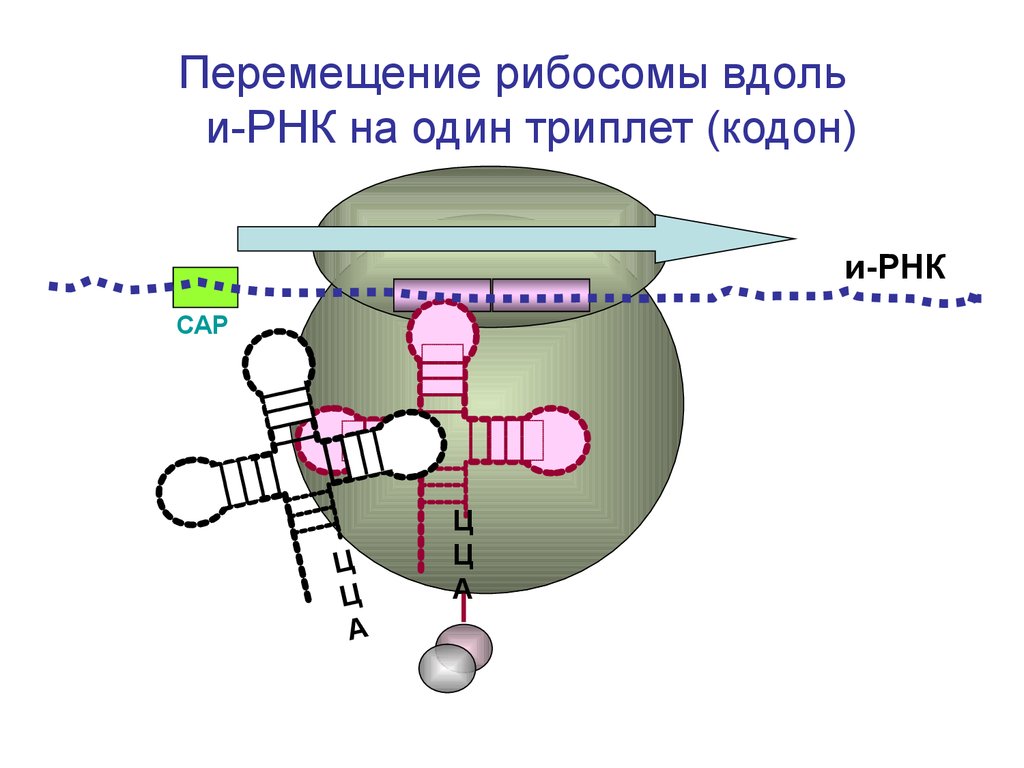
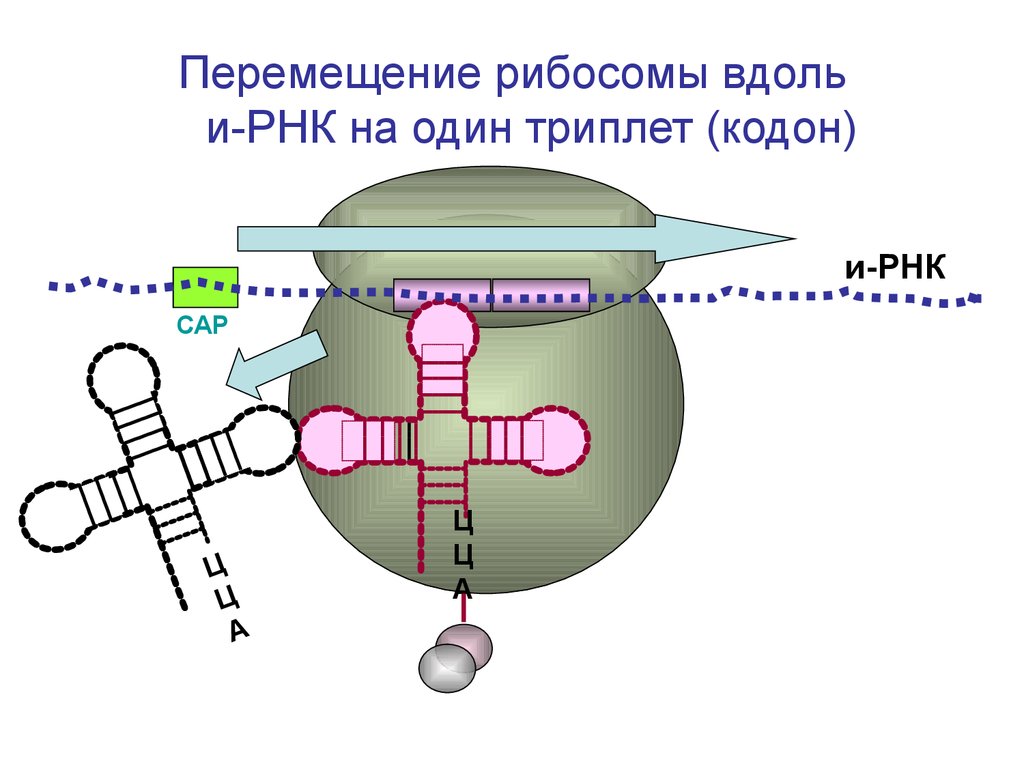
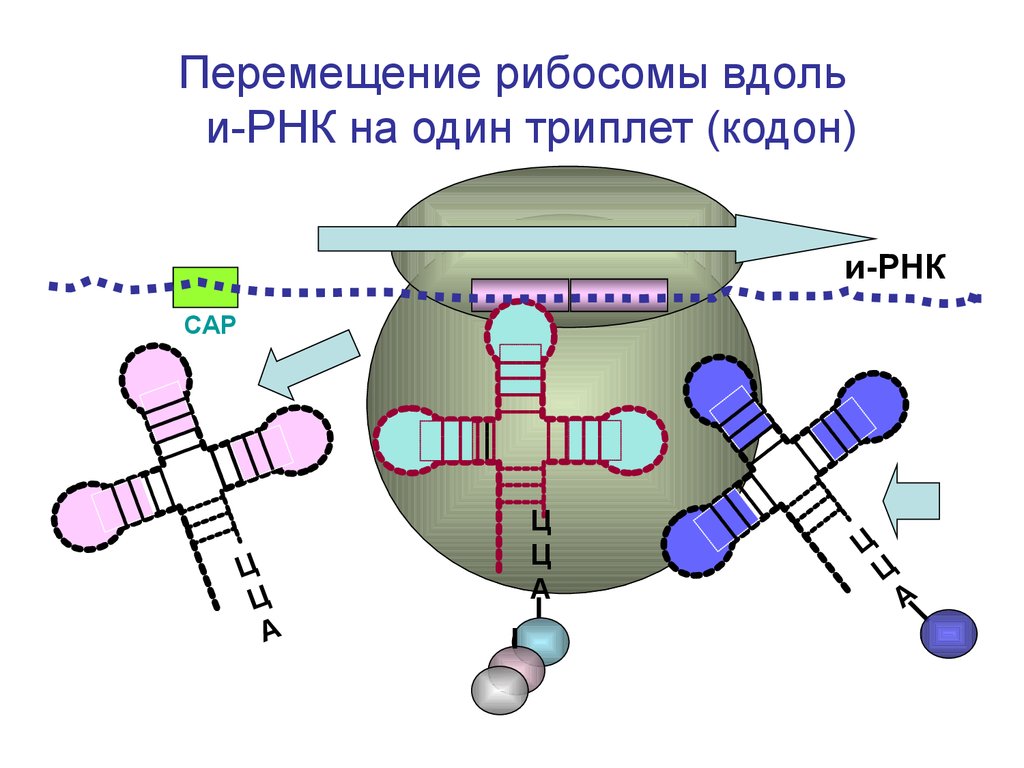
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
80.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
81.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
82.
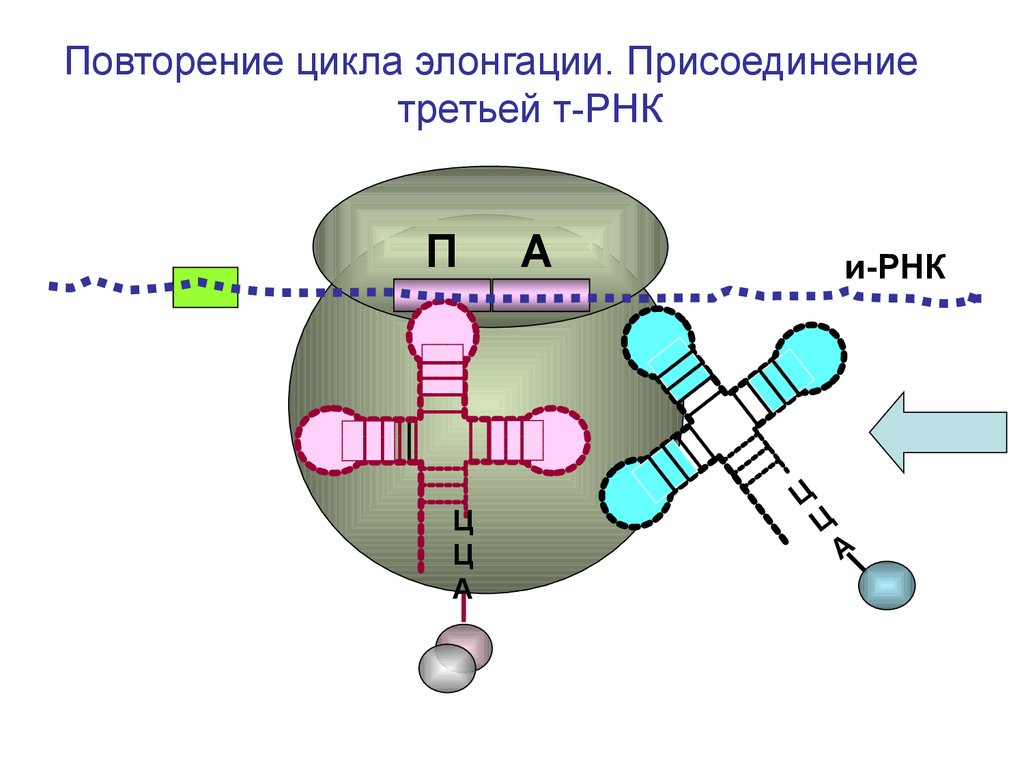
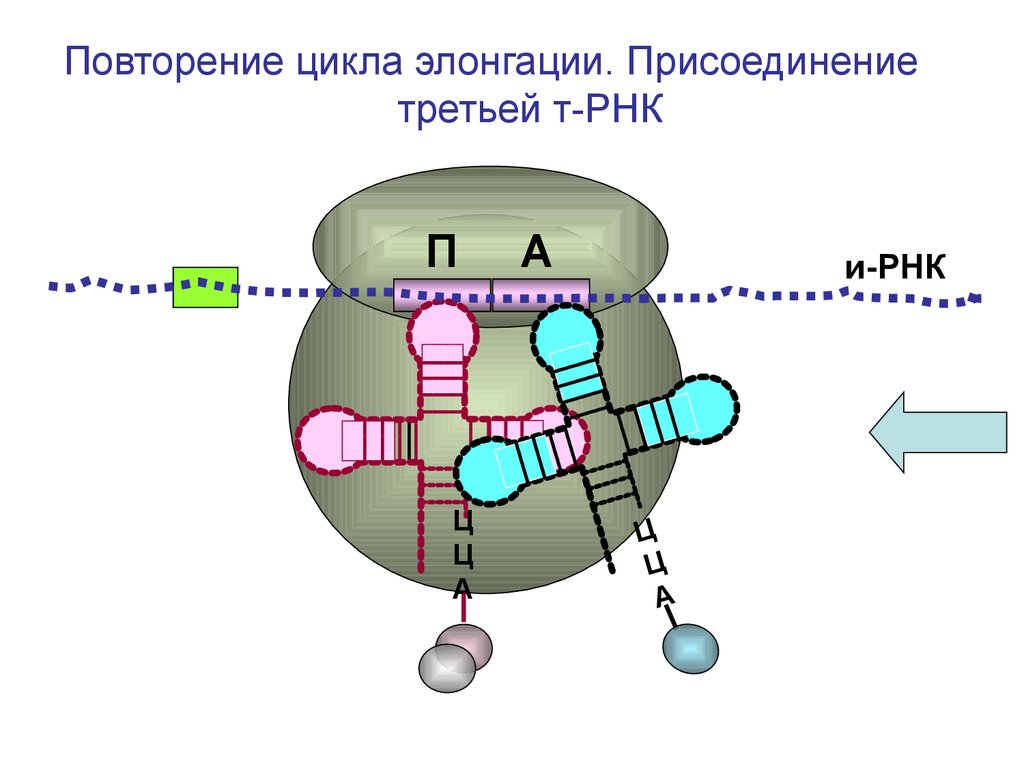
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
Ц
Ц
А
83.
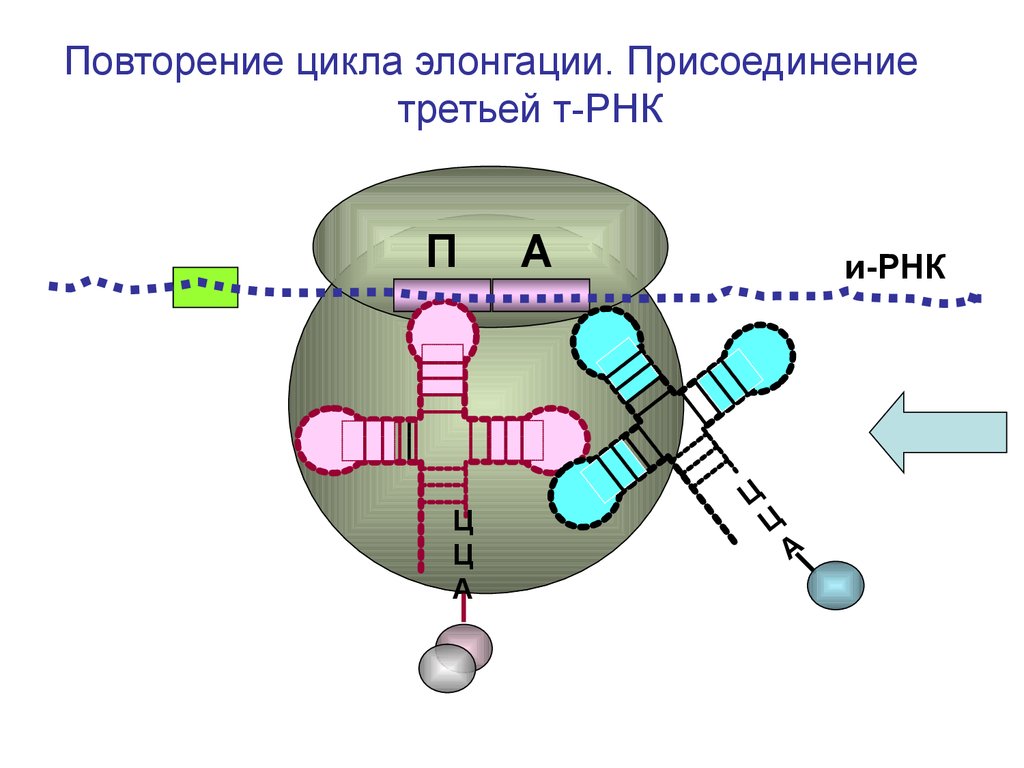
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
Ц
Ц
А
84.
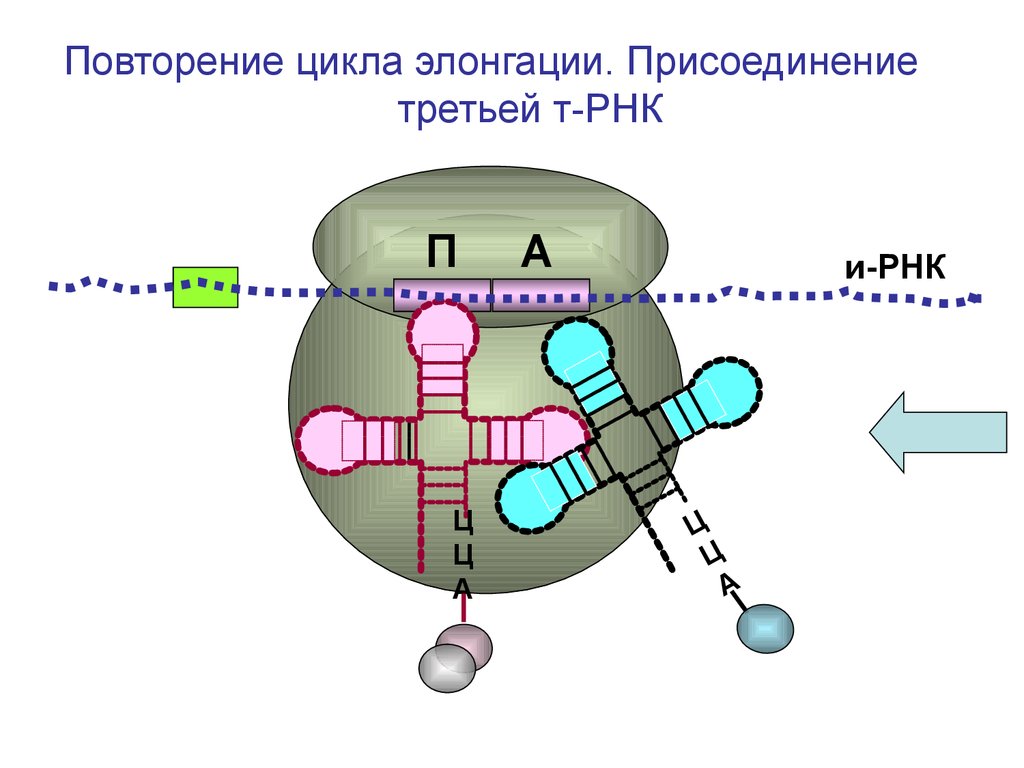
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
Ц
Ц
А
85.
Повторение цикла элонгации. Присоединениетретьей т-РНК
П
Ц
Ц
А
А
и-РНК
Ц
Ц
А
86.
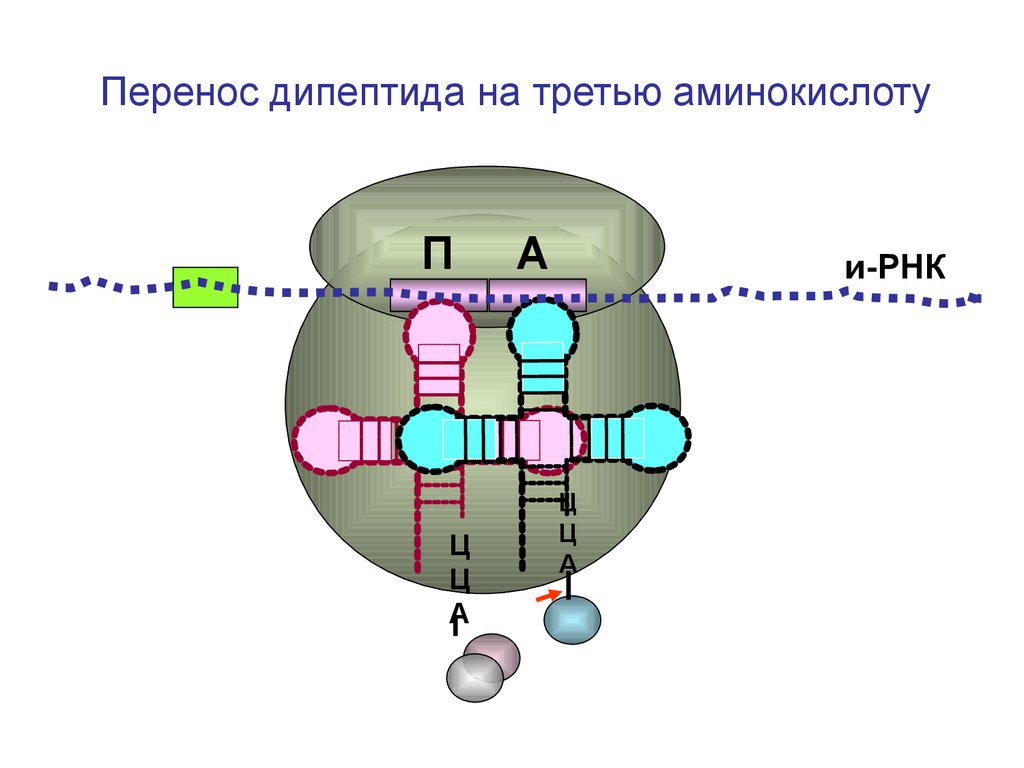
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
Ц
Ц
А
87.
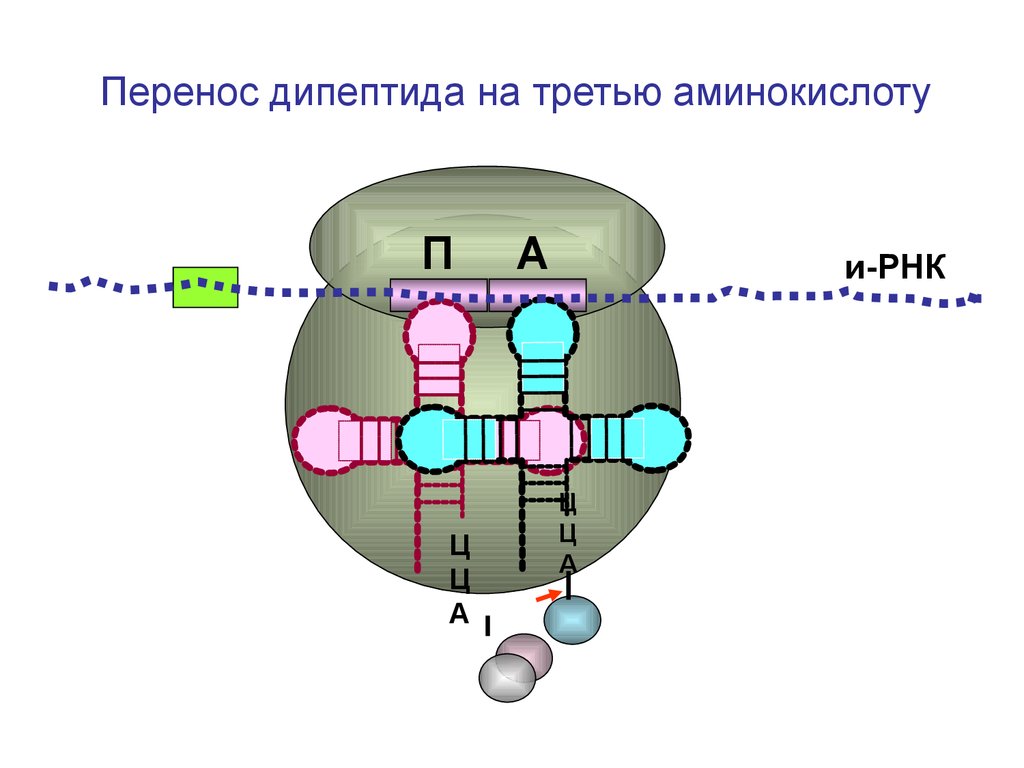
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
Ц
Ц
А
88.
Перенос дипептида на третью аминокислотуП
Ц
Ц
А
А
и-РНК
Ц
Ц
А
89.
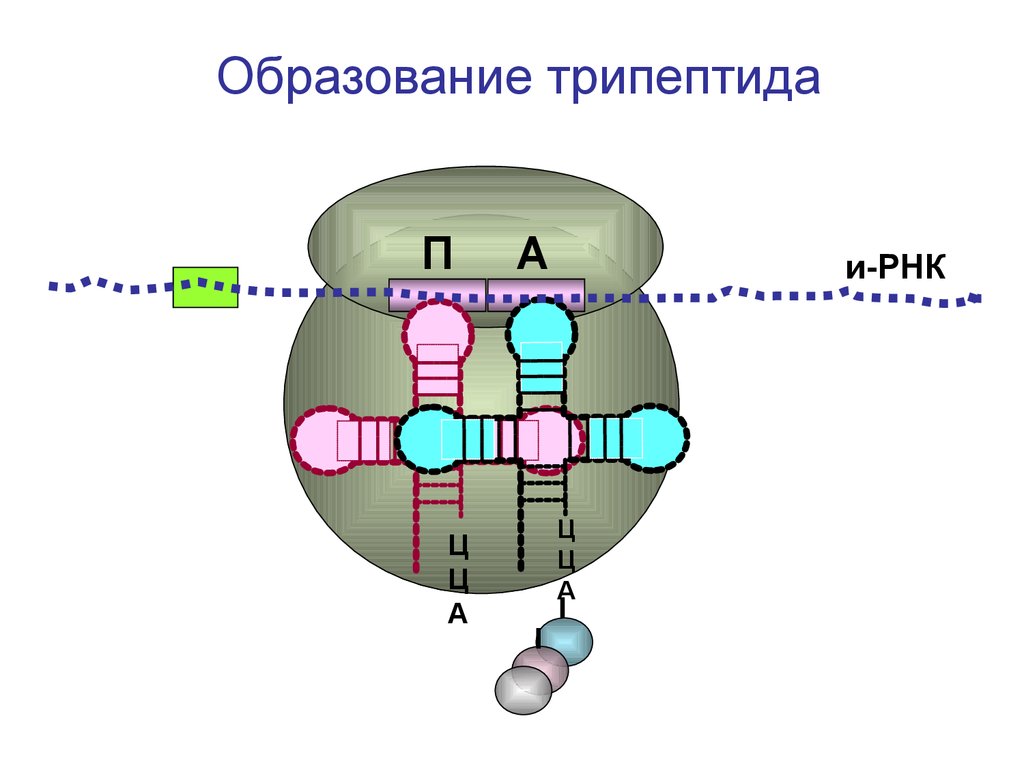
Образование трипептидаП
Ц
Ц
А
А
и-РНК
Ц
Ц
А
90.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
Ц
Ц
А
91.
Многократноеповторение циклов
элонгации, до
полного построения
белковой молекулы
92.
Компоненты инициирующего комплекса.пептидильный
центр
аминоацильный
центр
Малая
субъединица
рибосомы
К
Н
Р
И
Ц
Ц
А
О=С-СН-NH2
R
СAP
93.
Образование инициирующего комплексаП
А
СAP
Ц
Ц
А
О=С-СН-NH2
метионин
СН2-СН2-S-CH3
и-РНК
94.
Образование рибосомыП
А
и-РНК
СAP
Большая
субъединица
рибосомы
Ц
Ц
А
О=С-СН-NH2
метионин
СН2-СН2-S-CH3
95.
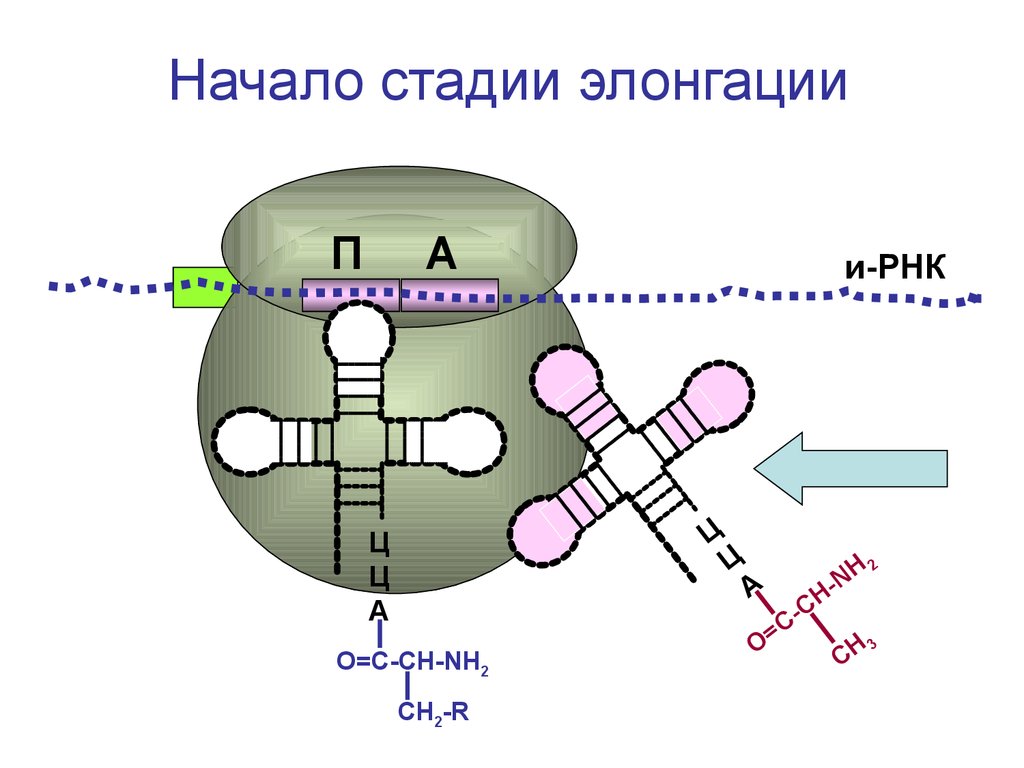
Начало стадии элонгацииП
А
и-РНК
Ц
Ц
Ц
А
О=С-СН-NH2
СН2-R
Ц
А
H2
N
-
СН
С
=
3
О
CH
96.
Перенос первой аминокислоты на вторуюферментом пептидилтрансферазой
П
А
Ц
Ц
А
и-РНК
Ц
Ц
А
О=С-СН-NH2
О=С-СН-NH2
СН3
СН2-R
97.
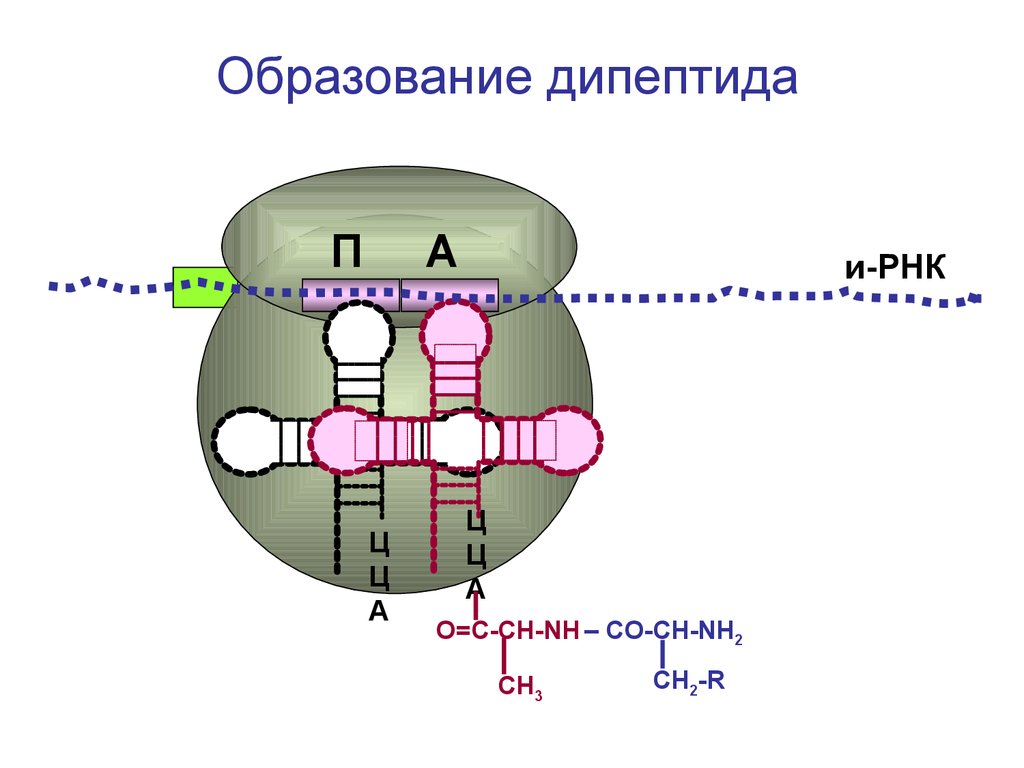
Образование дипептидаП
А
Ц
Ц
А
и-РНК
Ц
Ц
А
О=С-СН-NH – CO-CH-NH2
СН3
СН2-R
98.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
О=С-СН-NH – CO-CH-NH2
СН3
СН2-R
99.
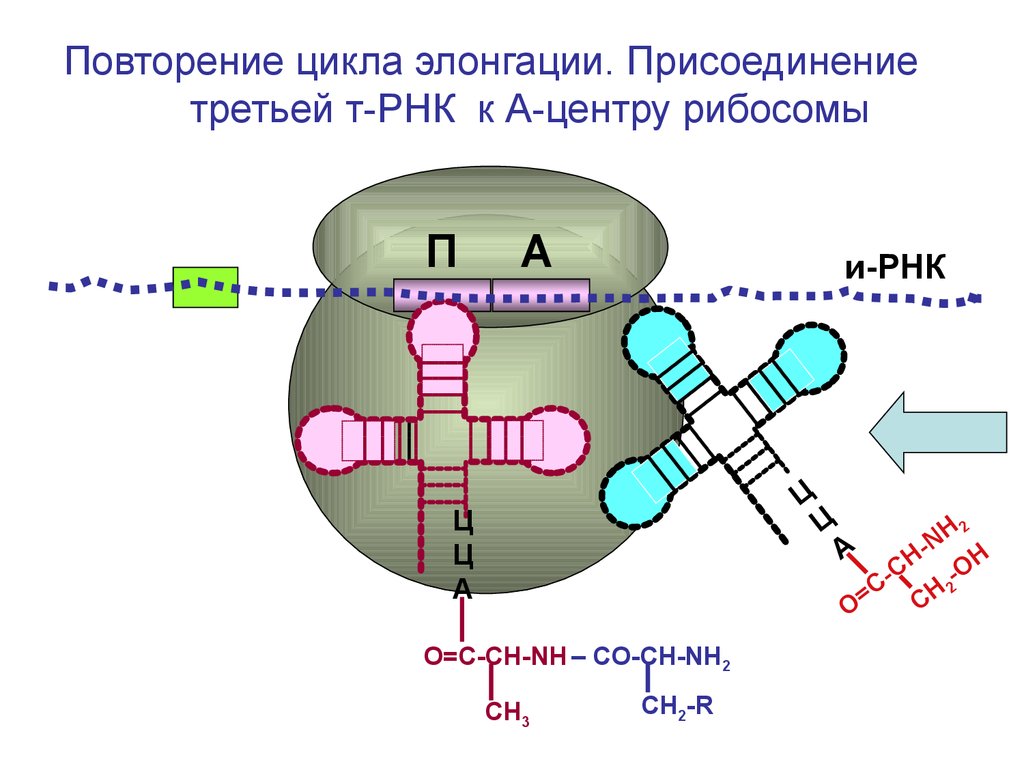
Повторение цикла элонгации. Присоединениетретьей т-РНК к А-центру рибосомы
П
А
и-РНК
Ц
Ц
Ц
А
О=С-СН-NH – CO-CH-NH2
СН3
СН2-R
Ц
H2
N
А
Н
С
OH
С
H2
=
C
О
100.
Перенос дипептида на третью аминокислотуферментом пептидилтрансферазой.
П
Ц
Ц
А
А
и-РНК
Ц
Ц
А
О=С-СН-NH2
CH2-OH
О=С-СН-NH – CO-CH-NH2
СН3
СН2-R
101.
Образование трипептидаП
Ц
Ц
А
А
и-РНК
Ц
Ц
А
О=С-СН-NH- ОС-СН-NH – CO-CH-NH2
CH2-OH
СН3
СН2-R
102.
Перемещение рибосомы вдольи-РНК на один триплет (кодон)
и-РНК
СAP
Ц
Ц
А
Ц
Ц
А
О=С-СН-NH- ОС-СН-NH – CO-CH-NH2
CH2-OH
СН3
СН2-R
103.
Стадиятерминации
104.
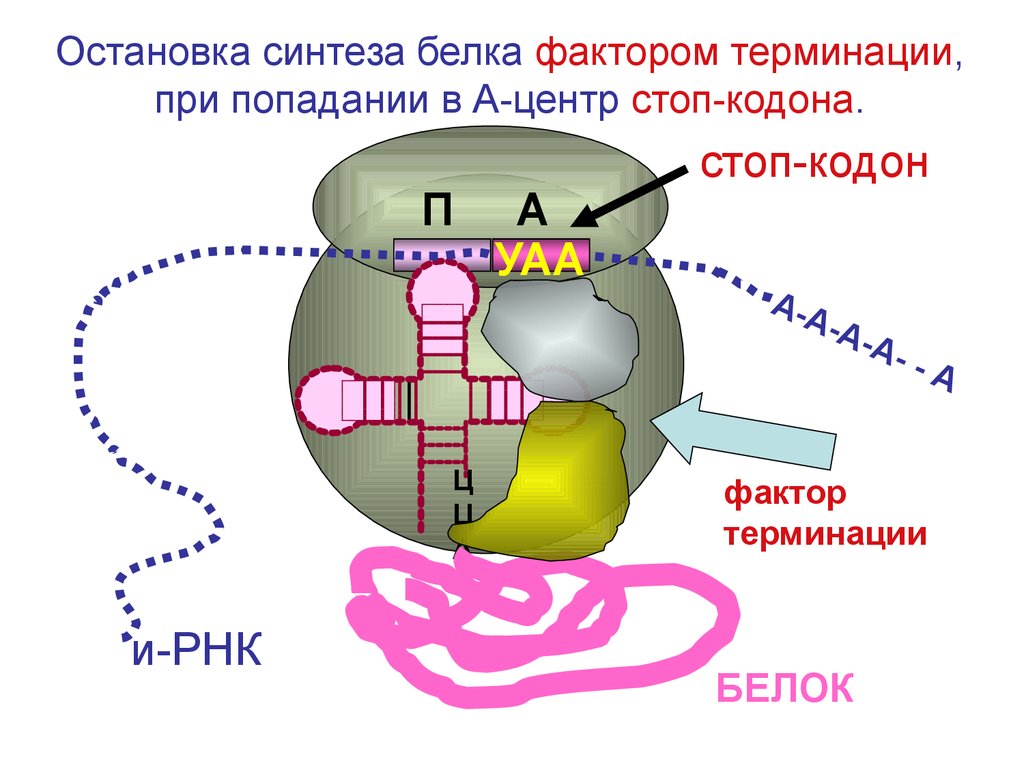
Остановка синтеза белка фактором терминации,при попадании в А-центр стоп-кодона.
П
Ц
Ц
А
и-РНК
А
УАА
стоп-кодон
А-А
-
А-А
--
фактор
терминации
БЕЛОК
А
105.
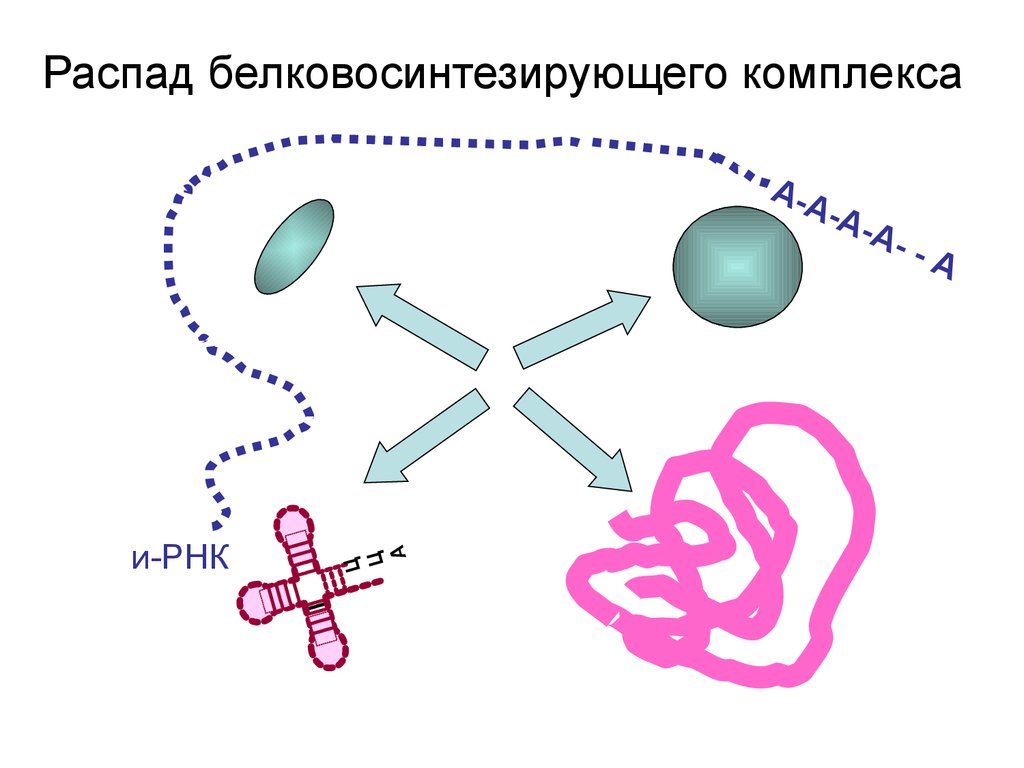
Распад белковосинтезирующего комплексаи-РНК
Ц
Ц
А
А-А
-
А-А
--
А
106.
Трансаминированиеаминокислот
107.
Биологическая ценность аминокислотзаменимые
незаменимые
пируват ----------------------→ аланин
треонин
глицерин- ---------------------→ серин
метионин
серин -------------------------→ глицин
валин
аланин-----------------------→ цистеин
лейцин
щук ---------------→ аспарагиновая к-та
изолейцин
оксоглутаровая → глутаминовая к-та
лизин
глутаминовая к-та -----→ пролин
фенилаланин
глутаминовая к-та ----→ гистидин
триптофан
фенилаланин --------------→ тирозин
аргинин
108.
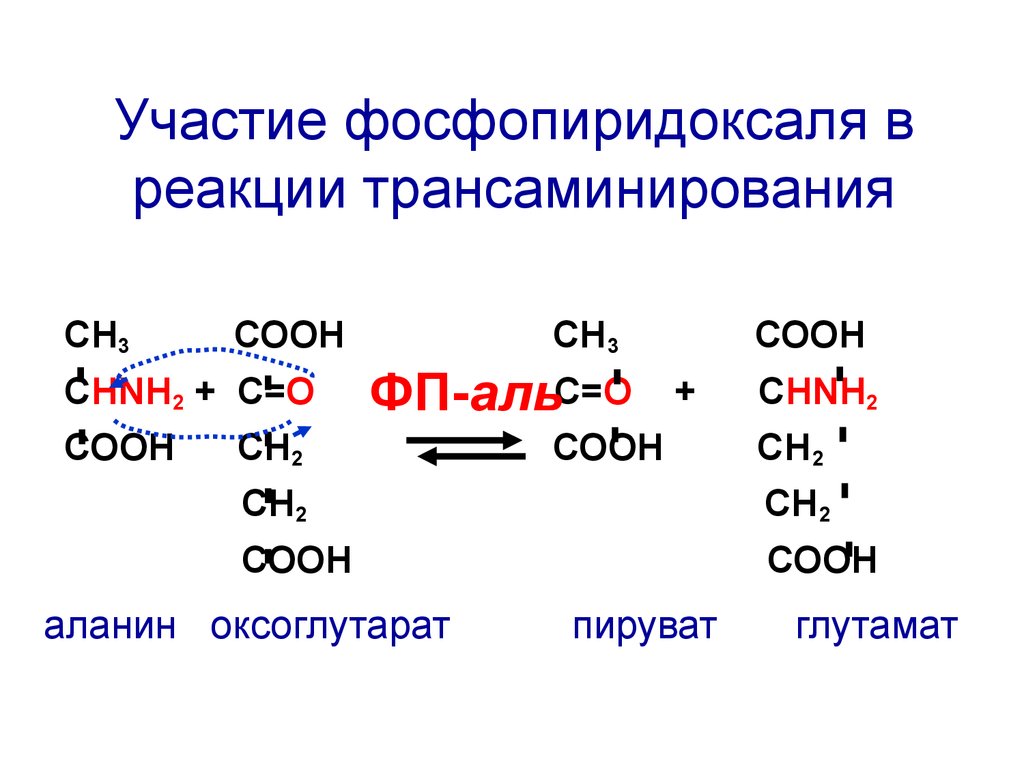
Участие фосфопиридоксаля вреакции трансаминирования
СН3
СООН
СНNH2 + C=О
СООН
СН3
ФП-альС=О
СН2
СООН
+
СООН
СНNH2
СН 2
СН2
СН 2
СООН
СООН
аланин оксоглутарат
пируват
глутамат
109.
1. перенос аминогруппы на коферментСН3
Н
СН-NH2
С
О
НО
+
COOH
Н3С
СН2О-РО3Н2
N
пиридоксаль-фосфат
СН2-NH2
НО
Н3С
СН2О-РО3Н2
N
пиридоксамин-фосфат
СН3
+
С= O
COOH
110.
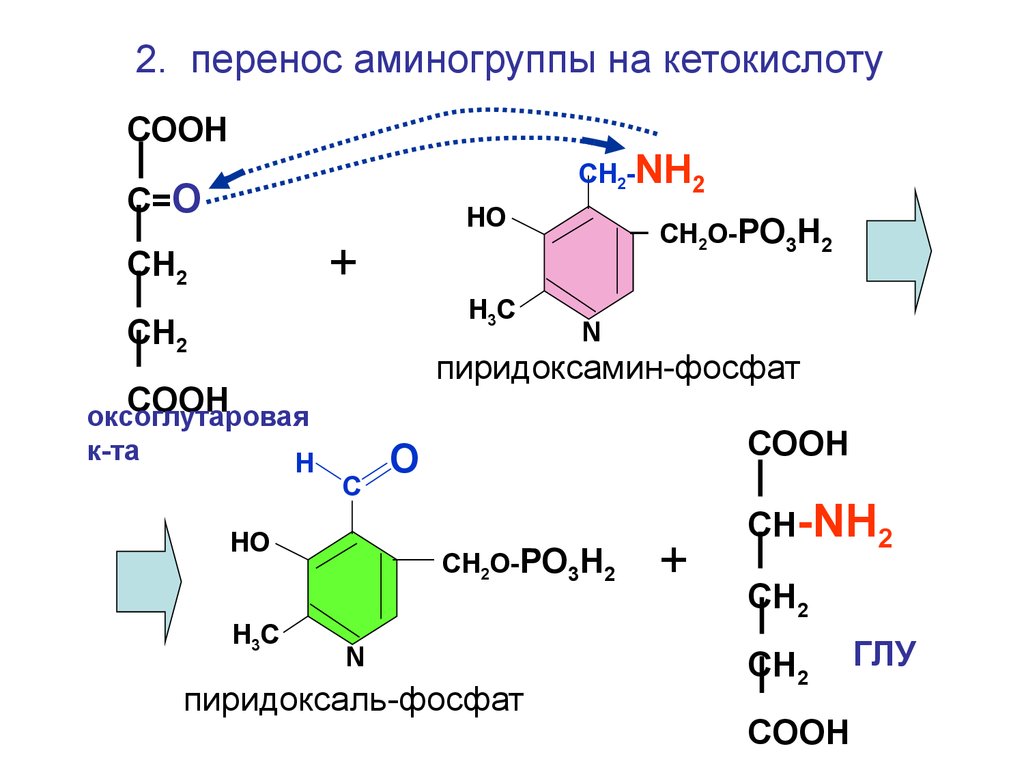
2. перенос аминогруппы на кетокислотуСООН
СН2-NH2
С=О
НО
СН2О-РО3Н2
+
СН2
Н3С
СН2
COOH
оксоглутаровая
к-та
Н
пиридоксамин-фосфат
С
НО
Н3С
N
СООН
О
СН2О-РО3Н2
N
пиридоксаль-фосфат
+
СН-NH2
СН2
СН2
COOH
ГЛУ
111.
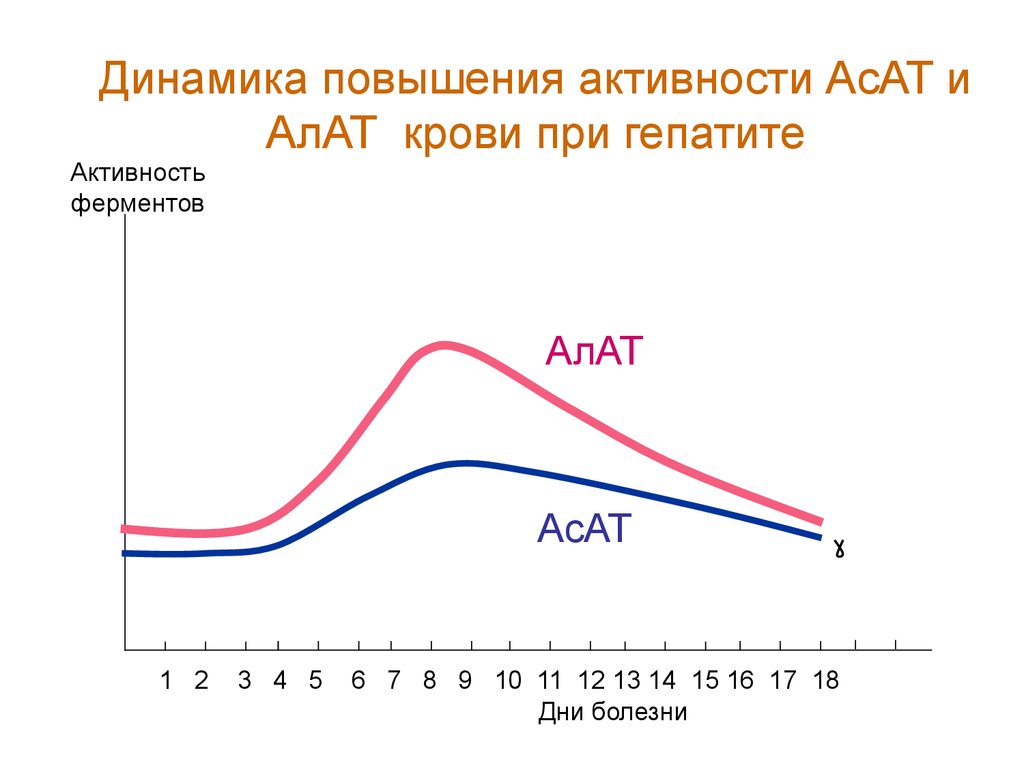
Динамика повышения активности АсАТ иАлАТ крови при гепатите
Активность
ферментов
АлАТ
АсАТ
1 2
3 4 5
6 7 8 9 10 11 12 13 14 15 16 17 18
Дни болезни
112.
Декарбоксилированиеаминокислот
(образование
биологическиактивных аминов)
113.
Образование гистаминаN
-CH2-CH-COOH
N
-CH2-CH2
NH2
NH2
NH
гистидиндекарбоксилаза
NH
+ СО2
114.
Окисление гистаминаN
-CH2-CH2
NH2
NH
гистамин
N
-CH2-C=О
Н
O2
моноаминооксидаза
NH3
NH
имидазолацетальдегид
115.
декарбоксилирование триптофана-CH2-CH-COOH
-CH2-CH2
NH2
NH2
+ СО2
NH
триптамин
NH
декарбоксилаза
116.
гидроксилирование триптофана-CH2-CH-COOH
НО
-CH2-CH-COOH
NH2 гидроксилаза
NH
NH2
NH
5-гидрокситриптофан
117.
синтез серотонинаНО
-CH2-CH-COOH
NH2
NH
НО
декарбоксилаза
СО2
-CH2-CH2
NH2
NH
5-гидрокситриптамин
(серотонин)
118.
Декарбоксилирование глутаминовойкислоты
СOOH
CH-NH2
CH2
CH2-NH2
декарбоксилаза
CH2
COOH
глутаминовая
кислота
CH2
CH2
+ CO2
COOH
гамма-аминомасляная
кислота (ГАМК)
119.
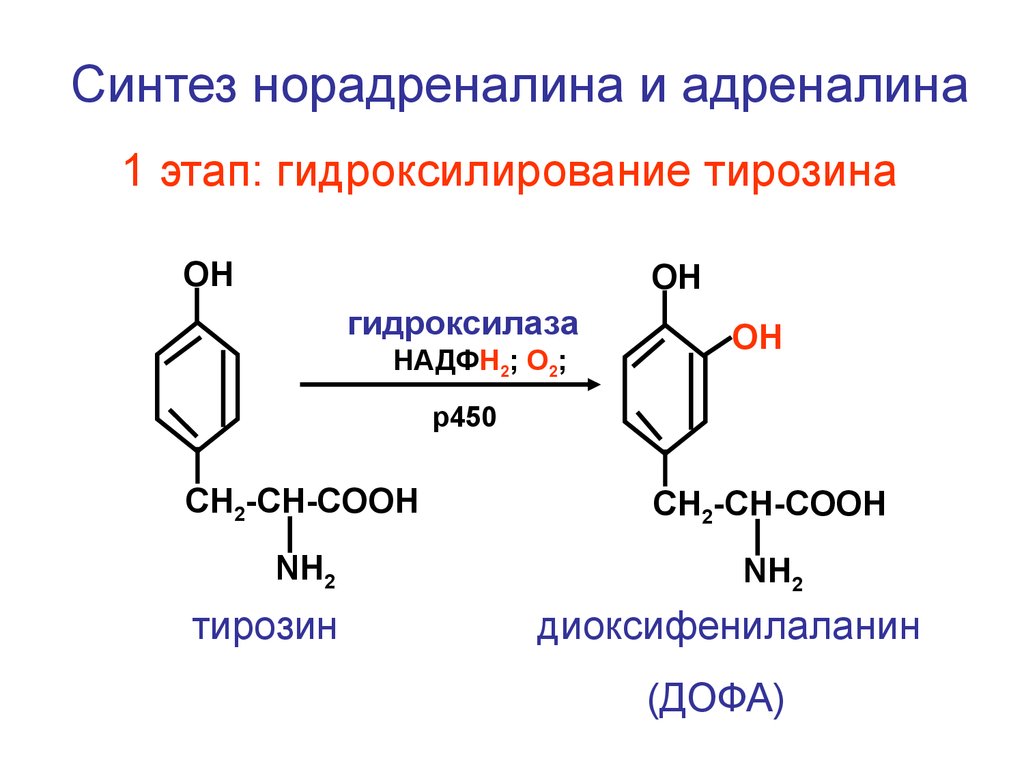
Синтез норадреналина и адреналина1 этап: гидроксилирование тирозина
ОН
ОН
гидроксилаза
НАДФН2; О2;
ОН
р450
CH2-CH-COOH
CH2-CH-COOH
NH2
NH2
тирозин
диоксифенилаланин
(ДОФА)
120.
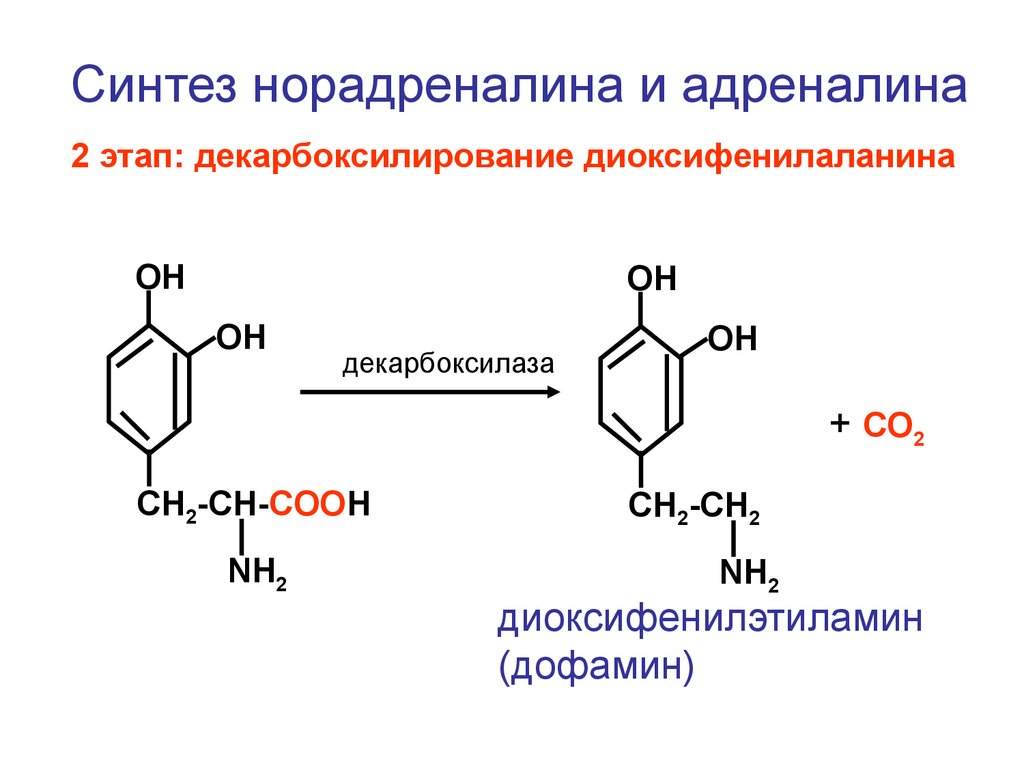
Синтез норадреналина и адреналина2 этап: декарбоксилирование диоксифенилаланина
ОН
ОН
ОН
декарбоксилаза
ОН
+ СО2
CH2-CH-COOH
NH2
CH2-CH2
NH2
диоксифенилэтиламин
(дофамин)
121.
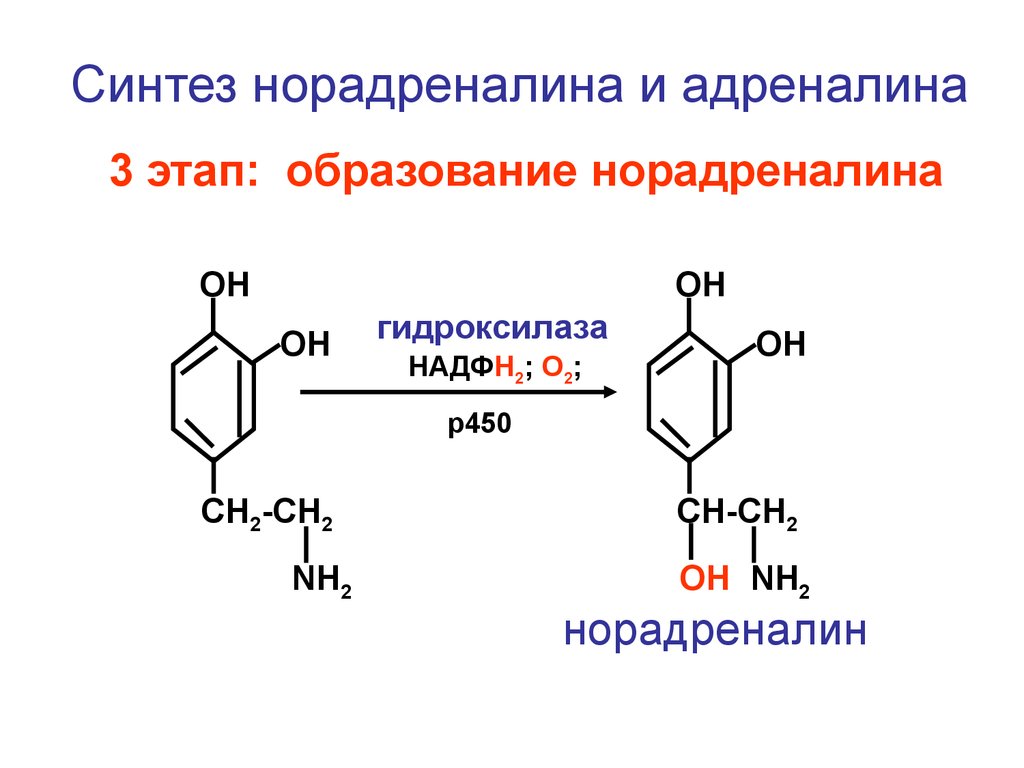
Синтез норадреналина и адреналина3 этап: образование норадреналина
ОН
ОН
ОН
гидроксилаза
НАДФН2; О2;
ОН
р450
CH2-CH2
NH2
CH-CH2
ОН NH2
норадреналин
122.
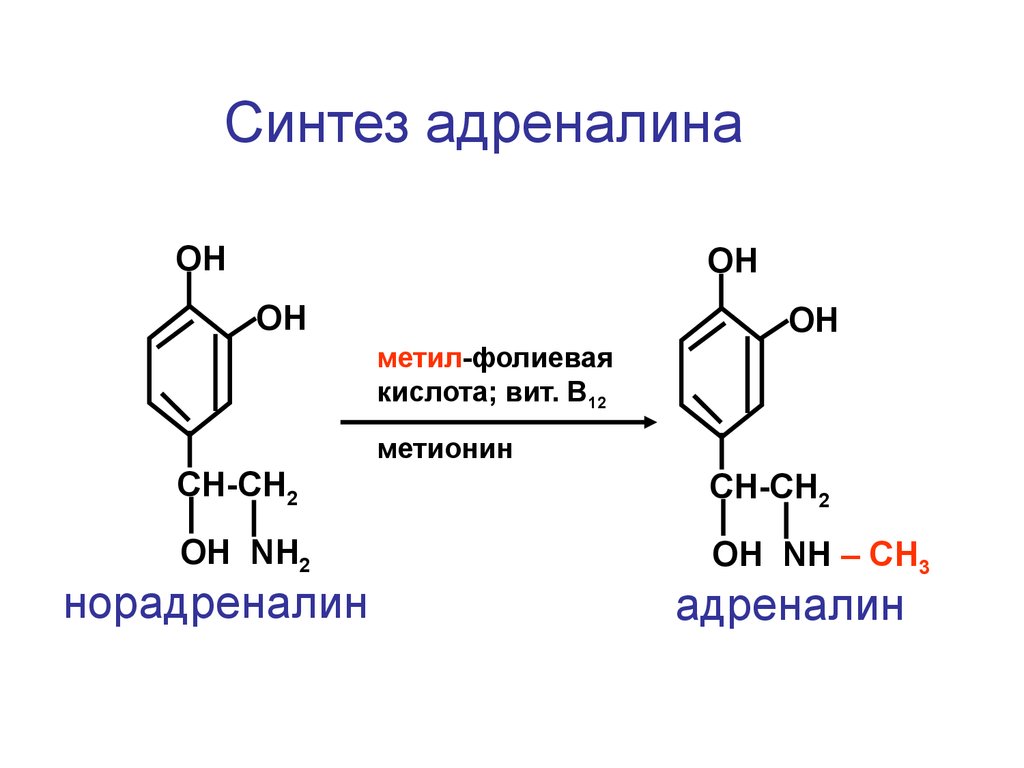
Синтез адреналинаОН
ОН
ОН
ОН
метил-фолиевая
кислота; вит. В12
метионин
CH-CH2
CH-CH2
ОН NH2
ОН NH – СН3
норадреналин
адреналин
123.
Окислительноедезаминирование
аминокислот
124.
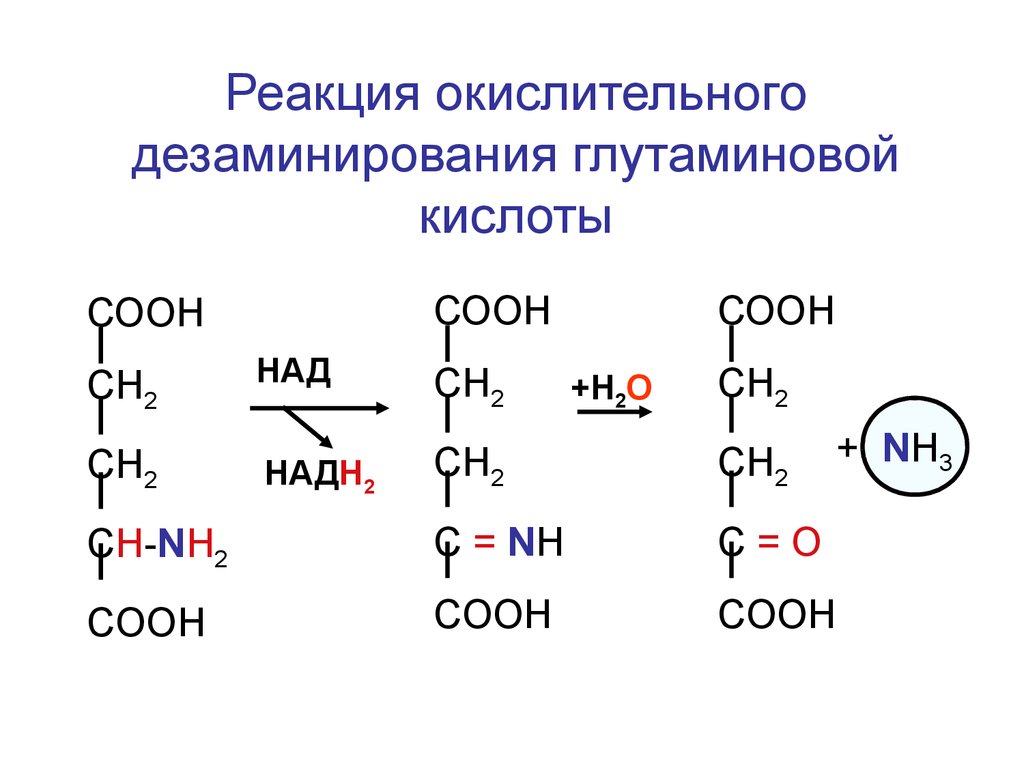
Реакция окислительногодезаминирования глутаминовой
кислоты
СООН
СООН
СООН
HАД
СН2
HАДН2
СН2
СН2
CH-NH2
C = NH
C=О
COOH
COOH
COOH
СН2
СН2
+Н2О
СН2
+ NH3
125.
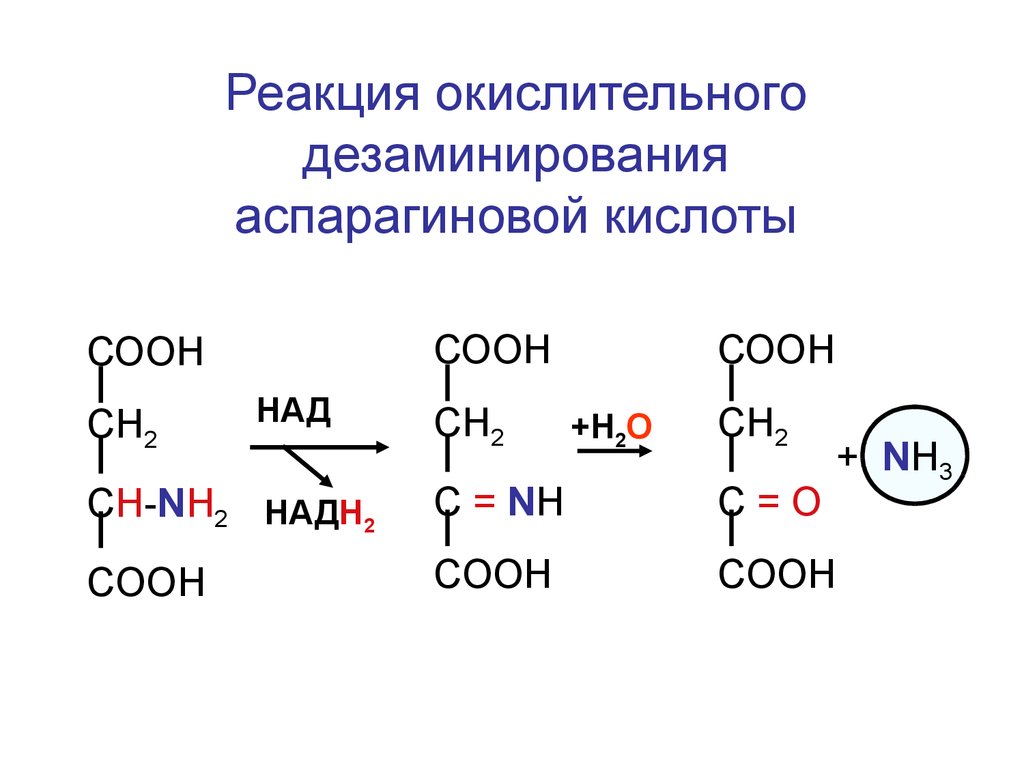
Реакция окислительногодезаминирования
аспарагиновой кислоты
СООН
СООН
СН2
HАД
СН2
СООН
+Н2О
СН2
CH-NH2 HАДН2
C = NH
C=О
COOH
COOH
COOH
+ NH3
126.
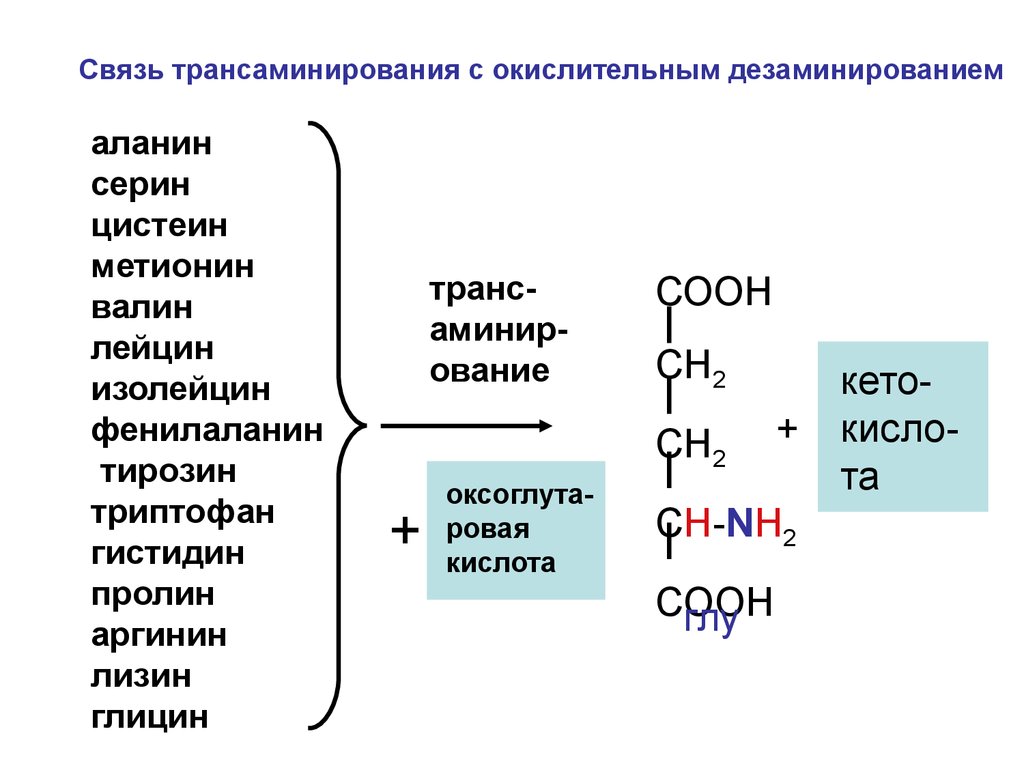
Связь трансаминирования с окислительным дезаминированиемаланин
серин
цистеин
метионин
валин
лейцин
изолейцин
фенилаланин
тирозин
триптофан
гистидин
пролин
аргинин
лизин
глицин
трансаминирование
СООН
СН2
СН2
+
оксоглутаровая
кислота
+
CH-NH2
COOH
глу
кетокислота
127.
Связь трансаминирования сокислительным дезаминированием
трансаминирование
СН3
СООН
СН3
СНNH2 + C=О
С=О
СООН
СООН
аланин
СН2
окислительное
дезаминирование
СООН
+ СНNH2
СН2
СН2
СН 2
СООН
СООН
оксоглутарат
пируват
глутамат
+ НАД
НАДН2
128.
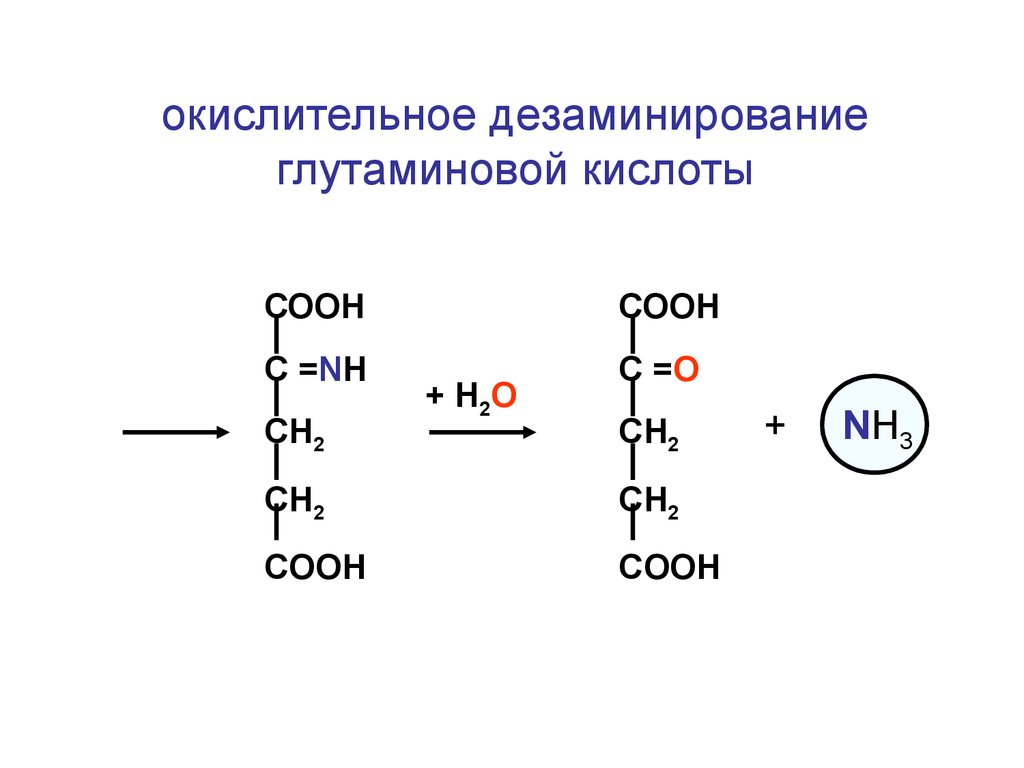
окислительное дезаминированиеглутаминовой кислоты
СООН
СООН
С =NH
С =O
СН2
+ Н2О
СН2
CH2
CH2
COOH
COOH
+
NH3
129.
метаболические источники аммиака в организмеокислительное
дезаминирование аминокислот
окисление
биологически
активных аминов
NH3
дезаминирование азотистых
оснований
дезаминирование
аминосахаров
130.
главныймеханизм
обезвреживания
аммиака в
организме
131.
Местом обезвреживания аммиака в организме( 20 г в сутки) является печень
132.
структурные формулы угольной кислоты имочевины
НО – С – ОН
О
NH2 – C – NH2
O
133.
синтезмочевины
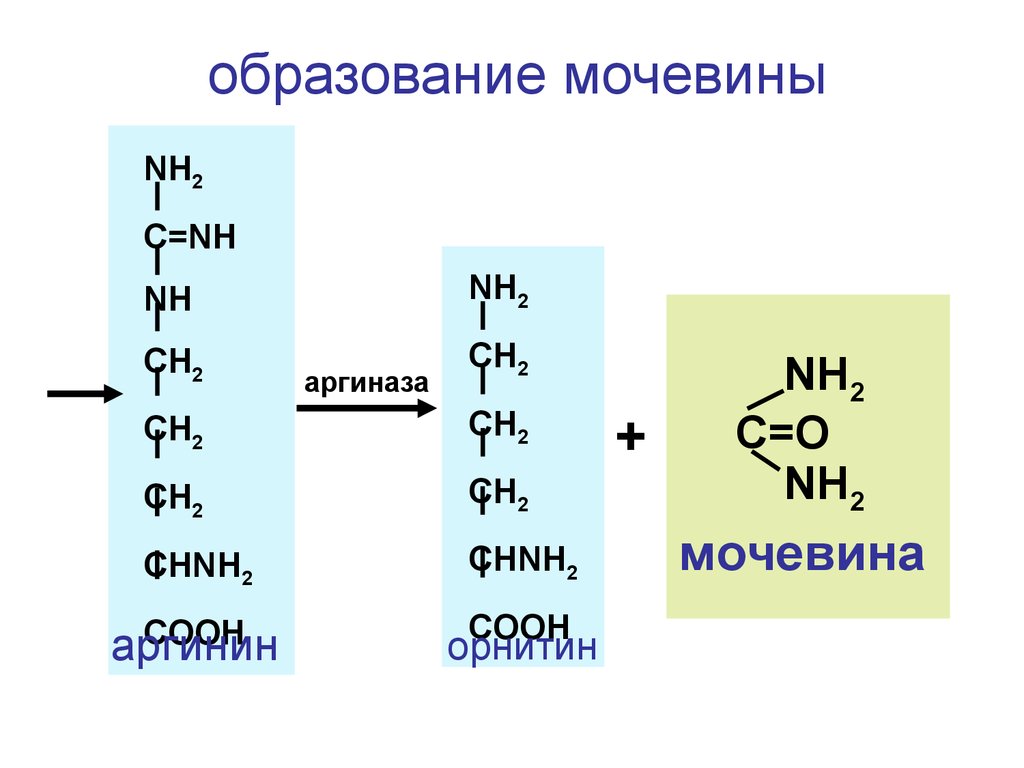
134.
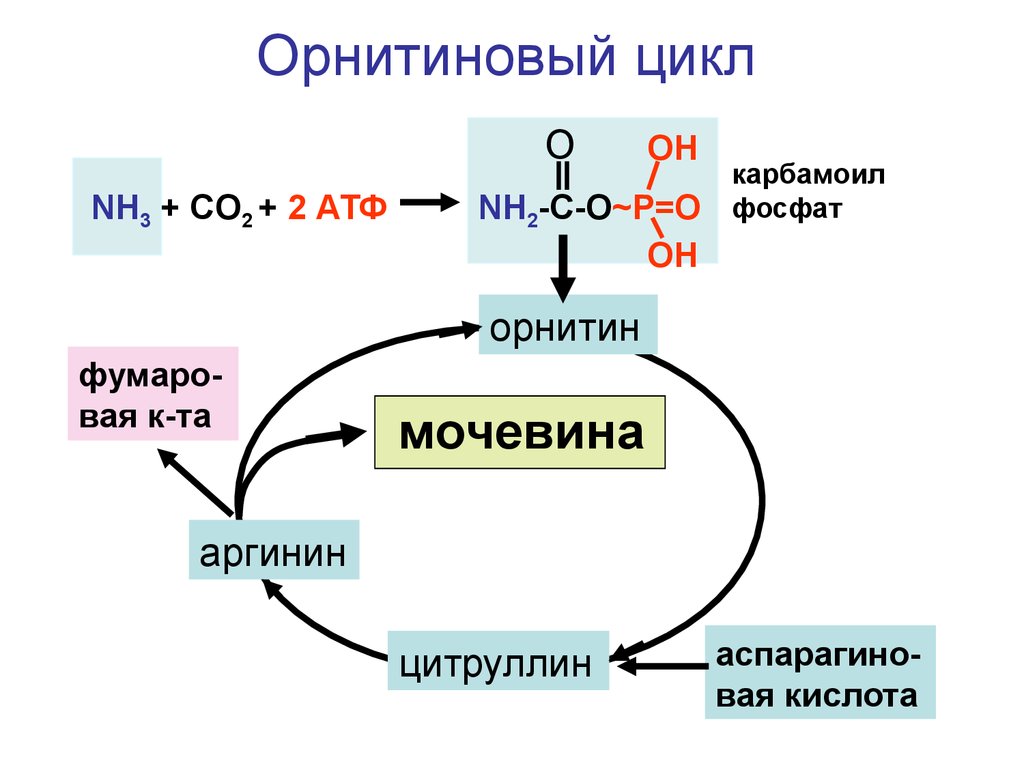
Орнитиновый циклO
NH3 + CO2 + 2 АТФ
OH
NH2-C-O~P=O
OH
карбамоил
фосфат
орнитин
фумаровая к-та
мочевина
аргинин
цитруллин
аспарагиновая кислота
135.
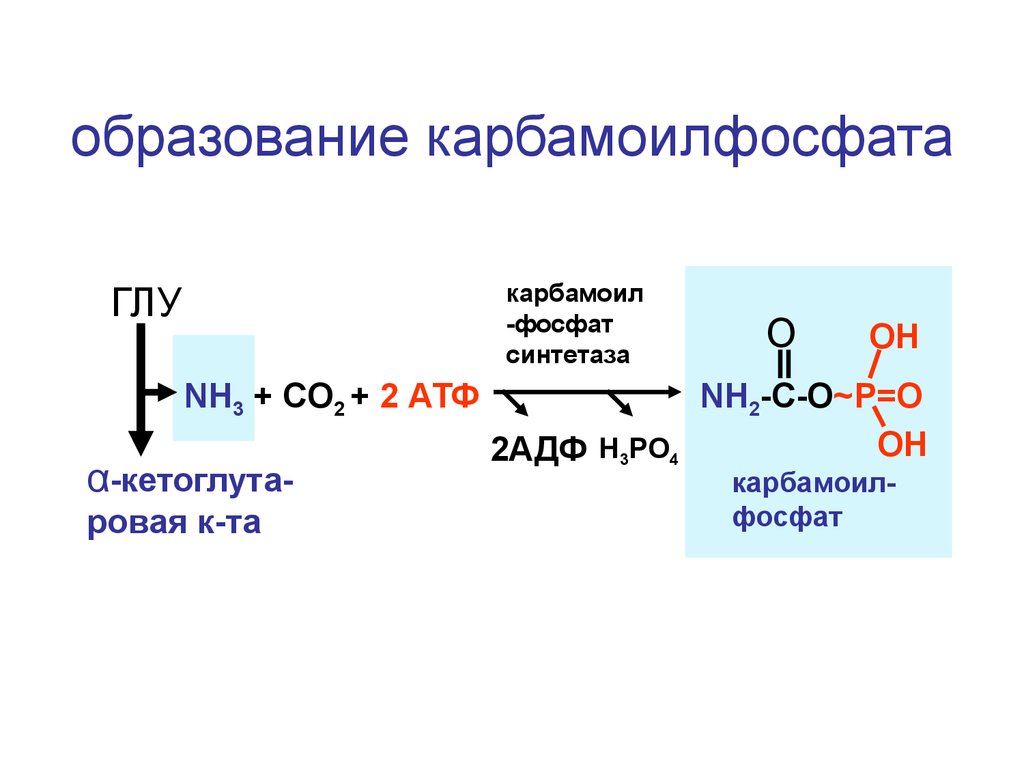
образование карбамоилфосфатакарбамоил
-фосфат
синтетаза
ГЛУ
NH3 + CO2 + 2 АТФ
α-кетоглутаровая к-та
O
OH
NH2-C-O~P=O
OH
2АДФ H3PO4
карбамоилфосфат
136.
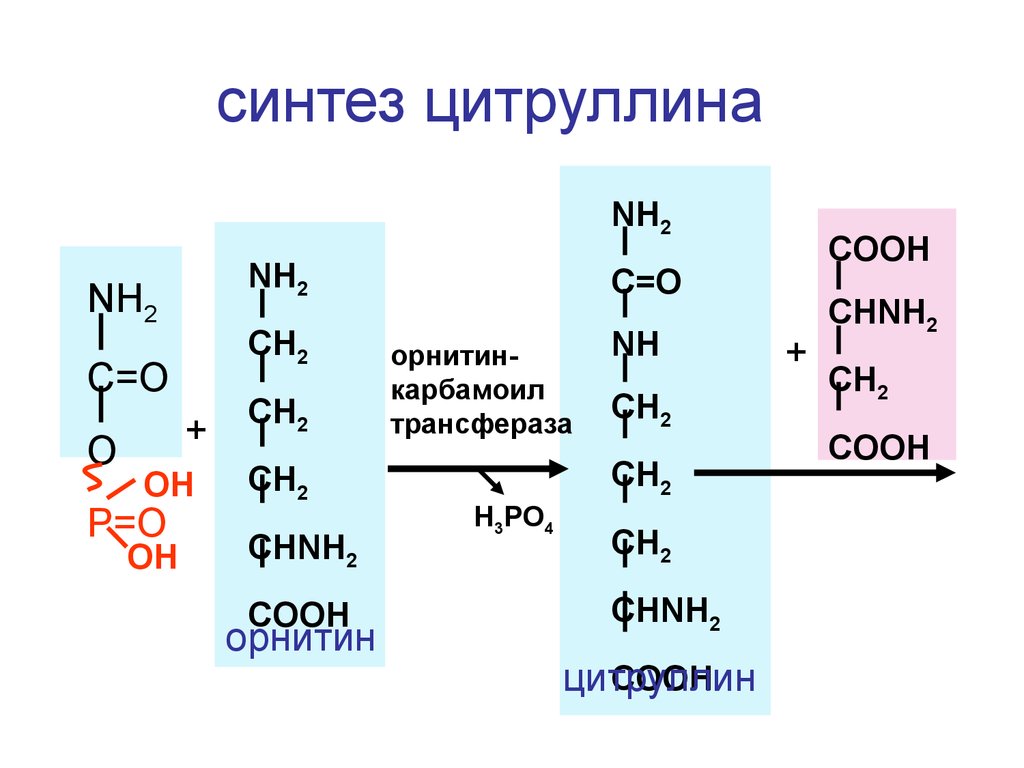
синтез цитруллинаNH2
NH2
NH2
CH2
C=O
O
+
OH
P=O
OH
CH2
CH2
CHNH2
COOH
орнитин
COOH
C=O
орнитинкарбамоил
трансфераза
NH
CH2
CH2
H3PO4
CH2
CHNH2
COOH
цитруллин
+
CHNH2
CH2
COOH
137.
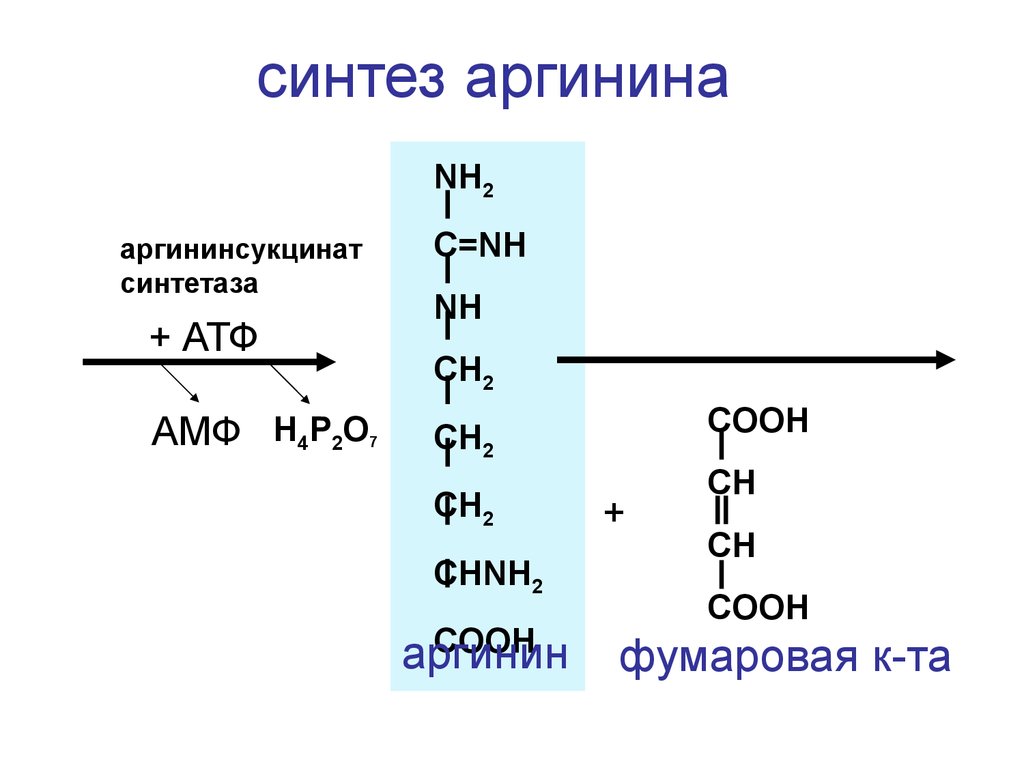
синтез аргининаNH2
C=NH
аргининсукцинат
синтетаза
NH
+ АТФ
АМФ H4P2O
CH2
7
COOH
CH2
CH2
CHNH2
COOH
аргинин
+
CH
CH
COOH
фумаровая к-та
138.
образование мочевиныNH2
C=NH
NH
NH2
CH2
CH2
аргиназа
CH2
CH2
CH2
CH2
CHNH2
CHNH2
COOH
аргинин
орнитин
COOH
+
NH2
C=O
NH2
мочевина
139.
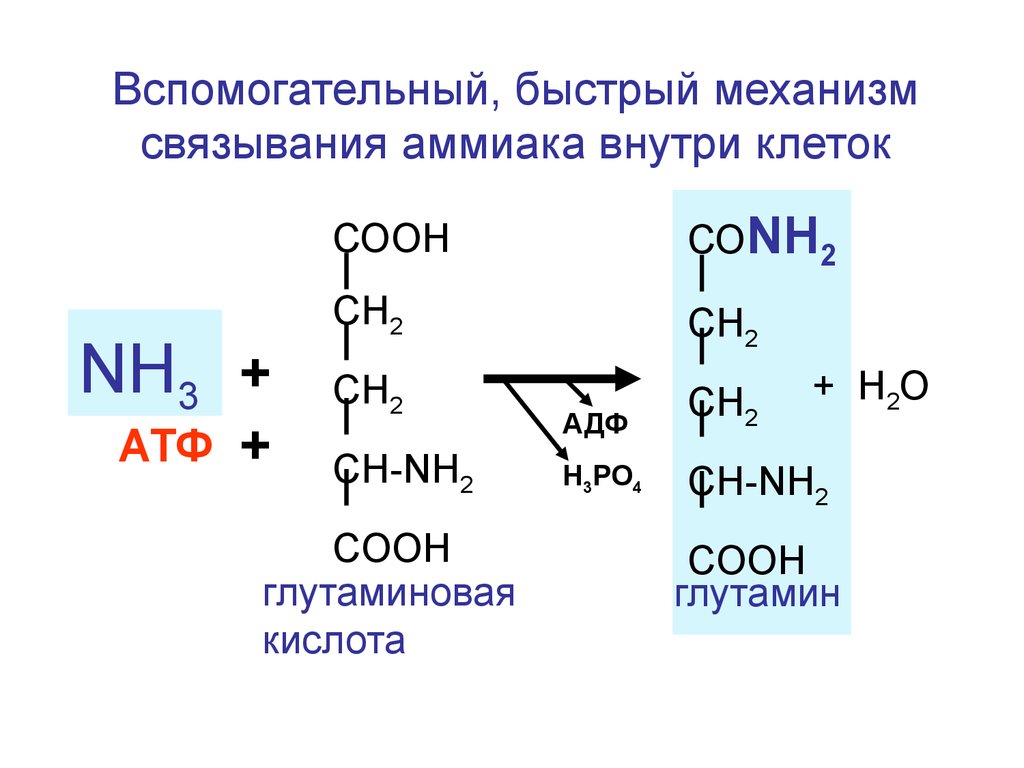
Вспомогательный, быстрый механизмсвязывания аммиака внутри клеток
NH3 +
АТФ
+
СООН
СОNH2
СН2
СН2
СН2
АДФ
СН2
Н3РО4
CH-NH2
CH-NH2
COOH
глутаминовая
кислота
+ H2O
COOH
глутамин
140.
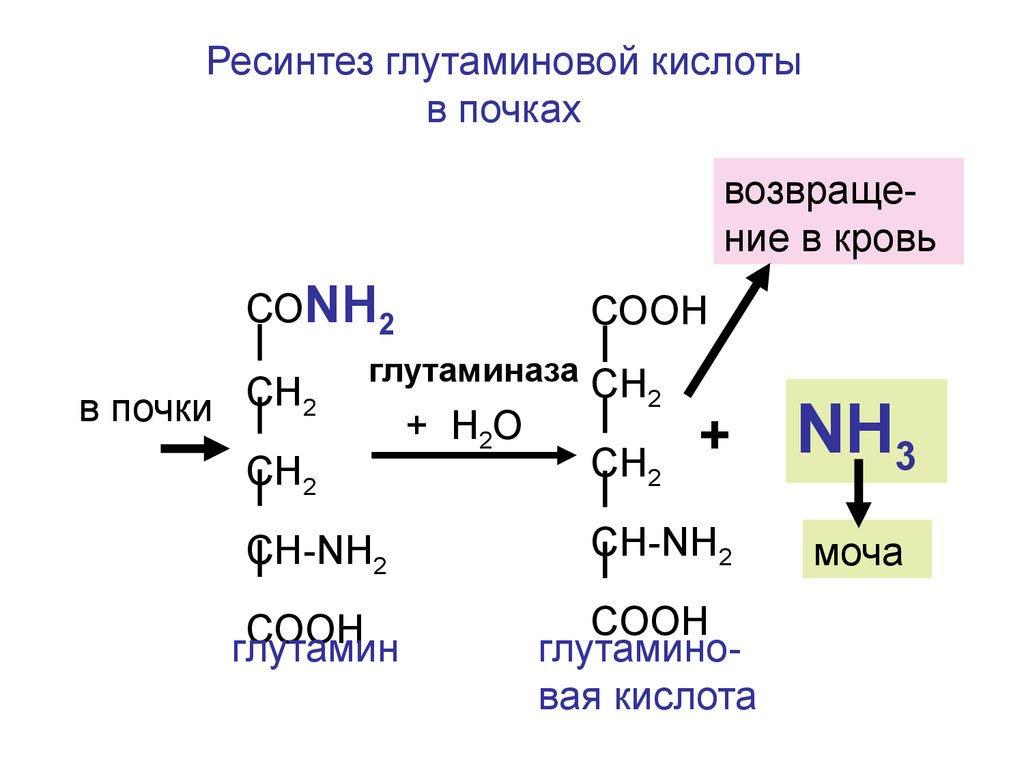
Ресинтез глутаминовой кислотыв почках
возвращение в кровь
СОNH2
в почки СН2
СООН
глутаминаза СН
2
СН2
CH-NH2
COOH
глутамин
+ H2O
СН2
+
CH-NH2
COOH
глутаминовая кислота
NH3
моча
141.
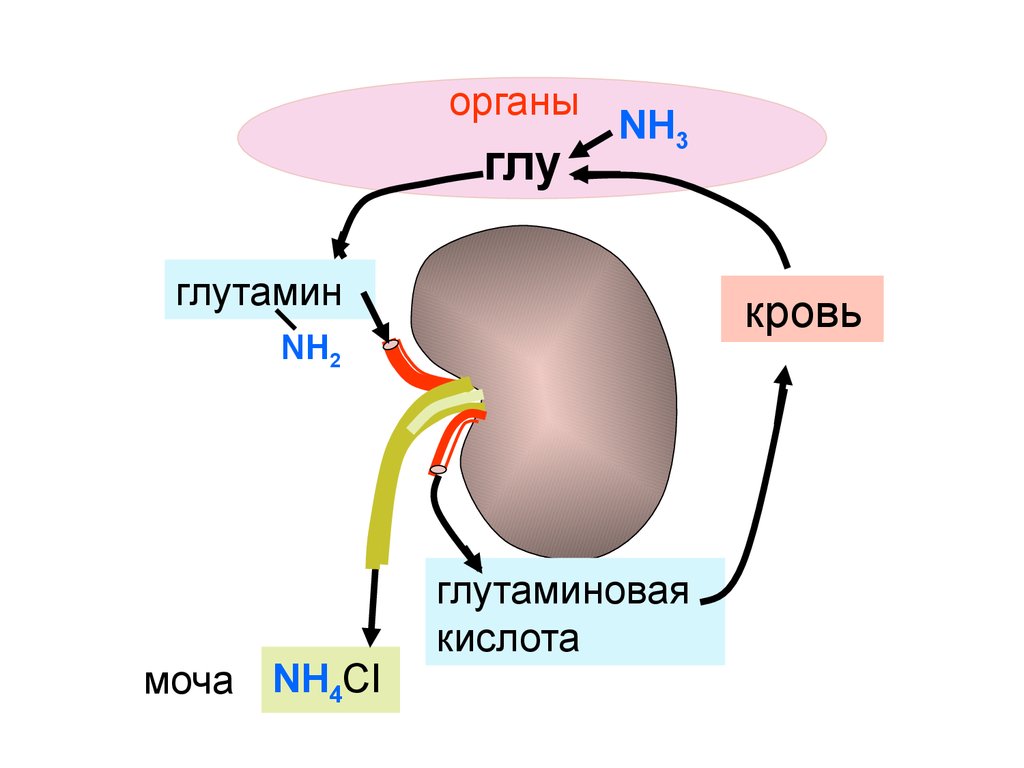
органыглу
NH3
глутамин
кровь
NH2
моча NH4CI
глутаминовая
кислота
142.
Содержаниемочевины в крови
2,5 – 8,3 ммоль/л
сыворотки
(За сутки с мочой выделяется 20-35 г)
143.
Регуляцияобмена
белков
144.
Факторы, влияющие на скорость синтеза белкаскорость
синтеза
концентрация
и состав
аминокислот
и-РНК,т-РНК
синтез белка
активность
АРС-аз
регуляция
гормонами
145.
Влияние некоторых факторов наконцентрацию и состав аминокислот
1. Доступность в белковой диете;
2. Наличие полноценных белков в продуктах;
2. Содержание альбумина в крови;
3. Заболевания органов пищеварения;
4. Нарушения всасывания аминокислот;
5. Заболевания почек, печени, поджелудочной
железы;
6. Гиповитаминоз (В6; фолиевой кислоты, В12)
146.
Влияние некоторых факторов наактивность АРС-аз
1.Активность белково-синтезирующей
системы;
2. Кислотно-основное состояние в
организме;
3. Состояние биоэнергетических
процессов.
147.
Факторы, влияющие наскорость синтеза и-РНК и т-РНК
1. Наличие нуклеотидного фонда;
2. Состояние биоэнергетических
процессов;
3. Влияние факторов роста на процесс
транскрипции (индукция и репрессия
генов).
148.
Гормональная регуляция скоростисинтеза белка
1. Соматотропин, половые гормоны (индукторы
транскрипции и биосинтеза белка);
2. Тироксин (активатор транскрипции ферментов,
осуществляющих липолиз и протеолиз);
3. Инсулин (активатор транскрипции ферментов,
участвующих в углеводном обмене);
4. Глюкокортикоиды (репрессоры транскрипции
генов, контролирующих синтез белков и липидов.
Индукторы транскрипции и биосинтеза ферментов
глюконеогенеза).
149.
На скорость дезаминированияаминокислот влияют:
1. Соотношение НАДН2 /НАД. При гипоксии
увеличивается концентрация НАДН2. Недостаток
НАД служит причиной замедления скорости
дезаминирования аминокислот.
2. Концентрация NH3. Увеличение концентрации
аммиака замедляет процесс дезаминирования.
3. Снижение концентрации глутаминовой кислоты
или аспарагиновой кислоты понижает скорость
окислительного дезаминирования.
150.
Взаимосвязьмежду обменом
белков,
углеводов и
липидов.
151.
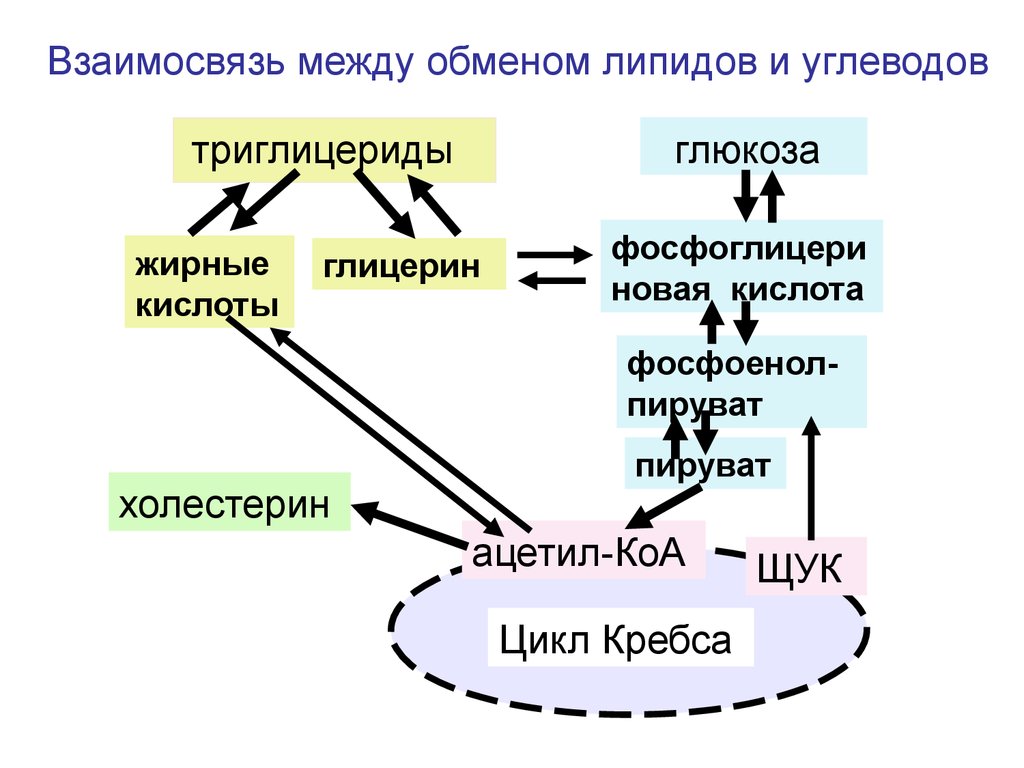
Взаимосвязь между обменом липидов и углеводовтриглицериды
жирные
кислоты
глюкоза
глицерин
фосфоглицери
новая кислота
фосфоенолпируват
холестерин
пируват
ацетил-КоА
Цикл Кребса
ЩУК
152.
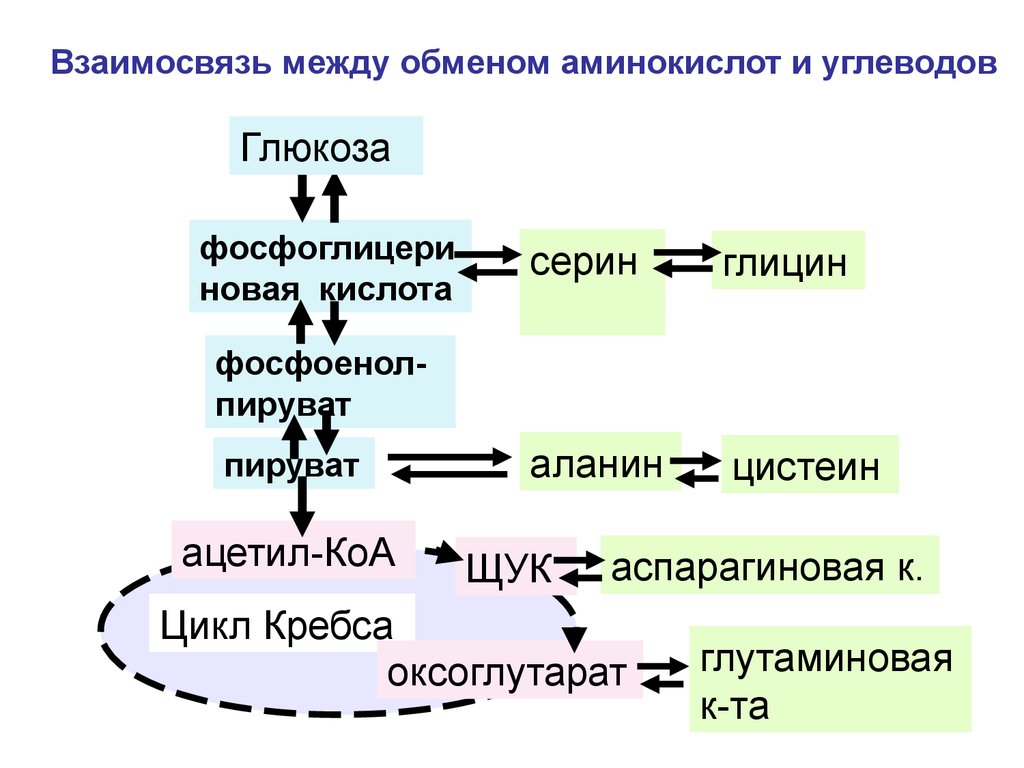
Взаимосвязь между обменом аминокислот и углеводовГлюкоза
фосфоглицери
новая кислота
серин
глицин
аланин
цистеин
фосфоенолпируват
пируват
ацетил-КоА
ЩУК
аспарагиновая к.
Цикл Кребса
оксоглутарат
глутаминовая
к-та
153.
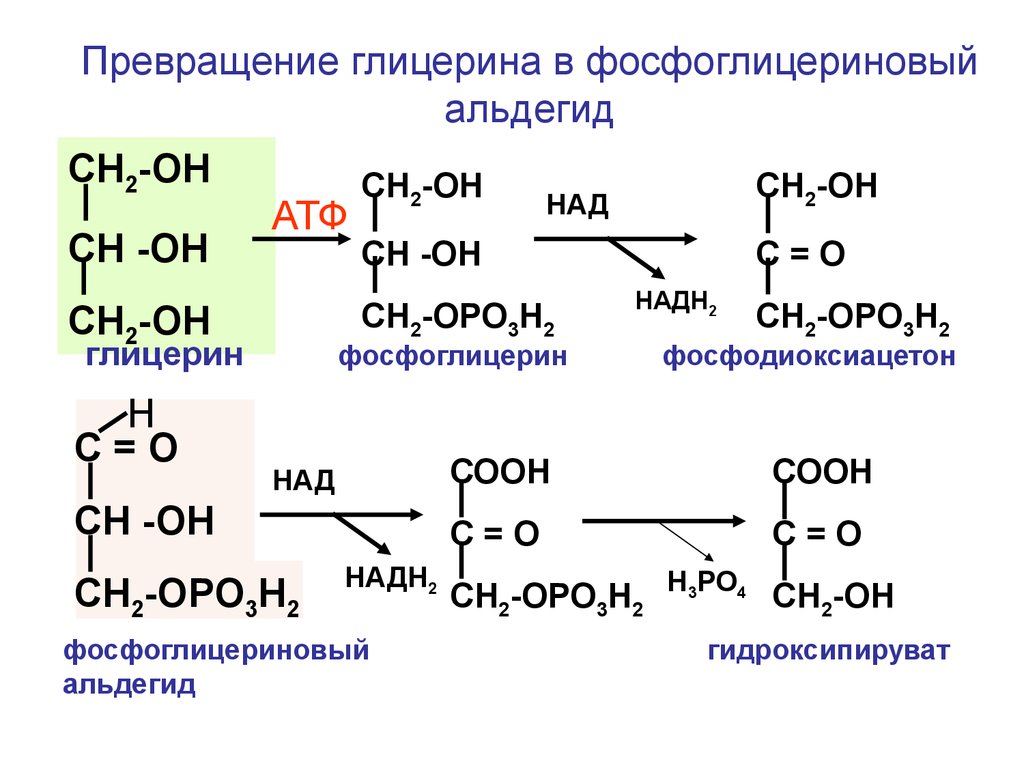
Превращение глицерина в фосфоглицериновыйальдегид
СН2-ОН
СН -ОН
АТФ
глицерин
СН -ОН
фосфоглицерин
НАД
СН -ОН
СН2-ОРО3Н2
СН2-ОН
НАД
СН2-ОРО3Н2
СН2-ОН
Н
С=О
СН2-ОН
НАДН2
фосфоглицериновый
альдегид
С=О
НАДН2
СН2-ОРО3Н2
фосфодиоксиацетон
СООН
СООН
С=О
С=О
СН2-ОРО3Н2 Н3РО4 СН2-ОН
гидроксипируват
154.
получение серинаСООН
СООН
+ СH-NH2
С=О
СН2-ОН
аминотрансфераза
CH2
В6
СООН
СH-NH2 + С = O
СН2-ОН
CH2
CH2
CH2
COOH
глутаминовая к-та
СООН
серин
COOH
оксоглутарат











































































 biology
biology chemistry
chemistry








