Similar presentations:
Производство серной кислоты
1. Производство серной кислоты
Серная кислота - хлебхимической
промышленности
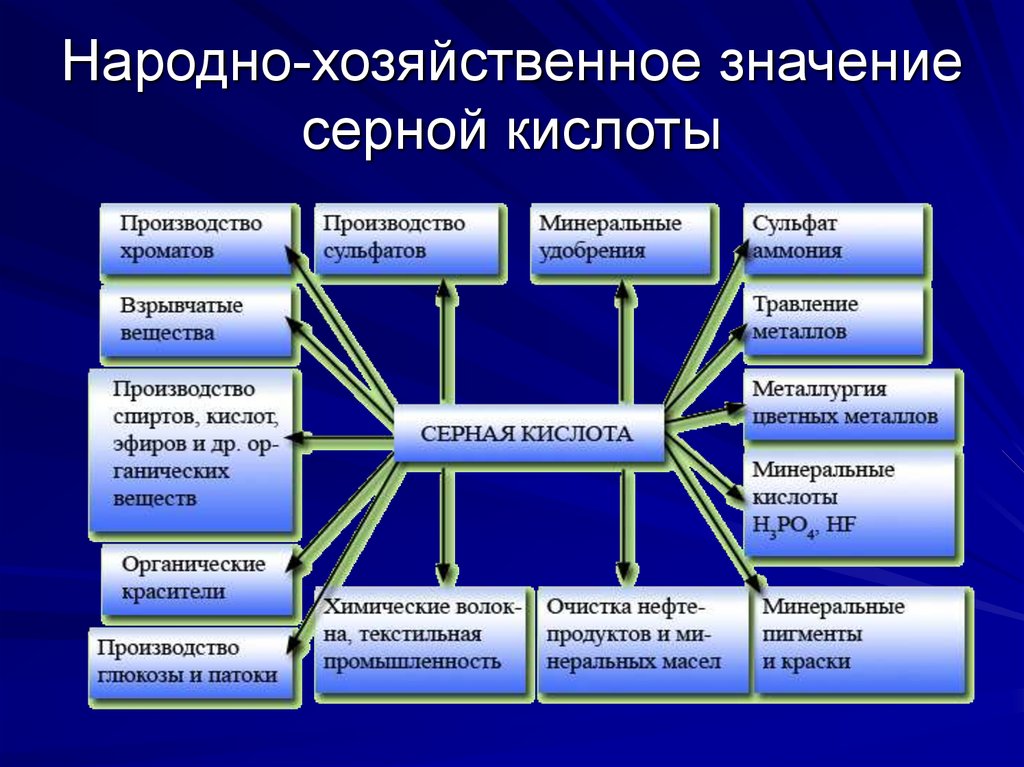
2. Народно-хозяйственное значение серной кислоты
3. Сырьевые источники H2SO4
H2S – образуется при коксовании угляFeS2 – месторождения пирита железа
S – месторождения самородной серы
или входит в состав нефти
SO2 – газовые отходы цветной
металлургии
4. 1 стадия
4 FeS2 + 11O2 = 2 Fe2O3 + 8 SO2 + Qт
г
т
г
Необратимая
Экзотермическая
гетерогенная
5. Оптимальные условия
Увеличить концентрацию кислорода ввоздухе
T – невысокая 400° - 800°
Увеличить поверхность
соприкосновения веществ:
а) измельчение серного колчедана;
б) обжиг в «кипящем слое»
6.
7. 2 стадия
К2SO2 + O2 ↔ 2SO3 + Q
г
г
г
Обратимая
Экзотермическая
Гомогенная
Каталитическая
8. Оптимальные условия
T = 500°К – Pt , V2O5, V + K2SO4 на шариковом
алюмоселикагеле
Окисляют чистым О2
9.
10. 3 стадия
SO3 + H2O = H2 SO4 + Qг
ж
ж
Необратимая
Экзотермическая
гетерогенная
11. Оптимальные условия
Для увеличения поверхностисоприкосновения: а) ж и г двигаются
противотоком; б) в поглотительной
башне на колосниковой решётке
находятся насадки из колец
Чтобы уберечь от соприкосновения с
водяными парами – поглотительную
башню орошают концентрированной
H2SO4 (98,3 %)
12.
Олеум - это концентрированная сернаякислота в которой растворён SO3
FeS2
1ст
→ SO2
2ст
3ст
→ SO3 → H2SO4
13.
14. Профессии работников сернокислотного производства
Инженер – технологАппаратчик
Лаборант - аналитик













 chemistry
chemistry








