Similar presentations:
Получение солей. Лекция №13. Подготовка к ЕГЭ
1.
Получение солей.Лекция №13
Подготовка к ЕГЭ
2.
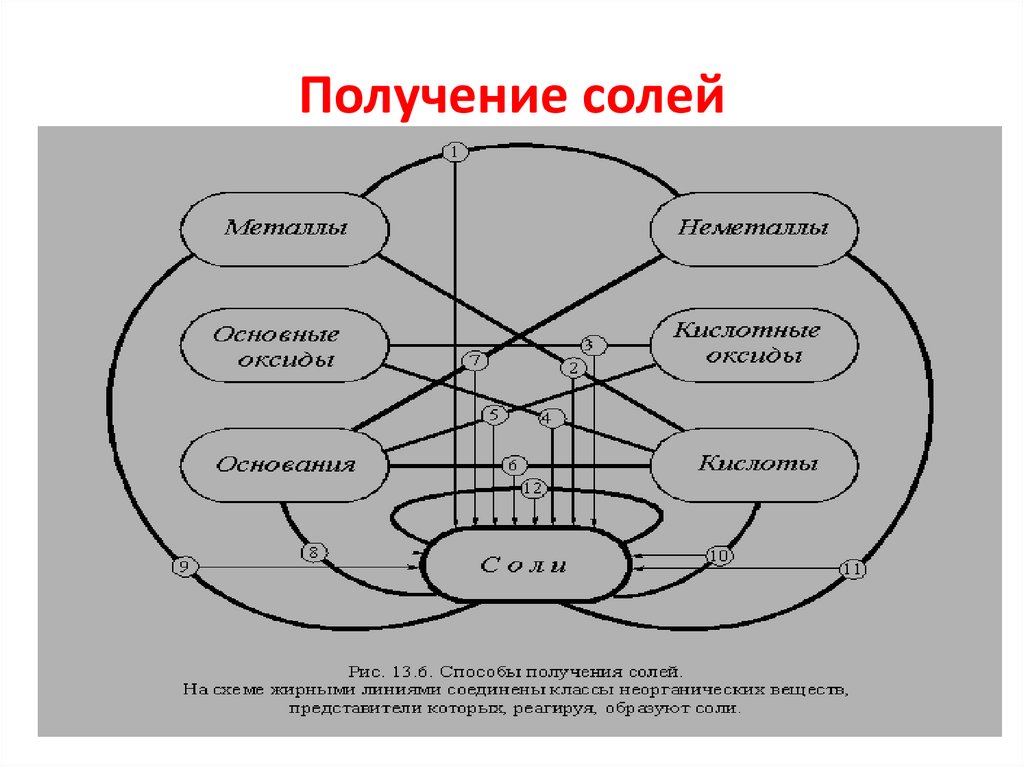
Получение солей3.
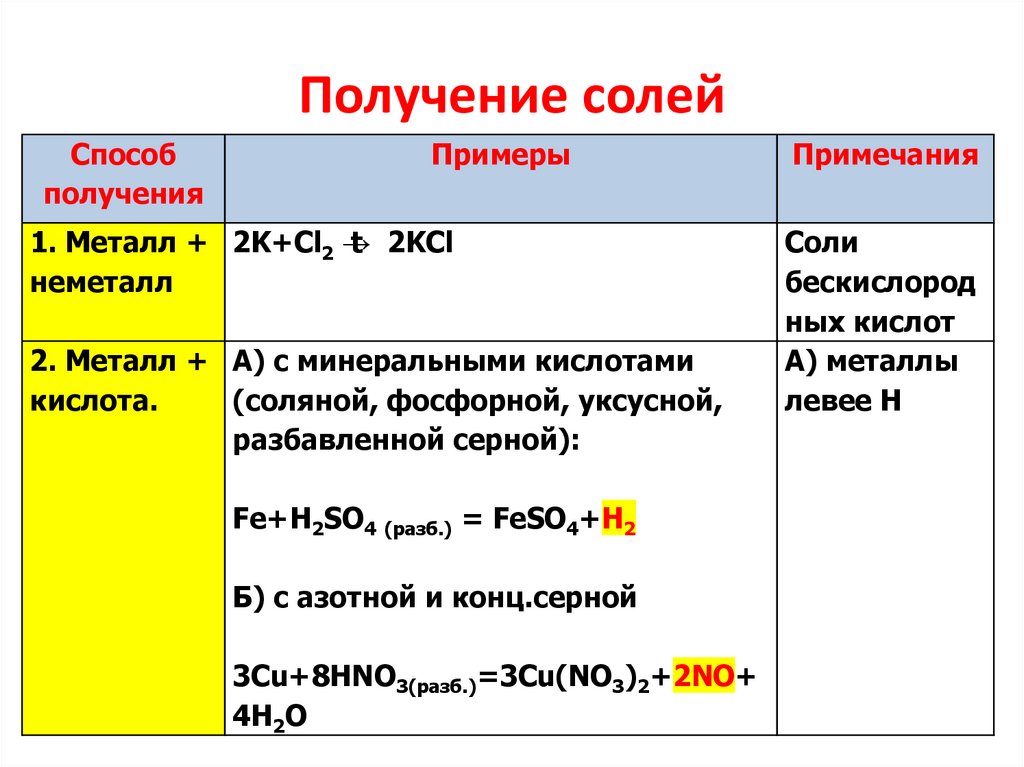
Получение солейСпособ
получения
Примеры
1. Металл + 2K+Cl2 →
t 2KCl
неметалл
2. Металл + А) с минеральными кислотами
кислота.
(соляной, фосфорной, уксусной,
разбавленной серной):
Fe+H2SO4 (разб.) = FeSO4+H2
Б) с азотной и конц.серной
3Cu+8HNO3(разб.)=3Cu(NO3)2+2NO+
4H2O
Примечания
Соли
бескислород
ных кислот
А) металлы
левее Н
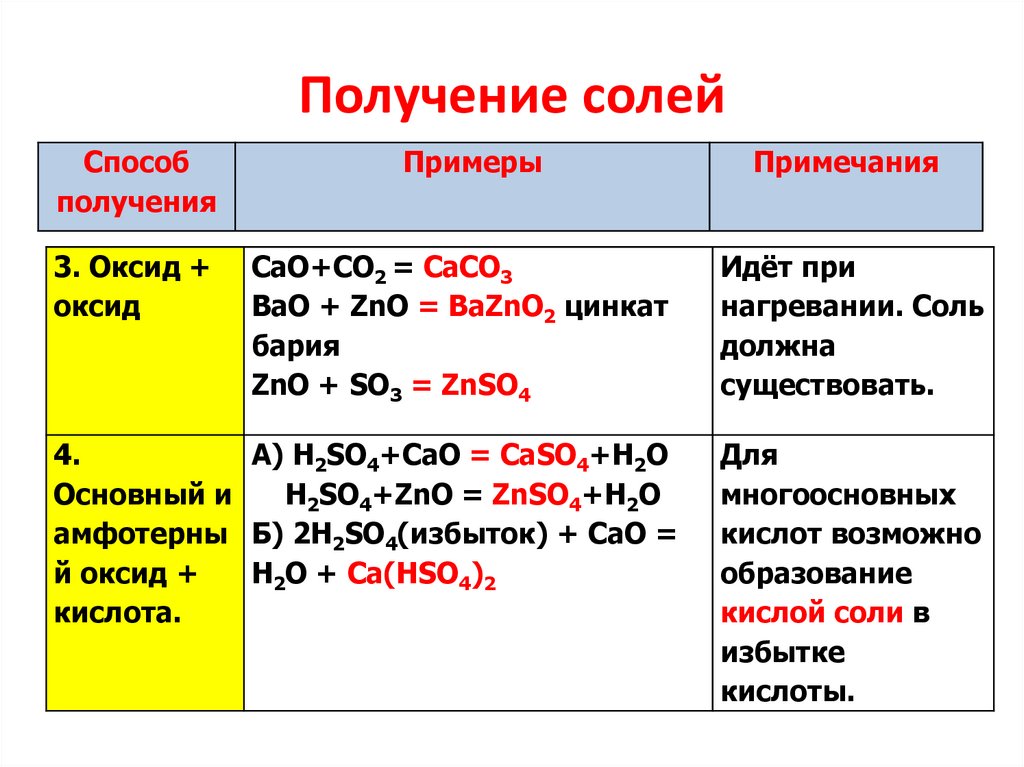
4.
Получение солейСпособ
получения
3. Оксид +
оксид
Примеры
CaO+CO2 = CaCO3
ВаО + ZnO = BaZnO2 цинкат
бария
ZnO + SO3 = ZnSO4
4.
А) H2SO4+CаO = CаSO4+H2O
Основный и
H2SO4+ZnO = ZnSO4+H2O
амфотерны Б) 2H2SO4(избыток) + СаО =
й оксид +
H2O + Са(НSО4)2
кислота.
Примечания
Идёт при
нагревании. Соль
должна
существовать.
Для
многоосновных
кислот возможно
образование
кислой соли в
избытке
кислоты.
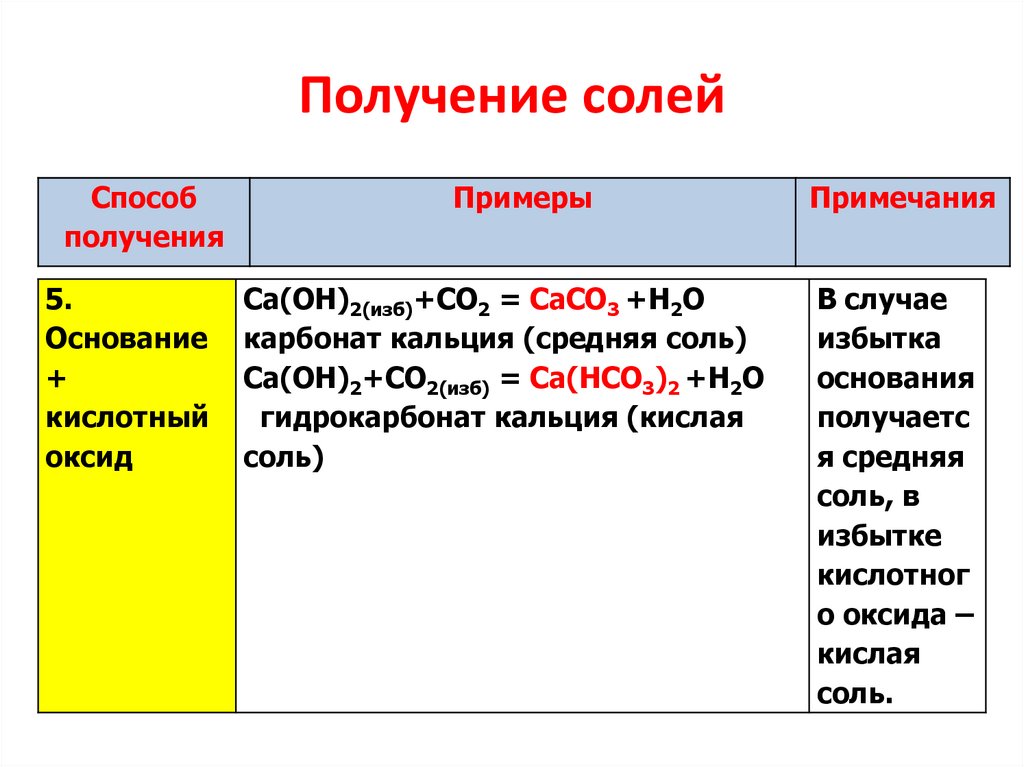
5.
Получение солейСпособ
получения
5.
Основание
+
кислотный
оксид
Примеры
Ca(OH)2(изб)+CO2 = CaCO3 +H2O
карбонат кальция (средняя соль)
Ca(OH)2+CO2(изб) = Ca(НCO3)2 +H2O
гидрокарбонат кальция (кислая
соль)
Примечания
В случае
избытка
основания
получаетс
я средняя
соль, в
избытке
кислотног
о оксида –
кислая
соль.
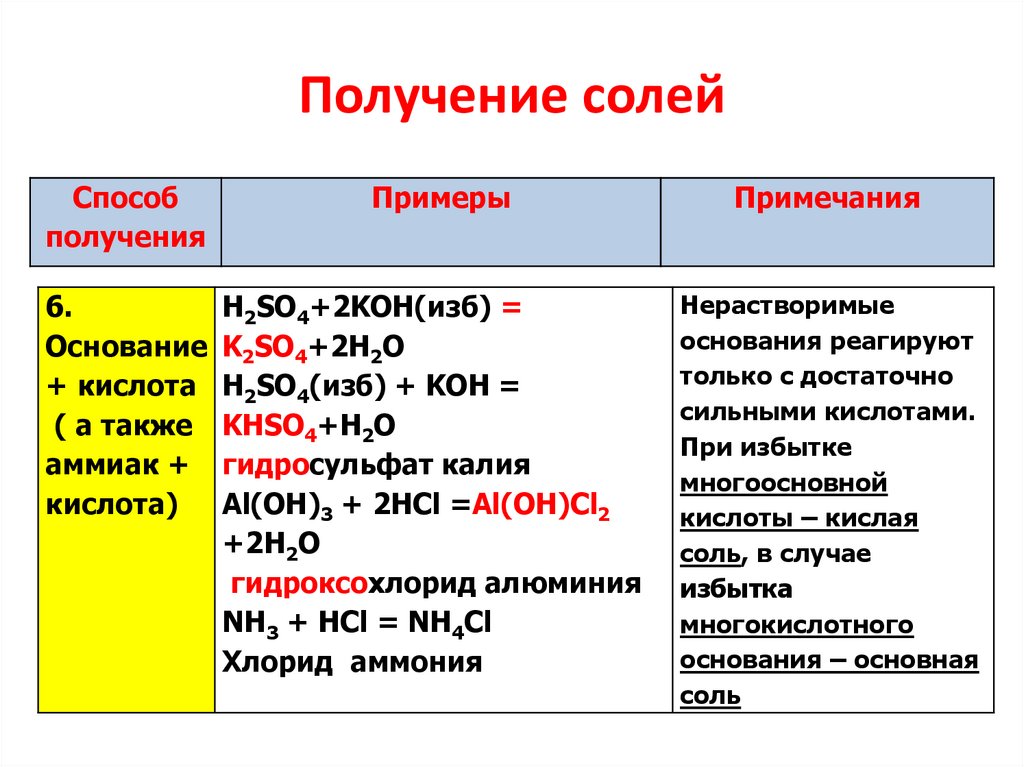
6.
Получение солейСпособ
получения
6.
Основание
+ кислота
( а также
аммиак +
кислота)
Примеры
H2SO4+2KOH(изб) =
K2SO4+2H2O
H2SO4(изб) + KOH =
KНSO4+H2O
гидросульфат калия
Al(OH)3 + 2HCl =Al(OH)Cl2
+2Н2О
гидроксохлорид алюминия
NH3 + HCl = NH4Cl
Хлорид аммония
Примечания
Нерастворимые
основания реагируют
только с достаточно
сильными кислотами.
При избытке
многоосновной
кислоты – кислая
соль, в случае
избытка
многокислотного
основания – основная
соль
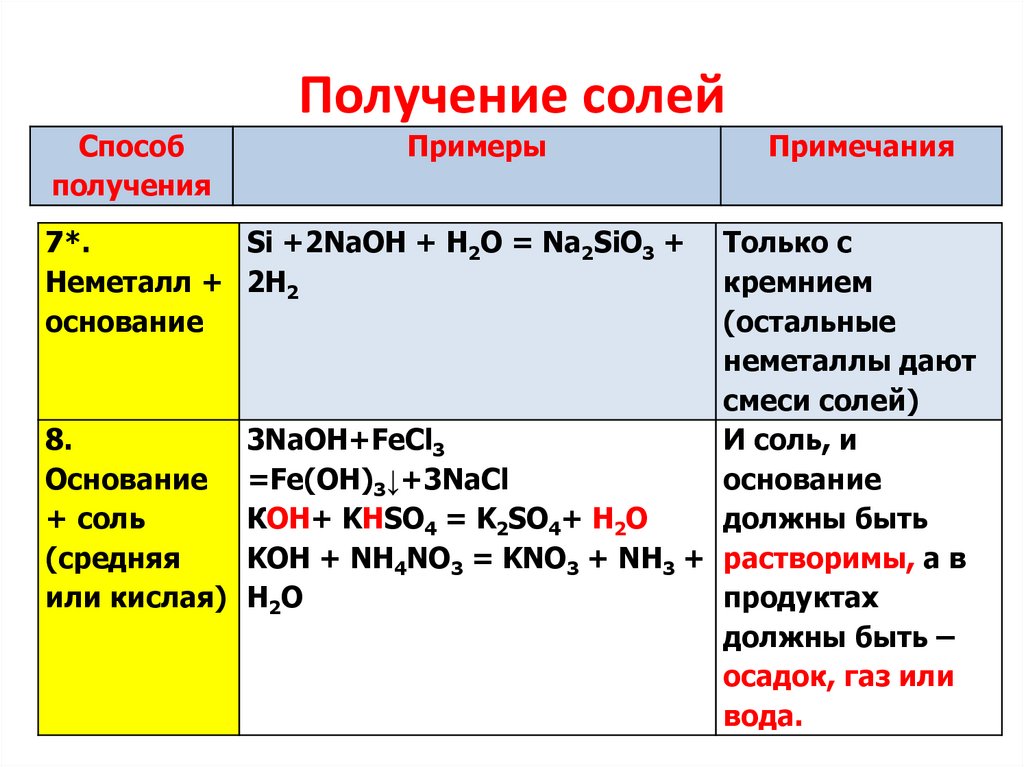
7.
Получение солейСпособ
получения
Примеры
7*.
Si +2NaOH + H2O = Na2SiO3 +
Неметалл + 2H2
основание
Примечания
Только с
кремнием
(остальные
неметаллы дают
смеси солей)
8.
3NaOH+FeCl3
И соль, и
Основание =Fe(OH)3↓+3NaCl
основание
+ соль
КОН+ KHSO4 = K2SO4+ H2O
должны быть
(средняя
KOH + NH4NO3 = KNO3 + NH3 + растворимы, а в
или кислая) H2O
продуктах
должны быть –
осадок, газ или
вода.
8.
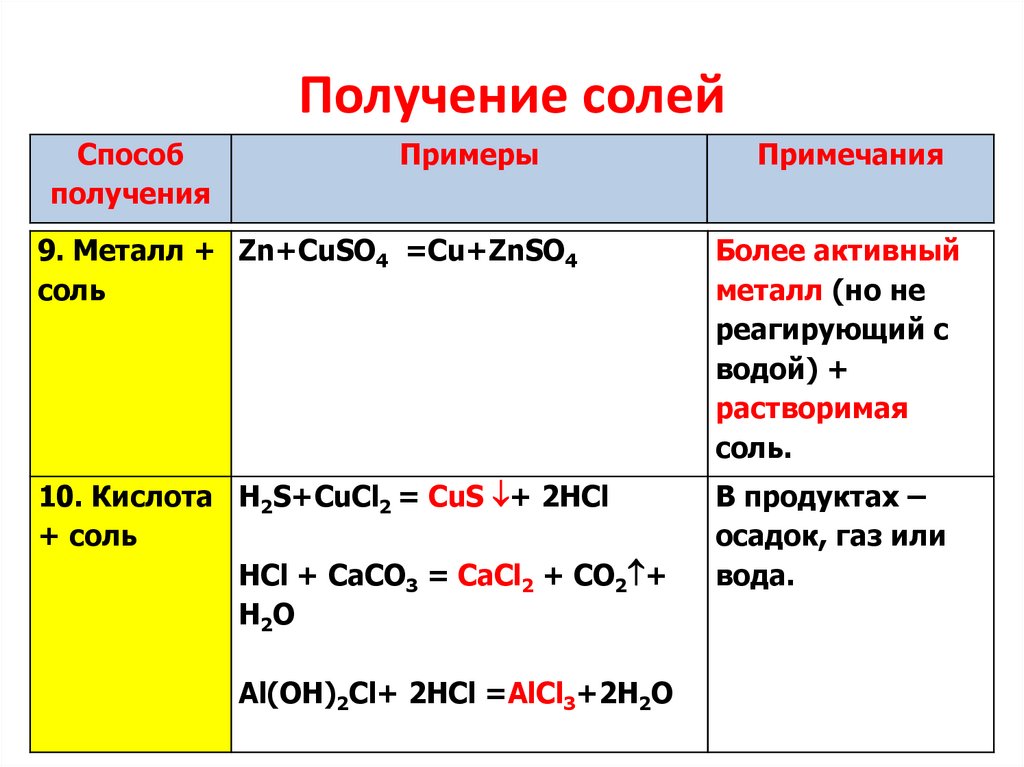
Получение солейСпособ
получения
Примеры
Примечания
9. Металл + Zn+CuSO4 =Cu+ZnSO4
соль
Более активный
металл (но не
реагирующий с
водой) +
растворимая
соль.
10. Кислота H2S+CuCl2 = CuS + 2HCl
+ соль
HCl + CaCO3 = CаСl2 + CO2 +
H 2O
В продуктах –
осадок, газ или
вода.
Al(OH)2Cl+ 2HCl =AlCl3+2H2O
9.
Получение солейСпособ
получения
Примеры
11*.
Cl2 + KI = KCl + I2
Неметалл +
соль
12. Соль + AgNO3+KCl=AgCl↓+KNO3
соль
(обе
растворимы
е!)
Примечания
Более активный
галоген
вытесняет из
соли менее
активный.
Реакцию идёт,
если хотя бы
одна из
образующихся
солей выпадает в
осадок.
* способ, применимый ТОЛЬКО для данного вещества (веществ).
10.
Источники• http://egeigia.ru/all-ege/materialyege/himiya/566-ege-him-2012-5
11.
• Автор: Калитина Тамара Михайловна• Место работы: МБОУ СОШ №2
с.Александров-Гай Саратовской области
• Должность: учитель химии
• Дополнительные сведения: сайт
http://kalitina.okis.ru/
• Мини-сайт http://www.nsportal.ru/kalitinatamara-mikhailovna




 chemistry
chemistry








