Similar presentations:
Кислородные соединения азота. Оксиды. Кислоты. Соли
1.
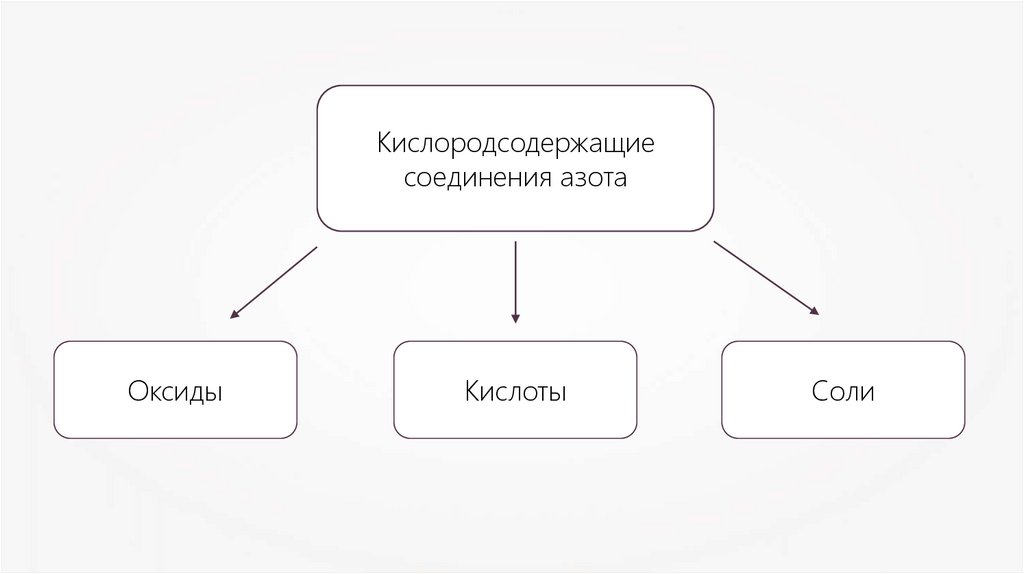
Кислородсодержащиесоединения азота
Оксиды
Кислоты
Соли
2.
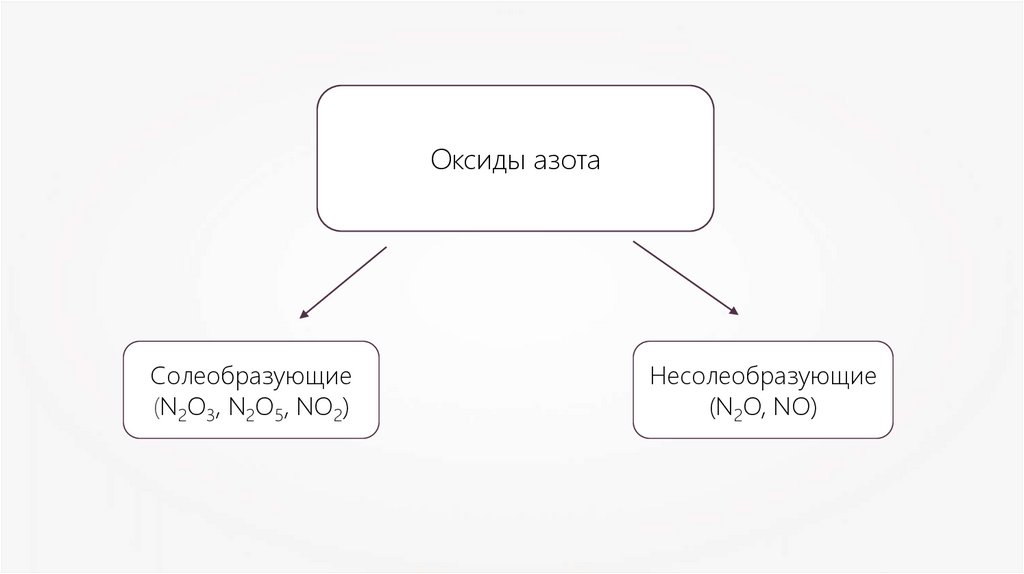
Оксиды азотаСолеобразующие
(N2O3, N2O5, NO2)
Несолеобразующие
(N2O, NO)
3.
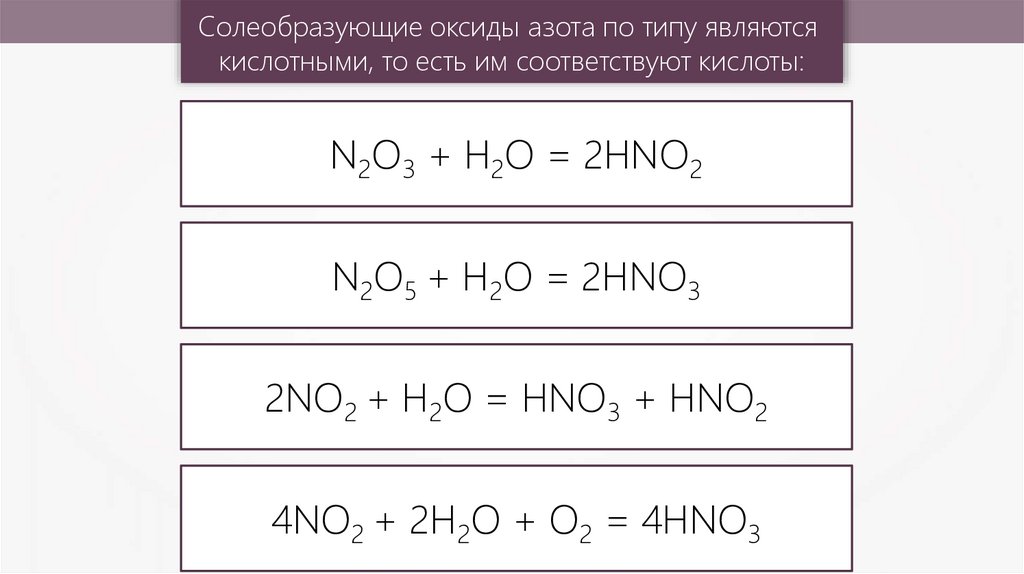
Солеобразующие оксиды азота по типу являютсякислотными, то есть им соответствуют кислоты:
N2O3 + Н2О = 2HNO2
N2O5 + Н2О = 2HNO3
2NO2 + Н2О = HNO3 + HNO2
4NO2 + 2Н2О + О2 = 4HNO3
4.
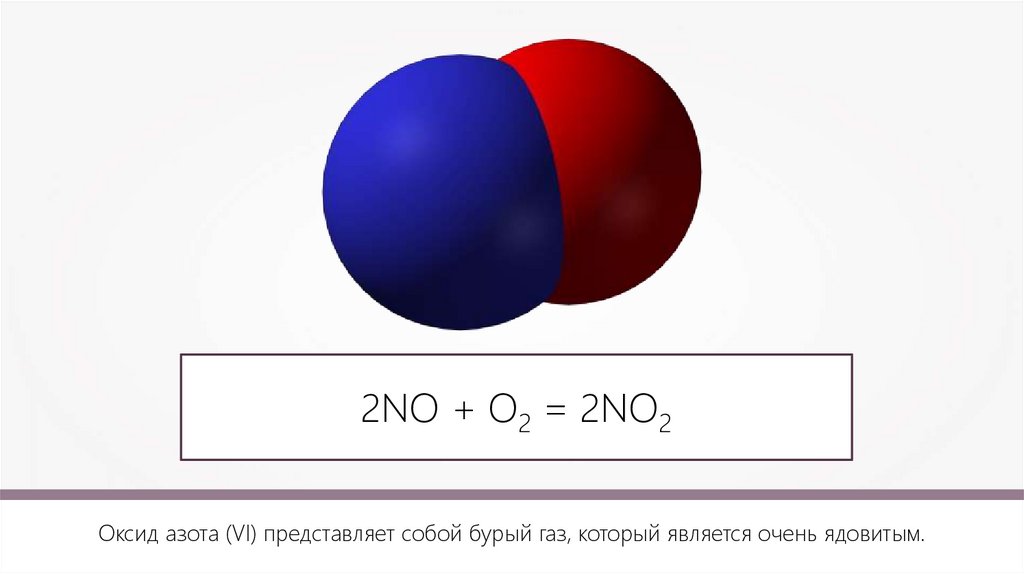
2NO + О2 = 2NO2Оксид азота (VI) представляет собой бурый газ, который является очень ядовитым.
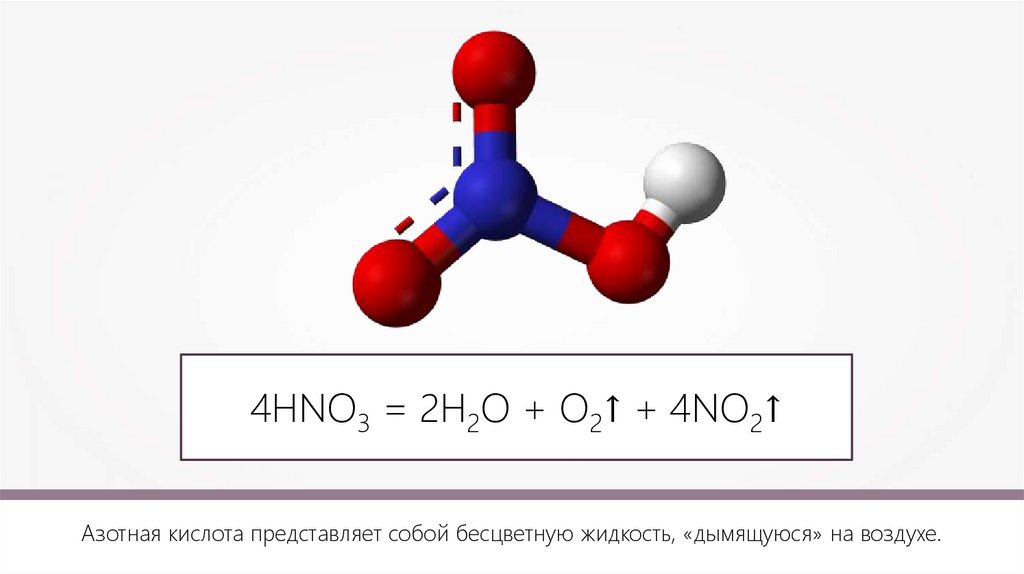
5.
4HNO3 = 2Н2О + О2↑ + 4NO2↑Азотная кислота представляет собой бесцветную жидкость, «дымящуюся» на воздухе.
6.
Химические свойства азотной кислотыВзаимодействует с основными оксидами:
2HNO3 + СаО = Са(NO3)2 + Н2О
Взаимодействует с амфотерными оксидами:
2HNO3 + ZnO = Zn(NO3)2 + Н2О
Взаимодействует с основаниями:
HNO3 + NaOH = NaNO3 + H2O
Взаимодействует с амфотерными гидроксидами:
3HNO3 + Al(OH)3 = Al(NO3)3 + 3H2O
Взаимодействует с солями:
2HNO3 + СaCO3 = Са(NO3)2 + Н2О + CO2↑
7.
При взаимодействии азотной кислоты с металлами невыделяется водород.
Продукт реакции зависит от нескольких факторов:
положения металла в ряду активности, концентрации
кислоты, условий проведения реакции.
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2↑ + 2H2O
8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
8.
9.
Азотная кислота — сильный окислитель. Она способна окислятьмногие органические вещества, обесцвечивать красители.
10.
Применение азотной кислоты:– производство минеральных азотных удобрений;
– производство искусственных волокон;
– производство пластических масс;
– производство лекарств;
– производство органических красителей и лаков;
– производство взрывчатых веществ.
11.
Нитраты — соли азотной кислоты.Соли азотной кислоты, такие как нитрат
натрия NaNO3, нитрат калия KNO3, нитрат
кальция Ca(NO3)2, нитрат аммония NH4NO3
называют селитрами и используют
в качестве азотных удобрений.
12.
KNO3 используют при изготовлениичёрного пороха.
NH4NO3 применяют в изготовлении
аммонала.
AgNO3 используют в медицине в качестве
прижигающего средства.
13.
14.
При нагревании нитраты разлагаютсяс выделением кислорода:
Ca(NO3)2 = Ca(NO2)2 + O2↑





 chemistry
chemistry








