Similar presentations:
Аммиак
1.
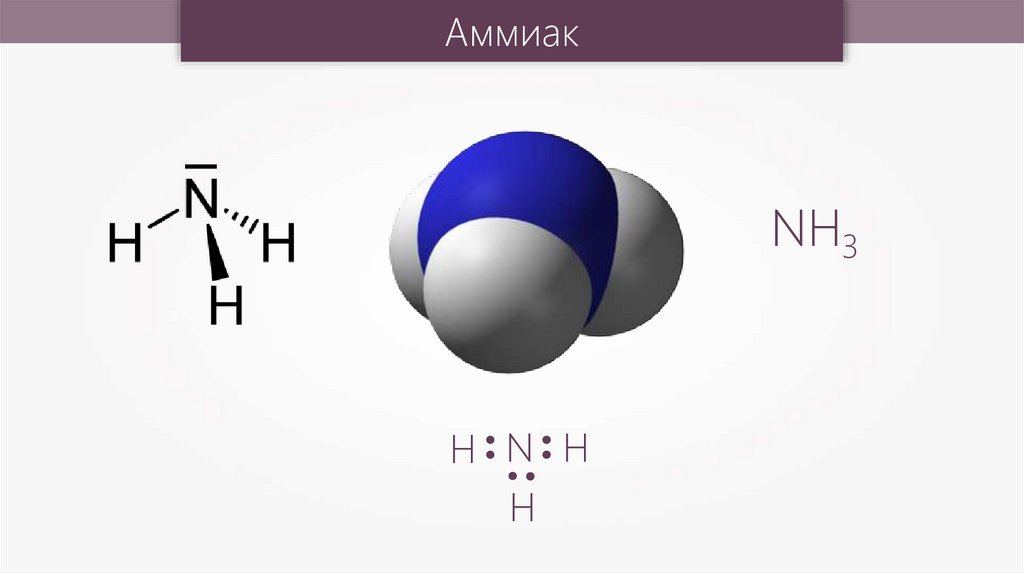
АммиакNH3
H N H
H
2.
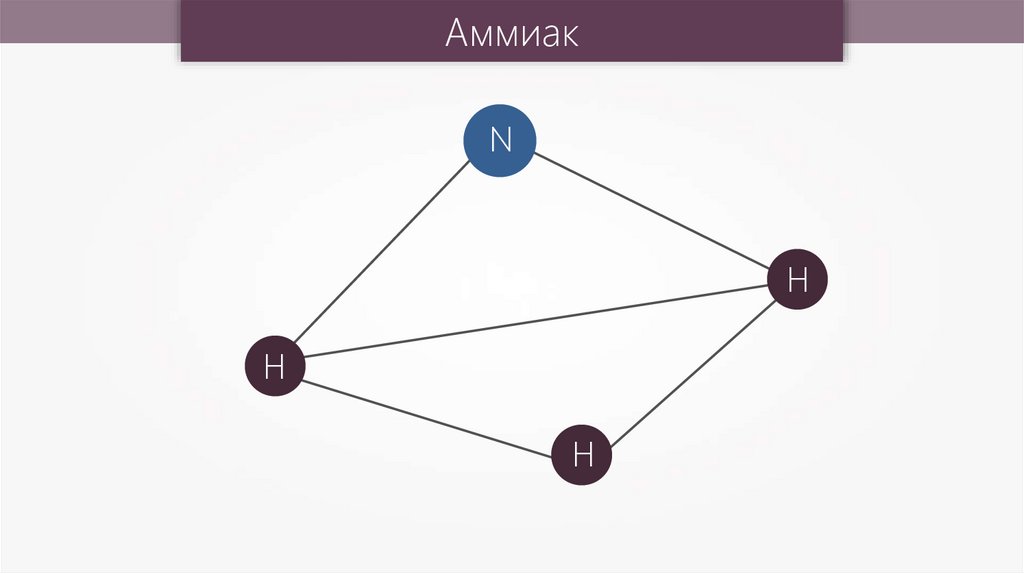
АммиакN
H
H
H
3.
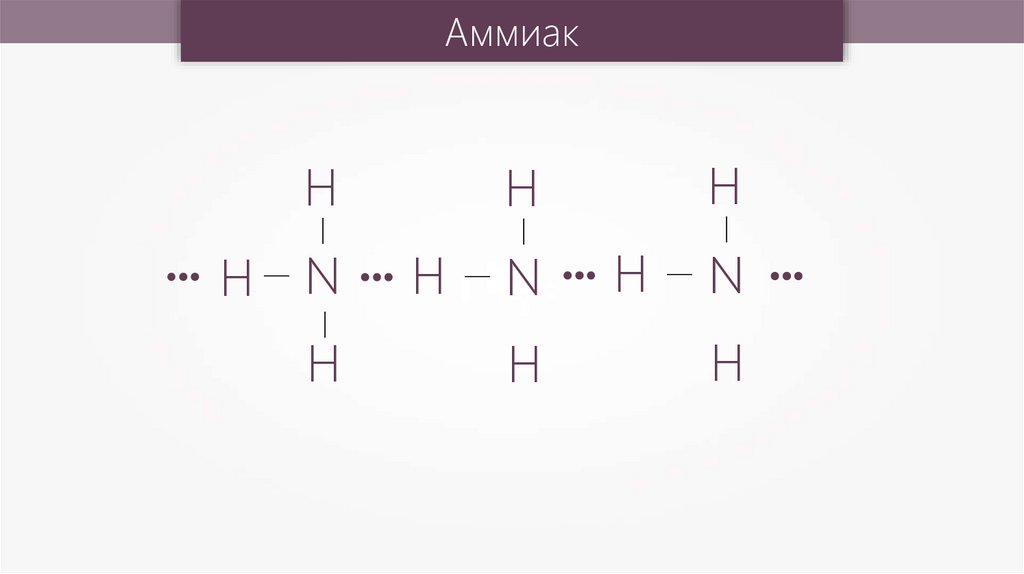
АммиакH
—
N
H
H
—
—
H
H
—
—
H— N
H
H
—
N
H
4.
Аммиак5.
Аммиак переходит из газообразного вжидкое состояние уже при –33,4 оС.
Процесс испарения жидкого аммиака
сопровождается поглощением тепла из
окружающей среды, такая особенность
позволяет использовать аммиак в
холодильных установках.
6.
АммиакАммиачная вода
Нашатырный спирт
7.
Гидрат аммиака8.
Гидрат аммиакаФенолфталеин
Гидрат аммиака
NH4OH
9.
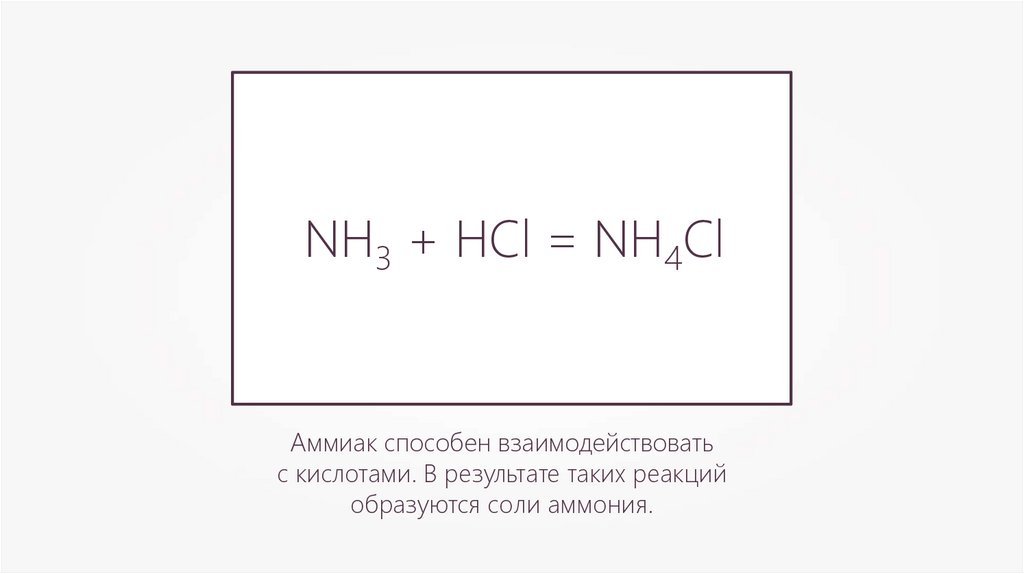
NH3 + HCl = NH4ClАммиак способен взаимодействовать
с кислотами. В результате таких реакций
образуются соли аммония.
10.
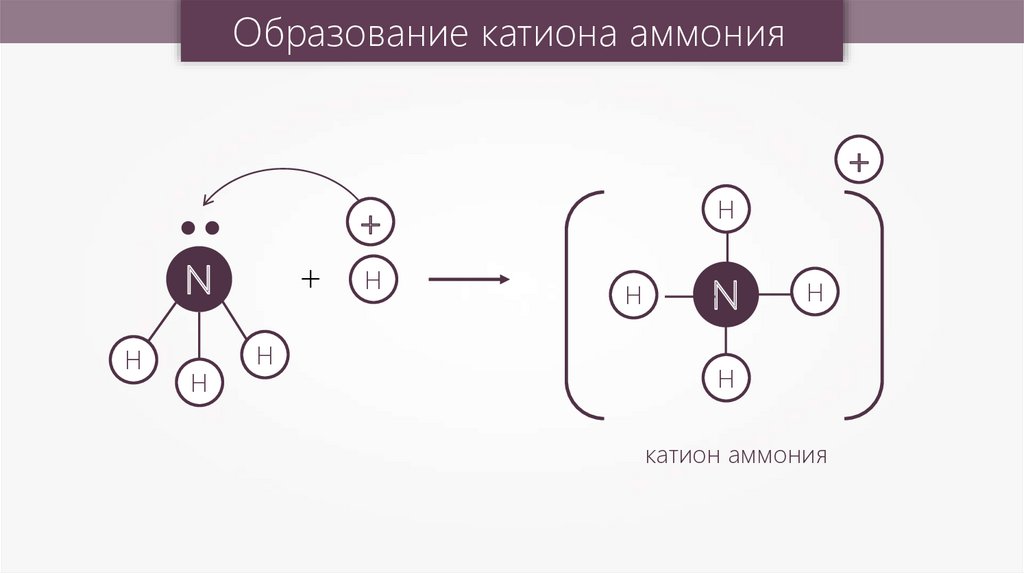
Образование катиона аммония+
H
+
+
N
H
H
H
H
H
N
H
H
катион аммония
11.
Степень окисления азота в молекулеаммиака минимальная отрицательная
и равна –3, следовательно, аммиак в
окислительно-восстановительных
реакциях может выступать
исключительно в роли
восстановителя.
12.
4NH3 + 3O2 = 2N2 + 6H2O4NH3 + 5O2 = 4NO + 6H2O
Без участия катализатора аммиак окисляется
кислородом до свободного азота, в присутствии
катализатора — до оксида азота (II).
13.
Получение аммиака в промышленностиN2 + 3H2 = 2NH3
14.
Распознать аммиак можно:По характерному запаху
Используя влажную лакмусовую бумажку,
которая в присутствии аммиака приобретёт
синюю окраску
По белому дыму, который появляется при
внесении в аммиак стеклянной палочки,
смоченной соляной кислотой
15.
Применение аммиакаИспользование в холодильных установках
Производство азотной кислоты
Производство минеральных удобрений
Использование для паяния
Для получения взрывчатых веществ
Использование в медицине и быту










 chemistry
chemistry








