Similar presentations:
Требования, особенности, оценка знаний по химии. ОГЭ - 2016
1.
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕТребования, особенности,
оценка знаний по химии.
ОГЭ - 2016
Родионова Марина Васильевна,
методист ГБОУ ДППО ЦПКС
Красногвардейского района СанктПетербурга «Информационнометодический центр»
2.
Нормативное обеспечение• Федеральный закон от 29.12.2013 № 273-ФЗ
«Об образовании в Российской Федерации»
• Приказ Минобрнауки России №1394 от 25.12.2013
«Об утверждении Порядка проведения государственной
итоговой аттестации по образовательным программам
основного общего образования»
• Приказ Министерства образования и науки РФ от 26.12.2013
№1400 «Об утверждении Порядка проведения
государственной итоговой аттестации по образовательным
программам среднего общего образования» (с изменениями
от 07.07.2015)
3.
Итоговая аттестацияОсновные задачи:
объективность проведения
создание условий для участников с ОВЗ
снижение уровня психологической
нагрузки для участников ГИА
4.
Формы ГИАГосударственная
итоговая аттестация
ОГЭ или ЕГЭ
Контрольные измерительные
материалы (КИМ) комплексы заданий
стандартизированной формы
- для обучающихся
образовательных организаций;
- для лиц, освоивших ОП
ООО в форме семейного
образования (самообразования)
и допущенных
в текущем году к ГИА
ГВЭ
Письменные и устные экзамены
с использованием текстов, тем,
заданий, билетов
- для обучающихся
специальных учебно-воспитательных
учреждений закрытого типа;
- обучающихся образовательных
организаций за пределами РФ;
- обучающихся с ОВЗ, инвалидов
5.
К ГИА допускаются обучающиесяне имеющие академической задолженности
в полном объеме выполнившие учебный план
либо
получившие отметки не ниже удовлетворительных на
промежуточной аттестации (экстерны)
6.
ГИА – 9 включает в себя:• обязательные экзамены по русскому языку и
математике
• обязательные экзамены по двум учебным
предметам по выбору:
физика, химия, биология, литература, география,
история, обществознание, иностранные языки
(английский, французский, немецкий и испанский
языки), информатика и информационнокоммуникационные технологии (ИКТ)
7.
Правительство Санкт-ПетербургаКомитет по образованию
В 2016 году
результаты экзаменов по выбору
(в том числе неудовлетворительные)
не влияют на получение аттестата об
основном общем образовании.
8.
Механизм обеспечения объективности проведения ГИАувеличение количества аудиторий с наблюдением в
режиме oн-лайн
расширение практики общественного наблюдения
уточнение и корректировка инструкций для лиц,
привлекаемых к проведению ГИА
привлечение федеральных инспекторов и федеральных
общественных наблюдателей
совершенствование КИМов: удаление заданий с
выбором ответа
отказ от проведения отрытых рейтингов (не сравнивать
по результатам ЕГЭ школы и педагогов)
9.
НОВОВЕДЕНИЯпо снижению уровня психологической нагрузки
для обучающихся, не прошедших ГИА в основные сроки,
возможность пересдать русский язык и математику в
сентябре 2016 года
отдельный день для обществознания
дополнительный резервный день для проведения
экзаменов по всем учебным предметам
для обучающихся СПО и ВПЛ возможность выбора даты
написания итогового сочинения (изложения)
10.
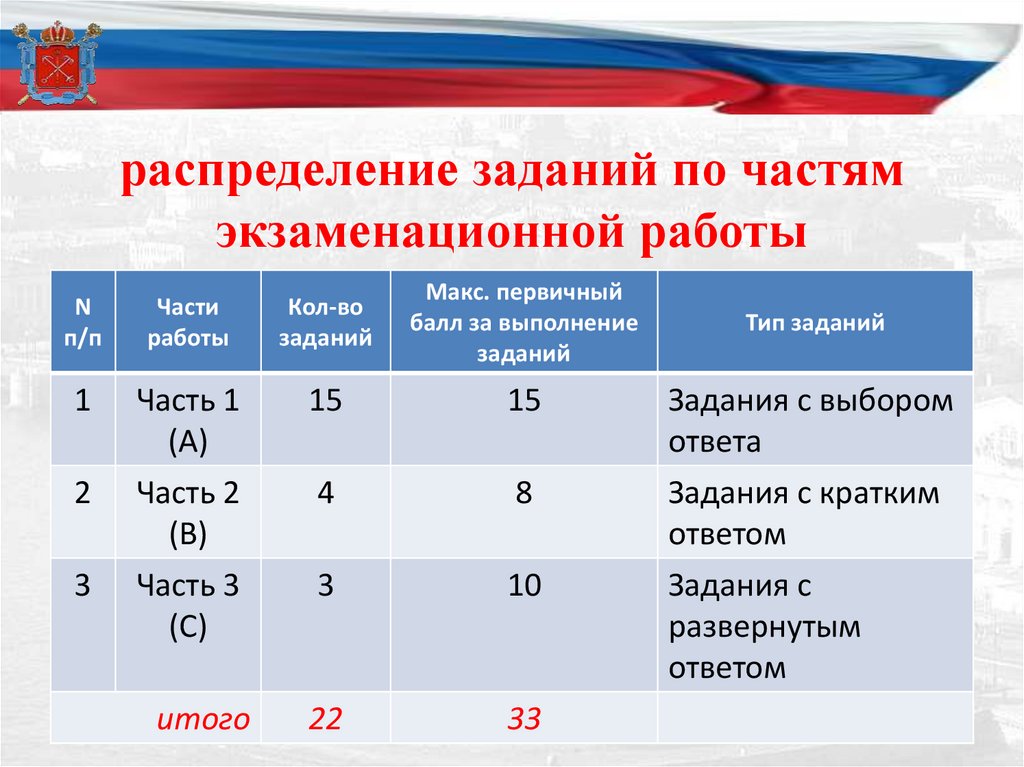
распределение заданий по частямэкзаменационной работы
N
п/п
Части
работы
Кол-во
заданий
Макс. первичный
балл за выполнение
заданий
1
Часть 1
(А)
15
15
Задания с выбором
ответа
2
Часть 2
(В)
4
8
Задания с кратким
ответом
3
Часть 3
(С)
3
10
Задания с
развернутым
ответом
итого
22
33
Тип заданий
11.
распределение заданий экзаменационнойработы по содержательным блокам курса
химии
N
п/п
Содержательные блоки
Кол-во
заданий
Макс. балл за
выполнение
заданий
каждого блока
1
Вещество
6
8
2
Химическая реакция
3
Элементарные основы неорганической химии.
Представления об органических веществах
5
8
8
12
4
Методы познания веществ и химических явлений.
Химия и жизнь
3
5
22
33
итого
12.
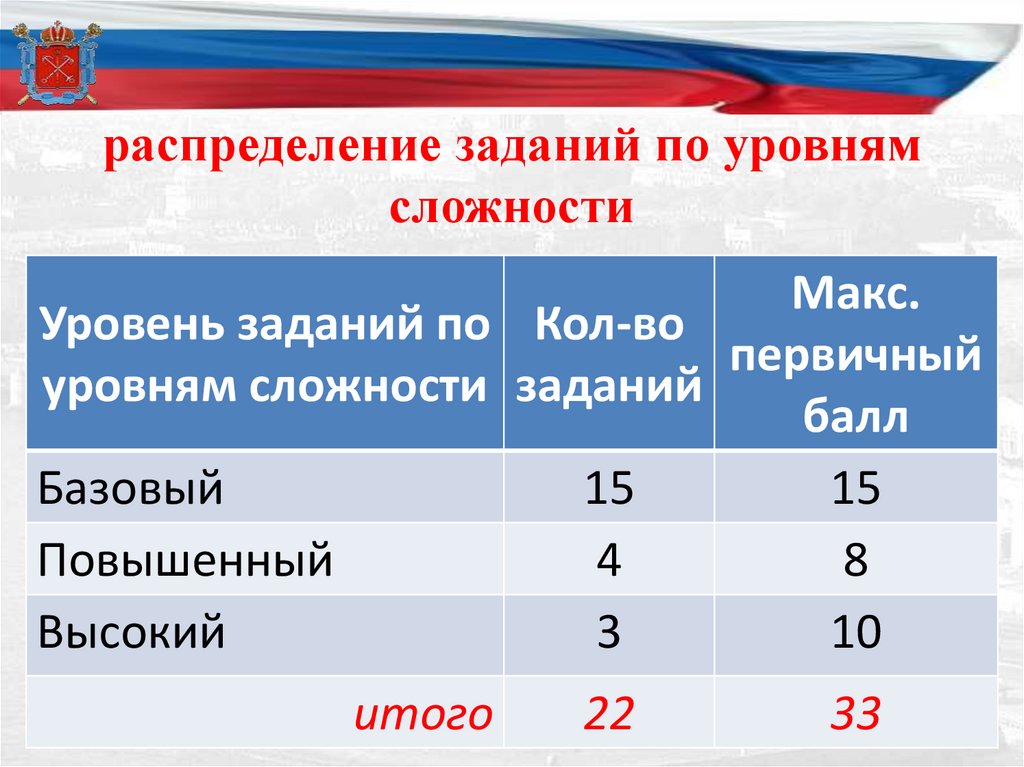
распределение заданий по уровнямсложности
Макс.
Уровень заданий по Кол-во
первичный
уровням сложности заданий
балл
Базовый
15
15
Повышенный
4
8
Высокий
3
10
итого
22
33
13.
шкала перевода первичных балллов вшкольную отметку
баллы 0-8 9-17 18-26 27-33
отметка 2
3
4
5
14.
сведения об участниках ОГЭ по химии2014 – 124 человека
2015 – 72 человека
2016 – заявлено 6,2 тыс.
человек
15.
структура работы ОГЭ по химии1-15 - на выбор одного правильного ответа
16 -17 - на выбор 2 правильных ответов из 5
18-19 - на соответствие
20 - на ОВР
21 - задача на растворы
23 - задание на знание качественных
реакций и свойств классов веществ
16.
время на написаниеработы ОГЭ по химии
120 минут
17.
наиболее типичные ошибки, выявленные взнаниях базового уровня
9. Химические свойства простых
веществ: металлов и неметаллов
11. Химические свойства оснований.
Химические свойства кислот
18.
наиболее типичные ошибки, выявленные взнаниях базового уровня
13. Чистые вещества и смеси. Правила
безопасной работы в школьной лаборатории.
Лабораторная посуда и оборудование. Человек в
мире веществ, материалов и химических
реакций. Проблемы безопасного использования
веществ и химических реакций в повседневной
жизни. Разделение смесей и очистка веществ.
Приготовление растворов. Химическое
загрязнение окружающей среды и его
последствия
19.
наиболее типичные ошибки, выявленные взнаниях повышенного уровня
17. Первоначальные сведения об
органических веществах…
19. Химические свойства простых
веществ. Химические свойства сложных
веществ
20.
Задание 20 (С1)Используя метод электронного баланса,
составьте уравнение реакции:
KNO3 + KI + H2SO4 → I2 + NO + K2SO4 + H2O
Определите окислитель и окислитель.
21.
Требования к выполнению задания 20 (С1)1) Составлен электронный баланс
2 N+3 + 1 е → N+2
1 2I-1 - 2 е → I 20
2) Указано, что йод в степени окисления -1 является
восстановителем, а азот в степени окисления +3 ( или
нитрит калия за счет азота в степени окисления +3) –
окислителем
3) Расставлены коэффициенты в уравнении реакции:
2KNO3 + 2KI + 2H2SO4 = I2 + 2NO + 2K2SO4 +
+ 2H2O
22.
Посмотрим варианты решения учащимисязадания 20 (С1)
Ученик №1
2
23.
Посмотрим варианты решения учащимисязадания 20 (С1)
Ученик №2
2
24.
Задание 21 (С2)Через раствор нитрата меди (II)
массой 37,6 г и массовой долей 5%
пропустили избыток сероводорода.
Вычислите массу осадка,
образовавшегося в результате
реакции.
25.
Требования к выполнению задания 21 (С2)1) Составлено уравнение реакции:
Cu(NO3)2 + H2S→ CuS + 2HNO3
2) Рассчитана масса и количество вещества
нитрата меди (II), содержащегося в
растворе:
m (Cu(NO3)2 = 36,5 * 0,05 = 1,88 г
n (Cu(NO3)2 = 1,88 :188 = 0,01 моль
3) Определена масса образовавшегося
осадка
m(CuS) = 0,01 * 96 = 0,96 г
26.
Посмотрим варианты решения учащимисязадания 21 (С2)
Ученик №1
3
27.
Посмотрим варианты решения учащимисязадания 21 (С2)
Ученик №2
3
28.
Посмотрим варианты решения учащимисязадания 21 (С2)
Ученик №3
1
29.
Посмотрим варианты решения учащимисязадания 21 (С2)
Ученик №4
3
30.
Посмотрим варианты решения учащимисязадания 21 (С2)
Ученик №5
1
31.
Задание 22 (С3)Для проведения эксперимента предложены следующие реактивы: Cu, CuO,
растворы: NaCl, AgNO3, HNO3, HCl.
Используя воду и необходимые вещества
из этого списка, получите в две стадии
хлорид серебра. Опишите признаки
проводимых реакций. Для второй реакции
напишите сокращенное ионное уравнение.
32.
Требования к выполнению задания 21 (С2)Составлены 2 уравнения реакции:
1) CuO +2 HCl = CuCl2 + H2O
2) CuCl2 + AgNO3 = Cu(NO3)2 + AgCl
Описаны признаки протекания реакции:
3) Для 1 реакции: растворение черного порошка
CuO с образованием голубого раствора CuCl2
4) Для 2 реакции: выпадение белого осадка AgCl
Составлено сокращенное ионное уравнение для
2 реакции:
5) Сl- + Ag+ = AgCl
33.
Посмотрим варианты решения учащимисязадания 22 (С3)
Ученик №1
0
34.
Посмотрим варианты решения учащимисязадания 22 (С3)
Ученик №2
2
35.
Посмотрим варианты решения учащимисязадания 22 (С3)
Ученик №3
4
36.
Посмотрим варианты решения учащимисязадания 22 (С3)
Ученик №4
5


































 chemistry
chemistry pedagogy
pedagogy








