Similar presentations:
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
1. Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению.
Соли – вещества, состоящиеиз катионов металлов и анионов
кислотного остатка
Соли – вещества,
образованные основанием и
кислотой
Марченко Е.П.
1
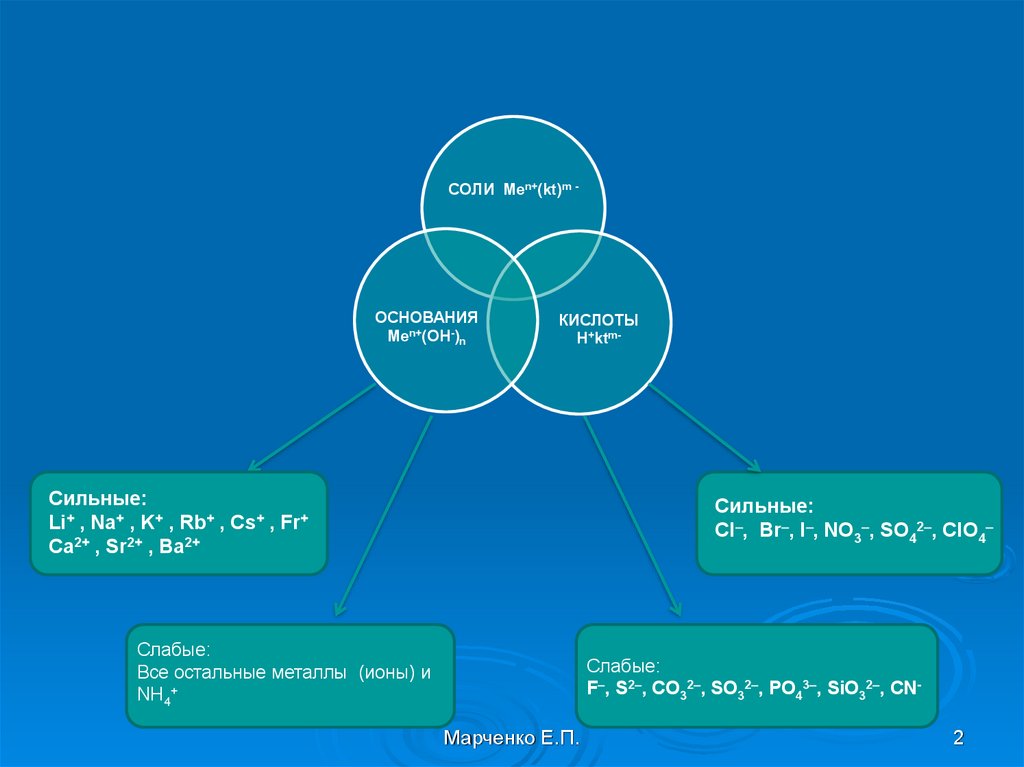
2.
СОЛИ Мen+(kt)m -ОСНОВАНИЯ
Men+(OH-)n
КИСЛОТЫ
H+ktm-
Сильные:
Li+ , Na+ , K+ , Rb+ , Cs+ , Fr+
Ca2+ , Sr2+ , Ba2+
Сильные:
Cl–, Br–, I–, NO3–, SO42–, ClO4–
Слабые:
Все остальные металлы (ионы) и
NH4+
Слабые:
F–, S2–, CO32–, SO32–, PO43–, SiO32–, CN-
Марченко Е.П.
2
3. Типы солей
Анионы (–)Катионы (+)
Сильное основание:
Слабое основание:
Li+ , Na+, K+, Rb+, Cs+,Fr+ Все остальные металлы
NH4+
Ca2+ , Sr2+ , Ba2+
Не гидролизуются
Сильная кислота:
Cl–, Br–, I–, NO3–, SO42–,
ClO42–
Слабая кислота:
F–, S2–, CO32–, SO32–,
PO43–, SiO32–, CN-
Среда: кислая (pH<7)
Гидролиз по катиону
Среда: щелочная (pH>7) Гидролизуются с
образованием слабых
Гидролиз по аниону
кислот и оснований
Марченко Е.П.
3
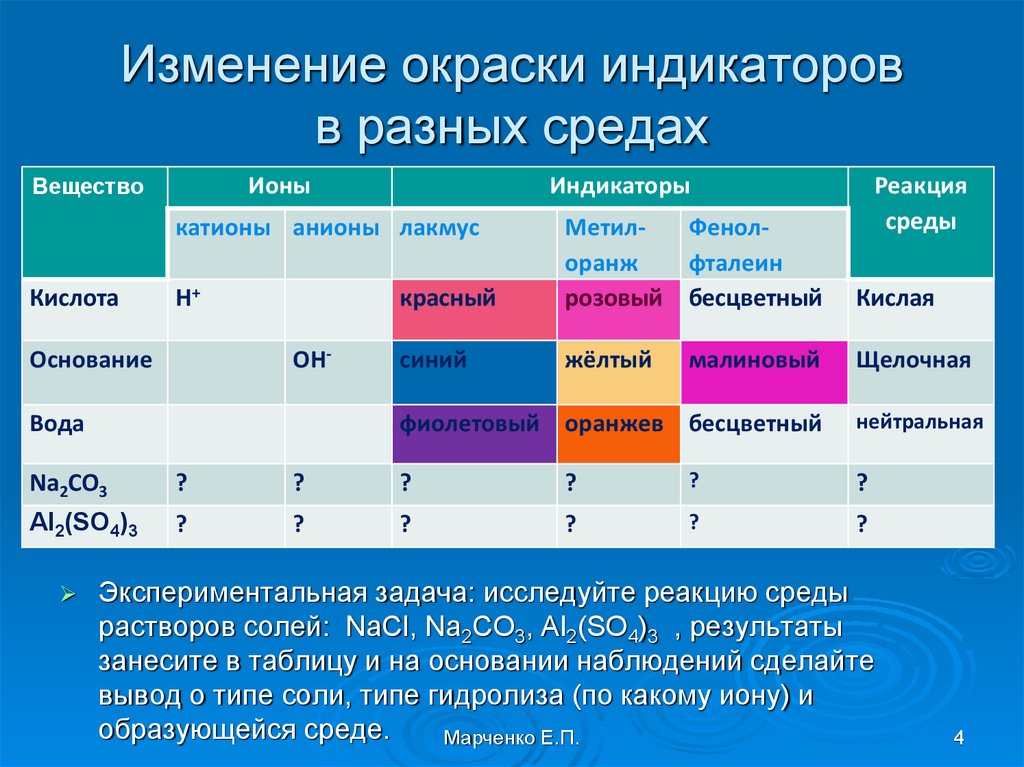
4. Изменение окраски индикаторов в разных средах
ВеществоИоны
Индикаторы
катионы анионы лакмус
Кислота
Н+
ОН-
Основание
Вода
Реакция
среды
красный
МетилФенолоранж
фталеин
розовый бесцветный
Кислая
синий
жёлтый
Щелочная
малиновый
фиолетовый оранжев бесцветный
нейтральная
Na2CO3
?
?
?
?
?
?
Al2(SO4)3
?
?
?
?
?
?
Экспериментальная задача: исследуйте реакцию среды
растворов солей: NaCl, Na2CO3, Al2(SO4)3 , результаты
занесите в таблицу и на основании наблюдений сделайте
вывод о типе соли, типе гидролиза (по какому иону) и
образующейся среде.
Марченко Е.П.
4
5. Экспериментальная задача
Веществокатионы анионы
NaCl
Na+
Na2CO3
Na+
Лакмус
Cl-
Метилоранж
фиолетовый оранжев
бесцветный
нейтральная
CO32-
синий
малиновый
Щелочная
бесцветный
ОНКислая
жёлтый
Фенолфталеин
по аниону
Al2(SO4)3
Al3+
SO42-
красный
розовый
Вывод
Н+
по катиону
Марченко Е.П.
5
6. ? Каким образом образуются в растворах солей ионы ОН- и Н+
Марченко Е.П.6
7. Составление уравнения гидролиза Соли, образованные сильным основанием и слабой кислотой
Na2CO3 + H2O ↔NaHCO3 + NaOH
гидрокарбонат
натрия
2Na+ + CO32- + H+OH- ↔
HCO3- + 2Na+ + OH(щелочная среда)
по аниону
Марченко Е.П.
7
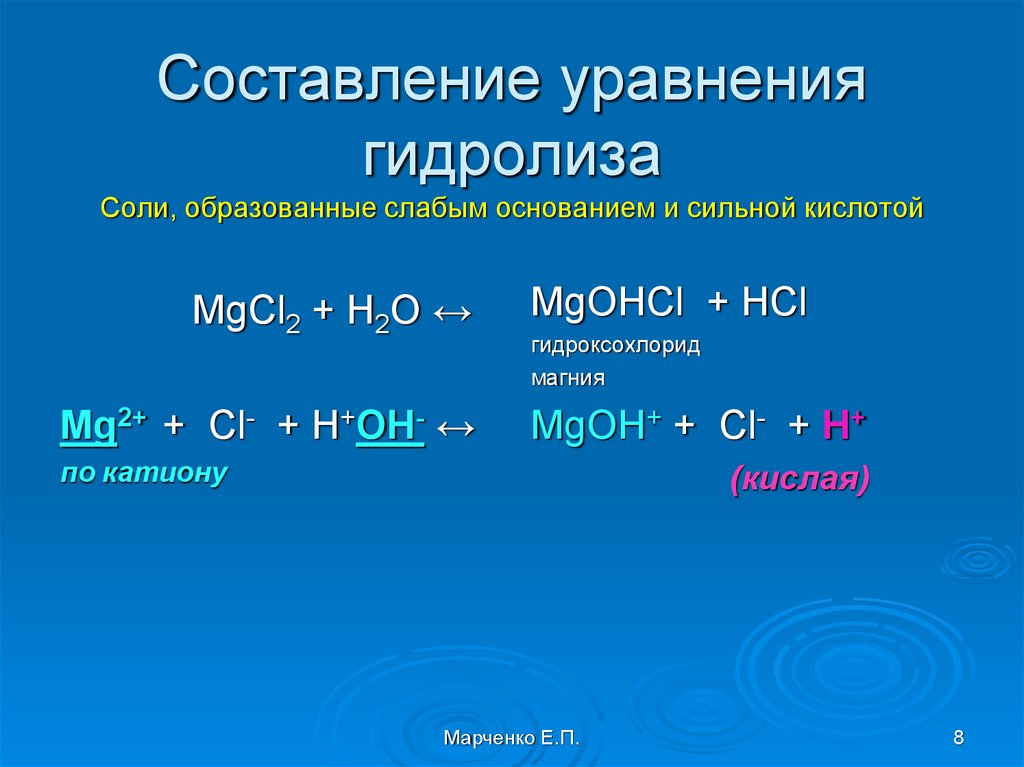
8. Составление уравнения гидролиза Соли, образованные слабым основанием и сильной кислотой
MgCl2 + H2O ↔Mg2+ + Cl- + H+OH- ↔
MgOHCl + HCl
гидроксохлорид
магния
MgOH+ + Cl- + H+
по катиону
(кислая)
Марченко Е.П.
8
9. Составление уравнения гидролиза Соли, образованные слабым основанием и слабой кислотой
Al2S3 + 6 H2O =2 Al(OH)3 +3 H2S
B реакцию с водой вступает и катион, и анион:
Гидролиз идёт по катиону и аниону
Марченко Е.П.
9
10.
Установление соответствия между составом соли,реакцией среды её водного раствора
и отношением к гидролизу.
Алгоритм выполнения задания
1. Определяем, каким основанием
и какой кислотой образована соль
Примеры
Al Cl3
Слабое осн. Сильная к-та
3+
2. Выбираем слабый ион, т.к.
Al - катион
гидролиз идёт по слабому иону
Сильная кислота
3. Выбираем сильный ион, т.к. он
определяет реакцию среды
Кислая среда
4. Формулируем вывод: соль образована слабым
основанием и сильной кислотой, гидролизуется по
катиону с образованием кислой среды
Марченко Е.П.
10
11. Закрепление («учимся говорить»)
Определите тип соли, тип гидролиза, реакцию средыпо алгоритму:
карбонат натрия Na2CO3 – соль образована сильным
основанием и слабой кислотой, гидролизуется по
аниону с образованием щелочной среды
AlCl3 Fe2S3 K2 SO4 FeBr2 CaCl2 Na3PO4 Сu(NO3)2
Помните:
1. Тип гидролиза определяем по слабому иону (катион
или анион)
2. Реакцию среды устанавливаем по сильному иону
(кислая, щелочная, нейтральная)
Марченко Е.П.
11
12. Гидролиз в ЕГЭ
Задания А-26 (ЕГЭ)Кислую среду имеет
водный раствор:
1. Na3PO4
2. KCl
3. Na2CO3
4. ZnSO4
Ответ: 4
Задания В-4 (ЕГЭ-2011)
Установите соответствие между
составом соли и реакцией среды
её водного раствора.
ФОРМУЛА СОЛИ
СРЕДА
РАСТВОРА
А) NaNO2
Б) Al2(SO4)3
В) NaNO3
Г) KCN
А
2
Марченко Е.П.
Б
1
В
3
1) кислая
2) щелочная
3) нейтральная
Г
2
12









 chemistry
chemistry








