Similar presentations:
Гидролиз органических и неорганических соединений
1. Гидролиз органических и неорганических соединений
ГПОУ «Макеевский медицинский колледж»Гидролиз органических и
неорганических соединений
преподаватель Ляскевич Л.Н.
2. Цели урока:
Ознакомиться с понятием гидролизасолей.
Рассмотреть типы гидролиза.
Научиться составлять ионные
уравнения гидролиза солей.
Научиться определять тип гидролиза
соли по её формуле.
3. Что такое гидролиз?
Гидролиз(от греческого hydro – вода;
lysis – разложение)
- взаимодействие органических и
неорганических веществ с водой
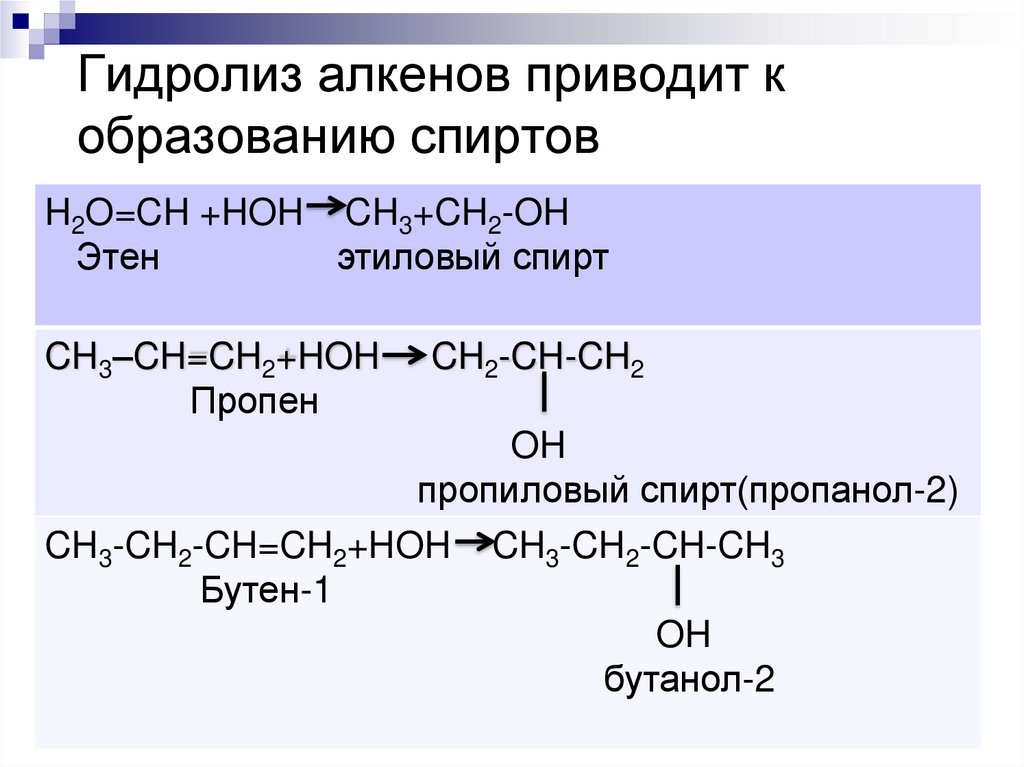
4. Гидролиз алкенов приводит к образованию спиртов
H2O=CH +HOH CH3+CH2-OHЭтен
этиловый спирт
CH3–CH=CH2+HOH
Пропен
CH2-CH-CH2
OH
пропиловый спирт(пропанол-2)
CH3-CH2-CH=CH2+HOH CH3-CH2-CH-CH3
Бутен-1
OH
бутанол-2
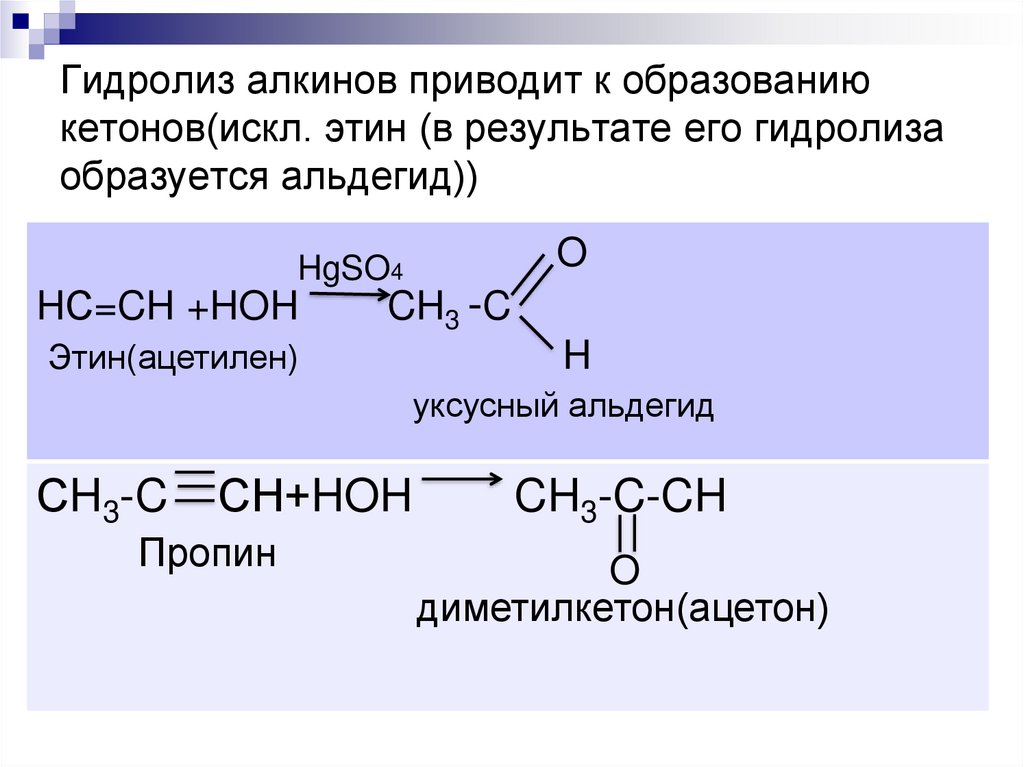
5. Гидролиз алкинов приводит к образованию кетонов(искл. этин (в результате его гидролиза образуется альдегид))
OHgSO4
HС=CH +HOH
CH3 -C
Этин(ацетилен)
H
уксусный альдегид
СH3-C
СН+HOH
Пропин
CH3-C-CH
O
диметилкетон(ацетон)
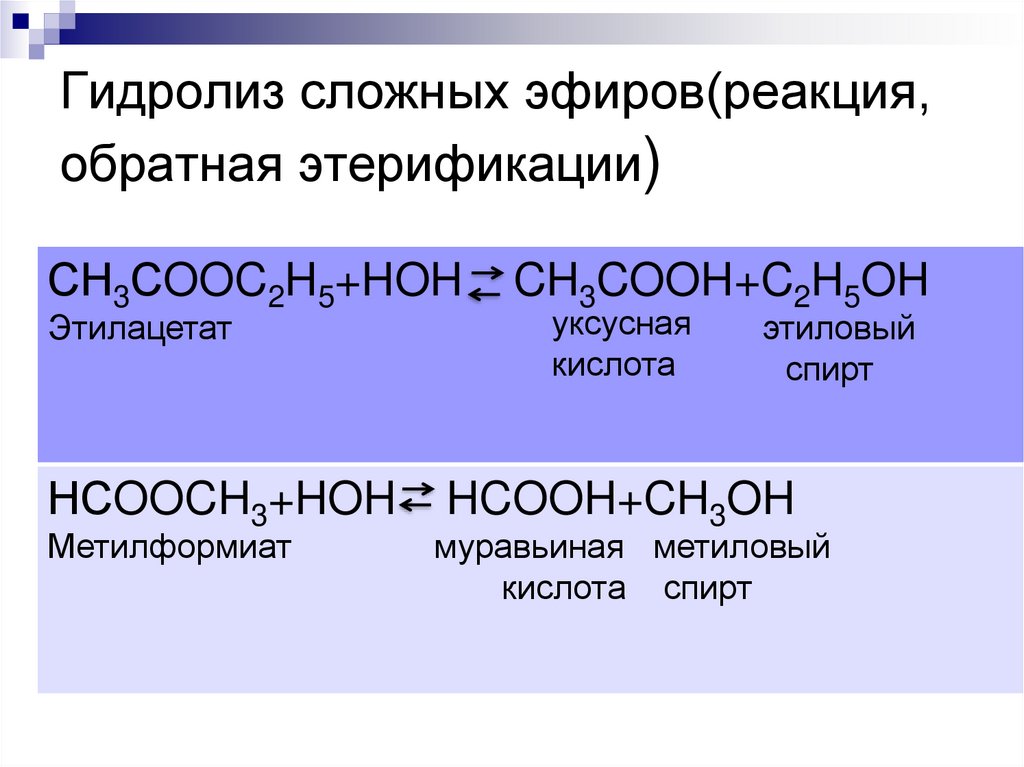
6. Гидролиз сложных эфиров(реакция, обратная этерификации)
СН3СOOC2H5+HOHЭтилацетат
НСOOCH3+HOH
Метилформиат
CH3COOH+C2H5OH
уксусная
кислота
этиловый
спирт
HCOOH+CH3OH
муравьиная метиловый
кислота спирт
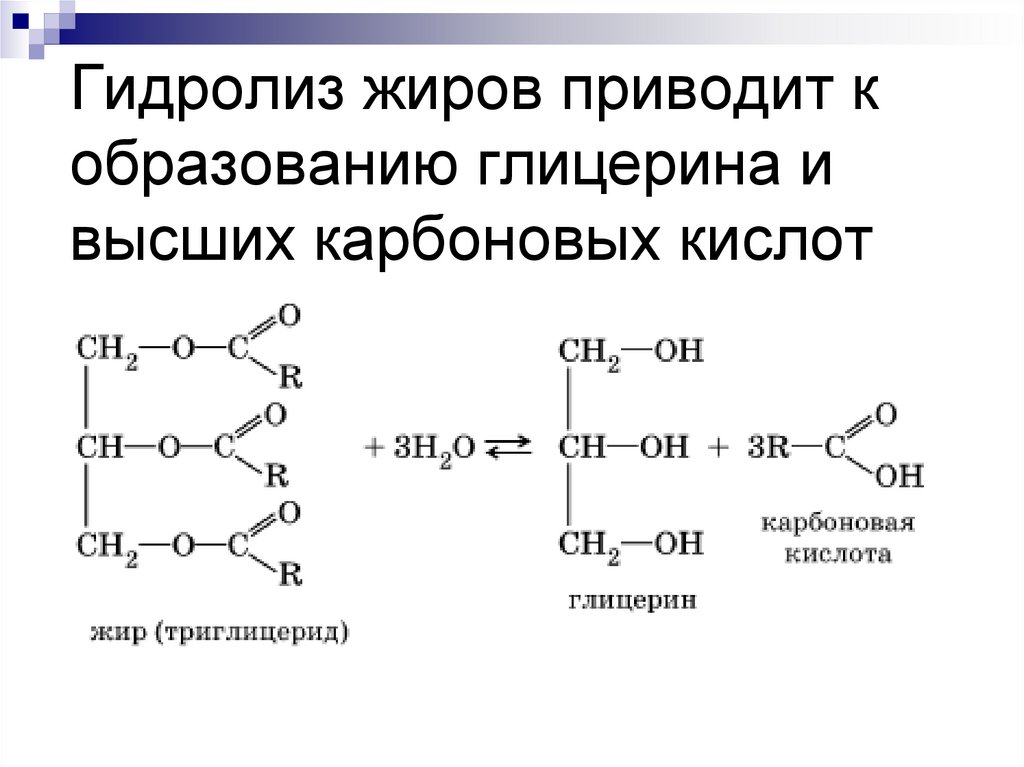
7. Гидролиз жиров приводит к образованию глицерина и высших карбоновых кислот
8. Гидролиз углеродов
C12H22O11 + H2Oсахароза
глюкоза
(C6H10O5)n + nH2O
Крахмал
C6H12O6 + C6H12O6
фруктоза
nC6H12O6
9. Определение гидролиза
Гидролиз соли – это химическаяреакция обмена соли с водой,
в результате которой ионы слабого
электролита, входящие в состав соли,
соединяются с составными частями
воды: H+ и OH- .
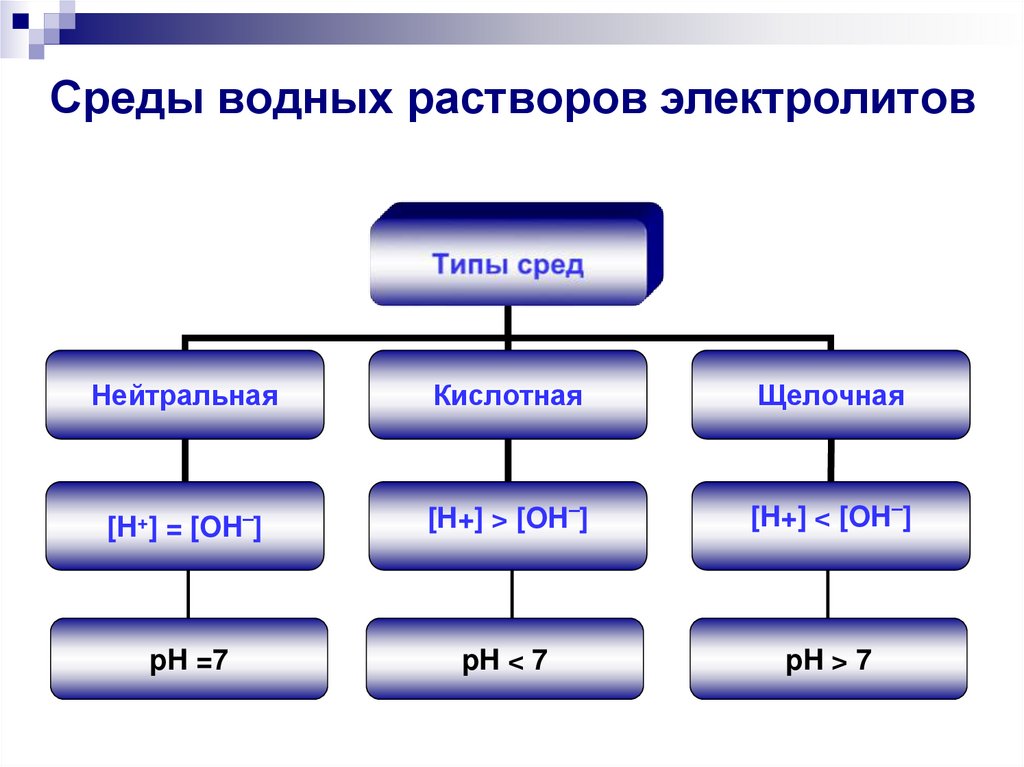
10. Среды водных растворов электролитов
НейтральнаяКислотная
Щелочная
[H+] = [OH–]
[H+] > [OH–]
[H+] < [OH–]
pH =7
pH < 7
pH > 7
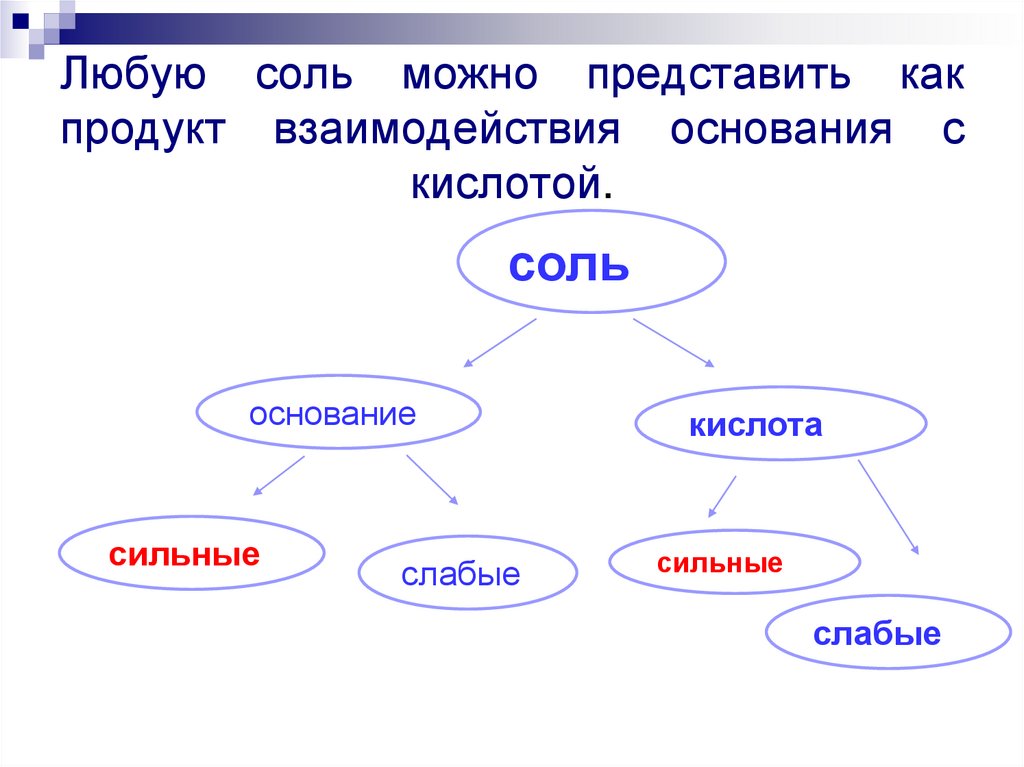
11. Любую соль можно представить как продукт взаимодействия основания с кислотой.
сольоснование
сильные
слабые
кислота
сильные
слабые
12. Электролиты
сильные: NaOH, KOH, H2SO4, HNO3,HClO4, HCl, HMnO4, HI, HBr;
слабые: , NH4OH, Cu(OH)2, Zn(OH)2,
Al(OH)3, H2SO3, H2CO3, H2SiO3, HF,
HNO2, СН3СООН
12
30.05.2023
Громова О.И
13.
1.Классификация солей
2.Соли, образованные сильной кислотой и
слабым основанием (AlCl3, FeSO4, Mn(NO3)2.)
1. Соли, образованные сильным основанием и
слабой кислотой (Na2CO3, КСN, NaCH3COO).
3. Соли, образованные слабой кислотой и
слабым основанием (NH4CN, Cu(CH3COO)2).
4. Соли, образованные сильной кислотой и
сильным основанием (NaCl, K2SO4, BaI2).
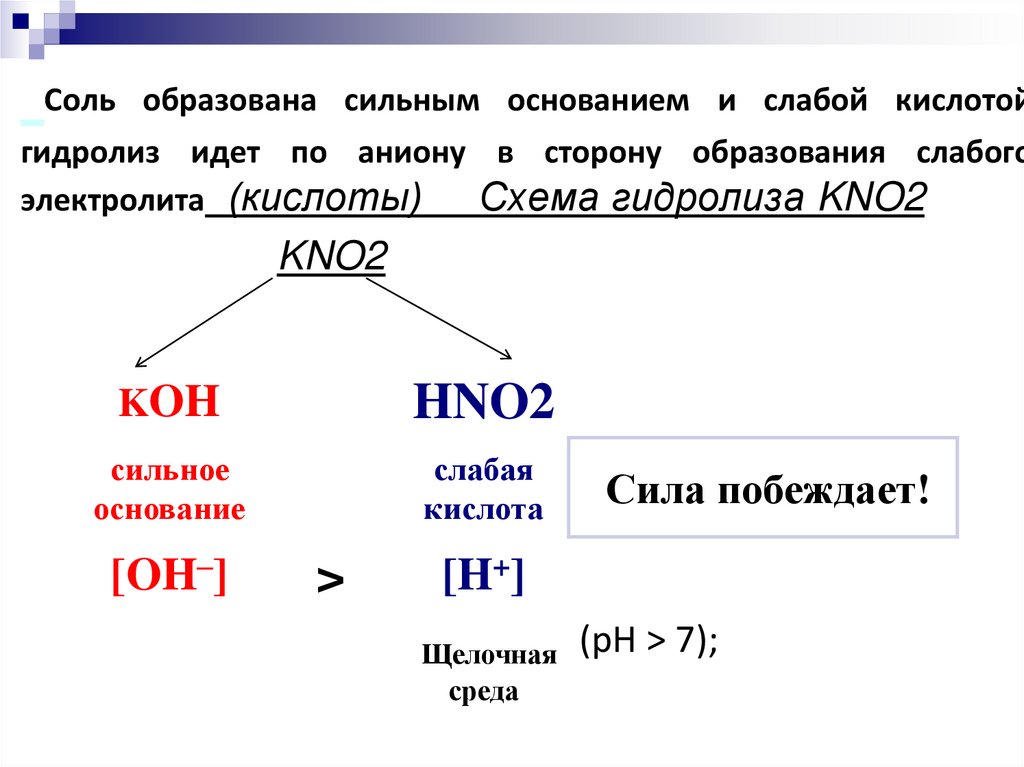
14. Соль образована сильным основанием и слабой кислотой гидролиз идет по аниону в сторону образования слабого электролита
(кислоты)Схема гидролиза KNO2
KNO2
KOH
HNO2
сильное
основание
слабая
кислота
[OH–]
>
Сила побеждает!
[H+]
Щелочная
среда
(pH > 7);
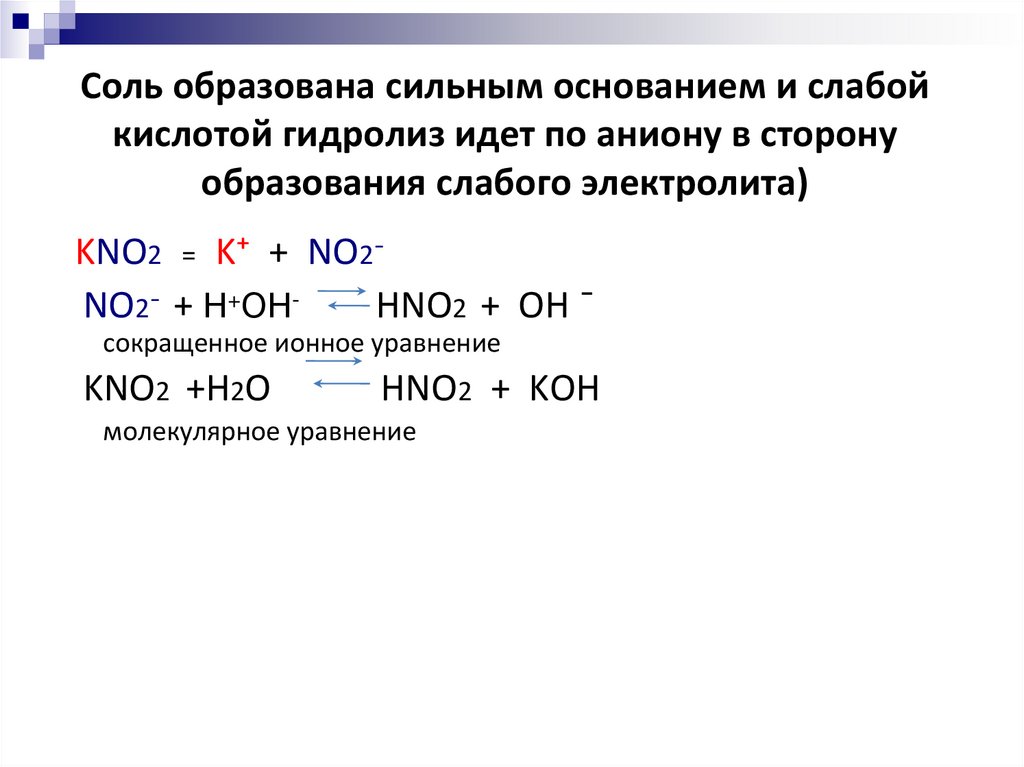
15. Соль образована сильным основанием и слабой кислотой гидролиз идет по аниону в сторону образования слабого электролита)
KNO2 = K⁺ + NO2¯NO2¯ + Н+ОНHNO2 + OH ¯
сокращенное ионное уравнение
KNO2 +H2O
HNO2 + KOH
молекулярное уравнение
16.
Выводы:• По аниону соли, как правило, гидролизуются
обратимо;
• Химическое равновесие смещено влево;
• Реакция среды – щелочная (pH > 7);
• При гидролизе солей, образованных слабыми
многоосновными кислотами, получаются
кислые соли.
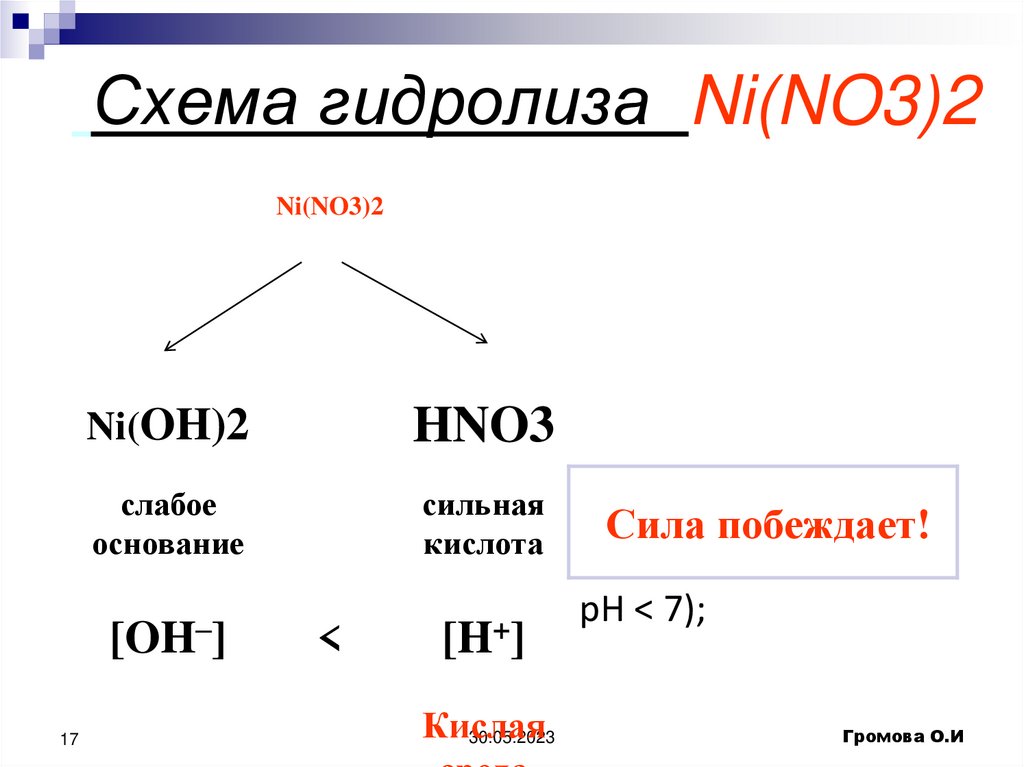
17. Схема гидролиза Ni(NO3)2
Ni(NO3)217
Ni(OH)2
HNO3
слабое
основание
сильная
кислота
[OH–]
[H+]
<
Кислая
30.05.2023
Сила побеждает!
pH < 7);
Громова О.И
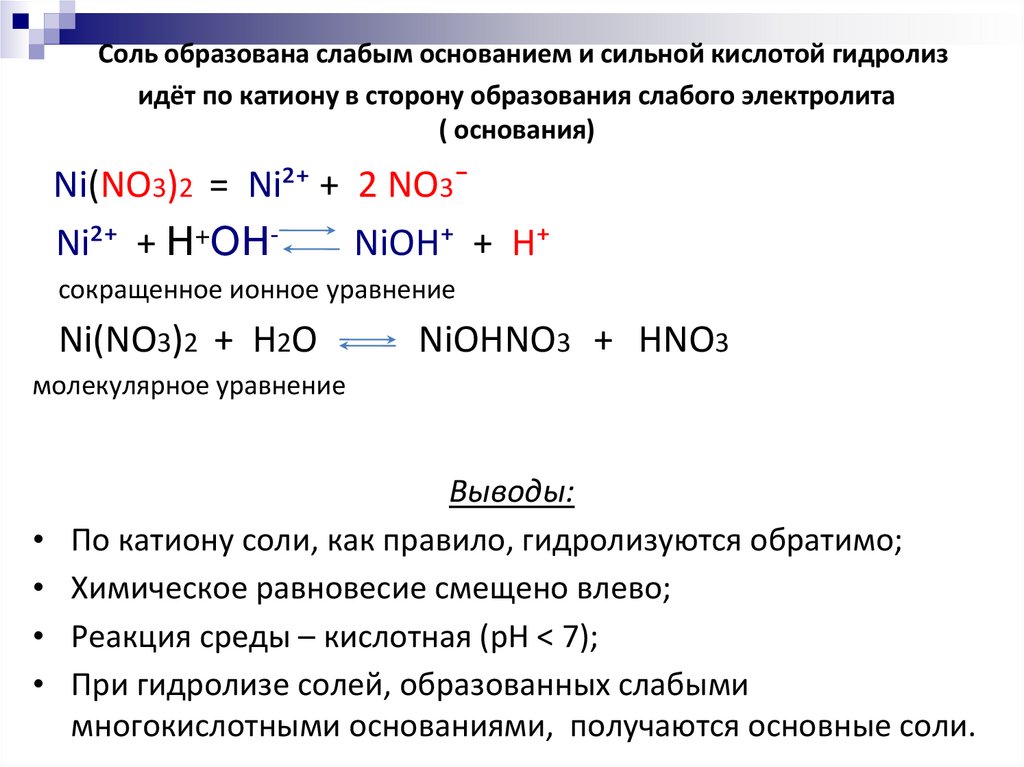
18. Соль образована слабым основанием и сильной кислотой гидролиз идёт по катиону в сторону образования слабого электролита (
основания)Ni(NO3)2 = Ni²⁺ + 2 NO3¯
Ni²⁺ + Н+ОНNiOH⁺ + H⁺
сокращенное ионное уравнение
Ni(NO3)2 + H2O
NiOHNO3 + HNO3
молекулярное уравнение
Выводы:
По катиону соли, как правило, гидролизуются обратимо;
Химическое равновесие смещено влево;
Реакция среды – кислотная (pH < 7);
При гидролизе солей, образованных слабыми
многокислотными основаниями, получаются основные соли.
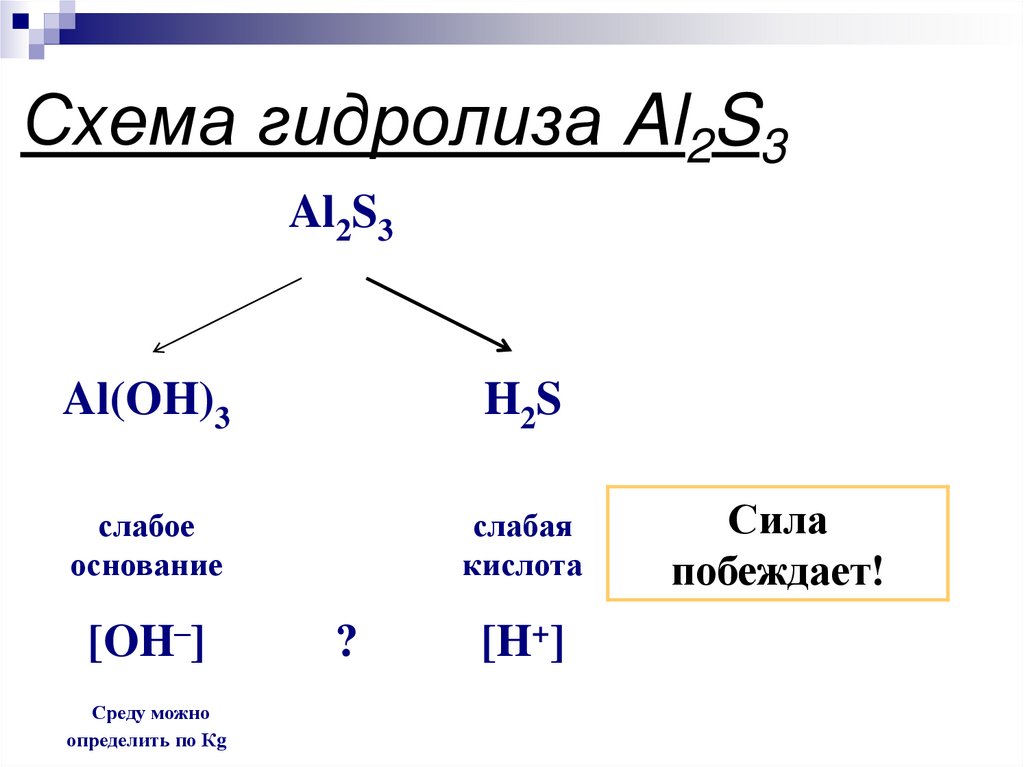
19. Схема гидролиза Al2S3
Al2S3Al(OH)3
H2 S
слабое
основание
слабая
кислота
[OH–]
Среду можно
определить по Кg
?
[H+]
Сила
побеждает!
20. Уравнения гидролиза Al2S3
Al2S3 + 6H2O-->2Al(OH)3 + 3H2SГидролиз по катиону и аниону.
[OH] = [H] pH=близко к 7-среда
нейтральная
20
30.05.2023
Громова О.И
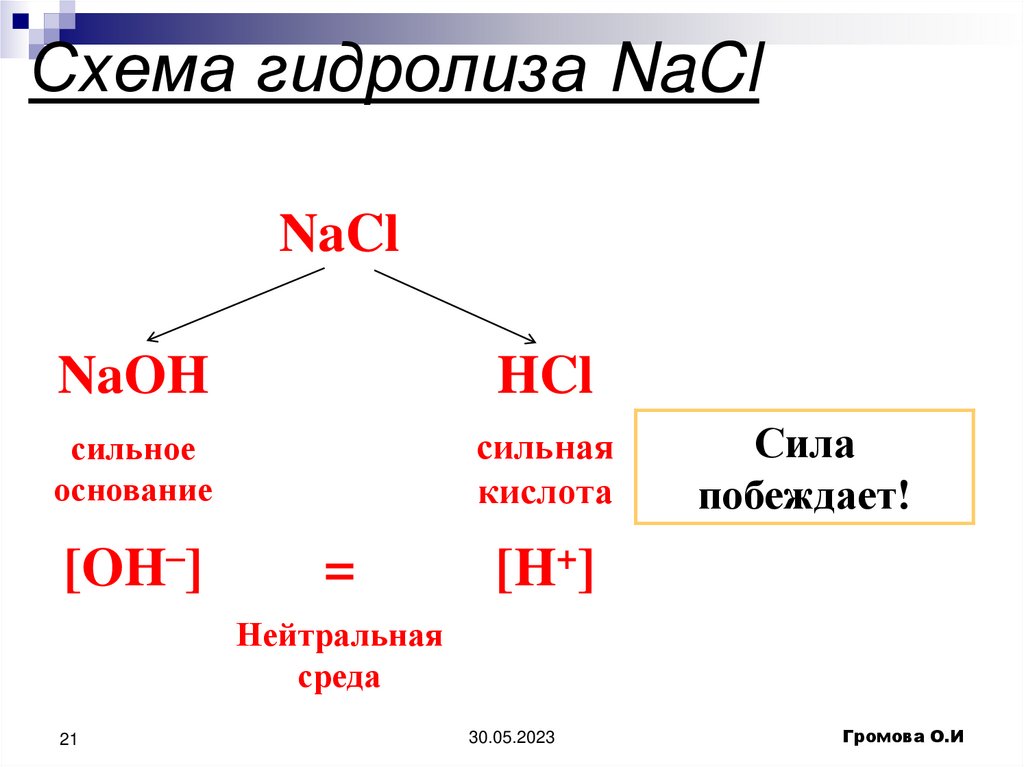
21. Схема гидролиза NaCl
NaClNaOH
HCl
сильное
основание
сильная
кислота
[OH–]
=
Сила
побеждает!
[H+]
Нейтральная
среда
21
30.05.2023
Громова О.И
22. Уравнения гидролиза NaCl
+NaCl ↔ Na + Сl
+
–
Н2O ↔ Н + ОН
–
____________________________________________________________________________
+
–
+
–
Na + Сl + Н2O ↔ Na + Cl + H2O
Одинаковое
количество гидроксидионов и ионов водорода дает соли
нейтральную
среду,
поэтому
индикаторы
не
меняют
окраску
(гидролизу не подвергается).
рн =7, среда нейтральная, гидролиз не
происходит.
23.
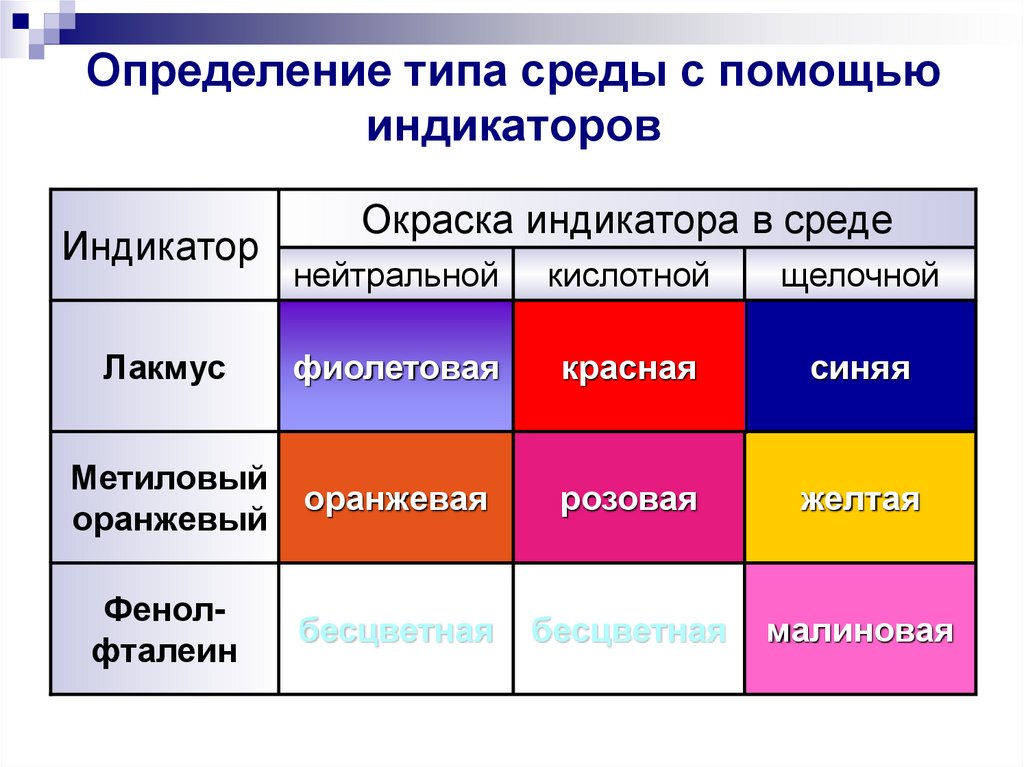
24. Определение типа среды с помощью индикаторов
ИндикаторОкраска индикатора в среде
нейтральной
кислотной
щелочной
Лакмус
фиолетовая
красная
синяя
Метиловый
оранжевый
оранжевая
розовая
желтая
Фенолфталеин
бесцветная
бесцветная
малиновая
25.
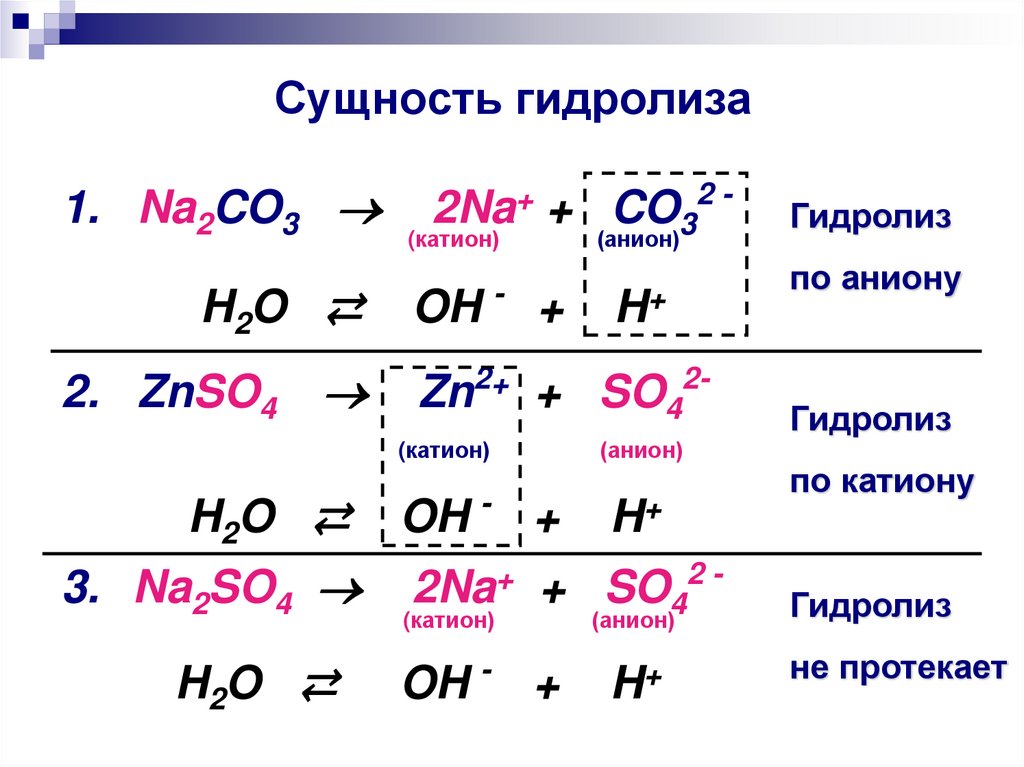
26. Сущность гидролиза
1. Na2CO3H 2O ⇄
2. ZnSO4
H 2O ⇄
3. Na2SO4
H2O ⇄
2Na+ + CO32 -
(катион)
(анион)
-
H+
OH
+
Zn2+ + SO42(катион)
(анион)
OH - +
H+
Гидролиз
по аниону
Гидролиз
по катиону
2Na+ + SO42 -
Гидролиз
OH - +
не протекает
(катион)
(анион)
H+
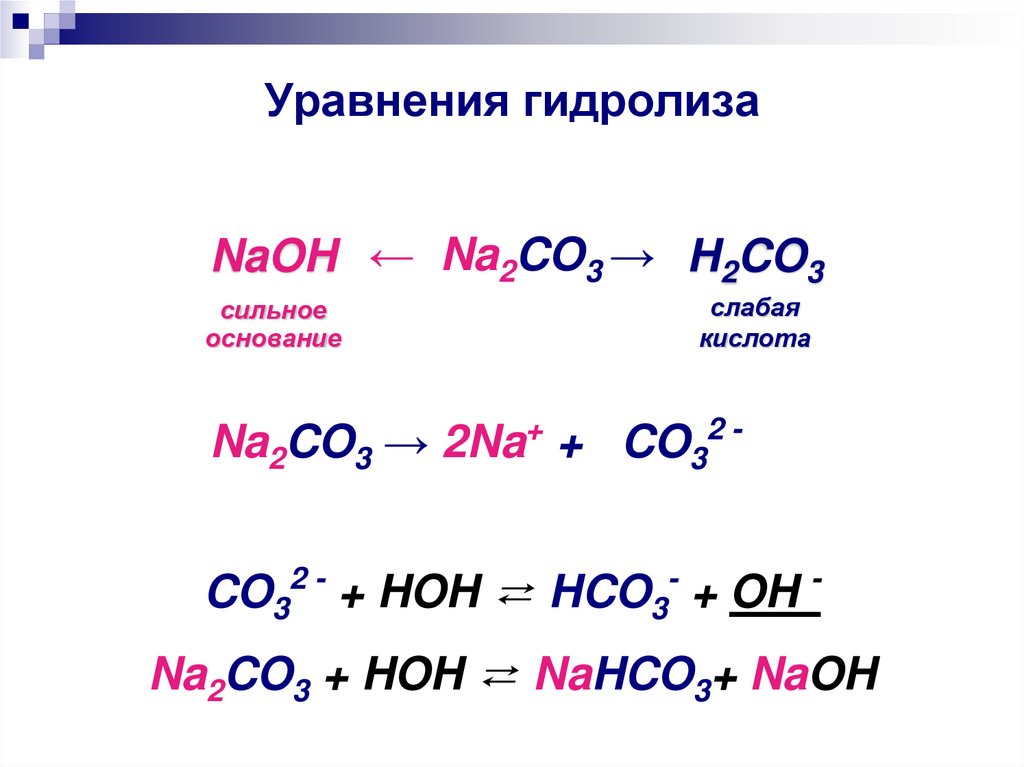
27. Уравнения гидролиза
NaOH ← Na2CO3 → H2CO3сильное
основание
слабая
кислота
Na2CO3 → 2Na+ + CO32 CO32 - + HOH ⇄ HCO3- + OH Na2CO3 + HOH ⇄ NaHCO3+ NaOH
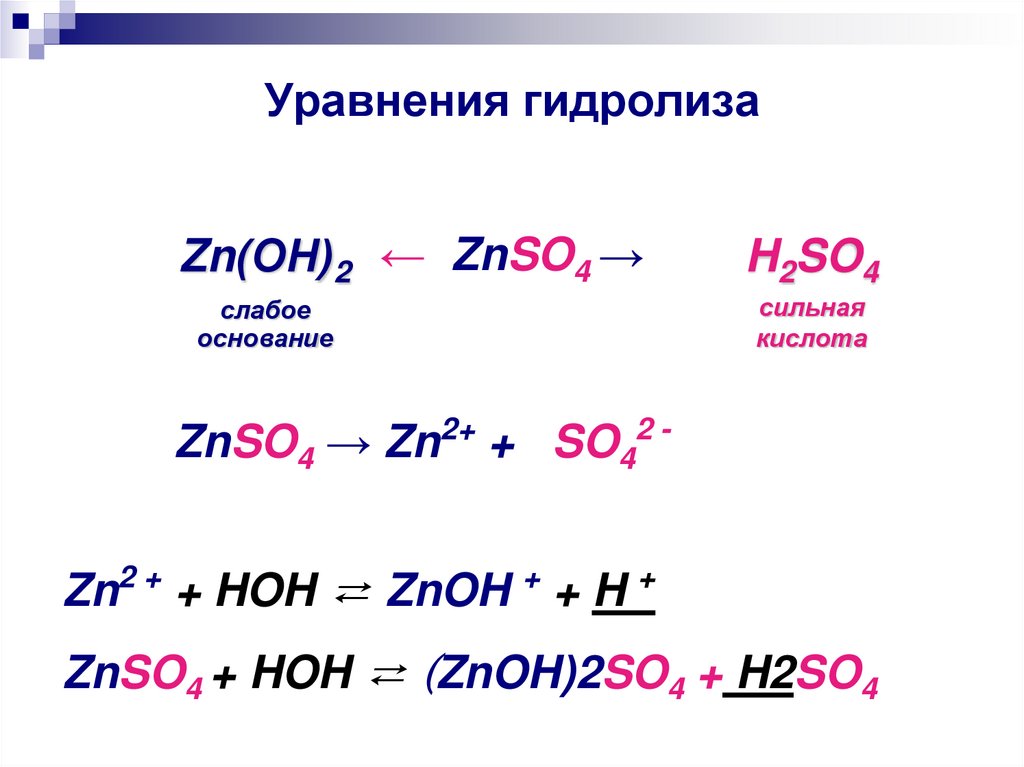
28. Уравнения гидролиза
Zn(ОН)2 ← ZnSO4 →H2SO4
слабое
основание
сильная
кислота
ZnSO4 → Zn2+ + SO42 Zn2 + + HOH ⇄ ZnOH + + H +
ZnSO4 + HOH ⇄ (ZnOH)2SO4 + H2SO4
29. Задание. Определите реакцию среды водных растворов солей. Таблица № 2
№I ряд
II ряд
III ряд
1. Li2SO4
NaNO2
Щ
KCl
2. CuSO4
FeCl3
К
Na2SO3
3. K3PO 4
KI
Н
KMnO4
4. NaClO4
LiNO3
Н
NH4NO3
5. Na2SiO3
K2S
Щ
NaNO3
н-нейтральная; к – кислотная; щ - щелочная
30. Выполните следующие задания
•Выполните следующие задания1.Составьте ионное и молекулярные уравнение
гидролиза этих солей
а) нитрата цинка
б) сульфата калия
в) сульфида натрия
30
30.05.2023
Громова О.И
31. Выполните задание
2. Установите соответствие:Формула соли
Тип гидролиза
1. FeCl2
А. по катиону
2. Ba(NO3)2
Б. по аниону
3. KF
В. не гидролизуется
4. Na3PO4
Ответ:
32. Выполните задание
3. Установите соответствие:Формула соли
Среда раствора
1. K2SO4
А. кислотная
2. Li2CO3
Б. щелочная
3. NH4Br
В. нейтральная
4. CrCl3
Ответ:
















 chemistry
chemistry








