Similar presentations:
Закон сохранения массы и энергии
1. Закон сохранения массы и энергии
2.
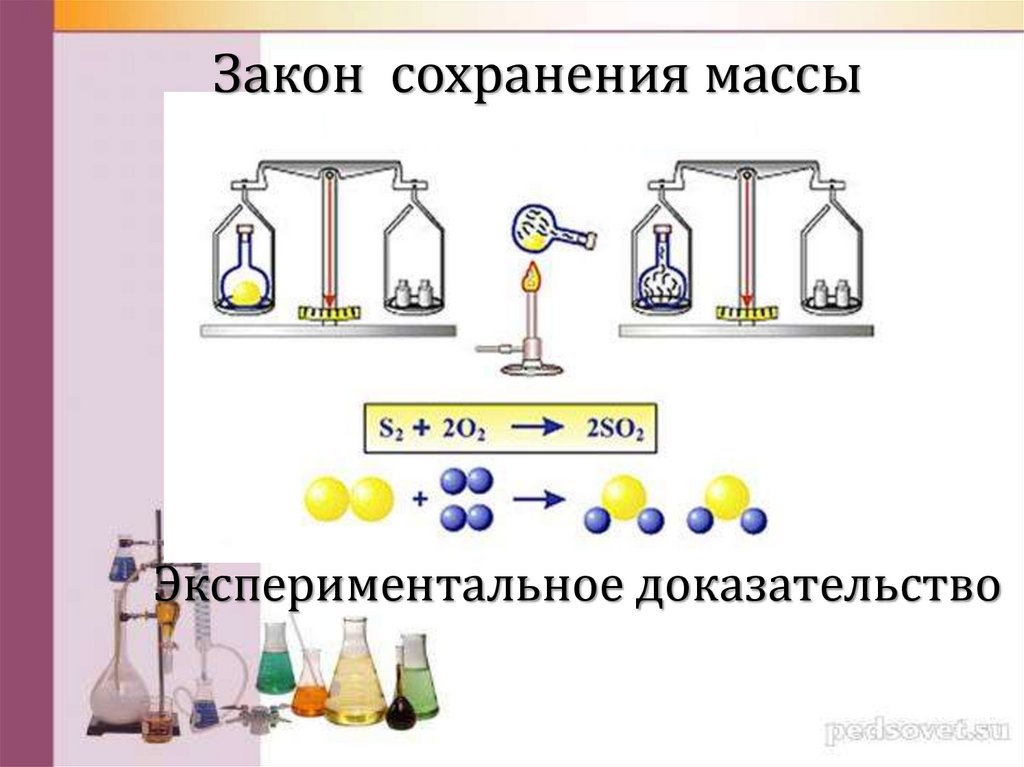
“Все перемены, в натуре случающиеся,такого суть состояния, что сколько
чего у одного тела отнимется,
столько присовокупится к другому.
М.В. Ломоносов 1748 г.
3.
Закон сохранения массыЭкспериментальное доказательство
4. Современная формулировка закона.
“ Масса веществ вступивших в реакцию,равна массе образовавшихся веществ.”
5.
В результате химической реакции атомыне возникают и не исчезают, а
происходит их перегруппировка.
Н
Н
О
Н
О
Н
Анимация
6.
Число атомов остаётся постоянным,значит масса веществ не изменяется.
7.
На основании закона сохранения массывеществ составляются химические
уравнения.
Химическое уравнение – это условная
запись химической реакции с помощью
химических формул и знаков.
8. Составление уравнений химических реакций.
Записать формулы исходных веществ ипродуктов реакции (составить на
основании валентности).
III 3 II
Al + O2
Al2O3
9.
Расставить коэффициенты, уравниваячисло атомов каждого элемента,
поставить знак равенства.
Индекс
4Al + 3O2 = 2Al2 O3
Коэффициент атомов
При подсчёте числа атомов элемента
индекс умножается на коэффициент.
10. 1905 г. А. Эйнштейн установил закон взаимодействия массы и энергии.
“При химических реакциях происходитвзаимопревращение различных видов
энергии. ”
11.
АнимацияТепловая
энергия
Световая
энергия
Химическая энергия
Реакция
горения
Реакция
разложения
Свечение
фосфора
Фотосинтез
Механическая
энергия
Электрическая
энергия
Разложение
взрывчатых
веществ
при ударе
Электролиз
12.
На основании закона сохранения ипревращения энергии составляются
термохимические уравнения.
C + O2 = CO2 + 401 кДж
2H2O = 2H2 – 572 кДж
13. Проявление закона сохранения массы и энергии в природе.
ФотосинтезРост зелёной массы
Урожайность с/х культур.
14.
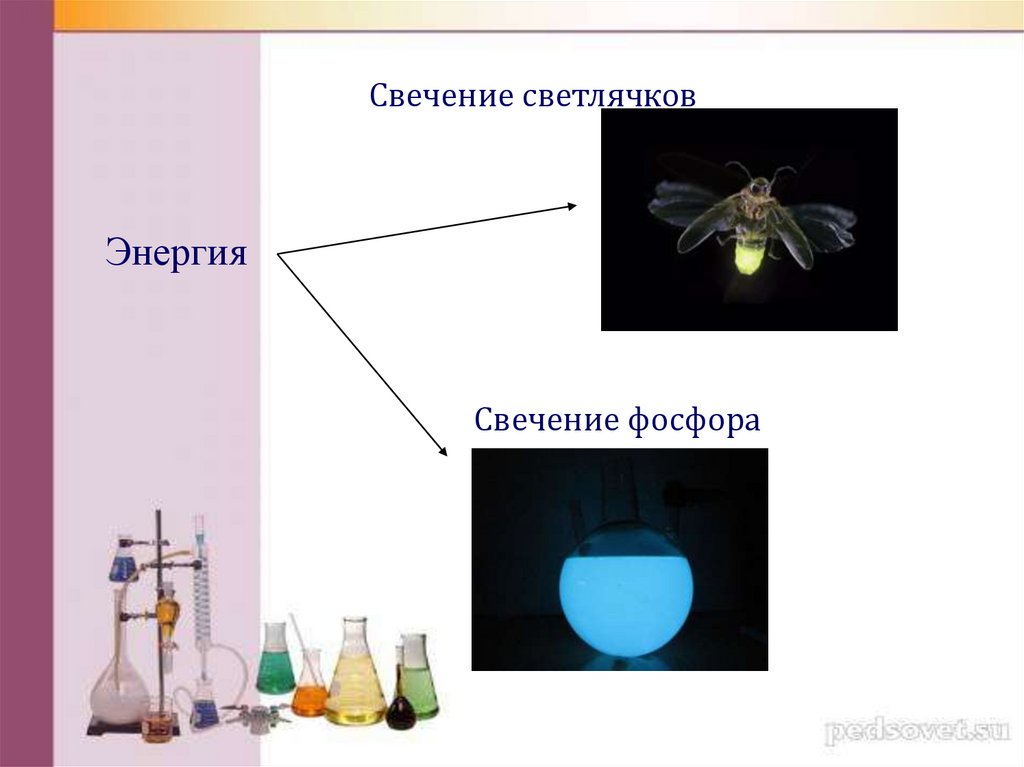
Свечение светлячковЭнергия
Свечение фосфора












 chemistry
chemistry








