Similar presentations:
Закон сохранения масс. 8 класс
1.
Закон сохранения массывеществ.
Химические уравнения.
2.
М.В.Ломоносов в 1748 г. впервыесформулировал, а в 1756 г.
экспериментально доказал закон
сохранения массы веществ
А.Лавуазье в 1789 г
независимо от
Ломоносова к пришел
тем же выводам
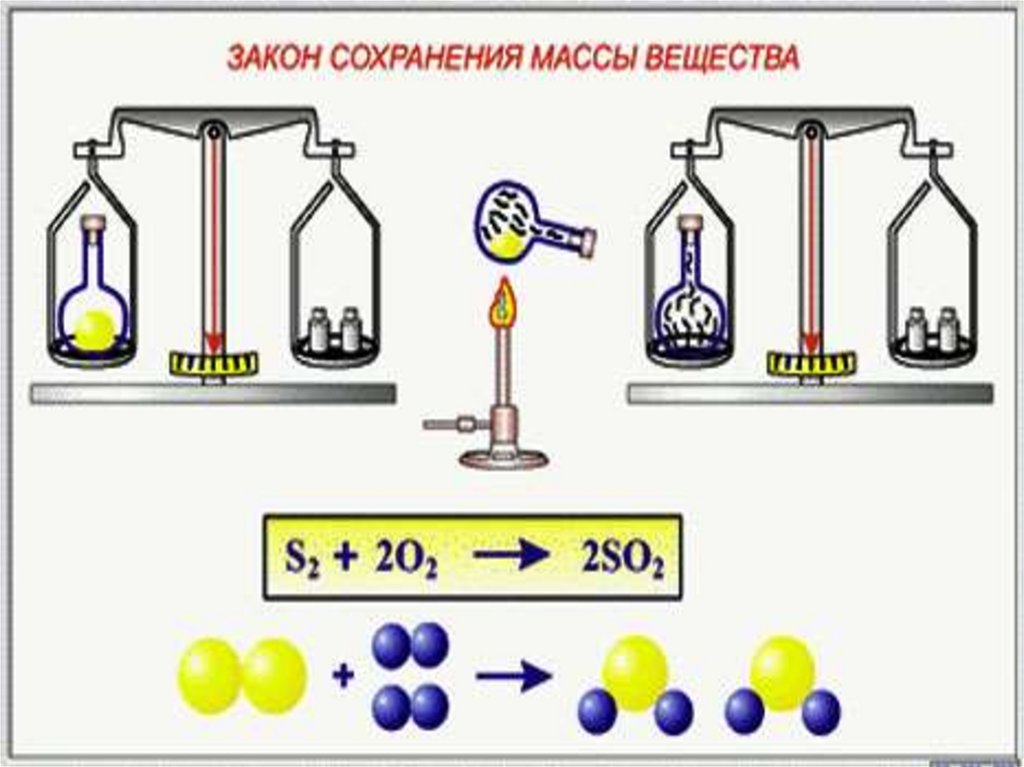
3. Формулировка закона
Масса веществ, вступивших вхимическую реакцию, равна массе
образовавшихся веществ
4.
5. Химические уравнения
Химическое уравнение –условная запись
химической реакции с
помощью химических
формул и математических
знаков.
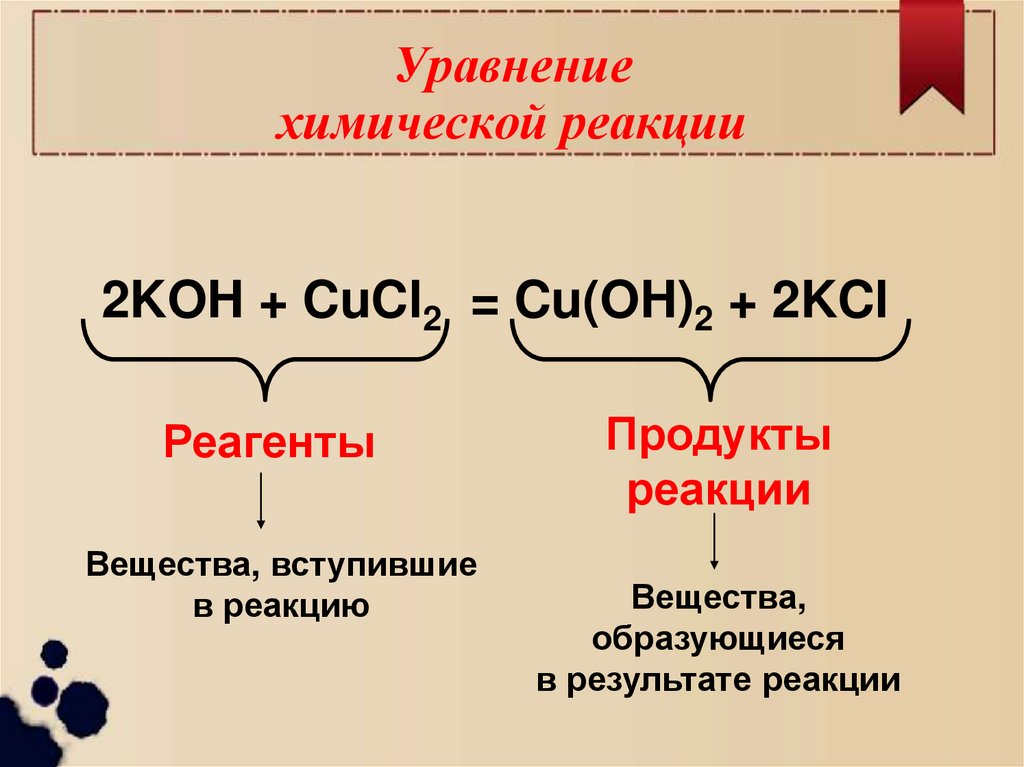
6. Уравнение химической реакции
2KOH + CuCl2 = Cu(OH)2 + 2KClРеагенты
Вещества, вступившие
в реакцию
Продукты
реакции
Вещества,
образующиеся
в результате реакции
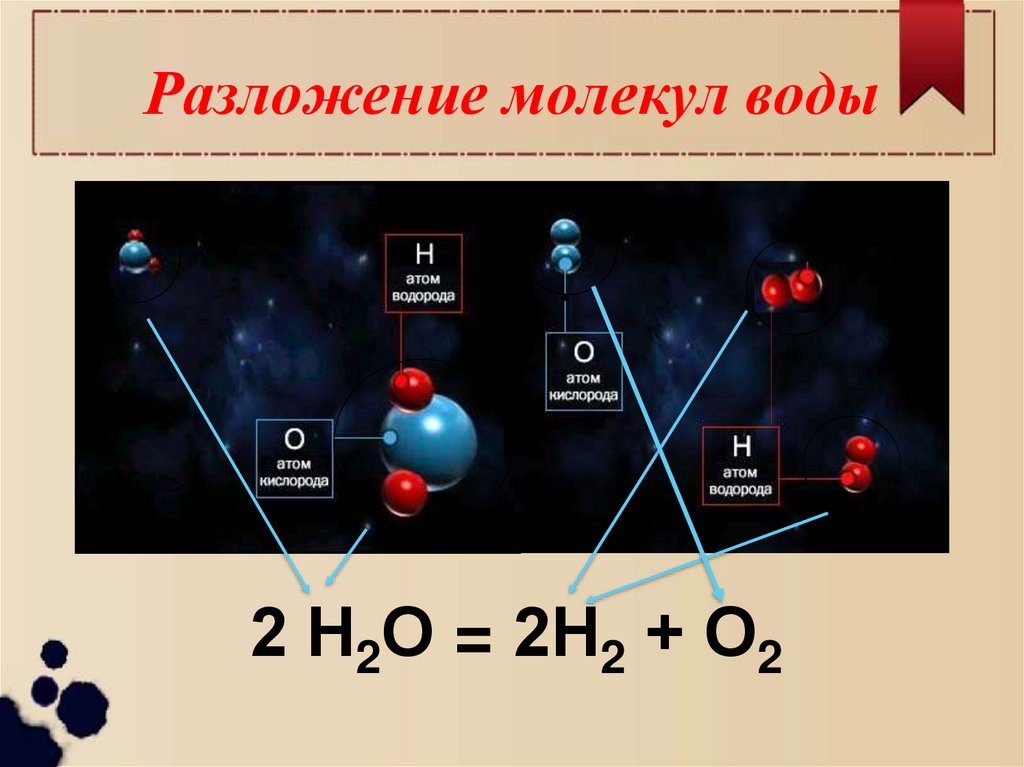
7. Разложение молекул воды
2 Н2О = 2Н2 + О28. Схема разложения воды
↯Кислород
и водород
Вода
Атом водорода
Атом кислорода
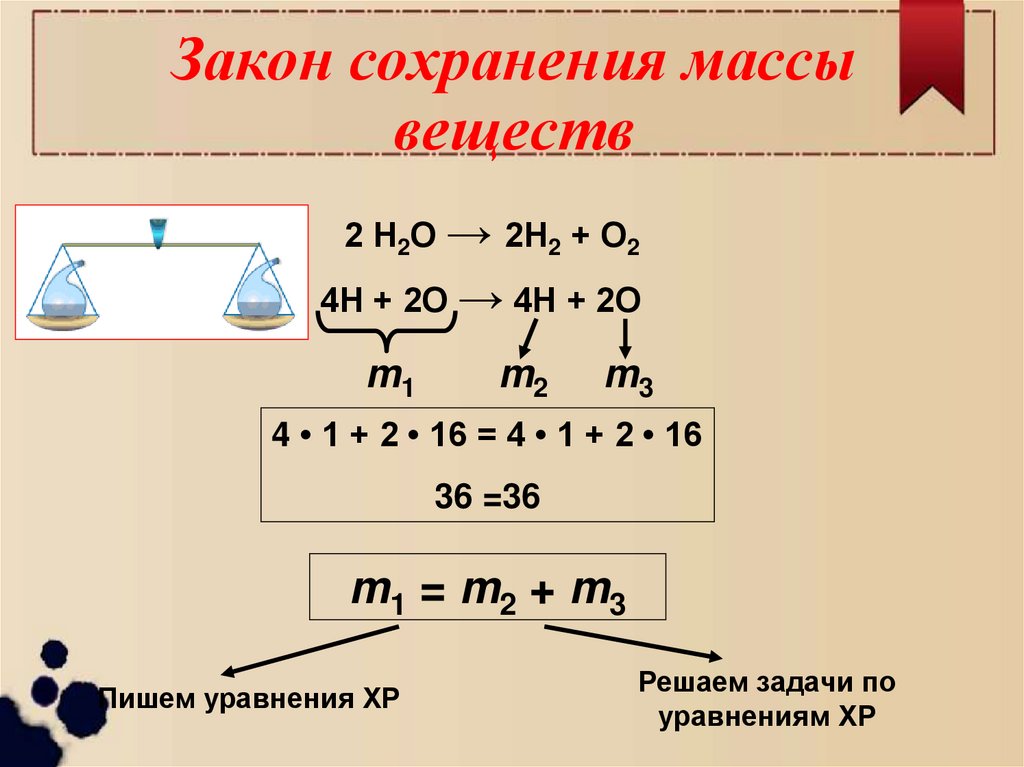
9. Закон сохранения массы веществ
2 Н2О → 2Н2 + О24Н + 2О → 4Н + 2О
m1
m2
m3
4 • 1 + 2 • 16 = 4 • 1 + 2 • 16
36 =36
m1 = m2 + m3
Пишем уравнения ХР
Решаем задачи по
уравнениям ХР
10. Алгоритм составления уравнений химических реакций
1. В левой части записываются формулы веществ,которые вступают в реакцию:
KOH + CuCl2 →.
2. В правой части (после стрелки) – формулы веществ,
которые получаются в результате реакции:
KOH + CuCl2 → Cu(OH)2 + KCl.
3. Затем с помощью коэффициентов уравнивается
число атомов одинаковых химических элементов в
правой и левой частях уравнения :
2KOH + CuCl2 = Cu(OH)2 + 2KCl.
11. Основные правила расстановки коэффициентов
Расстановку коэффициентов начинают с элемента, чьихатомов в реакции участвует больше.
Количество атомов кислорода до и после реакции в
большинстве случаев должно быть четным.
Если в реакции (обмена) участвуют сложные вещества, то
расстановку коэффициентов начинают с атомов металлов
или с кислотных остатков.
12.
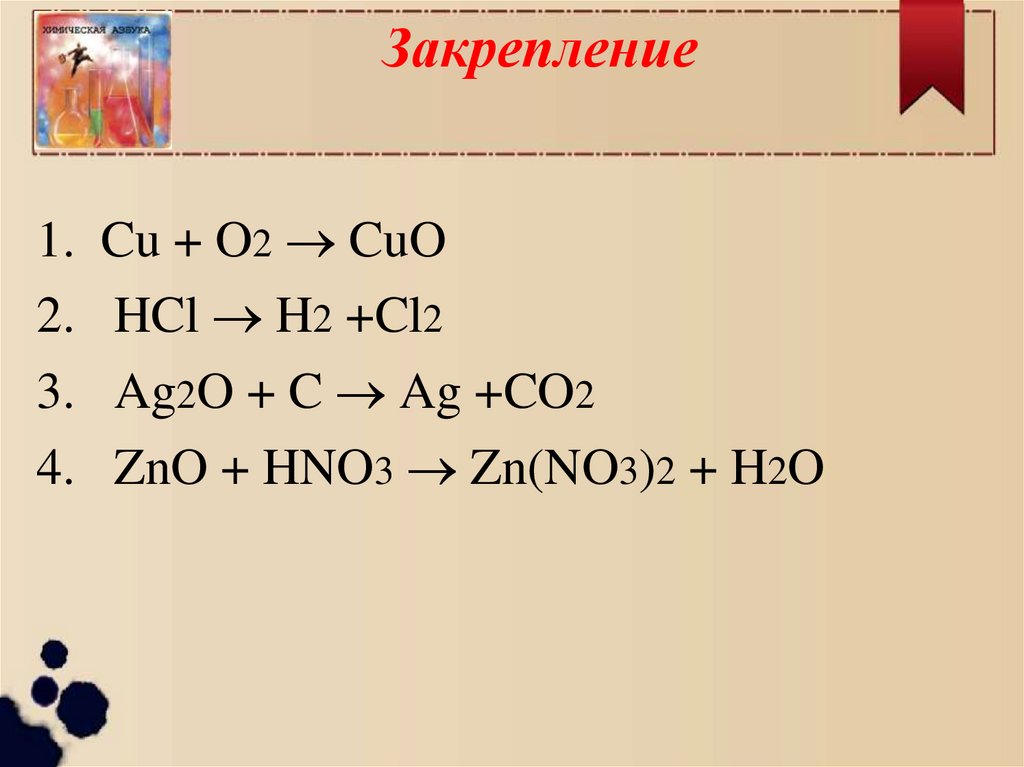
Закрепление1.
2.
3.
4.
Cu + O2 CuO
HCl H2 +Cl2
Ag2O + C Ag +CO2
ZnO + HNO3 Zn(NO3)2 + H2O
13.
Домашнее задание• Параграф 27 и 28, стр. 166 зад. 2 (г,
д, е, ж), зад. 3 (в,г) и зад. 4 (Белый
учебник)
• Параграф 26 и 27, стр. 145 зад. 2 (г,
д, е, ж), зад. 3 (в,г) и зад. 4
(Зеленый учебник)








 chemistry
chemistry








