Similar presentations:
Оксиды, их свойства, получение
1. Тема урока «Оксиды, их свойства, получение».
«ОКСИДЫ, ИХСВОЙСТВА,
ПОЛУЧЕНИЕ».
ТЕМА УРОКА
Цель урока:
Обобщить и систематизировать знания учащихся о
классификации оксидов.
Рассмотреть основные способы получения и
свойства кислотных и основных оксидов.
Продолжить формирование умений анализировать,
сравнивать, делать выводы, используя
современные педагогические и информационные
технологии, направленные на оптимизацию
образовательного процесса.
Продолжить формирование интереса к предмету и
химического видения мира и воспитывать
самостоятельность и навыки культуры общения.
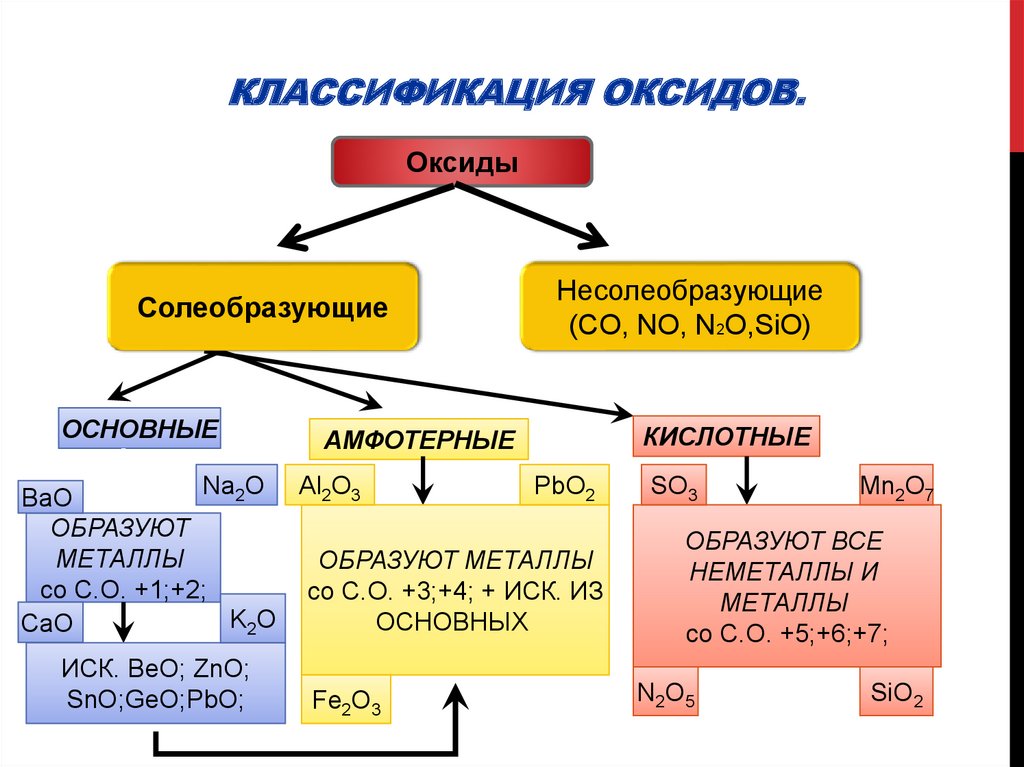
2. Классификация оксидов.
КЛАССИФИКАЦИЯ ОКСИДОВ.Оксиды
Солеобразующие
ОСНОВНЫЕ
Несолеобразующие
(CO, NO, N2O,SiO)
АМФОТЕРНЫЕ
PbO2
Na2O Al2O3
BaO
ОБРАЗУЮТ
МЕТАЛЛЫ
ОБРАЗУЮТ МЕТАЛЛЫ
со С.О. +1;+2;
со С.О. +3;+4; + ИСК. ИЗ
K2O
ОСНОВНЫХ
CaO
ИСК. BeO; ZnO;
SnO;GeO;PbO;
Fe2O3
КИСЛОТНЫЕ
SO3
Mn2O7
ОБРАЗУЮТ ВСЕ
НЕМЕТАЛЛЫ И
МЕТАЛЛЫ
со С.О. +5;+6;+7;
N2O5
SiO2
3.
1. Какие вещества называются оксидами?2. Игра «Найди родственников». Из
приведенных формул выберите формулы
оксидов и назовите их: H2SO4, NaOH, CuO,
Na2SO4, O2, SO3, HCl, Na2O, Fe2O3, Mn2O7, HMnO4
3. На какие две группы по химическим
свойствам делятся оксиды?
4. На какие группы делятся солеобразующие
оксиды?
5. Дать определения основных, амфотерных,
кислотных оксидов.
6. Проведите классификацию следующих
оксидов: ZnO, Na2O, CaO, Al2O3, SiO2, CO, SO3
7. Игра « Третий лишний»:
1) GeO, ZnO, CО
2) Na2O, SiO2, CaO
3) CO, CO2, SO2
4) N2O, P2 O5, NO
4. Тест №1
ТЕСТ №11. Среди следующих формул оксидом является:
1) НСl
2) Na2SO4 3) Na2O
4) NaOH.
2. Среди следующих оксидов несолеобразующим является:
1) СО2
2) СО
3) Na2O
4) SO3.
3. Среди следующих оксидов кислотным является:
1) СО
2) N2O
3) N2O3
4) Al2O3.
4. Среди следующих оксидов основным является:
1) СО2
2) FeO
3) ZnO
4) N2O.
5. Среди следующих оксидов амфотерным является:
1) SO2
2) CO
3) BeO
4) Mn2O7.
6. Массовая доля (в %) кислорода в оксиде алюминия:
1) 47
2) 52,94 3) 15,68
4) 26, 47.
7. Масса (г) 0,25 моль оксида натрия:
1) 155
2) 9,75
3) 248
4) 15,5.
3
2
3
2
3
1
4
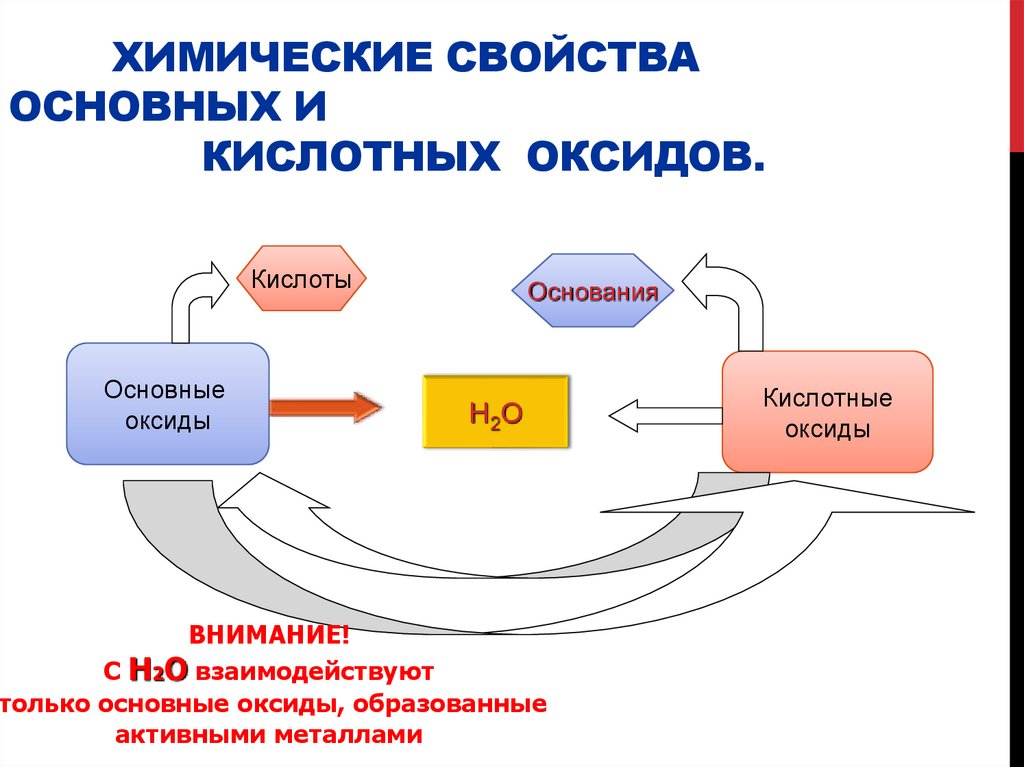
5. Химические свойства основных и кислотных оксидов.
ХИМИЧЕСКИЕ СВОЙСТВАОСНОВНЫХ И
КИСЛОТНЫХ ОКСИДОВ.
Кислоты
Основные
оксиды
Основания
H 2O
ВНИМАНИЕ!
С H2O взаимодействуют
только основные оксиды, образованные
активными металлами
Кислотные
оксиды
6.
а) Химические свойства основных оксидов:1) Взаимодействуют с кислотами, образуя соль и воду:
основной оксид + кислота = соль +Н2О
СаО + 2НСl = CaCl2 + H2 O
2) Взаимодействуют с кислотными оксидами, образуя
соль:
основной оксид + кислотный оксид = соль
СаО + N2O5 = Ca(NO3)2
HNO3
3) c водой реагируют только оксиды, образуемые
активными металлами:
основной оксид + Н2О = основание
СаО + Н2 О = Са(ОН)2
Негашеная
Гашенная
известь
известь
7. Видеофрагмент.
ВИДЕОФРАГМЕНТ.8. Тест № 2
ТЕСТ № 21. С серной кислотой будет взаимодействовать:
1) SO3
2) Mn2O7
3) N2O5
4) MgO.
4
Составьте уравнение реакции
2. С оксидом натрия будет взаимодействовать:
1) NO
2) MgO
3) SO3
4) K2O.
3
Составьте уравнение реакции.
3. С водой будет взаимодействовать:
1) FeO
2) Ag2O
3) BaO
Составьте уравнение реакции.
4) CuO
3
9.
Химические свойства кислотных оксидов:1) Взаимодействуют с основаниями, образуя соль и
воду:
кислотный оксид + основание = соль +Н2 О
СО2 + Са(ОН)2 = СаСО3 +Н2 О
Н2СО3
2) Взаимодействуют с основными оксидами, образуя
соль:
кислотный оксид + основной оксид = соль
СО2 + СаО = СаСО3
Углекислый
газ
3) Большинство кислотных оксидов взаимодействуют с
водой, с образованием кислот (иск. SiO2):
кислотный оксид + Н2О = кислота
t
Р2О5 + 3Н2 О → 2Н3РО4
10. Видеофрагмент
ВИДЕОФРАГМЕНТ11. Тест № 3
ТЕСТ № 31. С гидроксидом натрия будет реагировать:
1) СаО
2) СО
3) SO3
4) K2O
3
2. С оксидом азота (V) ,будет реагировать:
1
Составьте уравнение реакции.
1) ВаО
2) Mn2O7
3) CO
4) CO2
Cоставьте уравнение реакции.
3. С водой не будет взаимодействовать:
1) СО2
2) Р2О5
3) SiO2
4) N2O5 .
3
12.
Получение оксидов:1) Взаимодействие простых веществ с
кислородом:
t
4Р +5О2 =2Р2О5
избыток
t
4Р + 3О2 = 2Р2О3
недост
2) Окисление сложных веществ
(рассматривается только в избытке
кислорода)
t
СН4 +2О2 = СО2 +2Н2О
метан
CuS + 1,5O2 =CuO +SO2 2
2CuS +3O2 = 2CuO + 2SO2
13.
3) Разложение сложных веществ:нерастворимых оснований:
t
нерастворимое основание → оксид + Н2О
t
Mg(OH)2 → MgO +H2O
некоторых кислот:
t
H2SiO3 → SiO2 + H2O
некоторых солей :
t
СаСО3 → CаО + СО2
14. Тест № 4
ТЕСТ № 41. Коэффициент перед формулой кислорода в уравнении
реакции, схема которой
Аl + O2 → Al2O3 :
1) 2 2) 3 3) 4 4) 5.
2
2. При горении Н2S в избытке кислорода образуется:
1) SO и H2
2) SO2 и H2O
3) SO3 и H2O
2
4) SO2 и H2.
Составьте уравнение реакции.
3. При окислении ZnS образуются:
1) Zn и SO2
2) ZnO и SO2
3) ZnO и SO3
2
4) Zn и SO3.
Составьте уравнение реакции.
4. При разложении гидроксида железа (III) образуются:
1) Fe и H2O
2) FeO и H2O
3) Fe2O3 и H2O
3
4) Fe2O3 и H2.
Составьте уравнение реакции.
15. Домашнее задание
ДОМАШНЕЕЗАДАНИЕ
Учебник Новошинский И.И. Новишинская Н.С. 2013 г.
§44(основные оксиды) упр.2,4,6.
§45(амфотерные и кислотные оксиды) упр. 1,2,4,5.
Творческое задание: 1) где применяются
оксиды.(сообщение, презентация, доклад)
2) оксиды в природе(сообщение,
презентация, доклад)













 chemistry
chemistry








