Similar presentations:
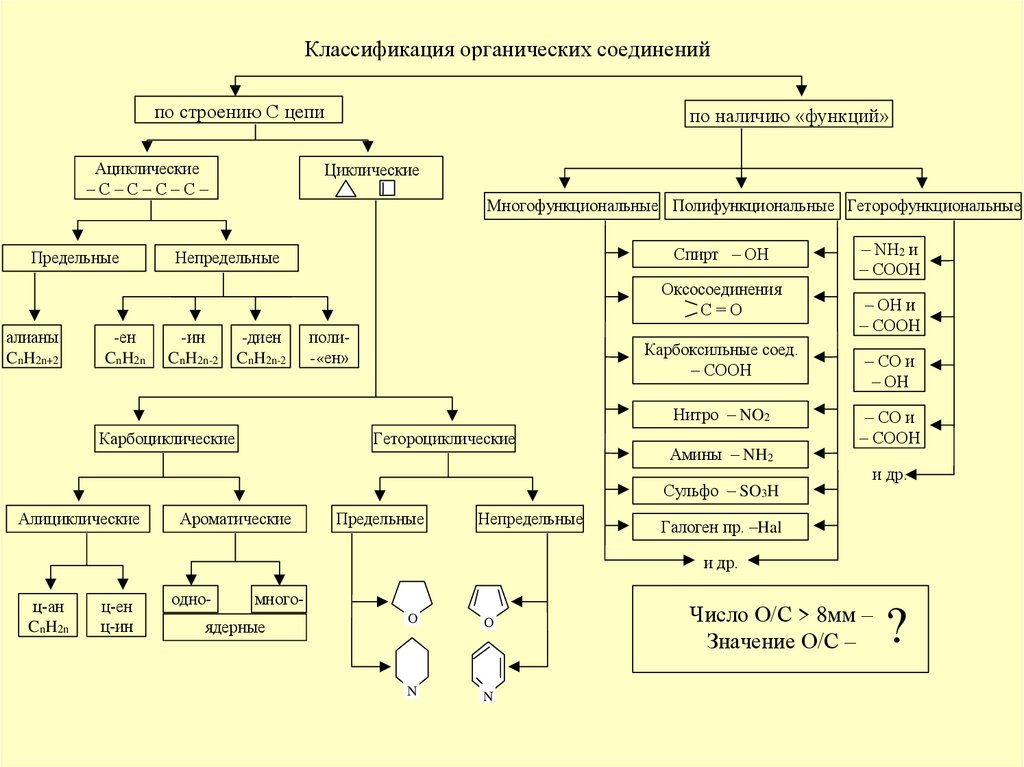
Классификация органических соединений
1.
Классификация органических соединенийпо строению С цепи
Ациклические
–С–С–С–С–
Предельные
по наличию «функций»
Циклические
Многофункциональные Полифункциональные Геторофункциональные
Спирт – ОН
Непредельные
Оксосоединения
С=О
алианы
CnH2n+2
-ен
CnH2n
-ин
CnH2n-2
-диен
CnH2n-2
поли-«ен»
Карбоксильные соед.
– СООН
Нитро – NO2
Карбоциклические
Гетороциклические
Амины – NH2
Сульфо – SO3H
Алициклические
Ароматические
Предельные
Непредельные
– NH2 и
– СООН
– OH и
– СООН
– CO и
– ОН
– CO и
– СООН
и др.
Галоген пр. –Hal
и др.
ц-ан
CnH2n
ц-ен
ц-ин
одно-
много-
ядерные
О
О
N
N
Число О/С > 8мм –
Значение О/С –
?
2.
ВАЖНЕЙШИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ3.
НАЗВАНИЯ ВАЖНЕЙШИХ РАДИКАЛОВ4.
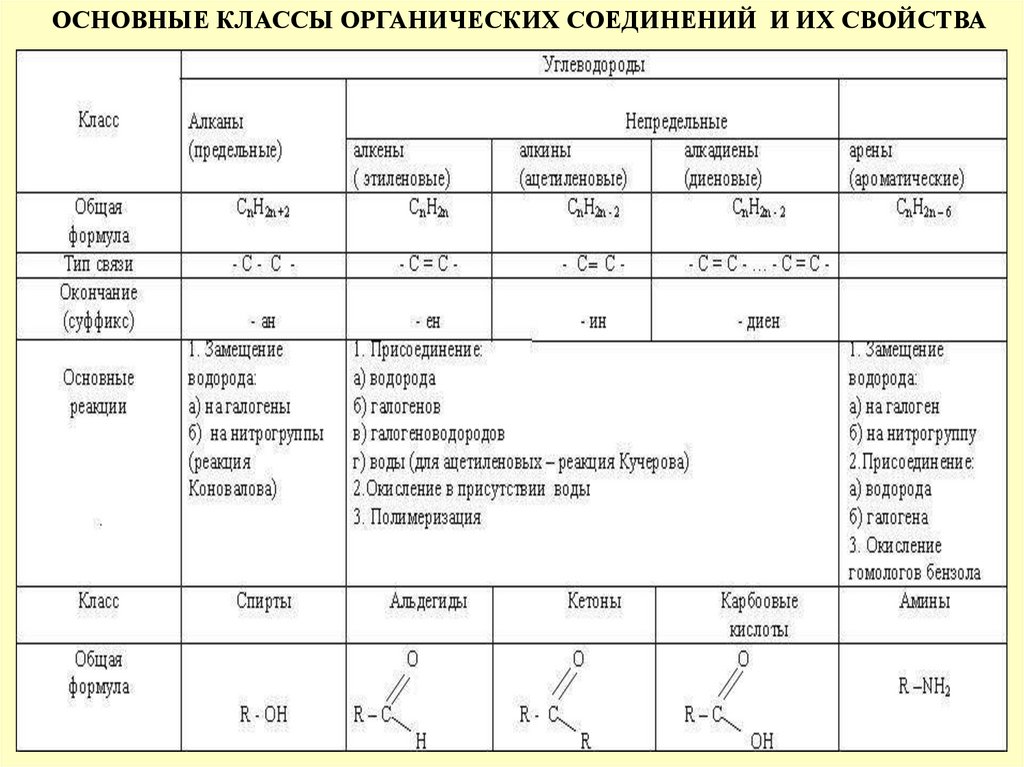
ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ И ИХ СВОЙСТВА5.
6.
R –ИЛ1–4
ОБЩ.ПРАВИЛА!
| |
| |
1. –С–С–…–С–С–
| |
| |
2. а…я греч –АН
3. ? №Сam
min
CnH2n+2
CH4
ИЗОМ
З: Hal
Со
Ц
За
Р
1–4
5 – 16
Тк
Mr
ГОМОЛОГИ
–СН2
1.Газ, нефть (до 97%)
2.Р.Вюрца 2R Hal+2Na
O
3.Лаб.: R – C ONa +NaO H
R
р
4
SP3
0
109 28’
+
Н ОН
5.nCO+(2n+1)H2
С2Н2
ПРИМ.
Н2
Н ОН
R
4.Zn
1S
3
–АН
–АН
–C–C–
0,154нм
Коновалов
к.XIX в.
СУЛЬФО–
HO–SO3H
t0
Н2 и С
«=»
Р:
Kat
«=» + Н2
17 – …
ПОЛ.
t0, hν
C1<C2<C3
свободно R (Sr)
HO–NO2
8
Р.
И.
С.
Р-ЛЬ
СМС
7.
СН3ИЗОМ
ЦИКЛО-АН CnH2n(n=3)
СН3 СН3
СН3
СН3
Со
Ц
3–4
5–6
За
Р
Тк , чем у – АН, – ЕН
нефть плохо
7–…
ТЕОРИЯ
НАПРЯЖЕНИЯ БАЙЕРА
ПОЛ.
60
1.Нефть >50% нафтены
+Zn
2.Ц–3,4: диHalAlk
Рt, t
3.Циклизация –АН
0
0
109 28’
4.
Ni
4
10 раз/сек
КОНФОРМ–
ПРИМ.
АЦИЯ
ЕР
!
ХИМ.СВ-ВА
СИНТЕЗ
СИНТЕЗ
А/К
ЛИМ./К.
ЦИКЛО–3,4: Н2, Hal2, HHal (AE)
ЦИКЛО–5,6: Hal2 I2>Br2>Cl2 (CR)
C – C – COOH
ОХ.: ТРУДНО
|
C – C – COOH АДИПИН.К.
8.
ХИМ.СВ.НОМ.
CnH2n
Р. греч –ИЛЕН
«=»
ИЗОМ
Ц
1–3
5 – 17
Р
П:
Тк
моло.
Mr
18 – …
С
«ЦИС–»
«ТРАНС–»
«=»
За
8
С. а…я греч –ЕН
Со
№
H
С
0
<120
0.134
ГИБР-Я!
1S +2p
3
(5 σ-св-й)
ПОЛ.
ДЕ
H2
Hal2
H2O
HHal
«=»
– ИН «=»
Н2
«=»
синтез
р.KMnO4
О2
ПОЛ-Я:
С/Х
ПРИМ.
3-4р
р-ль
р.Вагнера
– ЕН Ag, t
«=» σ прочность!
π
ЛАБ. из С2Н5ОН Т/Б!
В.В.Марк
Н – Hal
H
H – OH
О:
«=»
π-связь
2
Н2
Hal2 Кач.р.!
H2O
HHal
СК
ГЛИКОЛЬ
ОКИСЬ
МОНО –
ПОЛИ –
МЕР
9.
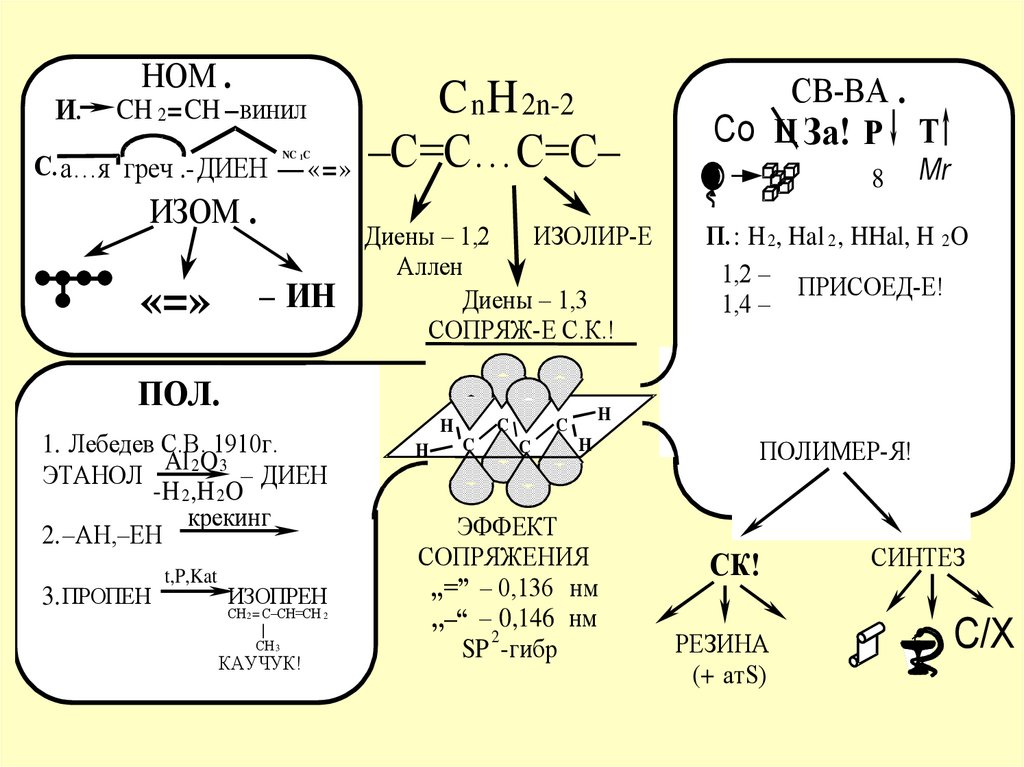
CnH2n-2ДИЕН
«=»
Ц–АЛКЕН
И.
Р.
С.
С2Н2
R1,R2… АЦЕТИЛЕН
ОБЩ.ПРАВИЛА!
№
–ИН «=»
Со
Ц
За
Р
2–4
5 – 15
Т
C2H2
Mr
8
ИЗОМ
П: Н2, Наl2, ННаl, Н2О
«=»
ИН-1
Кучеров
ИН-2
Ох: «=»
16 – …
СТРОЕН.
1S
–C=C–
0,120нм
ПРИМ.
0
σ
σ
π
σ
π
0
t =до3000
π
О
I
Ме
–ИД
МЕР
180
π
КАРБ.К. – С
Пол-я: моно–
2СН=СН ди–
3СН=СН три–
nСН? СН поли–
0
1.Вёлер, 1862:
С НОН
Са
+
С НОН
КРЕКИНГ
2.СН4
+сп.р.2NaOH
3.ДиHalAlKAH
+R
4.
Na
–ИН
О
Т/Б!
2
SP-ГИБР
р
2π
: ПРОЧНОСТЬ!
р РЕАКЦ-ОСТЬ!
ПОЛ.
Н
З:
Г-Я
+1
р.KMnO4
Сl
Р-ЛЬ
СИНТЕЗ
СК
СВОЛОКН.
СН2=СН–СN
АКРИЛОНИТРИЛ
–ОЛ
–АЛЬ
К/К
10.
И.НОМ .
CH 2 = CH – винил
С. а…я греч .-ДИЕН — « = »
NC 1C
ИЗОМ .
– ИН
«=»
C n H 2n-2
–C=C…C=C–
СВ-ВА .
Co Ц За! Р Т
Диены – 1,2
ИЗОЛИР-Е
Аллен
Диены – 1,3
СОПРЯЖ-Е С.К.!
П.: H 2, Hal 2 , HHal, H 2O
1,2 – ПРИСОЕД-Е!
1,4 –
ПОЛ.
1. Лебедев С.В. 1910г.
Al 2O 3
ЭТАНОЛ
– ДИЕН
-H 2,H 2O
крекинг
2.–АН,–ЕН
3. ПРОПЕН
t,P,Kat
ИЗОПРЕН
СН 2 = С–СН=СН 2
|
СН 3
КАУЧУК!
H
H
С
С
Mr
H
С
С
8
H
ЭФФЕКТ
СОПРЯЖЕНИЯ
,,=” – 0,136 нм
,,–“ – 0,146 нм
2
SP -гибр
ПОЛИМЕР-Я!
СК!
РЕЗИНА
(+ атS)
СИНТЕЗ
С/Х
11.
CnH2n-6ПОЛОЖЕНИЯ!
1,2 – ОРТО (–О)
1,3 – МЕТА (–М)
1,4 – ПАРА (–П)
№Cat – min
Со
Ц
За
Р
!
плохо
Х.СВ-ВА
Тк С6Н6+800
8
ИЗОМ
Mr
Кекуле 1865г.
C6H6
З: ПРАВ. ОРИЕНТАЦИИ
I рода (-О,-П): Hal-,-CH3,-OH,-NH3
II рода (-М): -COOH,-SO3H,-CN,-NO2
H
Se:
ПОЛ.
1.НЕФТЬ (АРОМАТ-Я) 60%
0
2.КОКСОВАНИЕ 1000 С
3.Ц-АН –Н2 Зеленский
4.3СН СН
5.Р.Вюрца-Фиттига
2Na
ArHal+AlkHal
6.Р.Фриделя-Крафтса
(АЛКИЛИРОВАНИЕ)
+ Alk Cl
Kat
2
Sp –гибр.
3
1
X
π
КОМПЛЕКС
HNO3, H2SO4, Hal2, RHal
П: Н2, Hal2
+
X
σ
JФ
, ГОМОЛОГИ С6Н6
ОХ:
0,140нм
0
120
ПРИМ.
АРОМАТИЧ-ТЬ!
6σ+6π
ПОЛИСТИРОЛ
АНИЛИН
НЕЙЛОН
12.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯАЦИКЛИЧЕСКИЕ
ЦИКЛИЧЕСКИЕ
ГЕТРОЦИКЛИЧЕСКИЕ
КАРБОЦИКЛИЧЕСКИЕ
С
С
С
С
С
С
С
О
АЛИЦИКЛИЧЕСКИЕ
S
АРОМАТИЧЕСКИЕ
Ar
ОДНОЯДЕРНЫЕ /Se/
МНОГОЯДЕРНЫЕ
ГОМОЛОГИ С6Н6
М.А.СхНу С ИЗОЛИР.ЯДРАМИ М.А.СхНу С КОНДЕН.ЯДРАМИ
НАФТАЛИН
8
1
1,4,5,8α
2,3,6,7β
5
4
Se:
П.:
H2
АНТРАЦЕН
8
9
1
5
10
4
α- поле
Se:
ДЕКАЛИН
П.:
ВЫСШИЕ
1,4,5,8α
2,3,6,7β
9,10γ
γ- поле
H2
НЕКОТ.КАНЦЕРОГЕНЫ
(от.лат.CANCERPAK)
13.
Обобщающий ОК: «Углеводороды»CnH2n+2
Sp
3
CnH2n
Sp
2
CnH2n-2
Sp
ДИЕНЫ
АЛКАНЫ
Гиб- Длина Вал. Вид Особ.в
рид-я С–С < связи название
Горение
С–С
нм
АЛКЕНЫ
Строение
АЛКИНЫ
Общ.
формула
CnH2n-2
СВОЙСТВА
З.
П.
Полим-я
Окисление
О2
КМnО2
0.154 1090
28’
σ
– АН
+
+
–
–
+
–
0.134 1200
σиπ
– ЕН
+
–
+
+
+
+
σи
2π
– ИН
+
+
+
+
+
+
+
+
+
+
+
гомол
С6Н6
t, Kat
+
0.12
0
180
Sp
2
0.146
0
120
0.136
Sp
2
0.140 120
Me
σиπ
и
σиπ
– ДИЕН
+
–
+
+
+
Se
IФ
АРЕНЫ
C
C
C
CnH2n-6
C
C
C
0
6σ и
6π
БЕНЗОЛ
–
гомол.+
14.
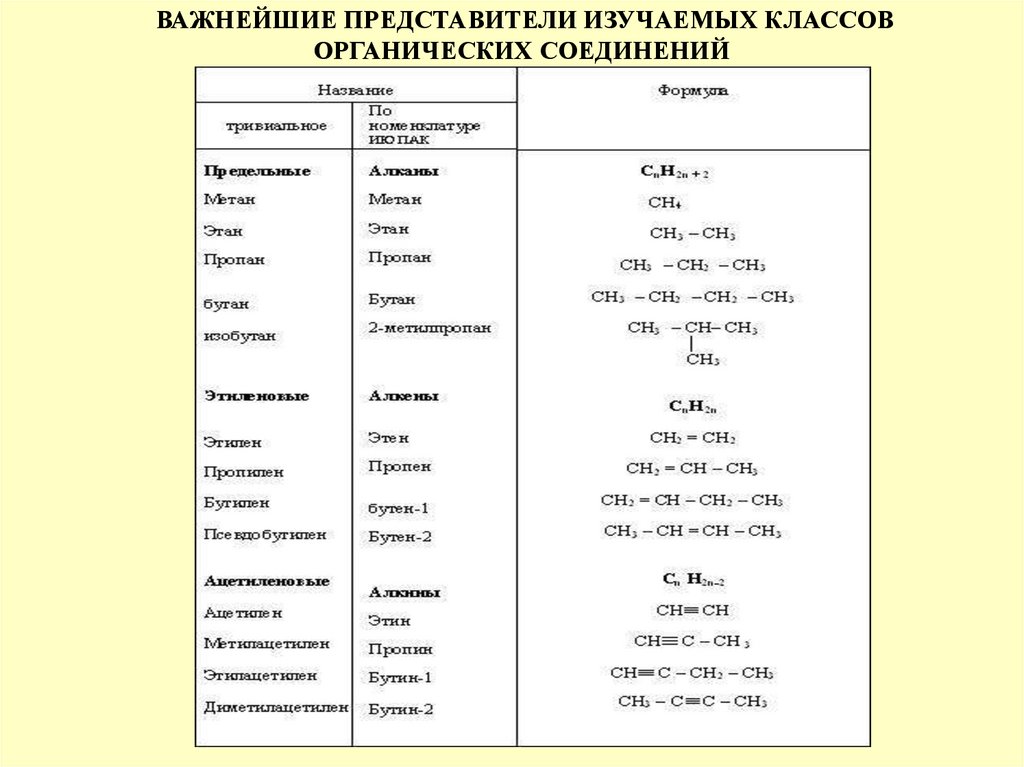
ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ ИЗУЧАЕМЫХ КЛАССОВОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
15.
16.
R-HalCnH2n+1Hal
CnH2n-1Hal
ПОЛУЧ.
I.
НОМ.
Ar-Hal
№СатHal, №СатR «греч» «АН»«ЕН» №Сат«=»
ИЗОМ.
«=»
«Hal» «цис- транс-»
«– » Halпр.
Со Ц За Р Т винилхлорид -14°
!
ССl4 -77°
+Hal2
1. из «АН»
(Sr)
+Hal2
2. из «ЕН»
(А)
3. «ЕН»+ННаl / Марк /.
4. ROH+Hhal
/ обмен /.
II.
«=» Halпр:
1. C2H4
t , Cl2
-HHal
2.
Cl
Cl
Винилхлорид
HHal
3.
III.
Hal2
JФ, О2
–
ХИМ. СВ-ВА
–
–
–
Se
δ+
С – Hal
–
δ-
(Sn)
–
–
1. Nu +R-Hal Nu-R + Hal
Nu : HO H, CH3C OONa, KC N, HN H2
2. «=», «Ar» – Halпр: ЭФ. СОПРЯЖЕН!
Sn-идут плохо.
3. Р. отщепление Hhal /элимениров-е, Е /.
ПРИМ.
Р-ль
«Ar» - Halпр:
Kat
диHal –
хладоагенты
A
С2Н5Сl
CK
ИНСЕКТИЦИДЫ
СF2=CF2 тефлон
CCl4
негорюч.
р-ль
17.
H2C – OHH2C – OH
|
|
n(OH) n>1
1=n
H2C – OH
HC – OH
одномного№сат
|
ди№сат
а…я «греч» ОЛ
атомные
а…я «греч» три- ОЛ
H2C – OH
ИЗОМ
Cu(OH)2 – КР! Со Ц сладк.
За Р Ткип>-ох
R С – ОН (I)
НОМ
в.
R
«– ОН»
С – ОН (II)
R
Со
Ц
За
Р
Т
С1-С3 – алк.
С1-С11 –
ВОДОРОД.СВ!
R
С
-С
–
непр.
Mr
4
6
С
…
–
С2Н5ОН+78
12
R С – ОН (II)
С7 > – нет
R
δ+ δ– δ+
ХИМ.СВ.
С – О – Н АМФ-ТЬ
ПОЛУЧ.
R – OH
СПИРТЫ
8
n=1
n>1
1.«ен» + НОН
(пр.Марк)
2.R – Hal + H OH
3.red – оксосоед-й:
H2
-аль
I-ол
H2
-он
II-ол
+2NaOH
1.Гидролиз диHalпр
2.р.Вагнера [O], H2O
ОХ: KMnO4, H2O2
ПРОМ-ТЬ: из С6Н12О6
OH
1.R – ОН
Ме
HBr
+
H
-H2O “ен”
2.ROH
3.ОХ: I
II
III
H2 +АКОГОЛЯТ
H2O+R – Br
-аль
-он
R – OH
О
ОН + Н О – R
R – OH
4.R – C
OH
СН3ОН
р-ль,АК
метеонии
ПР.
ЭФИР
С5Н11ОН
ПРИМ
брожение
СЛ.
этиленгликоль
С2Н5ОН
р-ль
груш/эс
орг/с
глицерин
ксилит
антифриз
!
18.
OHAr – (OH)n
OH
ФЕНОЛЫ
НАФТОЛЫ
ИЗОМ.
для 1– зам-х
Ц
Со
!
для 2– зам-х
«– ОН»
О– М– N–
Н
2.
ФЕНОЛЯТ
СH3
|
СH –CH3
+ М-эф
OH
MeOH
RHal
CH3–C
Н+
II.Реакции по
2.red: Н2
[O], HCl
C6H6Cl
пар
t, Kat
КИСЛ.СВ.
O
Cl
ПР
. ЭФИРЫ
СЛ.
: 1. SE (1,3,5 – пол.)
Ni
+
АЦЕТОН
3.OX
[O]
O
Кач.р.! FeCl3
КРЕЗОЛ
3.Сп.Рашига
С6Н6
трудно
0
I.Реакции по – ОН:
ФЕНОЛ
КУМОЛ
Ткип 181
ХИМ.СВ.
1.Смола, др.деготь:
NaOH
Р
охр.прир.
..
:O
ПОЛУЧ.
Ar – OH
За
ПРИМ
.
АНТИОКСИД.-ТЫ
СОХРАНЕН:
ЖИРЫ, МАСЛА
ПИЩ.КОНЦЕНТР.
Ф/Ф СМОЛЫ
КРАС-ЛЬ
O
хинон (п.п.)
фиолет.цв.
синий цв.
19.
СПИРТЫ И ФЕНОЛЫ20.
ПРИМ.ЭЛЕМЕНТ. ОРГ. СОЕДИНЕНИЯ
ПОЛУЧ.
1. Ме+ Rhal
2. PbNa/сплав /+Rhal
3. Р. Циглера:
+H 2+Al
Со Ц За
Т/Б
КРЕМНИЙ.-ОРГ.
Si( R )n
Si(CH 3)4 – тетра-CH 3-силан
ЭЛЕМЕНТЫ П. С. Д. И. М. +
ОРГАНОГЕНЫ
Ме(R)n
ном.
nR+назв.Ме
ХИМ. СВ-ВА.
С - – Ме +
tкип=26 C
HO H + + R -– MeHal
Электроизол
Каучук
подобные
Смаз./ м мат-лы
-
ОРГ. СИНТЕЗ
ПИЩ.ЖИР
-ол, к/к, NH 3.
П.: к С=О, С=N…
C + =O -+R -– Me + – Hal
формалин, укс. к.,
ацетон.
R-H
СМС
СЕРОСОДЕРЖ. О/С.
R–S–H–
СПИРТ
R–S–R–
ЭФИР
НОМ. :
За!
R ТИОЛ
З.: обр-е R-H:
0
-ОЛ
ПОЛ. : – ОЛ+Н 2S
Kat
t0
СВ-ВА : этантиол [o] R–S–S–
О.В.
ПРИМ.
(ИПРИТ)
ТИОМОЧЕВ.
(рост
)
21.
С.-П. «Оксосоединения»Определение
Общая формула
1.
2.
Чем отличается номенклатура альдегидов от
номенклатуры кетонов?
Номенклатура
Каковы особености изомерии оксосоединений?
Изомерия
Получение
из
ол
«
из
из
из
Ц
Назовите основные реакции получения
Альдегидов
Кетонов.
ДиНаlAlK кумола
1,1 и1,2
»
Физические свойства
Со
В чем отличие общей формулы альдегидов от
кетонов?
Почему альдегиды и кетоны можно объеденить в
класс «Оксосоединения»?
За
Р
Т
Каковы особенности физических свойств следующих
оксосоединений:
H–C
O
H
CH3–C
Химические свойства
Пр.
Зам.
Полим-я
(AN)
[O]
[H]
Значение
Кач.р.
1.
2.
3.
, CH3–C
O
H
, CH2=CH–C
O
H
,
CH3
O
Какие продукты образуются в реакции
присоединения H2 к ацетону, этаналю?
Приведите примеры реакций: замещения,
полимеризации. Назовите полученные продукты.
Каковы качественные реакции: альдегидов, кетонов?
Приведите примеры использования оксосоединений в
различных отраслях промышленности (в т.ч. и в
пищевой!)
22.
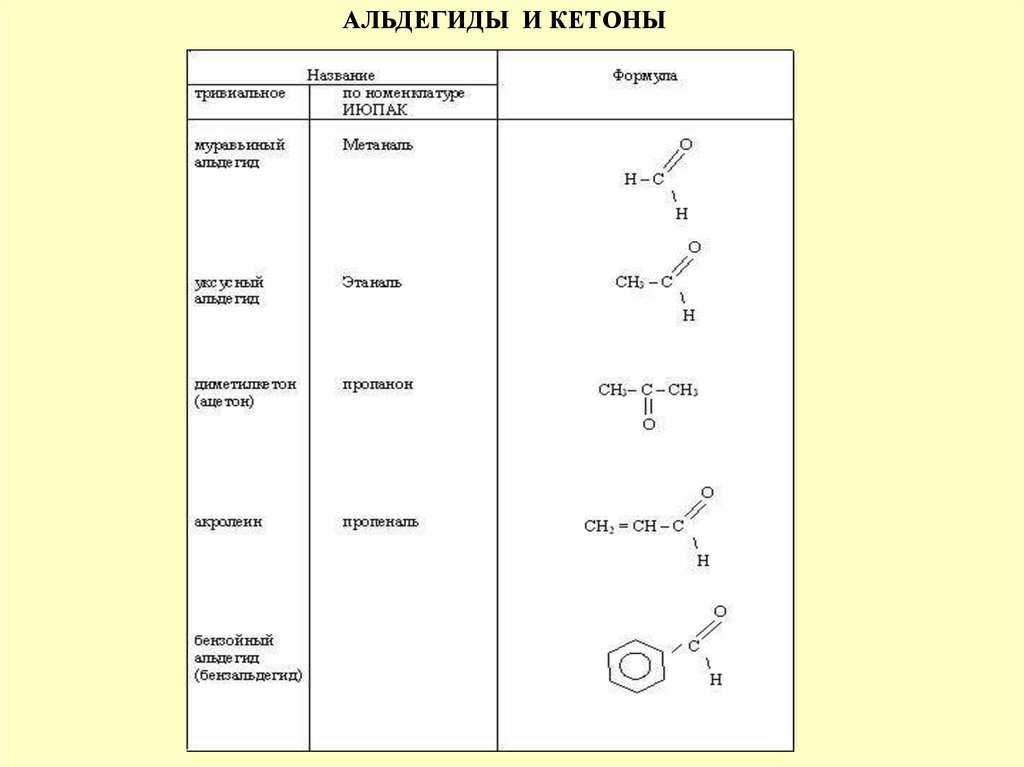
АЛЬДЕГИДЫ И КЕТОНЫА…Я «ГРЕЧ» -АЛЬ
R–С–
R–С–
H
O
O
<120
ПОЛ.:
[ О ] –АЛЬ
–ОН
II
–ОН
КУМОЛ
–ОЛI
С
0
О
0,121 нм
НОН
ДИ HalAlk
Co
Ц За
R– C
р.Кучерова
1,1– Н О Н
2,2–
O
П . H 2, N a S O 3, R O H …
Р Тк<
А цеталь
З.
ПРИМ.
Hal
Синтез Фриделя-Крафтса
С= О
C H 3 –С
P C l5
+H al
П О Л -Я : Ф .-Ф .С М О Л Ы М
–АЛЬ
–ОН
Н2
ХИМ.СВ.:
М -З М : A n
-ОЛ
–ИН
А…Я «ГРЕЧ» -ОН
R
ПИЩ.ПР.
С/Х
РИЗОЛ
О . К а ч .р !
C u (O H )
–А ЛЬ
п р о б а Л е га л я
2
АЦЕТАЛЬ
ОРГ.
СИНТЕЗ
К.АНАЛИЗ
(ВАНИЛИН)
1000
–О Н
23.
АЛЬДЕГИДЫ И КЕТОНЫ24.
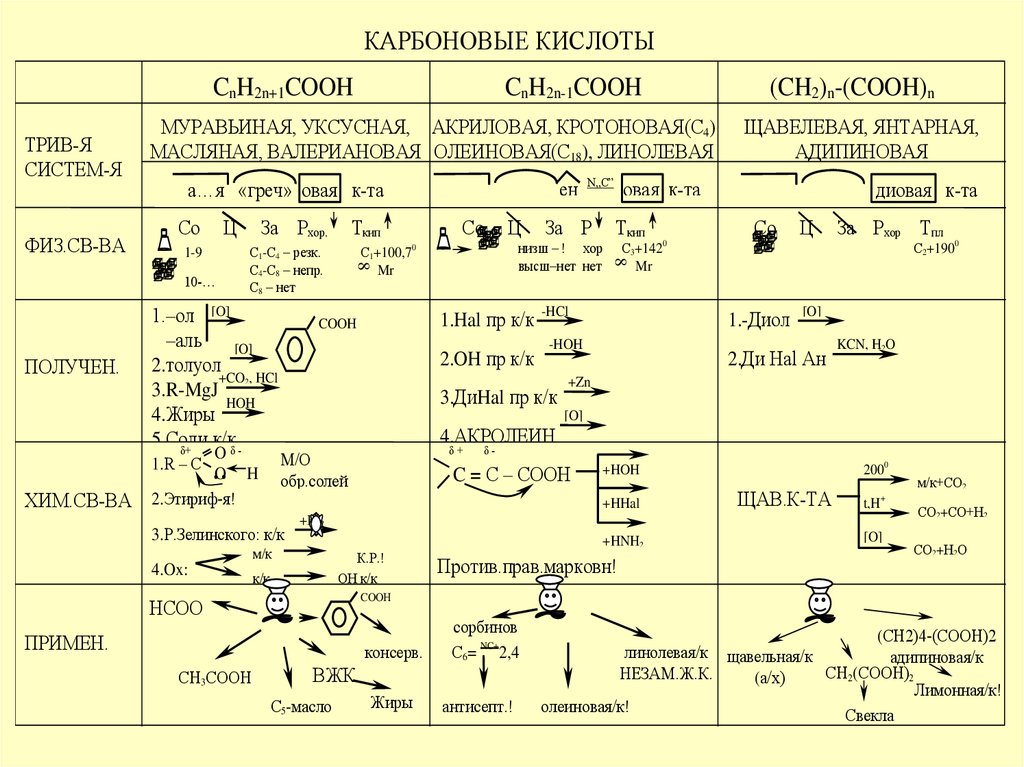
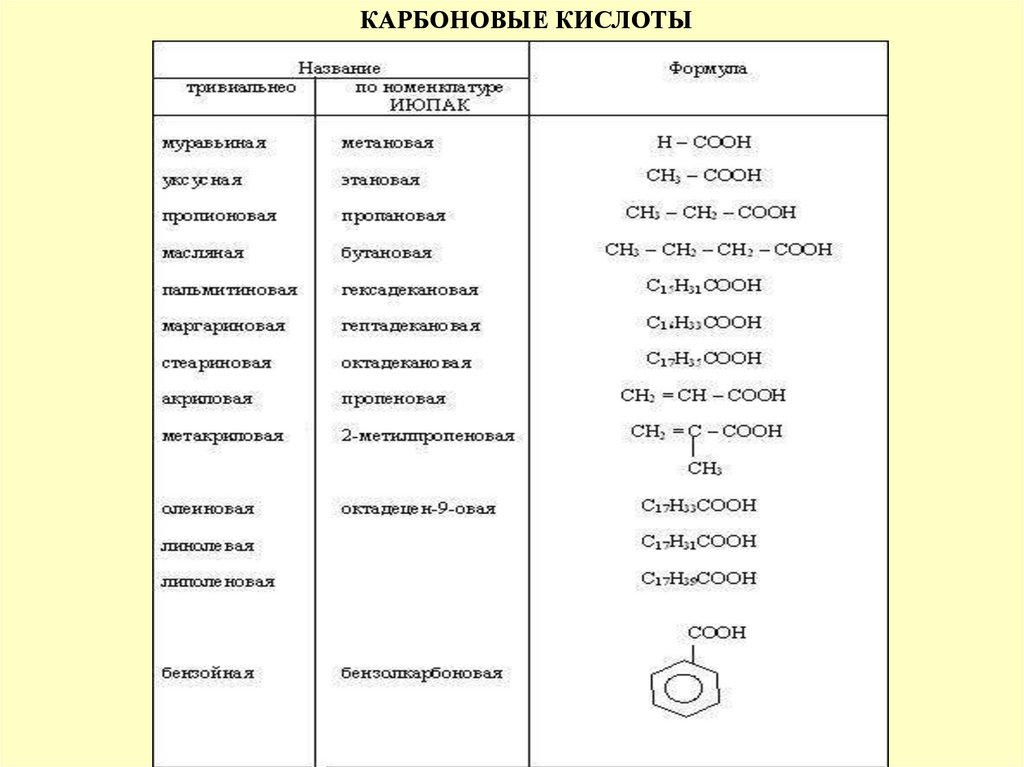
КАРБОНОВЫЕ КИСЛОТЫCnH2n+1COOH
ТРИВ-Я
СИСТЕМ-Я
ФИЗ.СВ-ВА
МУРАВЬИНАЯ, УКСУСНАЯ, АКРИЛОВАЯ, КРОТОНОВАЯ(С4)
МАСЛЯНАЯ, ВАЛЕРИАНОВАЯ ОЛЕИНОВАЯ(С18), ЛИНОЛЕВАЯ
Со
За Рхор.
С1-С4 – резк.
С4-С8 – непр.
С8 – нет
1.–ол [O]
–аль
[O]
2.толуол
+CO2, HCl
3.R-MgJ
HOH
4.Жиры
5.Соли
к/кδ δ+
O
1.R – C
O H
2.Этириф-я!
За Р
1.Hal пр к/к
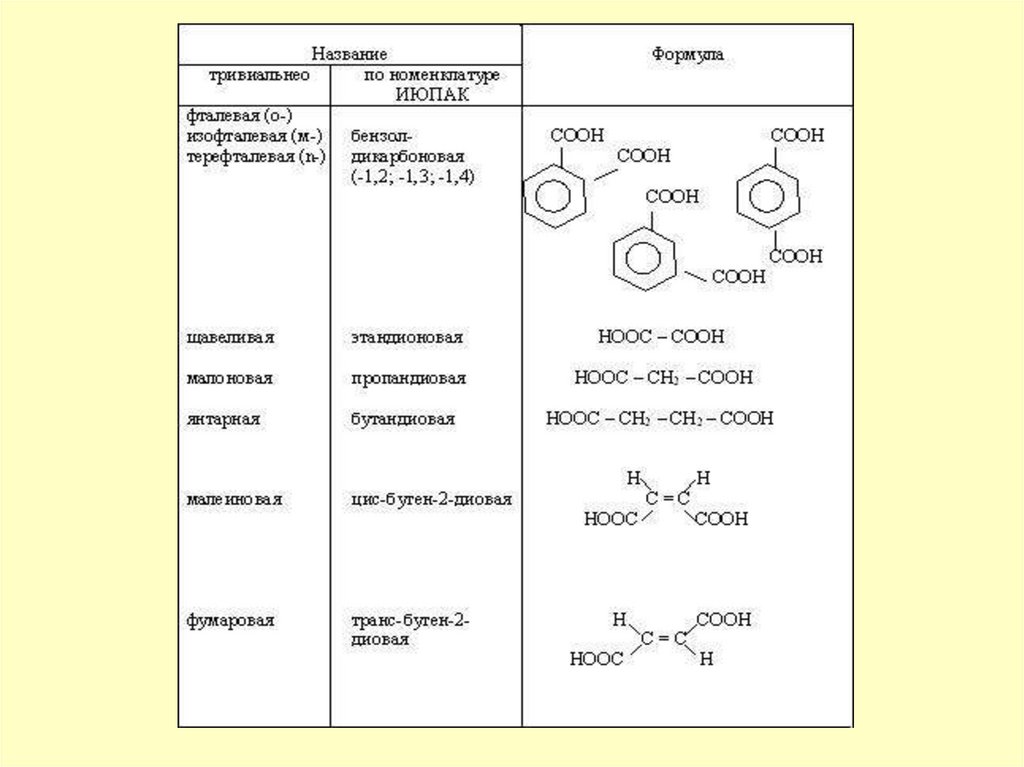
ЩАВЕЛЕВАЯ, ЯНТАРНАЯ,
АДИПИНОВАЯ
овая к-та
Ткип
низш – ! хор
высш–нет нет
диовая к-та
Со
Ц
За Рхор Тпл
С3+1420
Mr
-HCl
С2+1900
1.-Диол
-HOH
3.ДиHal пр к/к
[O]
2.Ди Hal Ан
KCN, H2O
+Zn
[O]
4.АКРОЛЕИН
δ+
М/О
обр.солей
δ-
C = C – COOH
2000
+HOH
+HHal
ЩАВ.К-ТА
+HNH2
К.Р.!
ОН к/к
к/к
Против.прав.марковн!
м/к+СО2
+
t,H
+Br2
[O]
СО2+СО+Н2
СО2+Н2О
COOH
НСОО
Н
СН3СООН
Ц
2.OH пр к/к
м/к
4.Ox:
С1+100,7
Mr
Со
0
COOH
3.Р.Зелинского: к/к
ПРИМЕН.
Ткип
N,,C”
(CH2)n-(COOH)n
8
1-9
Ц
8
ХИМ.СВ-ВА
ен
а…я «греч» овая к-та
10-…
ПОЛУЧЕН.
CnH2n-1COOH
консерв.
сорбинов
NC+
С6= 2,4
ВЖК
С5-масло
Жиры
антисепт.!
(СН2)4-(СООН)2
линолевая/к щавельная/к
адипиновая/к
СН2(СООН)2
НЕЗАМ.Ж.К.
(а/х)
Лимонная/к!
олеиновая/к!
Свекла
25.
КАРБОНОВЫЕ КИСЛОТЫ26.
27.
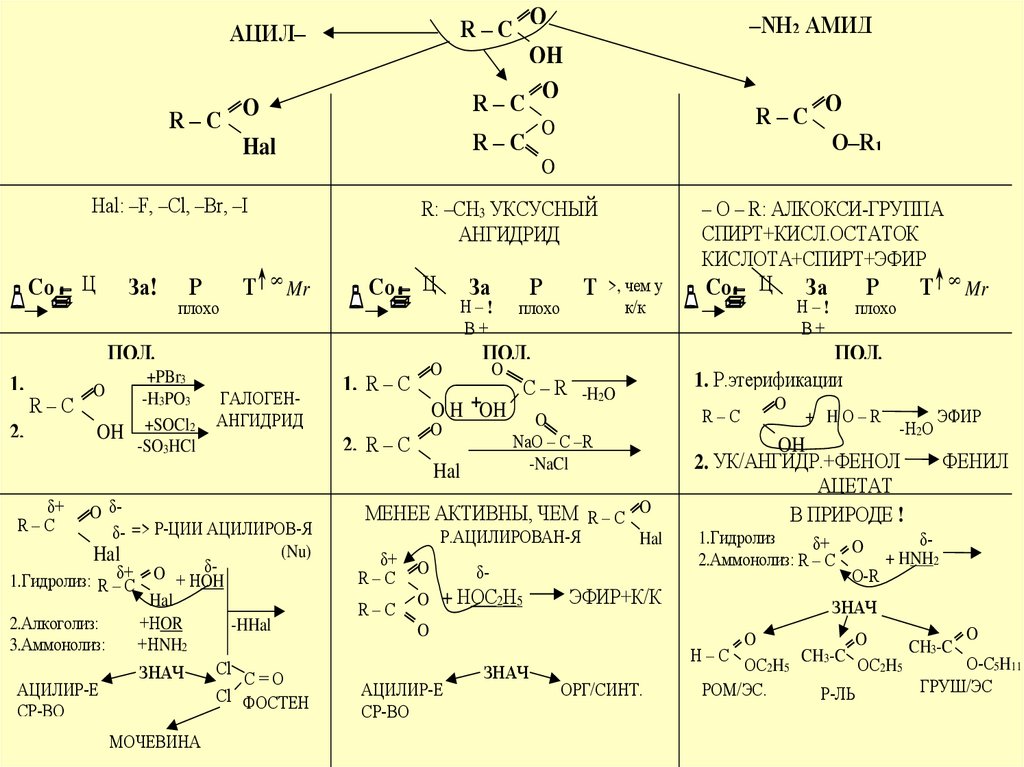
R–CO
R–C
Hal
R–C
Р
плохо
Т
Mr
Со
Ц
R–C
2.
+PBr3
-H3PO3
OH +SOCl2
-SO3HCl
O
ГАЛОГЕНАНГИДРИД
За
Н–!
В+
ПОЛ.
1.
O
O δδ- => Р-ЦИИ АЦИЛИРОВ-Я
(Nu)
Hal
δ1.Гидролиз: R –δ+C O + HOH
Hal
2.Алкоголиз:
+HOR
-HHal
3.Аммонолиз:
+НNH2
Сl
ЗНАЧ
С=O
АЦИЛИР-Е
Сl ФОСТЕН
СР-ВО
МОЧЕВИНА
O
1. R – C
Т
плохо
O
O H +OH
O
2. R – C
Р
>, чем у
к/к
ПОЛ.
Hal
δ+
R–C
R–C
O
O–R1
R–C
O
NaO – C –R
-NaCl
МЕНЕЕ АКТИВНЫ, ЧЕМ R – C O
δ+
R–C
R–C
O
Hal
δ-
O + НОС2Н5
ЭФИР+К/К
O
АЦИЛИР-Е
СР-ВО
ЗНАЧ
Н–!
В+
плохо
ПОЛ.
1. Р.этерификации
С – R -H2O
Р.АЦИЛИРОВАН-Я
– O – R: АЛКОКСИ-ГРУППА
СПИРТ+КИСЛ.ОСТАТОК
КИСЛОТА+СПИРТ+ЭФИР
Со Ц За
Р
Т Mr
8
За!
OH
O
R: –CH3 УКСУСНЫЙ
АНГИДРИД
8
Ц
–NH2 АМИД
O
Hal: –F, –Cl, –Br, –I
Со
O
R–C
АЦИЛ–
ОРГ/СИНТ.
O
+ HO–R
-Н2О
ЭФИР
OH
2. УК/АНГИДР.+ФЕНОЛ
АЦЕТАТ
В ПРИРОДЕ !
ФЕНИЛ
1.Гидролиз
δδ+ O
+ HNH2
2.Аммонолиз: R – C
О-R
ЗНАЧ
O
O
O
CH
3-C
H–C
CH3-C
О-C5H11
ОC2H5
ОC2H5
ГРУШ/ЭС
РОМ/ЭС.
Р-ЛЬ
28.
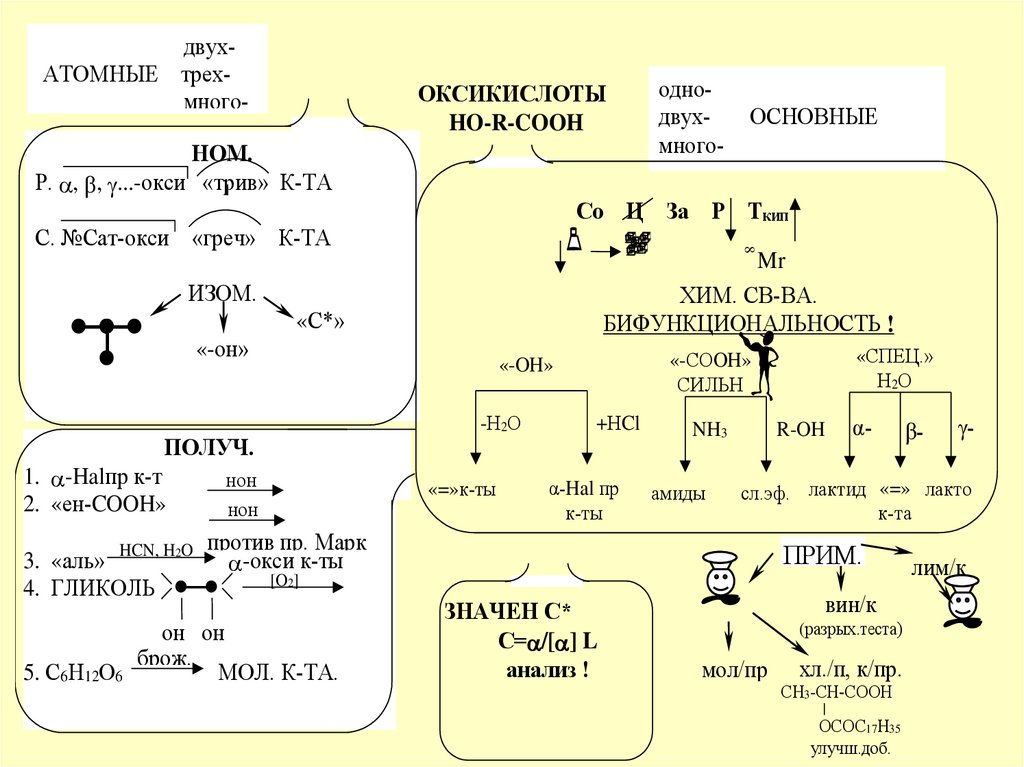
двухАТОМНЫЕ трехмного-ОКСИКИСЛОТЫ
HO-R-COOH
НОМ.
Р. , , ...-окси «трив» К-ТА
однодвухмного-
Со Ц За Р Ткип
8
С. №Сат-окси «греч» К-ТА
Mr
ХИМ. СВ-ВА.
БИФУНКЦИОНАЛЬНОСТЬ !
ИЗОМ.
«С*»
«-он»
-Н2О
1. -Halпр к-т
2. «ен-COOH»
HCN, H2O
3. «аль»
4. ГЛИКОЛЬ
нон
нон
«=»к-ты
«СПЕЦ.»
Н2О
«-СОOH»
СИЛЬН
«-OH»
ПОЛУЧ.
ОСНОВНЫЕ
+НCl
α-Hal пр
к-ты
NH3
амиды
R-OH
α-
ПРИМ.
лим/к
[O2]
он он
брож.
5. С6Н12О6
МОЛ. К-ТА.
γ-
сл.эф. лактид «=» лакто
к-та
против пр. Марк
-окси к-ты
ЗНАЧЕН С*
С= /[ ] L
анализ !
β-
вин/к
мол/пр
лим.
/
(разрых.теста)
к-та
хл./п, к/пр.
СН3-СН-СООН
|
вин./к
ОСОС
17Н35
улучш.доб.
29.
ОКСИКИСЛОТЫ30.
АЛЬДЕГИДО- И КЕТОКИСЛОТЫ31.
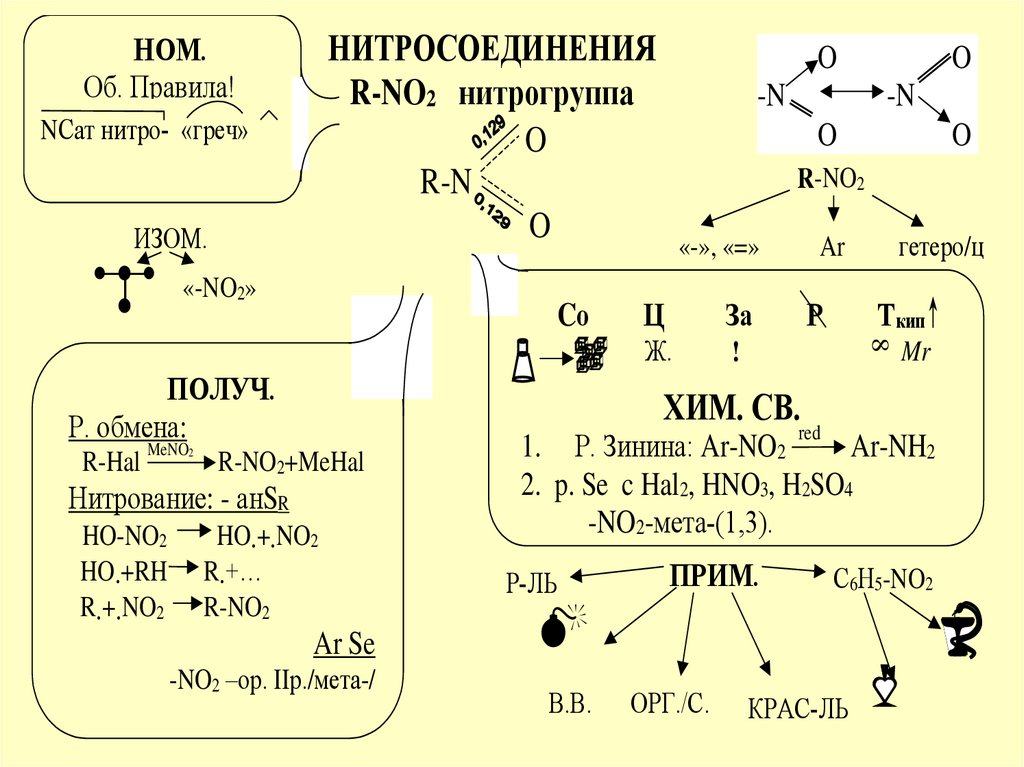
НИТРОСОЕДИНЕНИЯR-NO2 нитрогруппа
O
R-N
O
НОМ.
Об. Правила!
NСат нитро- «греч»
ИЗОМ.
«-NO2»
Cо
R-Hal
MeNO2
-N
O
O
R-NO2
«-», «=»
Ц
За
Ж.
!
гетеро/ц
Ar
Р
Ткип
Mr
ХИМ. СВ.
red
R-NO2+MeHal
Нитрование: - анSR
HO-NO2
HO +RH
R + NO2
-N
O
8
ПОЛУЧ.
Р. обмена:
O
HO + NO2
R +…
R-NO2
Ar Se
-NO2 –ор. IIр./мета-/
1. Р. Зинина: Ar-NO2
Ar-NH2
2. p. Se c Hal2, HNO3, H2SO4
-NO2-мета-(1,3).
Р-ЛЬ
ПРИМ.
С6Н5-NO2
В.В.
ОРГ./С.
КРАС-ЛЬ
32.
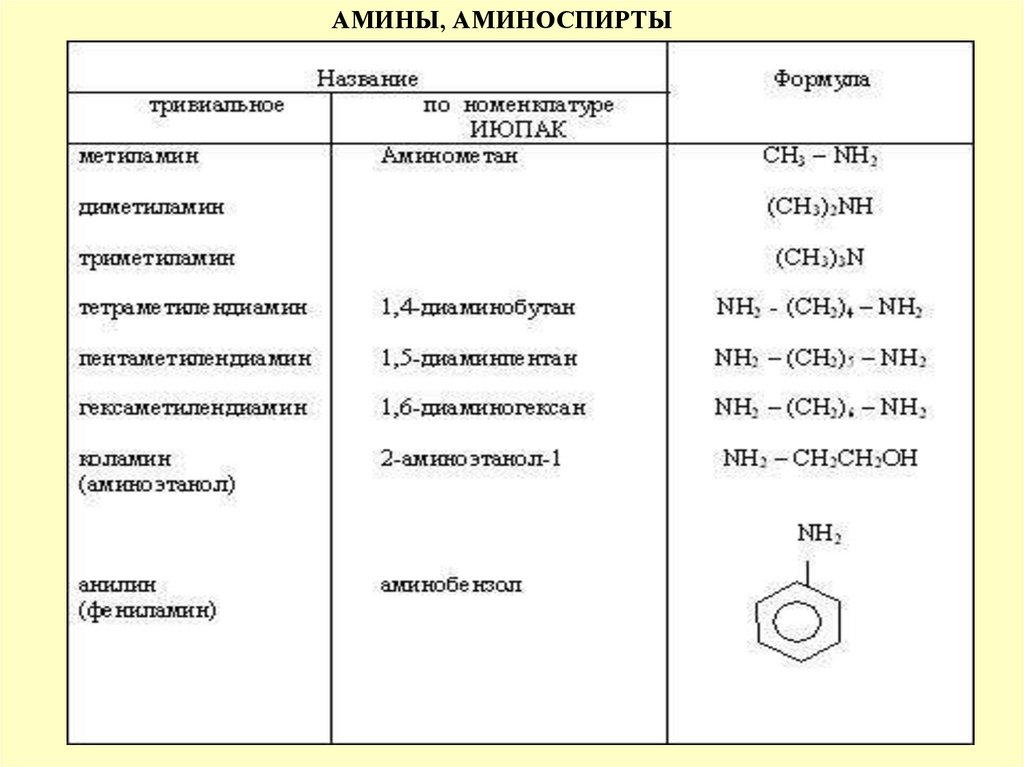
АМИНЫR 1-N-R2
NH3
|
R3
R-NH
•• 2
АНИЛИН
Ц
8
За
Р
Ткип
Mr
т.рыб.!
ХИМ. СВ-ВА.
Н
•
НОН
1. RNH2 +
НСl
НОМ.
|
H
Cо
R1-N-R2
+
–
R : N : H OH(Cl)
•
H
АМИНОГРУППА
Р. «греч» АМИН
С. ОБ. ПРАВИЛА!
NCaтАМИНО-«греч»-АН
-ЕН
ПОЛУЧ.
р. Зинина
R-NO2
р. Гофмана
H3N
R-OH+NH3
ИЗОМ.
«-NH2»
ион -R аммония
2. Alk-e /р. Гофмана /:
NH3 –
R-Hal
2R-Hal
3R-Hal
R-NH2
R2-NH
R3-NH
3. Ацилирование:
-CO-R
R-NH2
R-NH-CO-R
4. p. SE-NH2-op.Ip. /o-, n-/.
ПРИМ.
Р-ЛЬ
КРАС-ЛЬ
ПАВ.
5. R-NH2
N2 +CO2 +H2O
ИНСЕКТИЦ.
ВМС
33.
АМИНЫ, АМИНОСПИРТЫ34.
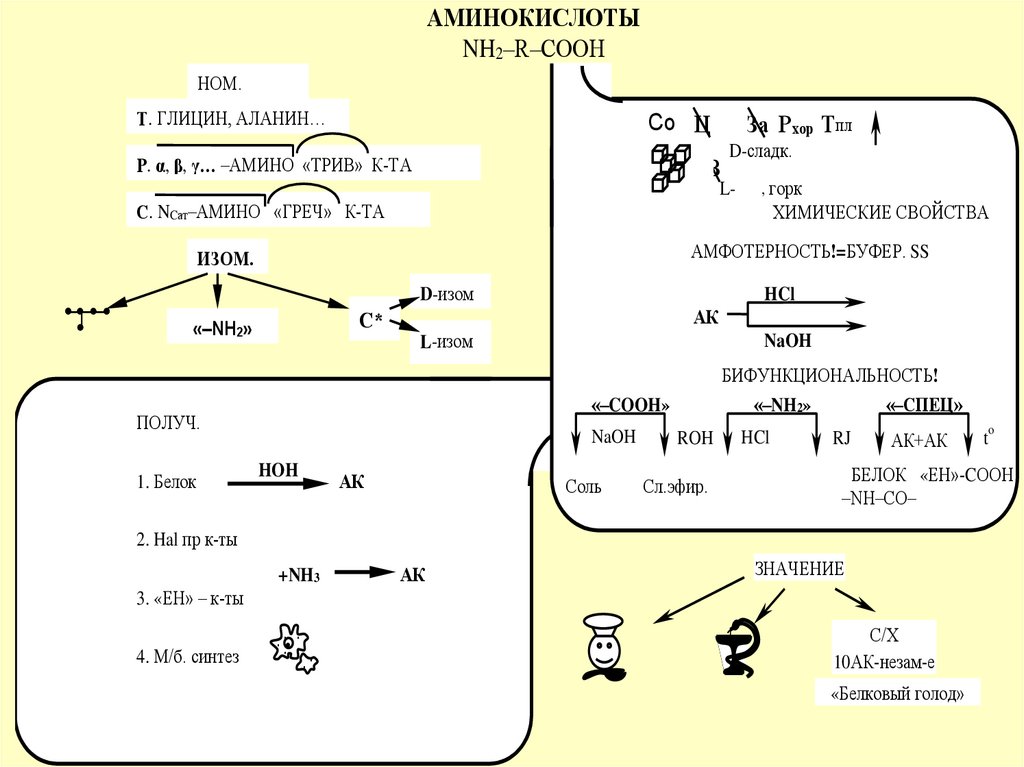
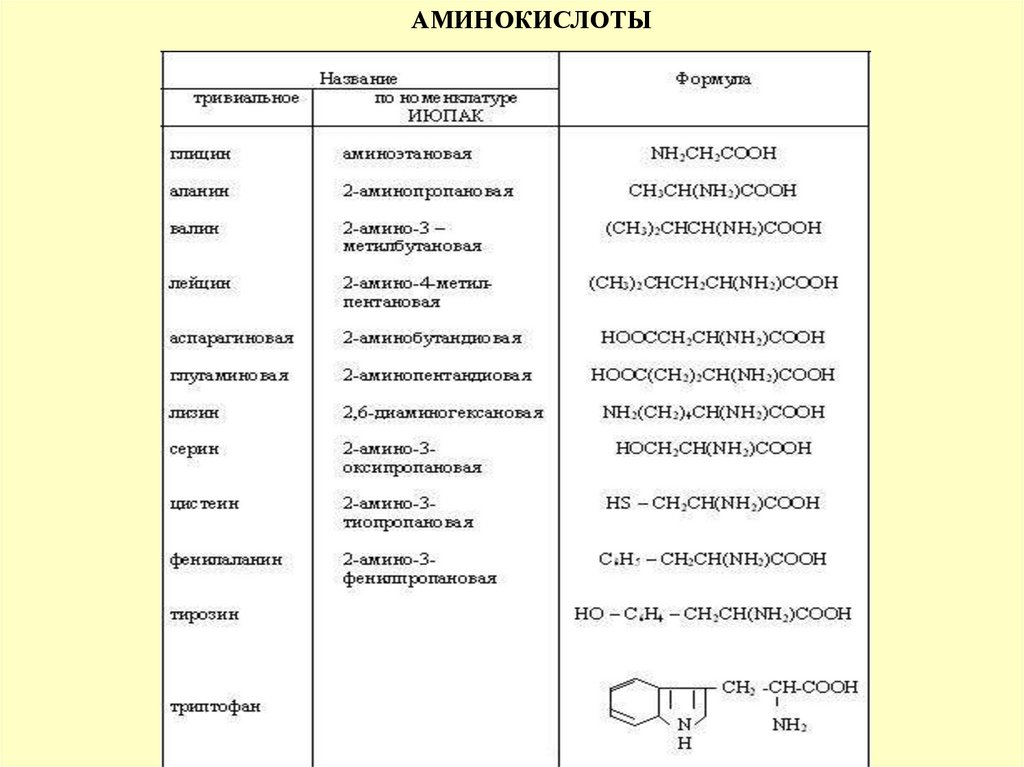
АМИНОКИСЛОТЫNH2–R–COOH
НОМ.
Т. ГЛИЦИН, АЛАНИН…
Co Ц
Р. α, β, γ… –АМИНО «ТРИВ» К-ТА
За Рхор Тпл
В
D-сладк.
L-
, горк
С. NCат–АМИНО «ГРЕЧ» К-ТА
ХИМИЧЕСКИЕ СВОЙСТВА
АМФОТЕРНОСТЬ!=БУФЕР. SS
ИЗОМ.
D-изом
АК
С*
«–NH2»
NaOH
L-изом
БИФУНКЦИОНАЛЬНОСТЬ!
«–NH2»
«–СПЕЦ»
«–COOH»
ПОЛУЧ.
1. Белок
HCl
NaOH
HOH
АК
Соль
ROH
Сл.эфир.
HCl
RJ
АК+АК
АК
ЗНАЧЕНИЕ
3. «ЕН» – к-ты
4. М/б. синтез
o
БЕЛОК «ЕН»-CООН
–NH–CO–
2. Hal пр к-ты
+NH3
t
С/Х
10АК-незам-е
«Белковый голод»
35.
АМИНОКИСЛОТЫ36.
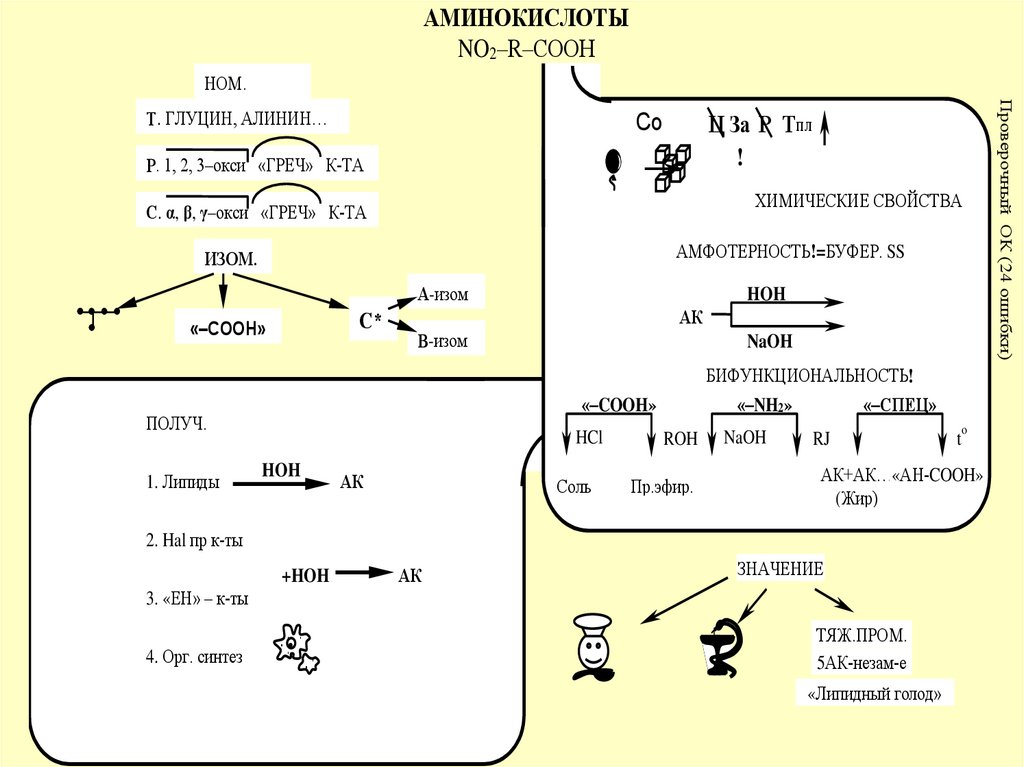
АМИНОКИСЛОТЫNO2–R–COOH
НОМ.
Ц За Р Тпл
!
Co
Р. 1, 2, 3–окси «ГРЕЧ» К-ТА
ХИМИЧЕСКИЕ СВОЙСТВА
С. α, β, γ–окси «ГРЕЧ» К-ТА
АМФОТЕРНОСТЬ!=БУФЕР. SS
ИЗОМ.
А-изом
С*
«–COOH»
АК
В-изом
NaOH
БИФУНКЦИОНАЛЬНОСТЬ!
«–NH2»
«–СПЕЦ»
«–COOH»
ПОЛУЧ.
1. Липиды
HOH
HCl
HOH
АК
Соль
ROH
Пр.эфир.
NaOH
RJ
АК
ЗНАЧЕНИЕ
3. «ЕН» – к-ты
4. Орг. синтез
o
АК+АК…«АН-COOH»
(Жир)
2. Hal пр к-ты
+HOH
t
ТЯЖ.ПРОМ.
5АК-незам-е
«Липидный голод»
Проверочный ОК (24 ошибки)
Т. ГЛУЦИН, АЛИНИН…
37.
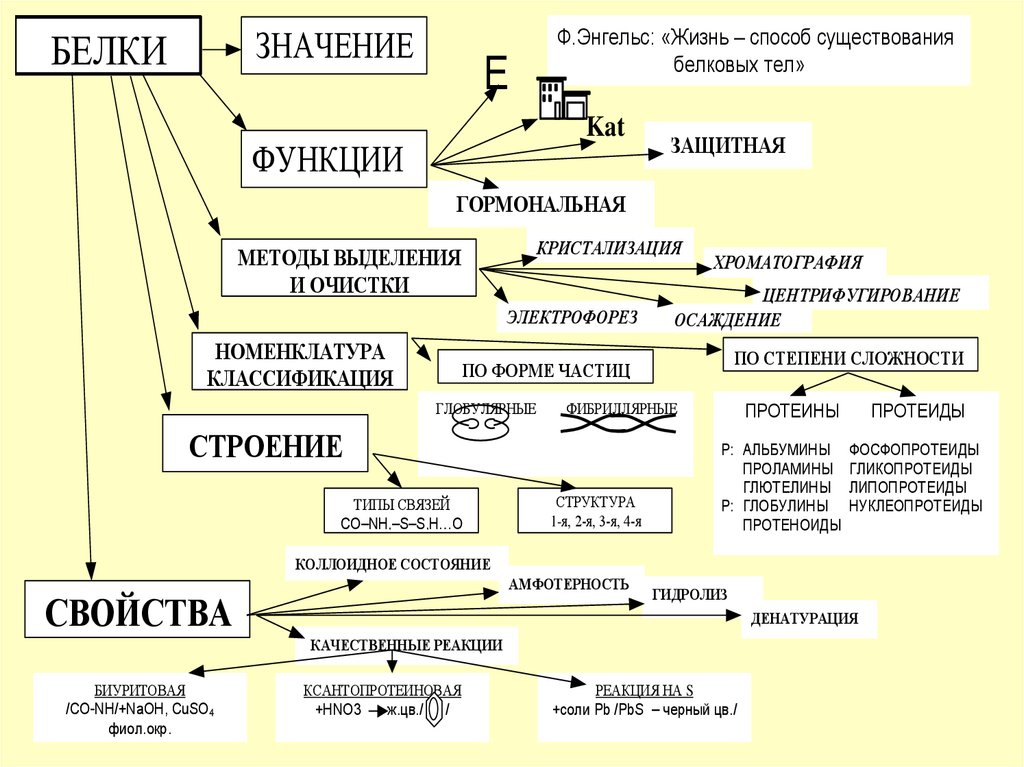
ЗНАЧЕНИЕБЕЛКИ
Е
Ф.Энгельс: «Жизнь – способ существования
белковых тел»
Kat
ФУНКЦИИ
ЗАЩИТНАЯ
ГОРМОНАЛЬНАЯ
КРИСТАЛИЗАЦИЯ
МЕТОДЫ ВЫДЕЛЕНИЯ
И ОЧИСТКИ
ЭЛЕКТРОФОРЕЗ
НОМЕНКЛАТУРА
КЛАССИФИКАЦИЯ
ХРОМАТОГРАФИЯ
ЦЕНТРИФУГИРОВАНИЕ
ОСАЖДЕНИЕ
ПО СТЕПЕНИ СЛОЖНОСТИ
ПО ФОРМЕ ЧАСТИЦ
ГЛОБУЛЯРНЫЕ
ФИБРИЛЛЯРНЫЕ
СТРОЕНИЕ
ТИПЫ СВЯЗЕЙ
CO–NH,–S–S,H…O
СТРУКТУРА
1-я, 2-я, 3-я, 4-я
ПРОТЕИНЫ
Р: АЛЬБУМИНЫ
ПРОЛАМИНЫ
ГЛЮТЕЛИНЫ
Р: ГЛОБУЛИНЫ
ПРОТЕНОИДЫ
ПРОТЕИДЫ
ФОСФОПРОТЕИДЫ
ГЛИКОПРОТЕИДЫ
ЛИПОПРОТЕИДЫ
НУКЛЕОПРОТЕИДЫ
КОЛЛОИДНОЕ СОСТОЯНИЕ
АМФОТЕРНОСТЬ
СВОЙСТВА
ГИДРОЛИЗ
ДЕНАТУРАЦИЯ
КАЧЕСТВЕННЫЕ РЕАКЦИИ
БИУРИТОВАЯ
/CO-NH/+NaOH, CuSO4
фиол.окр.
КСАНТОПРОТЕИНОВАЯ
+HNO3
ж.цв./ /
РЕАКЦИЯ НА S
+соли Pb /PbS – черный цв./
38.
Качественные реакцииИНСУЛИН-5700
ГЕМОГЛОБИН-650000
МИОЗИН-50000
Mr
БИУРЕТОВАЯ
–CO–NH+
HO–H
– NH – CO –
ЖЕЛУДОК
NaOH+CuSO4
˜P˜
ГИДРОЛИЗ
˜P˜
КОЛЛОИД
КИШЕЧНИК
Р-Р
КСАНТОПРОТЕИННАЯ
Б=АМФОТЕР. ЭЛЕКТР-Т
ПЕЧЕНЬ
NO2
HNO3P
Ak
КРОВЬ
КЛЕТКИ
РАСЩЕПЛЕНИЕ
[Ох]
CO2
H2O
NH3
ПРОТЕИНЫ
Б
ФУНКЦИИ
10
12
ОТ 10 – 10
Э.Фишер
ОРГАНИЗАЦИЯ
α
20 – АК –
ПЕПТИДНАЯ ТЕОРИЯ
От вирусов 1,2 млн. видов до
E 1г – 17кДж
ФЕРМЕНТНАЯ
>2 тыс.
оксидазы, лиазы,
синтетазы и др.
РЕГУЛЯТОРНАЯ
гормоны
ЗАЩИТНАЯ
антитела
Гемоглобин
СОСТАВ
Ak–Ak–Ak…
C-54
O-23
N-17
H-7
C-2
P, Fe, Mn, Mg…
I
II
%
III
ГЛОБУЛЫ
IV
39.
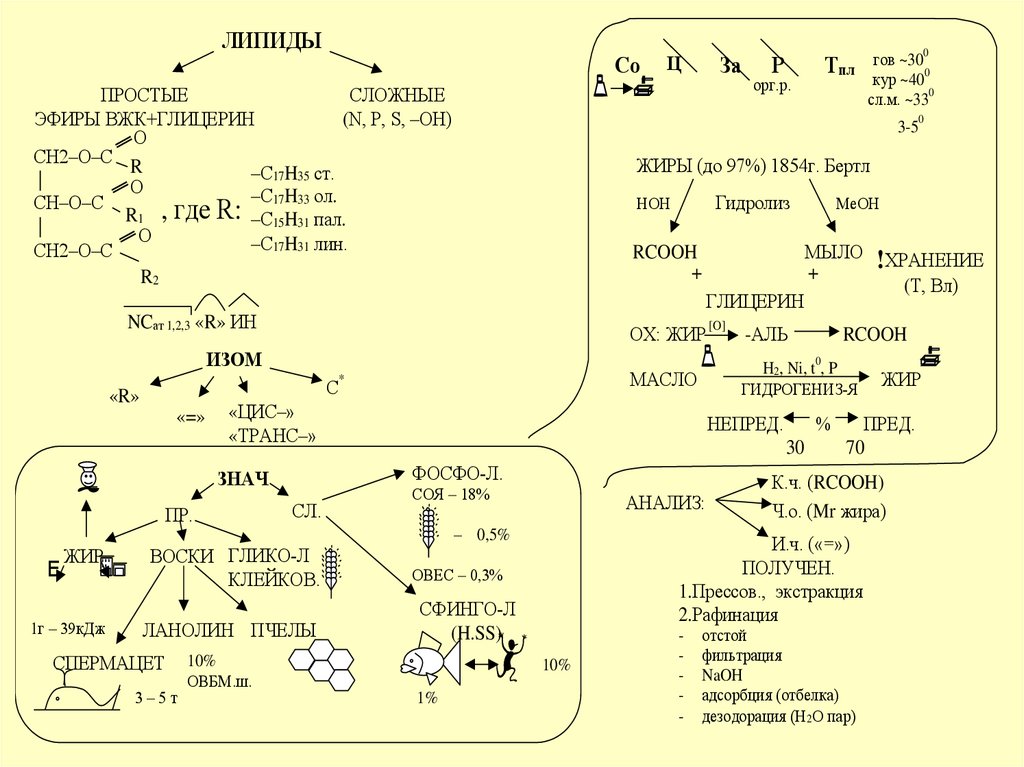
ЛИПИДЫСо
ПРОСТЫЕ
СЛОЖНЫЕ
ЭФИРЫ ВЖК+ГЛИЦЕРИН
(N, P, S, –OH)
О
CH2–O–C
R
–C17H35 ст.
|
О
–C17H33 ол.
CH–O–C
,
где
R:
R1
–C15H31 пал.
|
О
–C17H31 лин.
CH2–O–C
R2
0
МеОН
МЫЛО
+
RCOOH
+
[O]
-АЛЬ
!ХРАНЕНИЕ
(Т, Вл)
RCOOH
H2, Ni, t , P
ГИДРОГЕНИЗ-Я
МАСЛО
*
«ЦИС–»
«ТРАНС–»
НЕПРЕД.
СЛ.
1г – 39кДж
ЛАНОЛИН ПЧЕЛЫ
%
30
ФОСФО-Л.
ВОСКИ ГЛИКО-Л
КЛЕЙКОВ.
3–5т
0
гов ~30
0
кур ~40
0
сл.м. ~33
0
ЖИР
СПЕРМАЦЕТ
орг.р.
Гидролиз
НОН
ОХ: ЖИР
ЗНАЧ
Е
Тпл
ГЛИЦЕРИН
С
ПР.
Р
ЖИРЫ (до 97%) 1854г. Бертл
ИЗОМ
«=»
За
3-5
NCат 1,2,3 «R» ИН
«R»
Ц
СОЯ – 18%
АНАЛИЗ:
– 0,5%
СФИНГО-Л
(H.SS)
10%
ОВБМ.ш.
10%
1%
ПРЕД.
70
К.ч. (RCOOH)
Ч.о. (Mr жира)
И.ч. («=»)
ПОЛУЧЕН.
1.Прессов., экстракция
2.Рафинация
ОВЕС – 0,3%
-
ЖИР
отстой
фильтрация
NaOH
адсорбция (отбелка)
дезодорация (Н2О пар)
40.
Обобщающий ОККлассы
орг. соед-й
Альдегиды
Кетоны
Общая
формула
O
R–C
H
Особен. в
строении
δ+
–C
C
CnH2n+1COOH
Непредельн.
к/к
CnH2n-1COOH
Сложные
жиры
Жиры
R–C
O
Hal
O
O–R
CH2-O-COR
|
CH-O-COR
|
CH2-O-COR
–аль
из I-ол
C2H2
Cu(OH)2
Ag
Cu2O
из II-ол
Cu(OH)2
CuO
–он
O δ–
Предельные
к/к
R–C
H
Особености
получения
Основные хим.
реакции
кр.цв.
δ+
R C R
O
Галогенангидриды
Oδ–
Особен. в
названии
«–»
–C
«=»
–C
δ+
–C
δ+
–C
3к/к+-ол
O
O–H
O
O–H
δ–
O
Hal
O
δ–
δ–
–овая к-та
АЦИЛ+Hal-ИД
К/к+-ол эфир
O–R
3 к/к+три-ол
м/о, лакмус
из RCOOMe
Na2CO3
-EHNC-овая
к-та
CO2
Пр. Br2 (вода)
Hal- пр RCOOH
обесцв.
Ox
KMnO
(вода)
4
OHиз RCO OH
+Hal
Ацилирование!
HOH, HOR, NH2H
Ацилирование
HOH, NH2H
этерификация
+H2
NC 1,2,3
черн.цв.
гидролиз HOH
-ИН
гидрогенизация Ox
NaOH
O2
хранение
41.
Хеуорзс-20гСН2ОН
НО
О
ОН
С
ОН
Н
CH2OH
O OH
L
OH
HO
D
ОН
OH
О:
Ag2O
Cu(OH)2
П:
H2
HCN
C6H12O6
БРОЖЕНИЕ
мол.
CH3OH
5-OH: Cu(OH)2 –реакт. Фелинга
: А.П. Ag2O - реактив
Н
Толленса
глюк. к-та
сорбит
CH2-CH-CH-CH-CH-C
H
OH OH OH OH OH
-С
o
ОН
С2Н5ОН СН3-СН-COOH масл. к
O
О
t
В
Р
силос.
ПОЛ-Е.
Со
Ц
кваш.
1. Фотосинт. СО2+Н2О
Н2О. Н+
2. Ди- и Поли- Сах.
НСN
3. Оксонитр. синтез
Е
ЗНАЧ
.
h , ХЛ.
42.
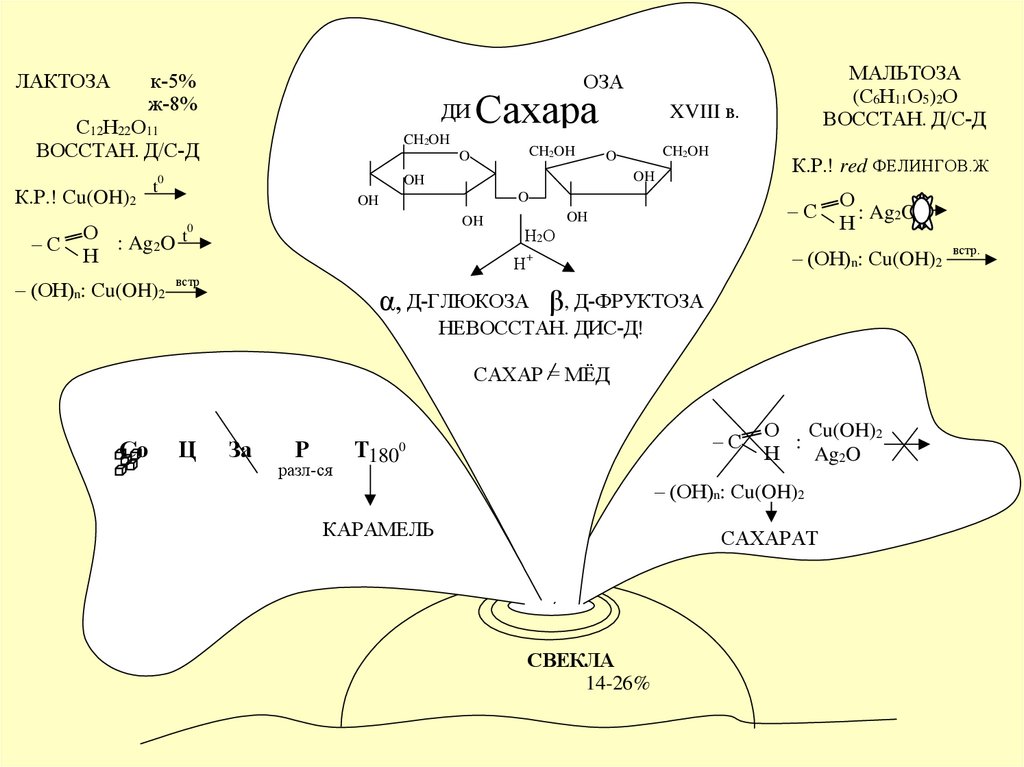
ЛАКТОЗАк-5%
ж-8%
ДИ
С12Н22О11
ВОССТАН. Д/С-Д
К.Р.! Сu(OH)2
–С
t
Сахара
CH2OH
CH2OH
O
XVIII в.
CH2OH
O
К.Р.! red ФЕЛИНГОВ.Ж
OH
OH
0
O
OH
OH
0
О
t
: Ag2O
Н
– (OH)n: Сu(OH)2
МАЛЬТОЗА
(С6Н11О5)2О
ВОССТАН. Д/С-Д
ОЗА
–С
OH
Н2О
– (OH)n: Сu(OH)2
+
Н
встр
О
: Ag2O
Н
α, Д-ГЛЮКОЗА β, Д-ФРУКТОЗА
НЕВОССТАН. ДИС-Д!
САХАР = МЁД
Со
Ц
За
Р
разл-ся
Т180
–С
0
О Сu(OH)2
:
Н
Ag2O
– (OH)n: Сu(OH)2
КАРАМЕЛЬ
САХАРАТ
СВЕКЛА
14-26%
встр.
43.
ПШЕНИЦА,57ПОЛУЧ. %
CO2
КАРТОФЕЛЬ,2
КУКУРУЗА,70
Глюкоза
РИС, 80
Со
КРАХМАЛ
(С6Н10О5)n
Ц
АМИЛОЗА
К.Р.! ЙОД
Cu(OH)2
H20
:Киргоф
+
/H /
Ц
~ P ~
АМИЛОПЕКТИН
80
ГЛЮКОЗА
2
Р
Т
клейстер
80
~ P ~
ПРИМ.
3
ПАТОКА
1
МАЛЬТОЗА
ДЕКСТРИНЫ
Со
За
бел.
За
Р
КЛЕЙ
ЦЕЛЛЮЛОЗА /C6H10O5/
Т
СН2ОН
О
ОН
... О
О
СН2ОН
О
ОН
ОН
...
ОН
ЭФИРЫ
HNO3
ПИРОКСИЛИН
/СН3СО/2О
АЦЕТАТЫ
ЛАКИ
Н2О
[H+]
КИНО
ВИСКОЗА
Мr 1млн.
ЦЕЛЛОФАН
полимоноост. , д-глюкоза
К. Р.! Cu(OH)2
Cu2O
44.
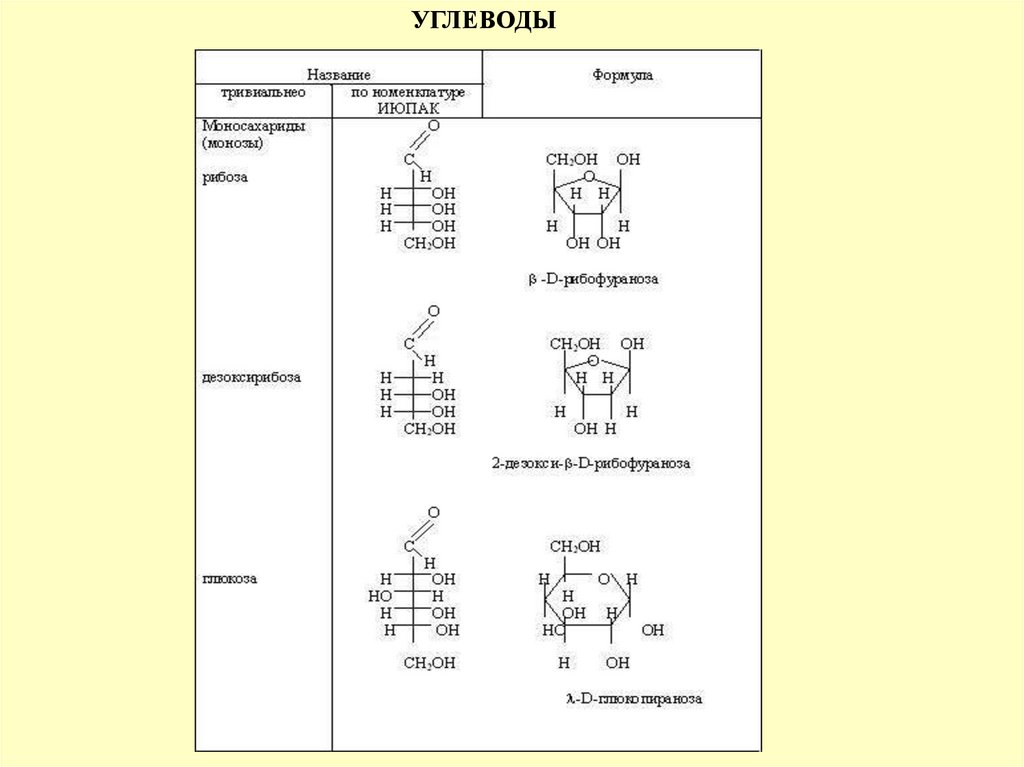
УГЛЕВОДЫ45.
46.
47.
48.
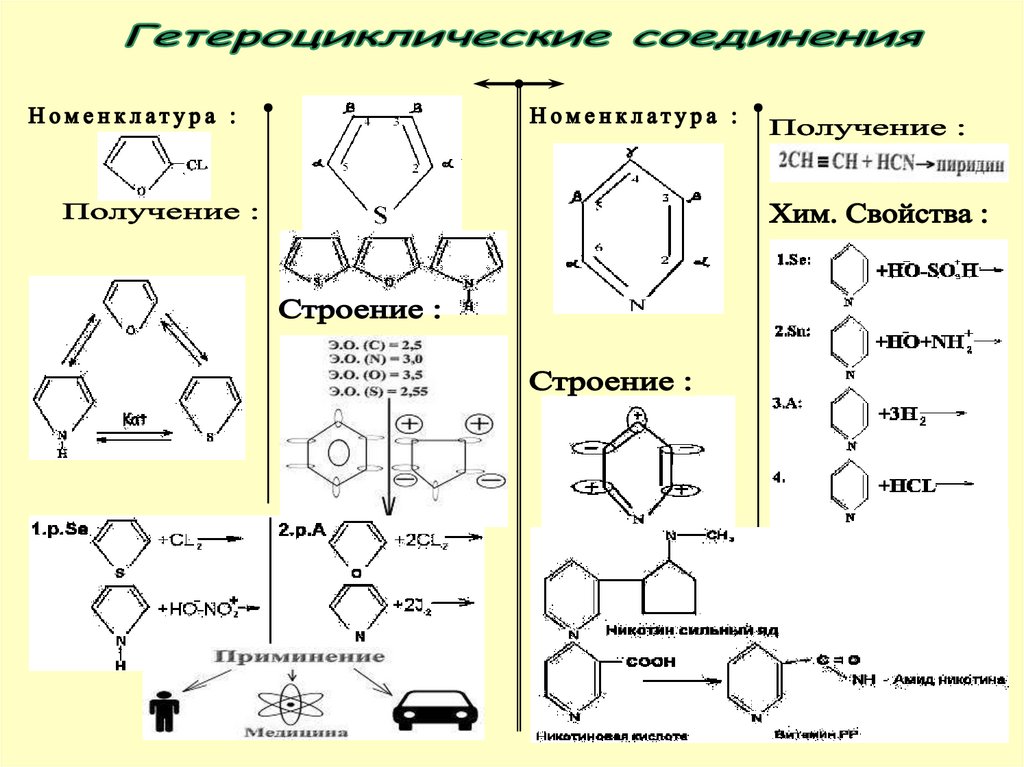
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ49. КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
СоединениеРеактив
Наблюдаемая реакция
Алканы
__
Пламя
Обычно определяют путем исключения Низшие
алканы горят голубоватым пламенем
Алкены
С=С
1) Бромная вода
2) р-р КмnО4
3) Горение
Обесцвечивание раствора
Обесцвечивание раствора, выпадение бурого
осадка МnО2
Горят слегка желтоватым пламенем (частицы
углерода)
Бензол
__
Горение
Обычно определяют путем исключения
Горит коптящим пламенем
Фенол
1)Бромная вода
2)р-р Na2СО3
3) FeCI3
Обесцвечивание, выпадение
трибромфенола
Выделение углекислого газа
Фиолетовое окрашивание
Спирты
1)Na
Выделение водорода
2)Горение
Горят светлым голубоватым пламенем
3) Черная горячая Восстановление
красной
окраски
прокаленная
Cu- прокаленной горячей медной проволоки
проволока
белого
осадка
у
50.
Многоатомныеспирты
Cu(OH)2 +
NaOH
Синее окрашивание – образование глицератов и
др.
Амины
1)Лакмус
2) HHaI
В водном растворе – синее окрашивание
Образует соли с галогеноводородами – после
выпаривания твердый осадок
Анилин
1)Бромная вода
2)HHaI
Обесцвечивание бромной воды, выподение
осадка триброманилина
После упаривания твердый осадок – соль
гидрогалогенида анилина
Альдегиды
1)Aq2O
2)Cu(OH)2
Реакция серебрянного зеркала
Выпадения красного осадка Cu2O
Карбоновые
кислоты
Лакмус
Красное окрашивание
! Муравьиная – реакция серебрянного зеркала
! Олеиновая – обесцвечивание бромной воды
Крахмал
Раствор I2 в КI или Синее окрашивание
спиртовой раствор
йода
Белки
Конц. HNO3
Желтое
окрашивание,
при
щелочного раствора - оранжевое
добавлении
51.
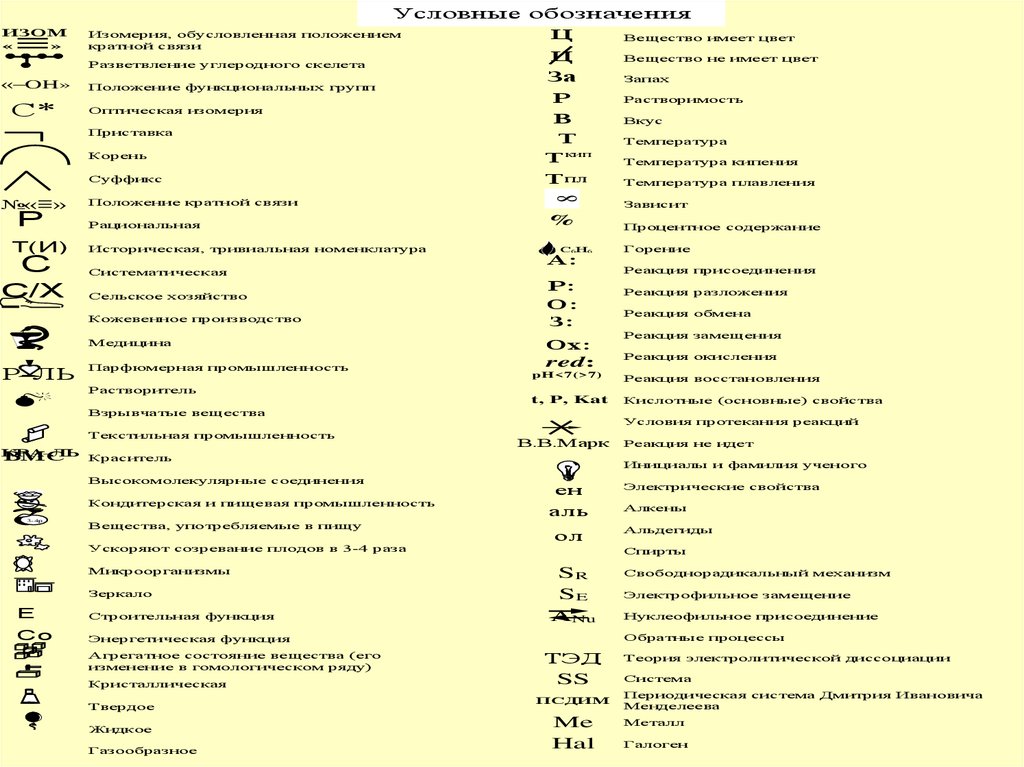
Условные обозначенияИзомерия, обусловленная положением
кратной связи
Разветвление углеродного скелета
«–OH»
С*
Положение функциональных групп
Оптическая изомерия
Приставка
Корень
Суффикс
№«
Р
»
Т(И)
С
С/Х
Положение кратной связи
Рациональная
Историческая, тривиальная номенклатура
Систематическая
Сельское хозяйство
Кожевенное производство
Медицина
Р-ЛЬ
Парфюмерная промышленность
%
С6Н6
А:
Р:
О:
З:
Ох:
red:
Высокомолекулярные соединения
Кондитерская и пищевая промышленность
Вещества, употребляемые в пищу
Ускоряют созревание плодов в 3-4 раза
Микроорганизмы
Зеркало
Е
Строительная функция
Co
Энергетическая функция
Агрегатное состояние вещества (его
изменение в гомологическом ряду)
Кристаллическая
Твердое
Жидкое
Газообразное
Вещество не имеет цвет
Запах
Растворимость
Вкус
Температура
Температура кипения
Температура плавления
Зависит
Процентное содержание
Горение
Реакция присоединения
Реакция разложения
Реакция обмена
Реакция замещения
Реакция окисления
Реакция восстановления
t, P, Kat
Кислотные (основные) свойства
Взрывчатые вещества
КРА-ЛЬ
ВМС
Краситель
Вещество имеет цвет
pH<7(>7)
Растворитель
Текстильная промышленность
3-4р
Ц
Ц
За
Р
В
Т
Т кип
Т пл
8
ИЗОМ
«
»
Условия протекания реакций
В.В.Марк
Реакция не идет
Инициалы и фамилия ученого
ен
аль
ол
Электрические свойства
Алкены
Альдегиды
Спирты
SR
SE
ANu
Свободнорадикальный механизм
Электрофильное замещение
Нуклеофильное присоединение
Обратные процессы
ТЭД
SS
ПСДИМ
Me
Hal
Теория электролитической диссоциации
Система
Периодическая система Дмитрия Ивановича
Менделеева
Металл
Галоген


























 chemistry
chemistry








