Similar presentations:
Растворы. Теория электролитической диссоциации. Гидролиз
1.
Растворы.Теория
электролитической
диссоциации.
Гидролиз.
2.
ЦЕЛИ УРОКА:• 1. Сформировать понятия об электролитах и
неэлектролитах.
• 2. Рассмотреть механизм диссоциации
веществ с ковалентной полярной и ионной
связью.
• Объяснить причину электропроводности
водных растворов солей, кислот, щелочей.
3.
Растворы(дисперсные системы)
Раствор – это однофазная система
переменного, или гетерогенного,
состава, состоящая из двух или
более компонентов.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
РастворениеРастворение — переход молекул вещества
из одной фазы в другую. Происходит в
результате взаимодействия атомов (молекул)
растворителя и растворённого вещества.
29.
Растворение• При растворении межфазная граница
исчезает, при этом меняются физические
свойства раствора (например, плотность,
вязкость, иногда — цвет, и другие).
30.
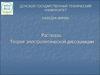
Дисперсная система, фаза, средаДисперсная система - гетерогенные
системы, в которых одна из фаз находится в
дисперсном (раздробленном состоянии).
Дисперсной фазой, называется растворенное
вещество
Дисперсионной средой (растворитель)вещество, в котором распределена
дисперсная фаза.
31.
Виды дисперсных системДФ
ДС
Обозначение
Примеры
Т/Г
Аэрозоли (пыль, дым, смог )
Жидкая
Т/Ж
Золи (золи металлов в воде, взвеси в
природных водах – ВД), суспензии - ГД
Твердая
Т/Т
Ж/Г
Твердые коллоидные растворы (бетон,
сплавы, цветные стекла, минералы –
самоцветы)
Аэрозоли (туман, облака)
Жидкая
Ж/Ж
Эмульсии (молоко, сырая нефть, крема)
Твердая
Ж/Т
Жидкость в пористых телах (адсорбенты,
почвы)
Г/Г
Системы с флуктуациями плотности
(атмосфера)
Жидкая
Г/Ж
Газовые эмульсии, пены
Твердая
Г/Т
Пористые и капиллярные тела (адсорбенты,
катализаторы, пемза, активированный уголь)
Твердая Газообразная
Жидкая Газообразная
Газообр Газообразная
азная
31
32.
По величине частиц дисперснойфазы растворы разделяют на:
Грубодисперсные системы(взвеси) –
это гетерогенные системы (неоднородные).
Размеры частиц этой фазы
от 10⁻⁵ до 10⁻⁷м.
Не устойчивы и видны невооруженным
глазом (суспензии, эмульсии, пены, порошки).
33.
По величине частиц дисперснойфазы растворы разделяют на:
Коллоидные растворы (тонкодисперсные
системы или золи) – это
микрогетерогенные системы. Размер
частиц от 10⁻⁷ до 10⁻⁹м.
Частицы уже не видны невооруженным глазом,
система не устойчивая. В зависимости от
природы дисперсионной среды золи называют
гидрозолями – дисперсионная среда – жидкость,
аэрозолями – дисперсионная среда воздух.
34.
По величине частиц дисперснойфазы растворы разделяют на:
Истинные растворы.
Размеры частиц составляют 10ˉ8 см (менее 1
нм), т.е. равны размерам молекул и ионов.
Они не видны невооруженным глазом.
Системы - гомогенные.
(растворы сахара, спирта, неэлектролитов,
электролитов и слабых электролитов).
35.
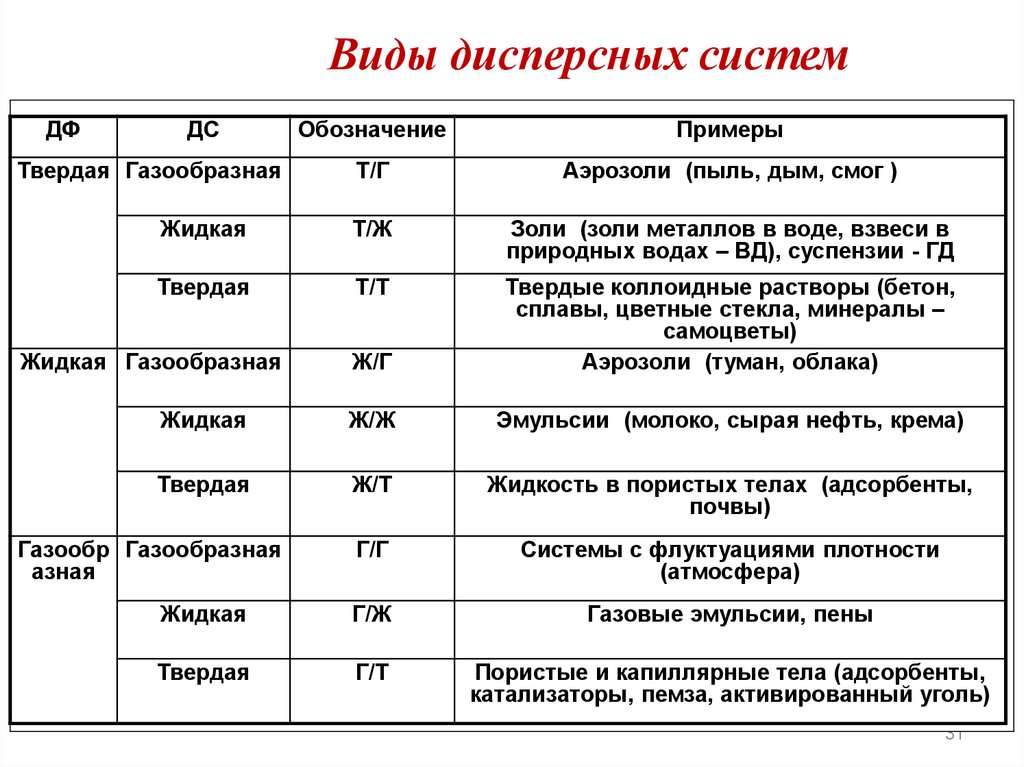
Растворимость• Растворимость выражают при помощи массы
вещества, которая может раствориться в 100 г
воды при данной температуре
ВЕЩЕСТВА
Хорошо растворимые
Малорастворимые
более 10 г вещества в
100 г воды
от 0,01 до 10 г
вещества в 100 г воды
Практически
нерастворимые
менее 0,01 г вещества в
100 г воды
36.
РастворимостьЕсли молекулы растворителя неполярны
или малополярны, то этот растворитель
будет хорошо растворять вещества с
неполярными молекулами. Хуже будет
растворять с большей полярностью.
И практически не будет с ионным типом
связи.
37.
РастворителиК полярным растворителям относят воду и
глицерин.
К малополярным спирт и ацетон.
К неполярным хлороформ,
эфир,
жиры,
масла.
38.
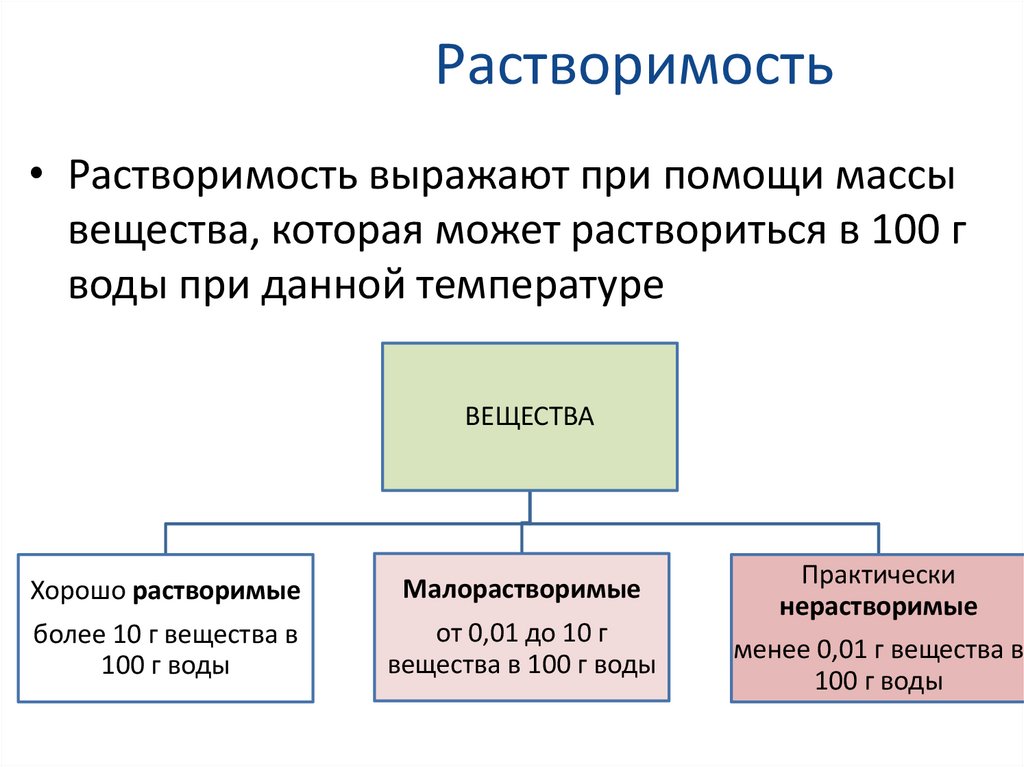
Виды растворовВ зависимости от растворимости
твердых веществ различают следующие
виды растворов:
Ненасыщенный
раствор
• Раствор, в
котором
данное
вещество при
данной
температуре
ещё
растворяется
Насыщенный раствор
• Раствор, в котором
данное вещество при
данной температуре
больше не растворяется
• Содержит
максимальное
количество
растворённого вещества
при данной температуре
Пересыщенный
раствор
• Раствор, который
содержит
растворённого
вещества больше,
чем его содержится в
насыщенном
растворе при данной
температуре
38
39.
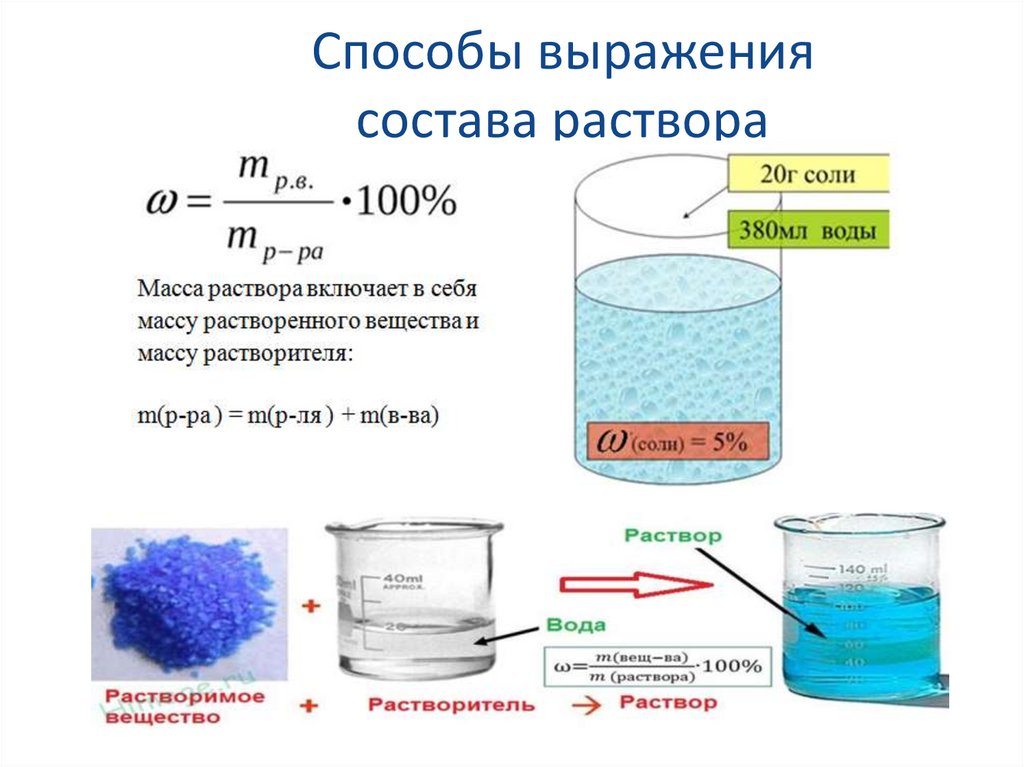
Способы выражениясостава раствора
40.
Типовая задача № 1.В растворе массой 100 г содержится хлорид
бария массой 20 г. Какова массовая доля
хлорида бария в растворе?
Д а н о:
m(р-ра) = 100 г;
m(ВаСl2) = 20 г.
• Найти: w%(ВаСl2)
Решение:
w(BaCl2)=m(ВаСl2)/m(р-ра)=20г/100г=0,2 или
20%
• Ответ: w%(ВаСl2)=0,2 или 20%
41.
Типовая задача № 2 .Сахар массой 5 г растворили в воде массой
20 г. Какова массовая доля (%) сахара в
растворе?
Д а н о:
m(H2O) = 20 г;
m(сахара) = 5 г.
Найти: w%(сахара)
Решение:
1. m(р-ра)=m(сахара)+m(H2O)=20г+5г=25г
2. w(сахара)=m(сахара)/m(р-ра)=5г/25г=0,2 или
20%
• Ответ: w%(сахара)=0,2 или 20%
42.
Выражение концентрацийрастворов.
Молярность - число молей растворенного
вещества в 1 л раствора.
ʋ - количество вещества
(моль);
V – объем раствора (л);
43.
Электролитическая диссоциация • процесс распада молекул электролитов наионы в водном растворе или в расплаве.
44.
СвантеАррениус
В 1887г. Шведский учёный
С.Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
45.
1. Что такое электрический ток?2. Какие вещества способны проводить
эл.ток?
3. Какие частицы являются переносчиками
эл.тока в металлах, полупроводниках?
4. Что такое ионы?
46.
Электрический ток - направленноедвижение заряженных частиц
(электроны, ионы)
Ионы - атомы или группы атомов,
имеющие заряд.
47.
Современное содержание ТЭД можносвести к четырем основным положениям.
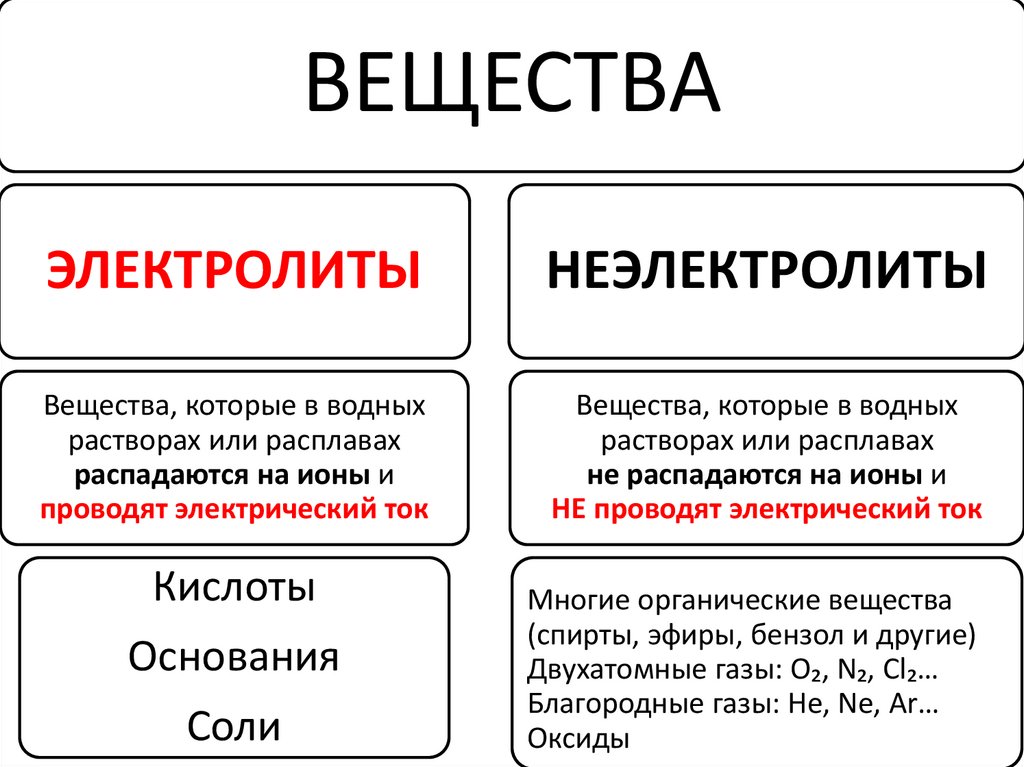
I-е положение:
Все вещества по их способности
проводить электрический ток в
растворах делятся на электролиты и
неэлектролиты.
48.
ВЕЩЕСТВАЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
Вещества, которые в водных
растворах или расплавах
распадаются на ионы и
проводят электрический ток
Вещества, которые в водных
растворах или расплавах
не распадаются на ионы и
НЕ проводят электрический ток
Кислоты
Основания
Соли
Многие органические вещества
(спирты, эфиры, бензол и другие)
Двухатомные газы: O₂, N₂, Cl₂…
Благородные газы: He, Ne, Ar…
Оксиды
49.
Основные положения ТЭД1. Молекулы электролитов диссоциируют на
положительно заряженные ионы (катионы) и
отрицательно заряженные ионы (анионы).
Упрощённо процесс диссоциации изображают с помощью
уравнений диссоциации:
NaOH = Na+ + OHМолекула
катион
анион
50.
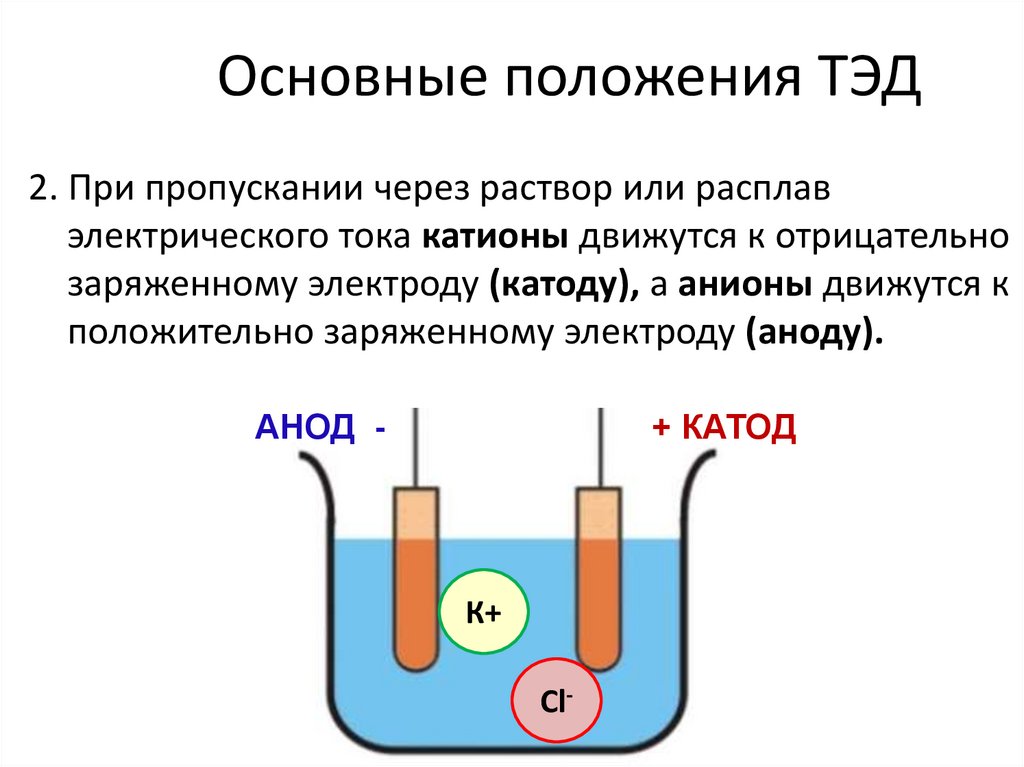
Основные положения ТЭД2. При пропускании через раствор или расплав
электрического тока катионы движутся к отрицательно
заряженному электроду (катоду), а анионы движутся к
положительно заряженному электроду (аноду).
АНОД -
+ КАТОД
К+
Cl-
51.
Основные положения ТЭД3. Диссоциация многих электролитов —
процесс обратимый.
Это значит, что одновременно идут два
противоположных процесса: распад молекул
на ионы (ионизация или диссоциация) и
соединение ионов в молекулы (ассоциация
или моляризация).
52.
Уравнение диссоциацииДиссоциацию молекул электролитов
выражают уравнениями, в которых ставят знак
обратимости ( ).
Пример, уравнение диссоциации азотистой
кислоты HNO2 записывается таким образом:
ионизация (диссоциация)
H+ + NO2-
НNO2
моляризация (ассоциация)
53.
Уравнение диссоциации• Общая сумма зарядов катионов равна
общей сумме зарядов анионов, так как
растворы и расплавы электронейтральны.
NaOH = Na+ + OHCaCl2 = Ca2+ + 2Cl-
54.
Диссоциация оснований• Применимo только к водным растворам!!!
• Основание - электролит, который диссоциирует в водном
растворе с образованием гидроксид-иона и катиона металла
основание ↔ катион металла+ гидроксид-ион
NaOH = Na+ + OHKOH = К+ + OHСвойства оснований определяет гидроксид-ион OH⁻
54
55.
Гидролиз солей• Гидролиз солей – это взаимодействие
солей с водой
• В результате гидролиза соли в растворе
появляется некоторое избыточное
количество ионов Н⁺ или ОН⁻
• При этом изменяется рН раствора.
55
56.
Закономерности гидролизаразбавленных растворов солей:
Протекает:
• Гидролиз соли слабого основания и сильной
кислоты
• Гидролиз соли слабой кислоты и сильного
основания
• Гидролиз соли слабой кислоты и слабого
основания
Не протекает:
• Гидролиз соли сильного основания и сильной
кислоты
57.
58.
Добрый день, уважаемые студенты!Работы с домашним заданием по химии направлять до 07 ноября
2021г. на эл. адрес: zavaylova.inna@kitnk.ru,отправлять с
обязательным указанием Ф.И.О. студента +№ группы
студента.
Вам необходимо согласно приложенного файла (презентация
Рower Point –Гидролиз. ЭД. Растворы. оформить письменно подробный
опорный конспект + оформить домашнюю работу) . Материал
сфотографировать и отравить на выше представленные координаты.
С уважением, Солуянова И.В.
59.
Проверка основных понятий темы.1. Электролиты
1. Процесс распада электролита на
ионы.
2. Неэлектролиты
2. Вещества, растворы которых
проводят электрический ток
3. Диполь
4. Диссоциация
3. Процесс превращения
ковалентной полярной связи в
ионную при растворении
вещества.
5. Ионизация
4. Молекула, имеющая
противоположно заряженные
полюса.
6. Гидратированные
ионы
5. Процесс соединения ионов в
молекулу.
6. Ионы, покрытые в растворе слоем
из молекул воды.
7. Вещества, растворы которых не
60.
Задания к 1-му положению ТЭД1. Какие вещества называются электролитами и
неэлектролитами?
2. Назовите по два вещества, которые являются
электролитами и неэлектролитами.
3. Укажите вид связи и принадлежность данных
веществ к электролитам и неэлектролитам: KCl, O2 ,
HNO3 ,CuO.
4. Назовите из перечня веществ электролиты (не
забудьте воспользоваться таблицей растворимости
!): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2
61.
Задания ко II-му положению ТЭД1.
2.
3.
4.
Сформулируйте второе положение ТЭД.
Что такое электролитическая диссоциация?
Что является причиной ЭД?
Каков механизм ЭД: а)веществ с ионной
связью, б) веществ с ковалентной связью?
5. Назовите частицы: а) H, H2 , H+ ;
б) Cl2 , Cl, Cl- .
6. Назовите катионы и анионы в соединениях,
формулы которых: CuCl2 , AgNO3 , Ca(OH)2 , H3
PO4 .
62.
СПАСИБО ЗА ВНИМАНИЕ!62
























































 chemistry
chemistry