Similar presentations:
«Острые лейкозы»
1.
«Острые лейкозы»2.
Онкогематологическиезаболевания
(гемобластозы) – злокачественные новообразования,
морфологическим
субстратом
которых
являются
неопластически трансформированные кроветворные
клетки
.
Гемобластозы, при которых костный мозг первично
повсеместно заселен опухолевыми клетками, называют
лейкозами
Термин “лейкемия” принадлежит R.Virchow (в 1845
описал ХМЛ)
3.
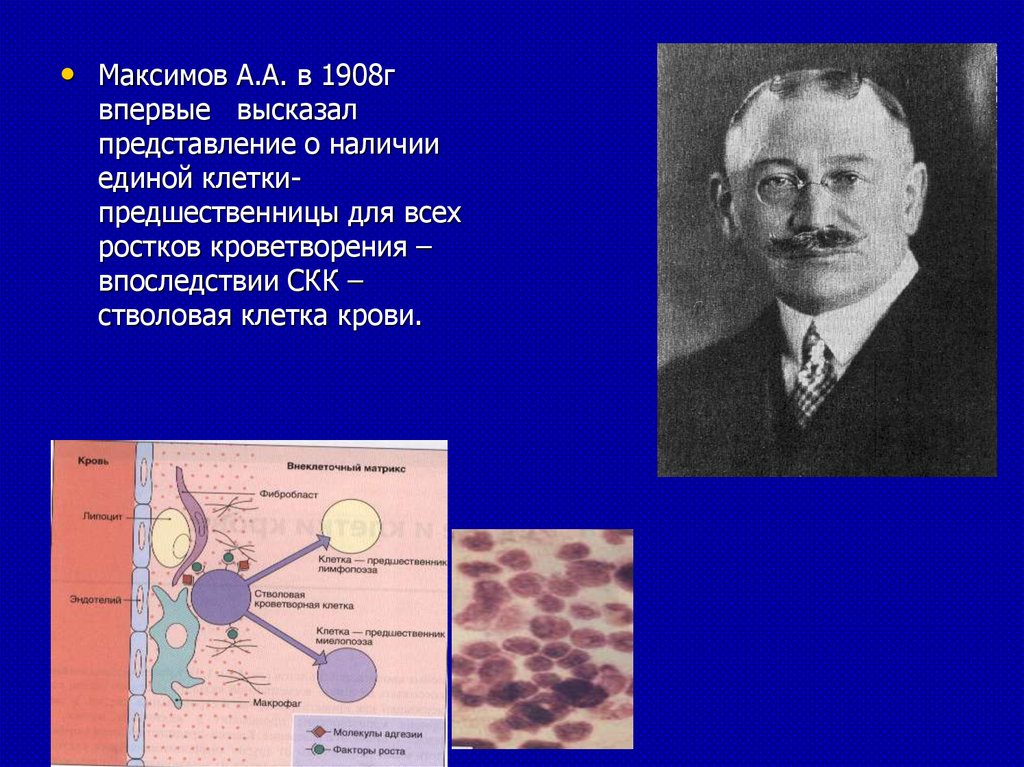
• Максимов А.А. в 1908гвпервые высказал
представление о наличии
единой клеткипредшественницы для всех
ростков кроветворения –
впоследствии СКК –
стволовая клетка крови.
4.
5.
Клеточный состав костного мозга %• Клеточный состав костного мозга – 50 – 250 кл в 1 мкл
• Мегакариоциты - 0,2-0,6
• Бласты – 0,1 -1,6%
Миелобласты – 0,2-1,7
Лимфоциты- 4,3-13,7
Промиелоциты – 1,0-4,1
Моноциты – 0,7-3,1
Миелоциты – 7,0 – 12,2
Метамиелоциты – 8,0- 15,0
Палочкоядерные – 12,8-23,7
Сегментоядерные 13,1-24,1
Всего нейтрофильного ряда- 52,7-68,9
Эозинофилы – 0,5-5,8
Базофилы – 0-0,5
Эритробласты- 0,2-1,1
Пронормоциты- 0,1-1,2
Нормоциты базофильные -1,4-4,6
Нормоциты полихроматофильные 8,9-16,9
Нормоциты оксифильные - 0,8-5,6
Всего клеток эритроидного ряда – 14,5 – 26,5
• ЛЭС – 2,1 – 4,5
6.
Распространенность гемобластозов• Суммарная частота гемобластозов: 25–30 случаев на
100
000 населения в год
• Наиболее распространены неходжкинские лимфомы (10–12
случаев). В последние 20–30 лет частота неходжкинских
лимфом постоянно увеличивается, заболеваемость другими
гемобластозами находится на стабильном уровне.
7.
Распределение гемобластозов• Все онкогематологические заболевания, за исключением острого
лимфобластного лейкоза, лимфобластной лимфомы и лимфомы
Беркитта, значительно чаще возникают
у взрослых
• Некоторые нозологические формы (хронический лимфолейкоз,
множественная миелома, истинная полицитемия, сублейкемический
миелоз) развиваются только в пожилом возрасте.
• Острый
лейкоз
заболевание у детей.
основное
злокачественное
• Большинство гемобластозов, особенно лимфопролиферативные
заболевания, достоверно чаще возникают у европеоидов (прежде
всего у семитов – арабов и евреев), существенно реже – у негроидов и
крайне редко – у лиц азиатского происхождения
8.
Этиологические (предрасполагающие)факторы гемобластозов
• В основе -
первичная мутации кроветворной клеткипредшественницы под действием мутагенов – хромосомные
поломки.
Ионизирующая радиация.
Химические соединения.
Генетические заболевания (7% всех опухолевых больных, в семьях с
ОЛ заболеваемость выше в 3-4 раза).
Связь с аутоиммунными заболеваниями , наследственными и
приобретенными иммунодифицитами.
Вирусы.
Длительное воздействие бактериальных Аг
+ Возрастное истощение противоопухолевого иммунитета (гена 53,
ответственного за апоптоз).
предшествующие
заболевания
системы
кроветворения
(рефрактерные формы анемий, пароксизмальная ночная гемоглобинурия, так
называемые миелодисплазии).
9.
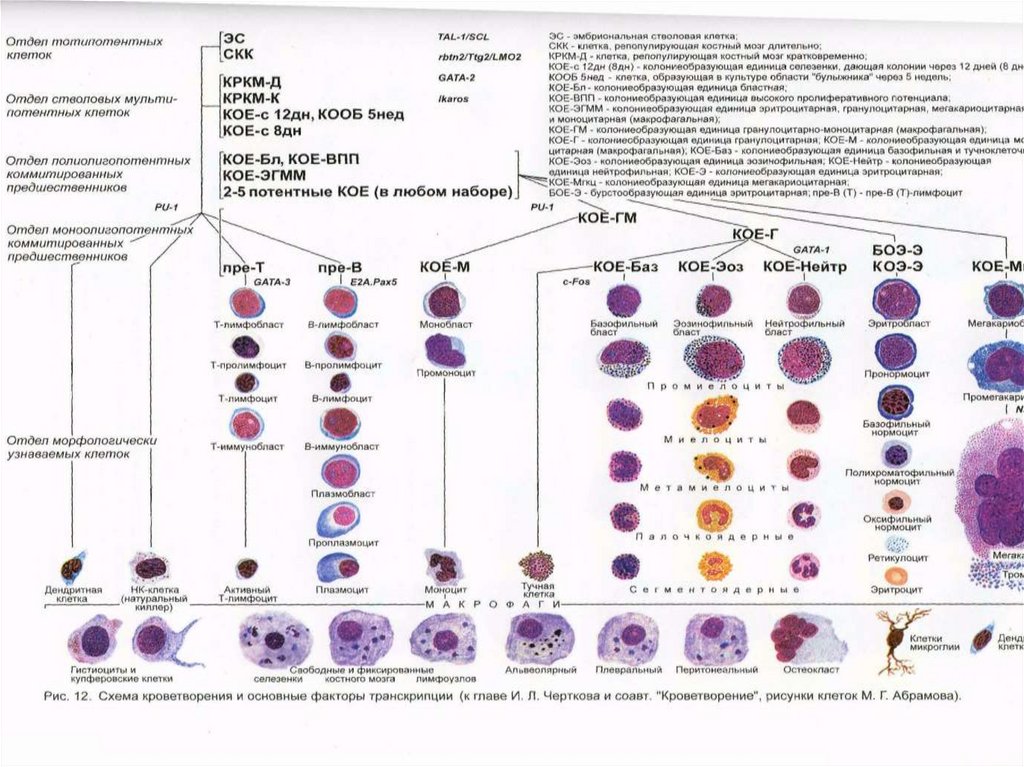
Патогенез онкогематологических заболеванийГемобластозы возникают вследствие мутации
клетки-предшественницы, приводящей к клональной
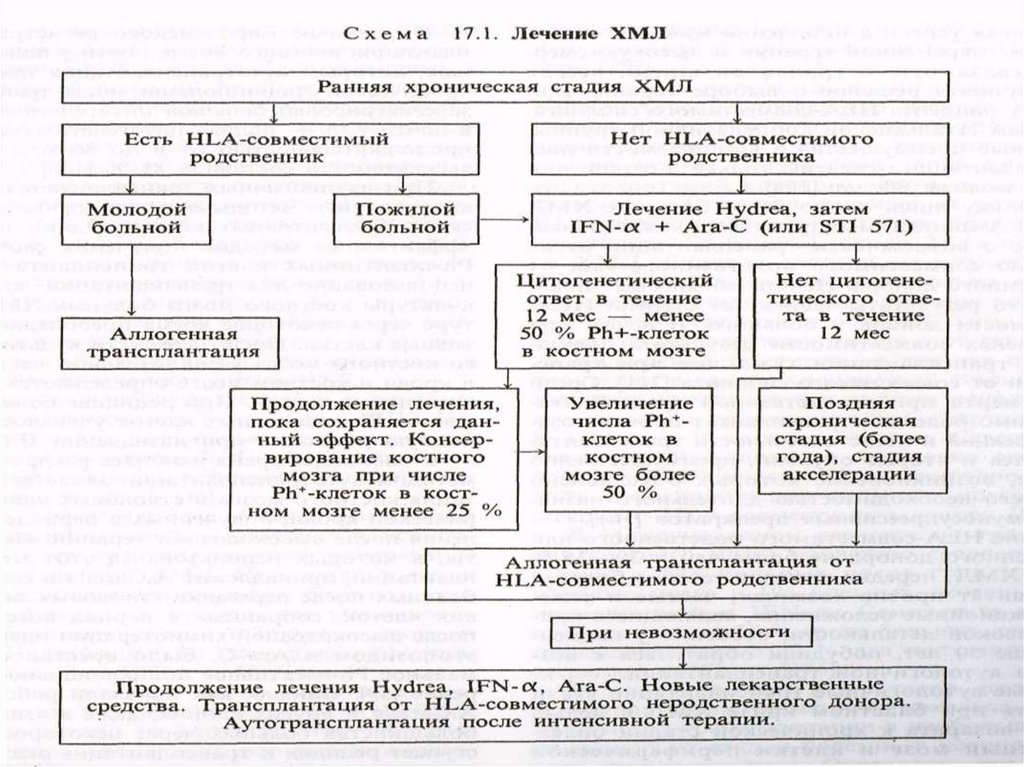
неопластической пролиферации злокачественно
трансформированных кроветворных клеток на любом
уровне их дифференцировки (полипотентность)!!,
характеризующихся:
1) блокадой дифференцировки;
2) способностью к неограниченному делению –
увеличенное количество митозов
. 3) большей продолжительностью жизни, поэтому они
быстро накапливаются в организме
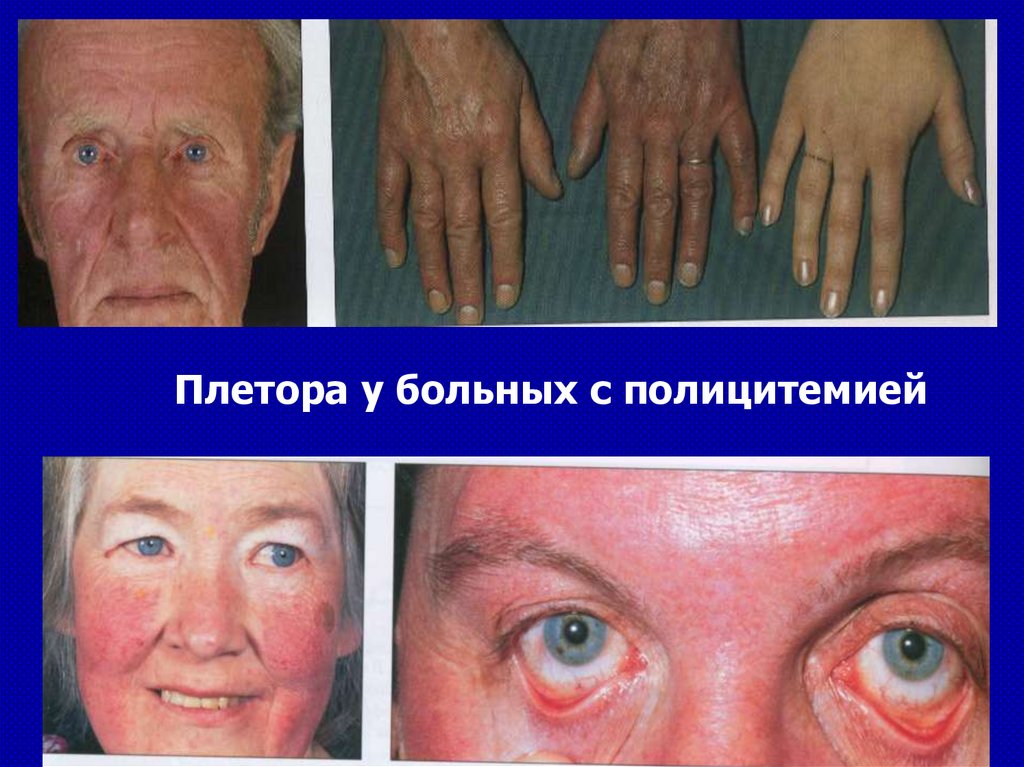
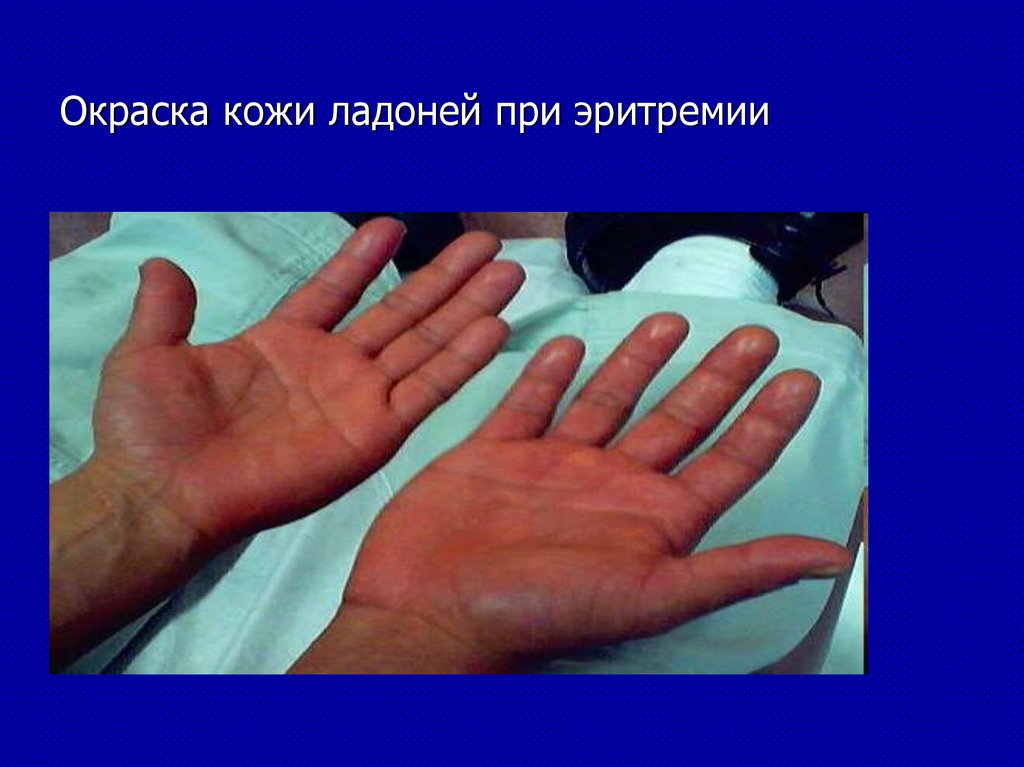
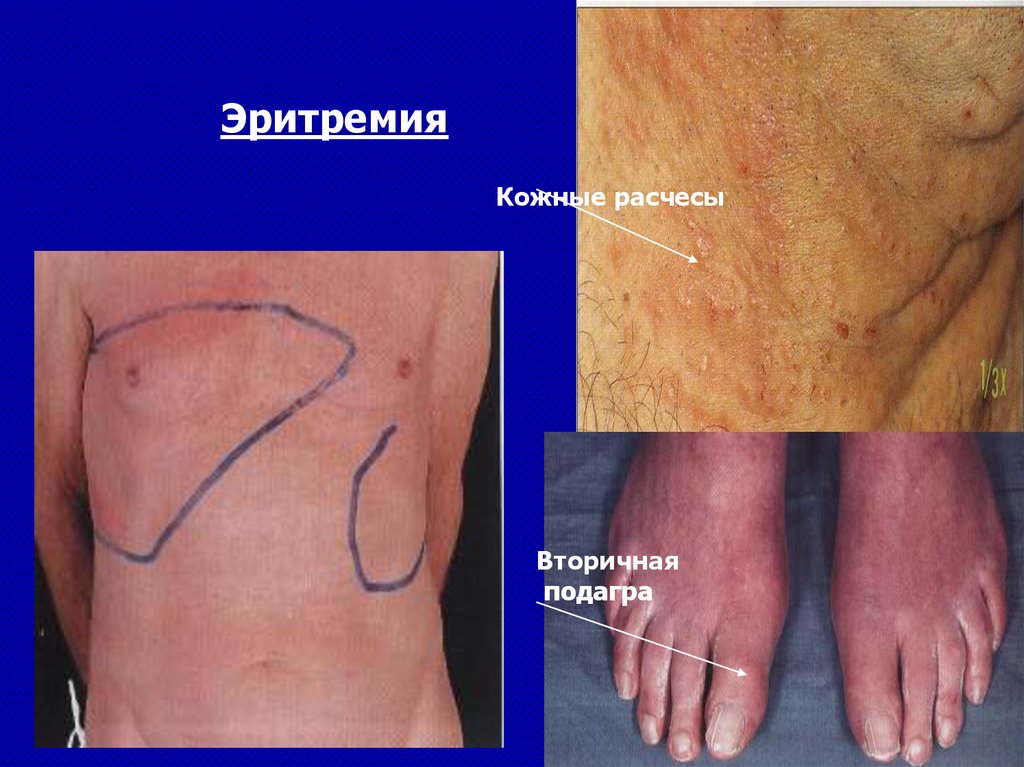
10.
Патогенез онкогематологических заболеваний(продолжение)
• При лабораторных признаках лейкозов в организме больного
имеется около 1011 бластных клеток, при развитии клинических
симптомов – 1012 бластов (1кг).
• При злокачественных лимфомах клинические симптомы
(прежде всего – лимфоаденопатия) появляются при значительно
меньшем объеме опухолевой массы
• Развитие большинства клинико-лабораторных проявлений
(анемия, геморрагический синдром, лихорадка, увеличение
размеров лимфатических узлов, селезенки) обусловлено
“вытеснением”
нормальной
гемопоэтической
ткани
опухолевыми клетками или выделением факторов, тормозящих
эритро- и тромбоцитопоэз.
11.
Патогенез онкогематологических заболеваний (окончание)• Для гемобластозов характерна опухолевая
прогрессия:
по мере развития заболевания появляются клоны более
злокачественных клеток с новыми свойствами (морфологическими,
цитохимическими, иммунологическими и т.д.), что объясняет развитие
резистентности к ранее эффективному лечению.
Злокачественные клетки активно метастазируют за пределы
органов кроветворения, что приводит к развитию опухолевой
инфильтрации внутренних органов, лимфатической ткани, кожи,
слизистых оболочек, оболочек и вещества головного и спинного мозга
и может сопровождаться органомегалией, функциональной
недостаточностью внутренних органов, лимфоаденопатией,
гиперпластическим гингивитом, лейкемидами кожи, нейролейкозом и
т.д.
12.
Острые лейкозы – группа клональныхзаболеваний системы крови, первично
поражающих костный мозг, морфологическим
субстратом которых являются злокачественно
трансформированные бластные
клетки, неспособные к нормальной
дифференцировке до зрелых клеточных форм, с
вытеснением ими нормальных элементов и
инфильтрацией ими различных органов и тканей.
13.
• Все острые лейкозы возникают из одной мутировавшей клетки,которая может относиться как к очень ранним, так и
коммитированным в направлении различных линий
кроветворения.
• Клиническое течение острого лейкоза,
терапия, эффективность лечения и прогноз
заболевания определяются:
• 1) принадлежностью бластных клеток к той или иной линии
кроветворения,
• 2) степенью их дифференцировки ,
• 3) степенью вытеснения нормальных ростков кроветворения
обуславливают
14.
Острые
лейкозы
–
отдельная
группа
онкогематологических заболеваний, которые никогда не
трансформируются в хронические лейкозы.
Острый
лейкоз
морфологический.
–
прежде
всего
диагноз
• Острый лейкоз может быть первичным и вторичным
• ( после цитостатической или лучевой терапии).
• Острый лейкоз составляет 3% всех злокачественных
опухолей человека.
• Частота острых лейкозов в среднем составляет 7,7-13,0
случаев на 100 000 населения в год и приблизительно
одинакова в различных регионах.
Соотношение М:Ж при ОЛ = 13,2 : 7,7
15.
Выделяют два вида заболевания, которые различаютсяпо
морфологии,
течению,
характеру
проводимой
химиотерапии и результатам лечения:
1)
Острый
лимфобластный
лейкоз
(80–90% в структуре лейкозов детей)
• 2) острые (нелимфобластные, миелобластные) лейкозы
• (в 80% случаев развиваются у взрослых)
• Среднее соотношение ОМЛ : ОЛЛ = 6:1
16.
FAB - классификация острых лейкозовВ 1976 году группой экспертов Франции, США и Великобритании
(FAB) была предложена классификация ОЛ, которая основана на
1) морфологических ,
2) цитохимических особенностях,
3) иммунофенотипировании бластных клеток
В соответствии с FAB-классификацией
8 типов ОМЛ (М0–М7) и 3 типа ОЛЛ (L1–L3).
Классификация ВОЗ 1991г учитывает цитогенетические и
молекулярно-генетические показатели, основана на меньшем
количестве клеток, позволяет выделить ряд подтипов,
биологических подгрупп, тем самым индивидуализировать
лечение больных.
17.
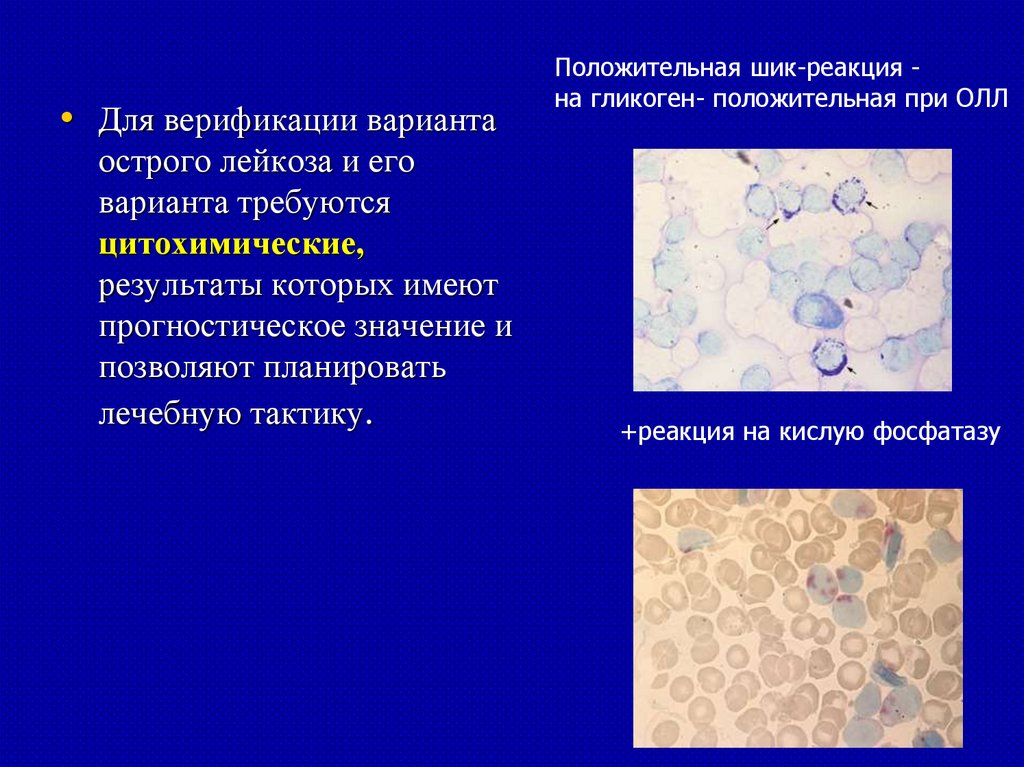
• Для верификации вариантаострого лейкоза и его
варианта требуются
цитохимические,
результаты которых имеют
прогностическое значение и
позволяют планировать
лечебную тактику.
Положительная шик-реакция на гликоген- положительная при ОЛЛ
+реакция на кислую фосфатазу
18.
ИммунофенотипированиеВнедрение в практику моноклональных антител
позволило идентифицировать специфические рецепторы,
антигены и другие молекулы (маркеры) на мембране
и/или в цитоплазме бластных клеток.
В настоящее время идентифицировано более 200 маркеров,
получивших название кластеров дифференцировки (CD).
Иммунофенотипирование необходимо для
1) подтверждение диагноза
2) установление диагноза при сомнительных морфологических и
цитохимических результатах
3) мониторинг для выделения новых более злокачественных клеток;
4) разделение ОЛ на различные прогностические группы
• Пример: острый недифференцированный лейкоз - HLA-DR+,
CD15+|-, CD13+\-, CD33+\-
19.
Цитогенетическое исследование• У 90% больных ОЛ находят
• генетические поломки
(транслокации, делеции,
инверсии, гиперплоидию…).
При ОЛЛ транслокация (9;22)
или
(4;11) – фактор неблагоприятного
прогноза. Гиперплоидия
характерна
для благоприятного течения ОЛ
(часто у детей с ОЛЛ).
20.
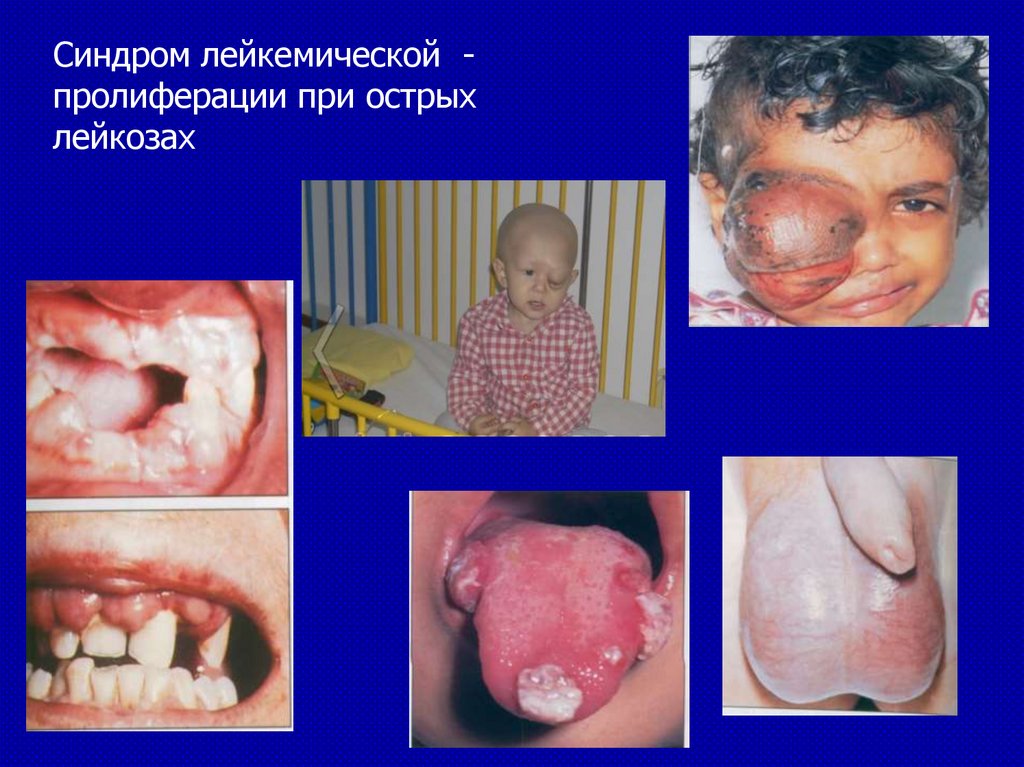
Основные клинические синдромы при ОЛ• Синдром лейкемической пролиферации: лимфоаденопатия,
гепатоспленомегалия, расширение средостения; инфильтрация десен и
яичек, лейкемиды кожи; поражение мозговых оболочек и черепномозговых нервов (нейролейкоз – чаще при ОЛЛ)
• Синдром опухолевой интоксикации (снижение массы тела,
общая слабость, усиленная потливость, повышение Т тела, болезненность
костей)
• Анемический синдром (бледность, тахикардия, одышка)
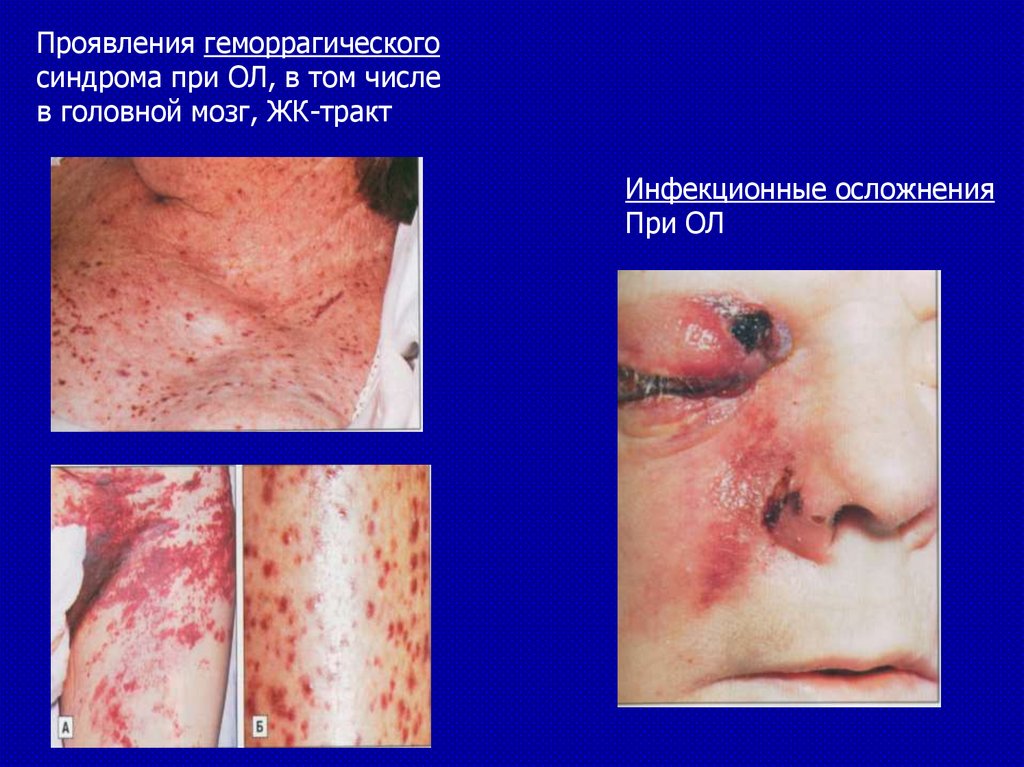
• Геморрагический синдром (экхимозы, петехии,
• внутренние кровотечения), ДВС-синдром
• Синдром инфекционных осложнений (стоматит,
некротизирующая ангина пневмония, сепсис, абсцессы)
21.
Синдром лейкемической пролиферации при острыхлейкозах
22.
Проявления геморрагическогоcиндрома при ОЛ, в том числе
в головной мозг, ЖК-тракт
Инфекционные осложнения
При ОЛ
23.
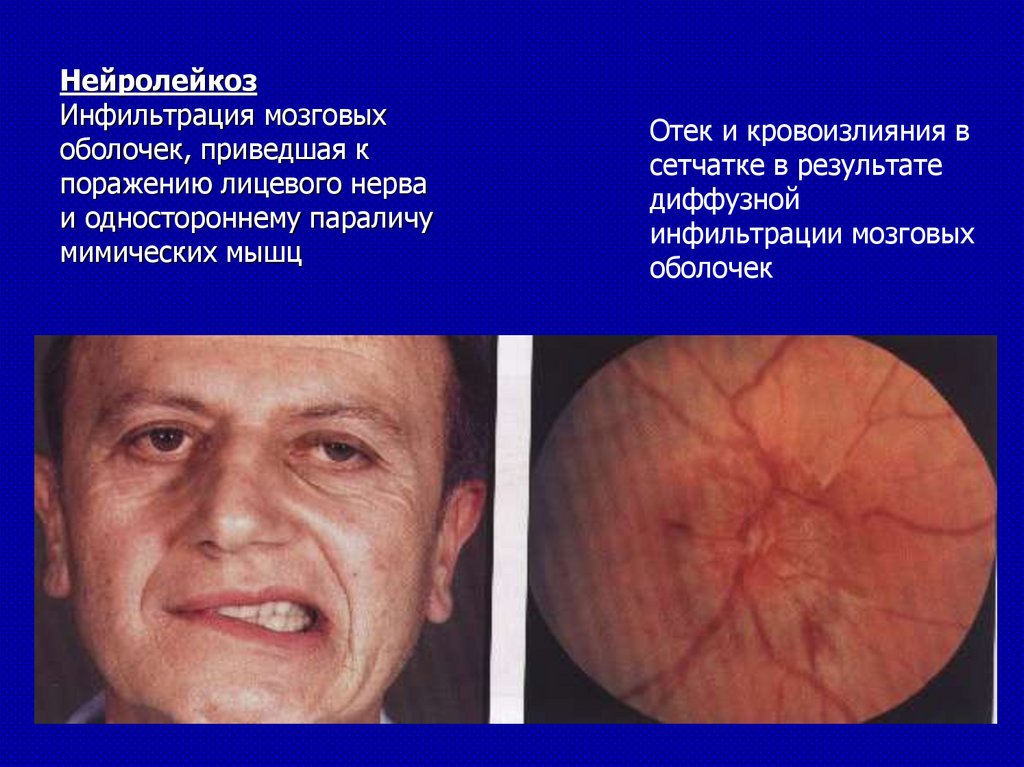
НейролейкозИнфильтрация мозговых
оболочек, приведшая к
поражению лицевого нерва
и одностороннему параличу
мимических мышц
Отек и кровоизлияния в
сетчатке в результате
диффузной
инфильтрации мозговых
оболочек
24.
Варианты начала острого лейкоза• - примерно у 50% больных начинается остро с клиники ангины,
пневмонии, инфекции мочевыделительных путей;
• - у 25-30% больных постепенное начало, проявляющееся слабостью,
повышенной утомляемостью, нарастанием
кардиальных проявлений (анемическим синдромом),
болями в суставах и мышцах;
ноющими
• - в 10% случаях заболевание манифестирует
геморрагическими проявлениями;
• - увеличение периферических лимфоузлов, селезенки,
печени;
• - реже дебютом могут быть стоматит, мигрирующий тромбофлебит,
специфические кожные проявления, внезапные параличи или парезы.
• - 5% (до 52 %) - выявляется при случайном исследовании крови.
25.
Особенности течения некоторых форм ОМЛ• О недифференцированный лейкоз (М0): частота его уменьшается в
связи появляющимися дополнительными маркерами ОЛ при
иммунофенотипировании.
• О. миелобластный лейкоз (М1+М2)- 50-60% всех случаев ОЛ.
Заболевание чаще встречается у лиц старше 40 лет;
характеризуется быстрым развитием всех синдромов:
интоксикационного, анемического, геморрагического синдрома.
• О. Промиелоцитарный лейкоз (М3)- встречается у 5% больных.
Характерно развитие тяжелого ГЕМОРРАГИЧЕСКОГО СИНДРОМА, ДВСсиндрома, при адекватной терапии которого прогноз б-го = ОЛЛ
• О. миеломонобластный лейкоз (М4) -15%, течение более
агрессивное, чем М1. Нередко развиваются экстрамедуллярные
очаги (нейролейкз, лейкемиды кожи, гипертрофический гингивит).
26.
• О. монобластный лейкоз (М5) – 10%, клиника схожа с М4,экстрамедуллярные очаги встречаются еще чаще- до 30%.
• .
• О. Эритромиелоз (М6)- 5%. –острый эритробластый лейкоз –
болезнь Ди Гульельмо. Начальным проявлением может быть
анемия. В костном мозге картина напоминает В12-дефицитную
анемию. Помогает диагностике увеличение % бластных клеток.
Нередко встречаются «ревматические» симптомы: серозиты,
артралгии; лечение менее эффективно.
• О. Мегакариоцитарный лейкоз (М7) – наиболее редкая форма
острого лейкоза, характерно развитие миелофиброза,
затрудняющее получение костного мозга. Нередко развивается
гипертромбоцитоз.
27.
• О. Лимфобластный лейкоз – 10-15% (до 25%)взрослых больных ОЛ, (85% детей).
• Характено частое развитие синдрома лейкемической
пролиферации и нейролейкоза.
• Интоксикационный, анемический, геморрагический и синдром
инфекционных осложнений встречаются значительно реже.
• Более чем у 50% больных встречаются изменения кариотипа:
при этом гиперплоидия сопровождается хорошим ответом на
терапию.
• Особенно неблагоприятно течение при наличии
филадельфийской хромосомы .
• Лечение ОЛЛ проводится по другим программам химиотерапии,
поэтому д/д между ними строго обязателен.
28.
Клинический анализ крови• Количество лейкоцитов периферической крови чаще
остается на сублейкемическом уровне и не превышает 20–
30х109/л (может варьировать в очень широких пределах (от
1х109/л до 200х109/л)
• - тромбоцитопения (менее 50х109/л) - у 25-50% больных
• - нормохромная нормоцитарная анемия на момент
диагностики заболевания имеется у большинства больных
29.
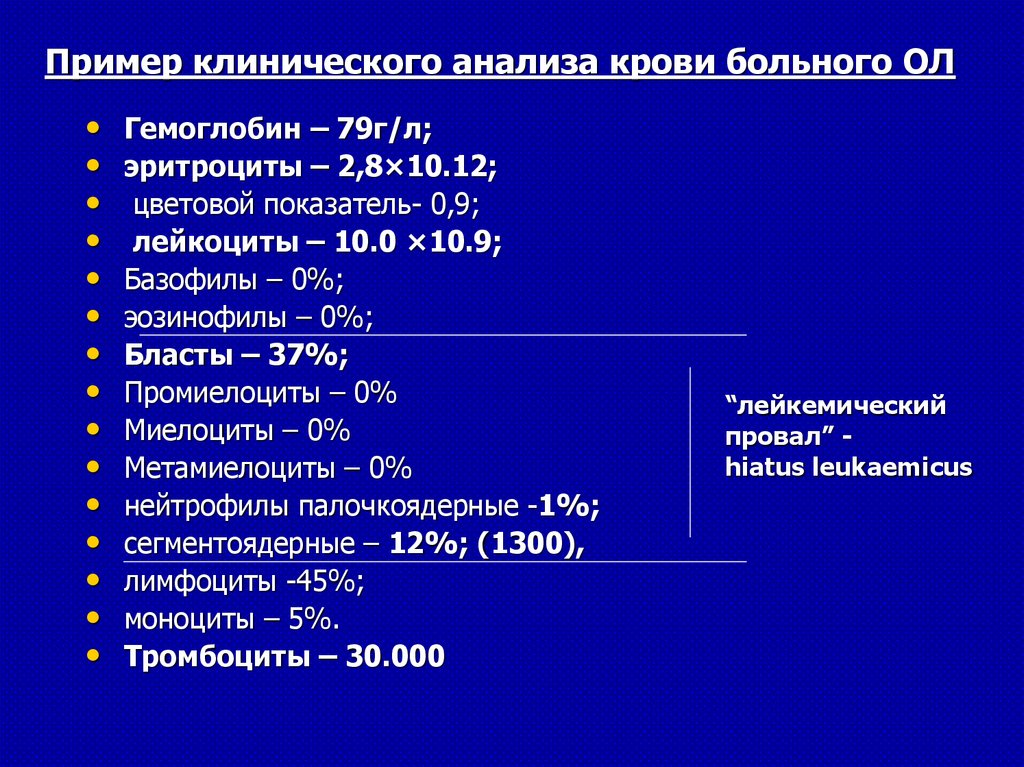
Пример клинического анализа крови больного ОЛГемоглобин – 79г/л;
эритроциты – 2,8×10.12;
цветовой показатель- 0,9;
лейкоциты – 10.0 ×10.9;
Базофилы – 0%;
эозинофилы – 0%;
Бласты – 37%;
Промиелоциты – 0%
Миелоциты – 0%
Метамиелоциты – 0%
нейтрофилы палочкоядерные -1%;
сегментоядерные – 12%; (1300),
лимфоциты -45%;
моноциты – 5%.
Тромбоциты – 30.000
“лейкемический
провал” hiatus leukaemicus
30.
• В типичных случаях между бластами и зрелымигранулоцитами отсутствуют промежуточные формы
клеток нейтрофильного ряда (“лейкемический провал”
или hiatus leukaemicus).
• При уровне лейкоцитов свыше 100х109/л резко
повышается риск развития лейкостатических
осложнений (неврологические нарушения, острый
респираторный дистресс-синдром, у мужчин –
приапизм).
• Биохимическое исследование: повышение уровня
ЛДГ, мочевой кислоты.
31.
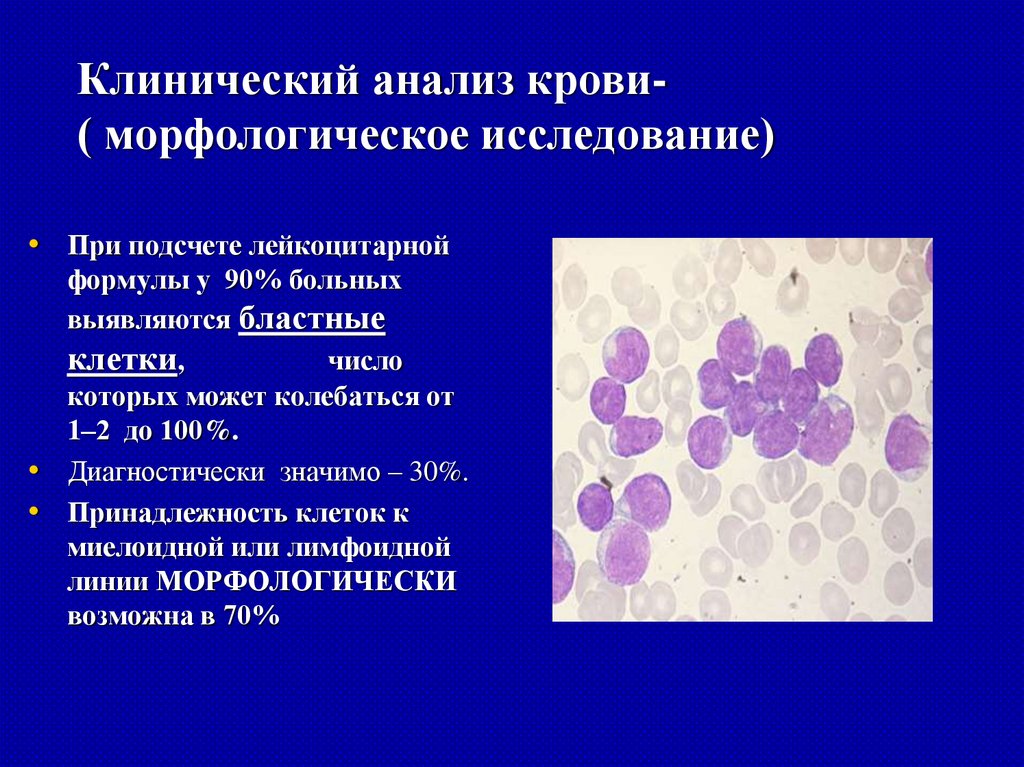
Клинический анализ крови( морфологическое исследование)• При подсчете лейкоцитарной
формулы у 90% больных
выявляются бластные
клетки,
число
которых может колебаться от
1–2 до 100%.
• Диагностически значимо – 30%.
• Принадлежность клеток к
миелоидной или лимфоидной
линии МОРФОЛОГИЧЕСКИ
возможна в 70%
32.
Проведение костномозговой пункцииобязательно!!!
• Иглы для проведения пункции:
Игла Кассирского
Современные иглы
33.
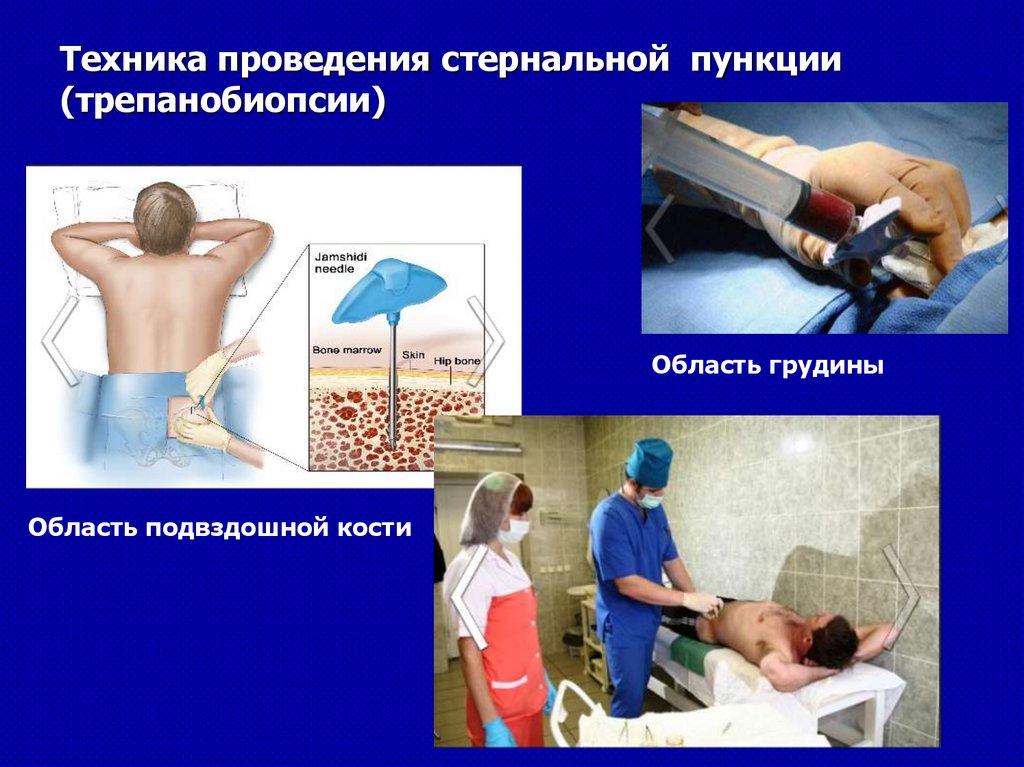
Техника проведения стернальной пункции(трепанобиопсии)
Область грудины
Область подвздошной кости
34.
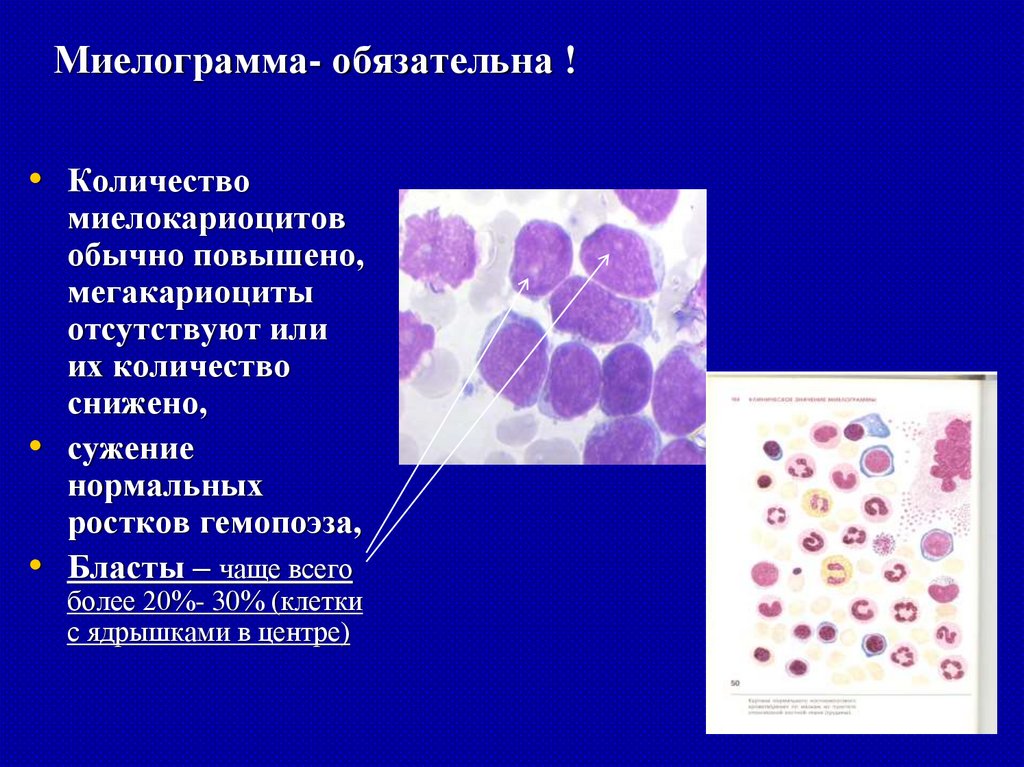
Миелограмма- обязательна !• Количество
миелокариоцитов
обычно повышено,
мегакариоциты
отсутствуют или
их количество
снижено,
сужение
нормальных
ростков гемопоэза,
Бласты – чаще всего
более 20%- 30% (клетки
с ядрышками в центре)
35.
Для проведения морфологическогоисследования используются:
• 1 Клетки периферической крови
• 2 Мазки-отпечатки лимфоузла (опухоли) на предметном стекле
• 3 Пункционная аспирационная биопсия лимфоузла или
тотальная биопсия
• 4 Цитологическое исследование костного мозга: миелограмма,
трепанобиопсия с иммунофенотипированием клеток,
• 5 Цитологическое исследование биожидкостей (спинномозговой ликвор, плевральная жидкость)
36.
• Существует правило:необходимо в течение всей жизни больного ОЛ хранить
пунктаты костного мозга и мазки периферической крови, так
как под влиянием проводимой цитостатической терапии картина
крови и костного мозга становится нетипичной для ОЛ (в
препаратах появляются так называемые терапевтические
бласты с более грубым ядром и их практически нельзя отличить
от лимфоцитов).
• При повторных обращениях больного в другие лечебные
учреждения диагноз ОЛ может быть подтвержден лишь при
изучении первичных препаратов.
37.
Стадии острого лейкоза• I.
Первая атака (первый острый период) – время от первых
проявлений заболевания до определения результатов индукционной
химиотерапии.
• II. Полная ремиссия – ≥ 4-х недель отсутствуют клинические и
гематологические признаки ОЛ:
а) без очагов экстрамедуллярного лейкемического роста;
б) в периферической крови отсутствуют бластные клетки,
количество нейтрофилов > 1,5х109/л, тромбоцитов > 100х109/л;
в) имеется достаточная клеточность костного мозга (>20% по
данным трепанобиопсии);
г) в миелограмме бластов <5%, представлены все ростки
кроветворения с нормальным созреванием.
38.
Стадии острого лейкоза (окончание)• III. Рецидив – появление клинических и гематологических
признаков ОЛ после полной ремиссии различной длительности.
- снижение количества нормальных клеток или появление
бластов в периферической крови;
- изолированный экстрамедуллярный рецидив (нейролейкоз,
лейкозная инфильтрация яичка и др.). При бластозе костного
мозга >5% диагностируется костномозговой рецидив.
Выделяют ранний (длительность полной ремиссии <12
месяцев) и поздний (продолжительность полной ремиссии >18
месяцев) рецидив.
• IV. Терминальная стадия – полная резистентность к
проводимой терапии с ближайшим неблагоприятным
исходом.
39.
Дифференциальный диагноз ОЛ1 - заболевания, не являющимися гемобластозами:
инфекционный мононуклеоз,
Апластическая анемия,
В12-дефицитная анемия.
2 - Гемобластозы:
Хронический лейкоз в стадии бластного криза,
Миелодиспластический синдром
Неходжкинские лимфомы в ст. лейкемизации
Лейкемоидные реакции
Солидные опухоли через 2-3 года после ЛТ или ХТ
• 3. Метастазы в костный мозг
40.
• Прогностические факторы при острыхмиелоидных лейкозах:
• 1) Значимые: - возраст более 60 лет – неблагоприятный
прогноз;
• - хромосомные нарушения: т(8,12) – высокая частота полных
ремиссий, длительная выживаемость;
• - вторичные лейкозы – прогноз неблагоприятный.
• 2) Менее значимые: другие FAB – варианты лейкоза (М4-М7) –
неблагоприятный прогноз.;
• - общесоматический статус (более 50% - благоприятный
прогноз)
• - лейкоциты более 50 в микролитре – благоприятный;
• - наличие палочек Ауэра – благоприятный прогноз.
41.
• Прогностически неблагоприятныефакторы при остром лимфобластном
лейкозе:
-
возраст более 35 лет;
лейкоцитоз более 300 в 1 микролитре;
достижение ремиссии более чем за 4 недели;
хромосомные аномалии (т9;22) и т (4;11);
В-иммунологический вариант лейкоза.
42.
Лечение острого лейкоза• 1 исторический этап – 19 – начало 20 века – определение
нозологической формы и отсутствие какого-либо лечения.
Длительность жизни больных – около 3 месяцев!!
• 2 этап – с начала 40-х годов 20 века начали использовать
гемотрансфузии, достигали отдельных клинических ремиссий.
• 3 этап – 1948 год, первое клиническое применение
аминоптерина – цитостатика, антагониста фолиевой кислоты
– привело к первой полной клинико-гематологической
ремиссии.
• В настоящее время – программная (протокольная) система
использования химиотерапевтических препаратов.
• Заслуга во внедрении программной терапии ОЛ принадлежит
академику АМН Воробьеву АИ
43.
Принципы химиотерапии острыхлейкозов
• 1.
Лечение необходимо начинать сразу же после
установления диагноза, ( не только морфологического, но
по результатам иммунофенотипирования, цитогенетики,
молекулярно-биологического исследования) поскольку при
отсутствии терапии продолжительность жизни пациентов
не превышает трех месяцев.
2. Терапия должна проводиться в специализированном
гематологическом
стационаре,
оснащенном
асептическими палатами. Лечение больных острым
лейкозом в терапевтическом отделении недопустимо!!!
44.
• 3.Выбор схемы лечения определяется морфологическим,
цитохимическим и иммунофенотипическим, цитогенетическим
вариантом острого лейкоза.
• 4. В большинстве случаев используется ПХТ: так как
цитостатики действуют на определенные стадии клеточного
митотического цикла, изменение протокола проведения схемы
недопустимо!
45.
Основные методы лечения ОЛ• 1 Цитостатическая терапия
– уничтожение лейкозного клона;
- восстановление нормального кроветворения
• 2 Трансплантация костного мозга
• 3 Сопроводительная терапия ( для уменьшения риска
осложнений)
• 4 Лейкоферез
46.
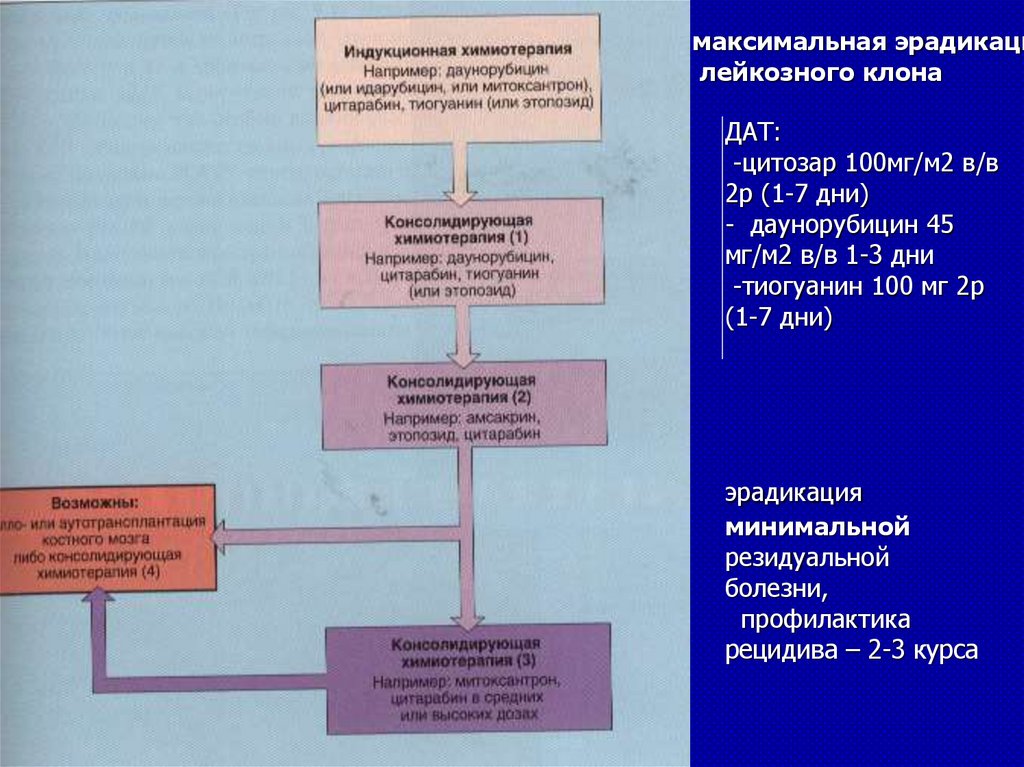
максимальная эрадикацилейкозного клона
ДАТ:
-цитозар 100мг/м2 в/в
2р (1-7 дни)
- даунорубицин 45
мг/м2 в/в 1-3 дни
-тиогуанин 100 мг 2р
(1-7 дни)
эрадикация
минимальной
резидуальной
болезни,
профилактика
рецидива – 2-3 курса
47.
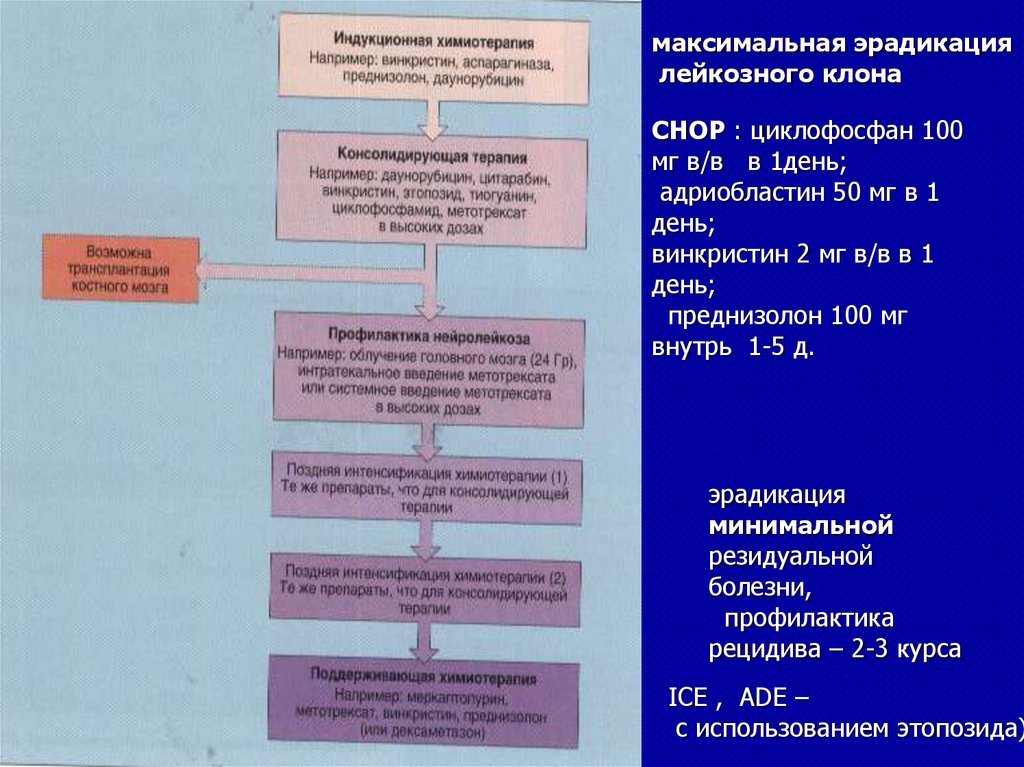
максимальная эрадикациялейкозного клона
CHOP : циклофосфан 100
мг в/в в 1день;
адриобластин 50 мг в 1
день;
винкристин 2 мг в/в в 1
день;
преднизолон 100 мг
внутрь 1-5 д.
эрадикация
минимальной
резидуальной
болезни,
профилактика
рецидива – 2-3 курса
ICE , ADE –
с использованием этопозида)
48.
Сопроводительная терапия лейкозов:• 1 – Дезинтоксикационная терапия (физиологический раствор,
полиглюкин, форсированный диурез и др.)
• 2 – Гемокомпонентная терапия ( переливание тромбоцитарной
массы, эритроцитарной массы, очень редко лейкоцитов)
• 3 – Коррекция метаболических нарушений
• ( плазмоферез, гемосорбция и др.)
• 4 – Лечение инфекционных осложнений (антибактериальные,
противогрибковые, противовирусные средства)
• 5 – Аллопуринол для лечения антилейкоцитозного синдрома.
• Антиэметическая терапия
49.
Осложнения острых лейкозов• 1. Инфекционные осложнения (у 70%
больных определяют летальные исходы).
• Для их профилактики за 1-2 дня до начала ХТ назначают
противогрибковые препараты;
• - с момента начала ХТ начинают неадсорбируемый а/б:
бисептол, офлоксацин, канамицин.
• - поводом для начала комбинированной а/б терапии является
подъем Т тела до 38 градусов, отмеченная 2 или более раз в
сутки, при исключении других причин для ее развития.
50.
• 2 Геморрагический синдром• - выраженная тромбоцитопения – у 1\2 больных
• - летальность от ГС – 5-10% - кровоизлияния в головной мозг,
желудочно-кишечный тракт, легочные кровотечения.
• - Показания для переливания тромбомассы:
• а) при наличии признаков кровотечения на фоне
тромбоцитопении,
• б) при уровне ТР - 30×10.9 + инфекционные осложнения,
• В) при уровне ТР до 10 ×10.9 без признаков инфекции и
повышенной кровоточивости.
51.
• 3 Анемический синдром• - анемия встречается у всех больных ОЛ,
• - основной метод лечения – переливание эритроконцентрата
или отмытых эритроцитов.
• - Показания к переливанию эритромассы:
• - снижение Нв ниже 70 г/л и гематокрита 14-30% ;
• - снижение Нв ниже 45 г/л и Нт менее 14% требует
неотложной гемотрансфузии!
52.
• 4 Энтеропатия• Состояние, характеризующееся поражением слизистой ЖКТ,
возникающее на фоне миелотоксического агранулоцитоза и
проявляющееся болями в животе, вздутием живота, частым жидким
стулом.
• - частота энтеропатии – 10%.
• 5 Синдром лизиса опухоли
• - имеет место при гиперлейкоцитозе более 100тыс и органомегалии.
• -быстрый лизис опухоли выбрасывает в кровь мочевую кислоту и
биогенные амины, блокирующих микроциркуляцию и повреждающих
мембраны клеток, в результате развиваются ОПН, дистресс-синдром,
мозговая кома.
• - больным перед ПХТ проводят гидратацию,
• - назначают аллопуринол, лазикс,
• - с помощью гидроксимочевины снижают лейкоцитоз до 20.000 до
начала ПХТ.
53.
• 6 Нейролейкоз- частота при ОЛЛ – 30-50%; при ОНЛЛ- 5%.
Клинические варианты:
а) менингеальные симптомы – 70%,
б) очаговое поражение головного мозга -5%, в) изолированное
поражение черепно-мозговых нервов – 20%,
• г) полирадикулоневрит – 5%.
• - основной критерий нейролейкоза – повышенный цитоз
спинномозговой жидкости за счет бластоза.
• - развитие нейролейкоза ухудшает прогноз ОЛ.
54.
Современная химиотерапия позволяет получить
полные ремиссии у 50–95% взрослых больных
• В большинстве случаев через 3-4 года
рецидив.
развивается
• 5-летняя
безрецидивная
выживаемость
при
химиотерапии составляет 20–25% для ОМЛ, 30% для
ОЛЛ.
• У больных после лечения острого лейкоза значительно
чаще возникают соматические опухоли.
55.
Лекциядля 5 курса 4 факультета ФПВ на тему:
« Хронические лейкозы »
56.
Хронические лейкозы – гетерогенная группаопухолевых заболеваний крови, морфологическим
субстратом которых является неопластически
трансформированная клетка костного мозга,
сохраняющая определенную способность к
делению, при этом длительно сохраняется
нормальный гемопоэз.
Вторично может происходить метастазирование опухолевых
клеток из костного мозга в периферические органы (лимфоузлы,
печень, селезенка и другие органы)
57.
Хронический лимфолейкоз(хронический лимфоцитарный лейкоз - клональное
лимфопролиферативное заболевание, первично
локализующееся в костном мозге, субстратом которого
являются зрелые лимфоциты.
( Наряду с костным мозгом вторично поражаются лимфоузлы, селезенка,
печень, нервная система и другие органы).
58.
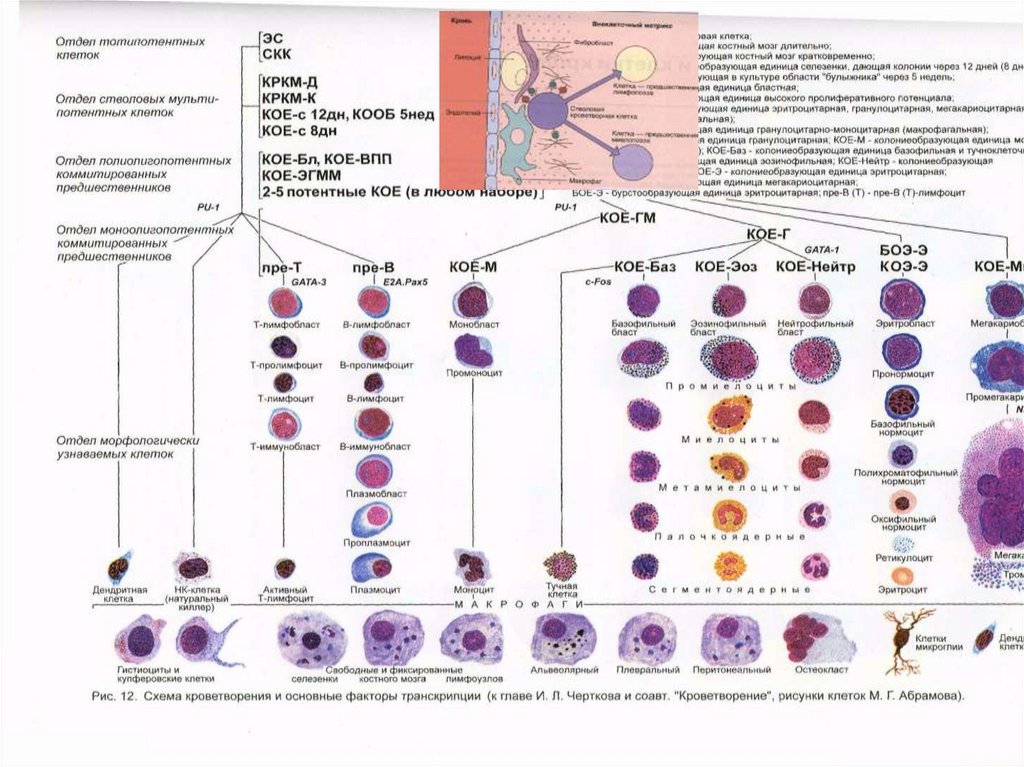
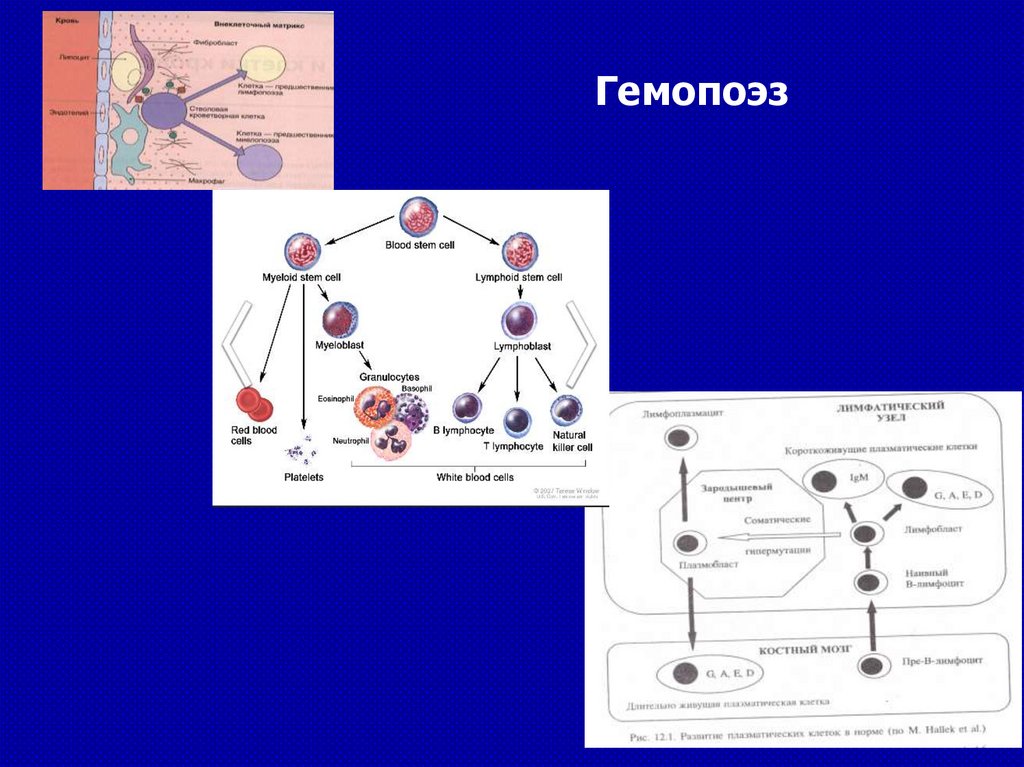
59.
Гемопоэз60.
Эпидемиология• Составляет более 30% всех лейкозов в Северной Америке и
Европе
Ежегодная заболеваемость в этих регионах составляет 3-4
случая на 100 000 населения, а среди лиц старше 65 лет − 20
на 100 000 населения в год
• Средний возраст к началу заболевания составляет 55 лет,
однако около 10% пациентов моложе 40 лет
• М:Ж = 2:1
В
Европе
и
Северной
Америке
В-клеточный иммунофенотип встречается у 95-98%
больных,
у
2-5%−
Т-клеточный
·
В странах Азии преобладает
Т-клеточный
хронический
лимфолейкоз
61.
Этиология ХЛЛДля ХЛЛ не доказана этиологическая роль
ионизирующего облучения.
• Для ХЛЛ животных доказана этиологическая роль вирусов.
• Болезнь нередко носит наследственный характер.
• Отмечается увеличение частоты ХЛЛ в семьях с
лимфопролиферативными заболеваниями (ХЛЛ- фактор риска у
родственников 1 поколения)
• .
62.
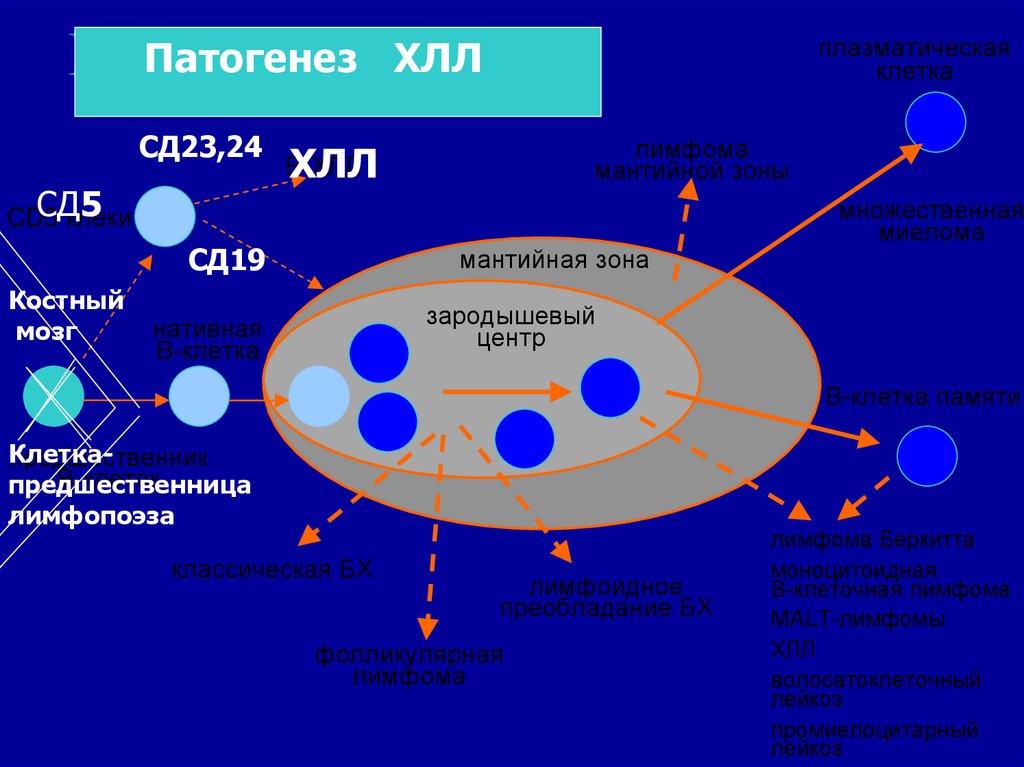
Патогенез лимфомХЛЛ
Патогенез
СД23,24
СД5
CD5
клеки
Костный
мозг
лимфома
мантийной зоны
В-ХЛЛ
ХЛЛ
СД19
плазматическая
клетка
мантийная зона
множественная
миелома
зародышевый
центр
нативная
В-клетка
В-клетка памяти
Клеткапредшественник
В-клеток
предшественница
лимфопоэза
классическая БХ
лимфоидное
преобладание БХ
фолликулярная
лимфома
лимфома Беркитта
моноцитоидная
В-клеточная лимфома
МALT-лимфомы
ХЛЛ
волосатоклеточный
лейкоз
промиелоцитарный
лейкоз
63.
• Патогенетические особенности ХЛЛ:• - пролиферация клона трансформированных «зрелых»
лимфоцитов;
• в иммунофенотипе - CD19, СД23, СД24, СД5+;
• -характеризуется уменьшением числа мембранных Ig,
• - наличием кластера СД5+, который ассоциируется с
аутоиммунными феноменами (гемолитическая анемия,
тромбоцитопения, тиреоидит..);
• - вытеснение нормального кроветворения с развитием анемии и
тромбоцитопении;
• - в финале болезни может развиваться трансформация ХЛЛ в
лимфосаркому (синдром Рихтера);
• - нарушение противоопухолевого иммунитета часто приводит к
развитию второй опухоли.
64.
Клиническая картина• В
70% случаев заболевание начинается постепенно
характеризуется
лишь
абсолютным
лимфоцитозом
периферической крови
и
в
Основные клинические синдромы:
1. Синдром лейкемической пролиферации:
-- Лимфаденопатия:
- периферические лимфатические узлы имеют тестоватую
консистенцию, безболезненные, не спаянные с кожей , клетчаткой
и между собой, не образующие свищей;
• - висцеральные лимфоузлы;
• - позднее появляется увеличение размеров селезенки и печени.
65.
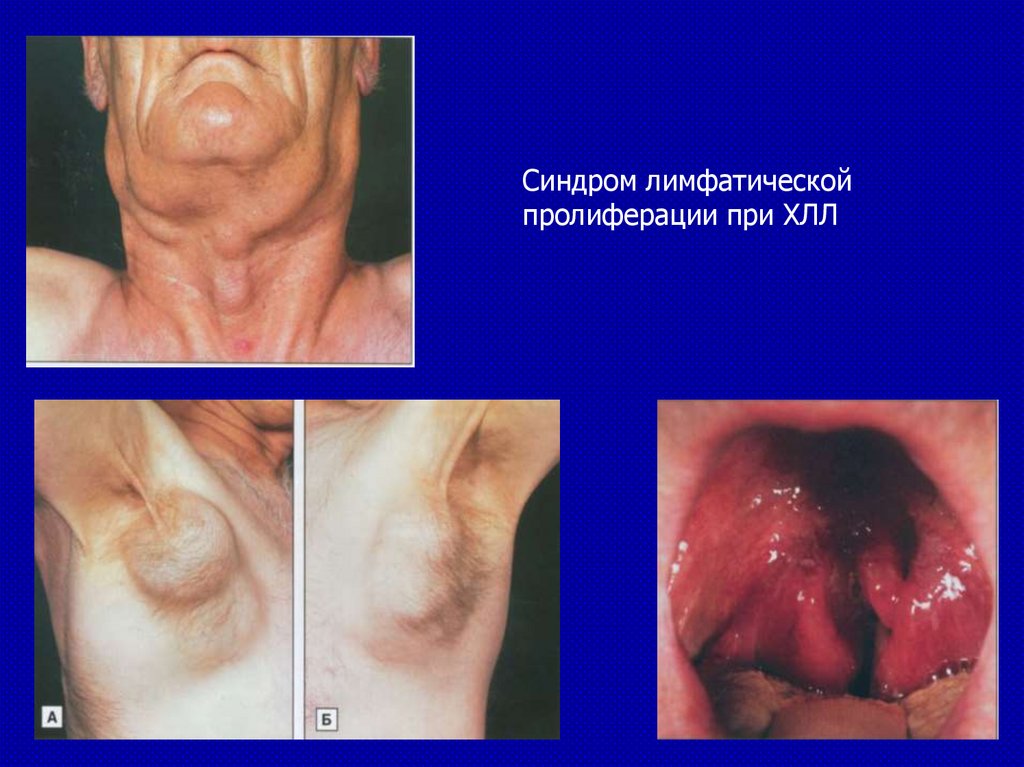
Синдром лимфатическойпролиферации при ХЛЛ
66.
• 2 Симптомы опухолевой интоксикации: истощение, боли вкостях, повышение температуры тела.
• 3 Аутоиммунные осложнения: гемолитическая анемия в
25% и тромбоцитопения в 15%/, возможно сочетание с СКВ.
• 4 Инфекционные осложнения: бронхиты, пневмонии,
сепсис, опоясывающий лишай, выраженная инфильтрация при
укусе насекомых – 70%.
• 5 Возможна трансформация в более агрессивную лимфому
(синдром Рихтера), продолжительность жизни < 6 месяцев
• 30% ХЛЛ имеет индолентное течение.
67.
Лабораторные данные• Лейкоцитоз с абсолютным (более 5 × 109/л)
• и относительным лимфоцитозом;
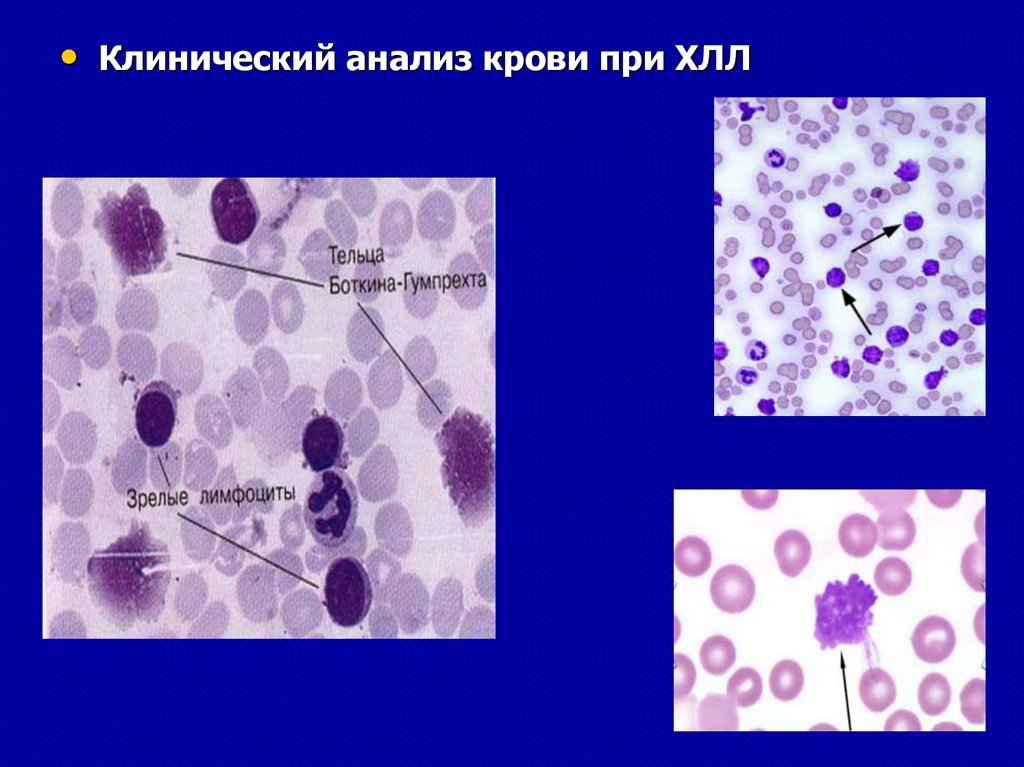
• Морфологически лимфоциты не отличаются от нормальных;
• В ряде случаев встречаются пролимфоциты (обычно менее
10%);
• Характерно наличие в мазке крови клеток Боткина-Гумпрехта
(полуразрушенные ядра лимфоцитов – артефакт, образующийся
при приготовлении мазка);
• Снижение уровня иммуноглобулинов G,A,M.
• По
мере
прогрессирования
тромбоцитопения
развиваются
анемия
и
68.
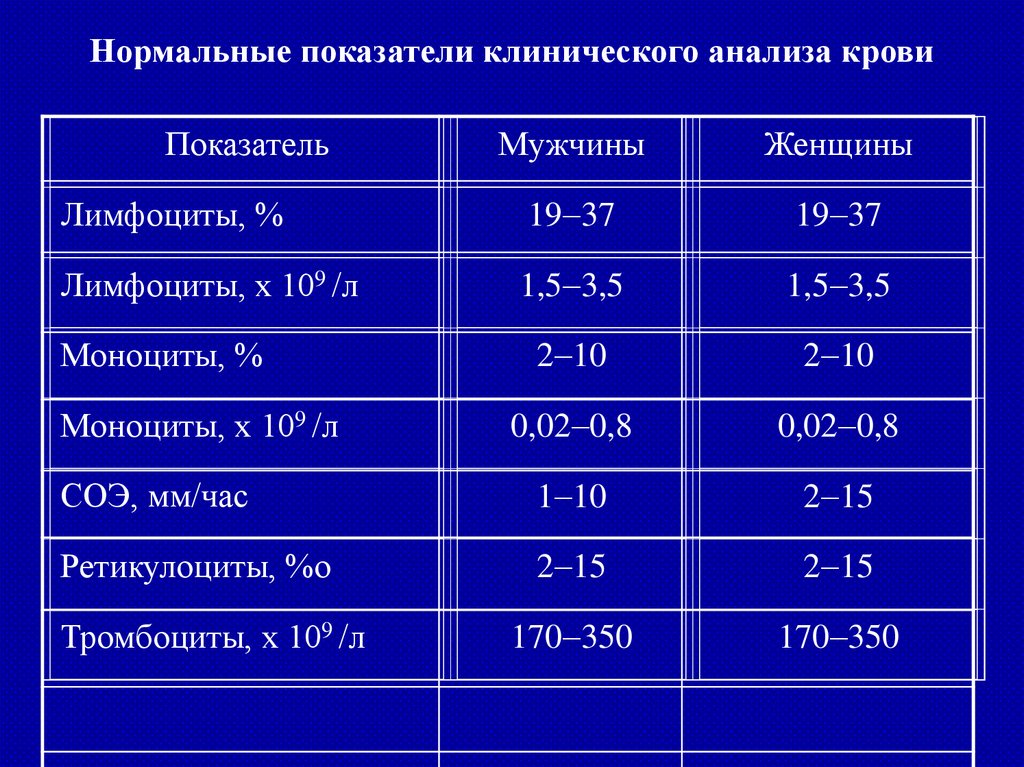
Нормальные показатели клинического анализа кровиПоказатель
Мужчины
Женщины
Лимфоциты, %
19 37
19 37
Лимфоциты, х 109 /л
1,5 3,5
1,5 3,5
2 10
2 10
0,02 0,8
0,02 0,8
СОЭ, мм/час
1 10
2 15
Ретикулоциты, %о
2 15
2 15
170 350
170 350
Моноциты, %
Моноциты, х 109 /л
Тромбоциты, х 109 /л
69.
• Клинический анализ крови при ХЛЛ70.
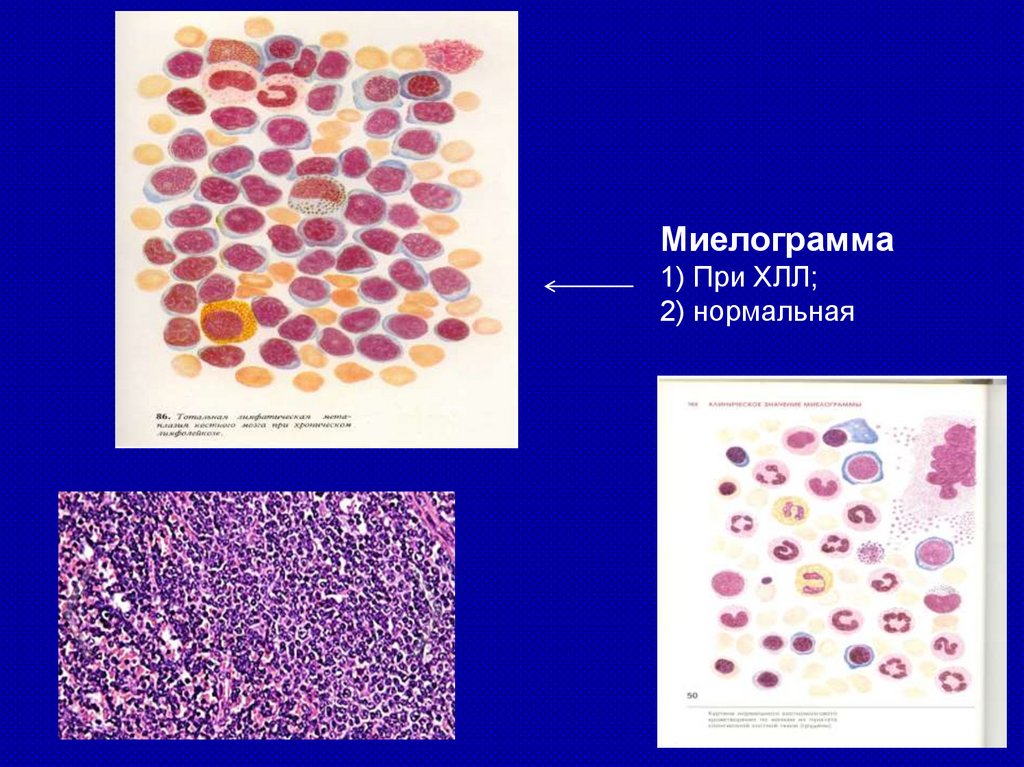
Миелограмма1) При ХЛЛ;
2) нормальная
71.
72.
Критерии диагноза• Абсолютный лимфоцитоз более 5 (10) 109/л
• Нормальная
микроскопии
морфология
• Более
30% лимфоцитов
(миелограмме)
лимфоцитов
в
аспирате
при
световой
костного
мозга
• Лимфоидная метаплазия костного мозга в трепанобиоптате.
• Характерный иммунофенотип
(CD19+, CD20+, CD24+, CD5+, CD 23+, слабая экспрессия SIg,
CD79b)
73.
Классификация RaiСтадия
Характеристика
Медиана
выживаемости
O
Только лимфоцитоз более 15х109/л в
крови, более 40% в костном мозге
Как в популяции15 лет
I
Лимфоцитоз + увеличение
лимфатических узлов
9 лет
II
Лимфоцитоз + спленомегалия и/или
гепатомегалия независимо от
увеличение лимфатических узлов
6 лет
III
Лимфоцитоз + уровень гемоглобина
ниже 110 г/л независимо от увеличения
лимфатических узлов и органов
1, 5 года
IV
Лимфоцитоз + количество тромбоцитов
ниже 100х10 9/л независимо от
увеличения лимфатических узлов и
органов
< 1,5 года
74.
Критерии для начала лечения• (Рано
начатое
лечение
не
продолжительность жизни больных !!!)
увеличивает
• Симптомы интоксикации (потливость, снижение веса)
• Анемия или тромбоцитопения в связи с инфильтрацией костного мозга
• Аутоиммунная анемия или тромбоцитопения
• Симптомы компрессии в связи с массивной лимфаденопатией или
спленомегалией
• Удвоение абсолютного лимфоцитоза менее, чем за 12 месяцев
• Лимфоцитоз периферии более 150х109/л .
• Повышенная частота инфекций
• Продвинутая стадия заболевания (C по классификации Binet, III-IV по
классификации Rai)
75.
Принципы лечения• Хлорбутин или циклофосфан
• При неэффективности − полихимиотерапия (программы
COP, CHOP и др.)
• Преднизолон при аутоиммунной гемолитической анемии или
тромбоцитопении
• Пуриновые аналоги (флюдарабин по 25 мг/м2) 5 дней
подряд каждые 28 дней
• Анти CD 20 моноклональные антитела (ритуксимаб,
мабтера )
• α-интерферон
• Трансплантация аллогенных стволовых кроветворных
клеток (у молодых пациентов)
76.
• В ряде случаев у больных ХЛЛ используются паллиативныеметоды: лучевая терапия, спленэктомия,
лейкацитоферез.
• Лучевая терапия применяется при наличии выраженной
спленомегалии или конгломерата лимфатических узлов с
признаками компрессии окружающих органов.
• Особое значение придается профилактике и лечению
инфекционных осложнений.
• Больные ХЛЛ должны избегать укусов пчел и комаров.
77.
• Темпы прогрессирования хронического лимфолейкоза широковарьируют: продолжительность жизни колеблется от 2-3 до 30
лет и более
• Средняя продолжительность жизни составляет 5-7 лет
78.
«В течение последних двух десятилетий ХЛЛ из
неизлечимого заболевания превратился в
заболевание, которое в большинстве случаев при
своевременном начале можно успешно лечить,
продлевая жизнь и соматическое благополучие
больных, и которое в настоящее время стало
принципиально излечимым».
79.
Хронический миелоидныйлейкоз
– клональное миелопролиферативное
заболевание, характеризующееся
-- поражением гемопоэза на уровне стволовой
кроветворной клетки,
--увеличением продукции гранулоцитов
в костном мозге и периферической крови
--и наличием филадельфийской (Ph) хромосомы
и/или химерного гена BCR/ABL.
80.
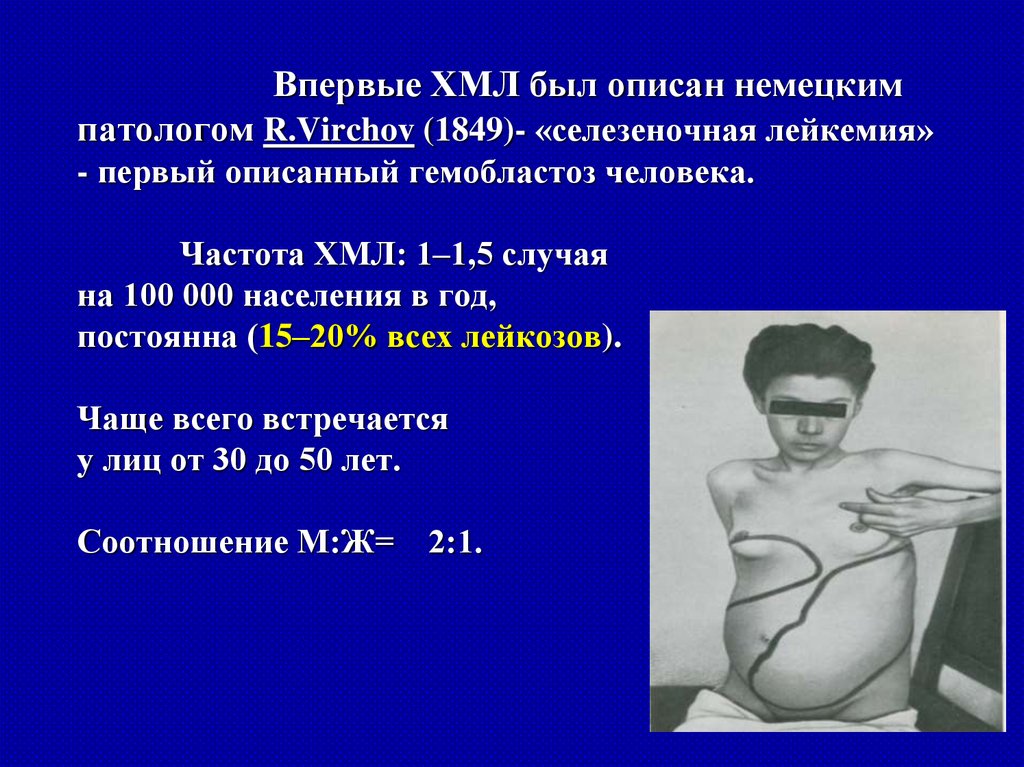
Впервые ХМЛ был описан немецкимпатологом R.Virchov (1849)- «селезеночная лейкемия»
- первый описанный гемобластоз человека.
Частота ХМЛ: 1–1,5 случая
на 100 000 населения в год,
постоянна (15–20% всех лейкозов).
Чаще всего встречается
у лиц от 30 до 50 лет.
Соотношение М:Ж= 2:1.
81.
82.
Клеточный состав костного мозга %• Клеточный состав костного мозга – 50 – 250 кл в 1 мкл
• Мегакариоциты - 0,2-0,6
• Бласты – 0,1 -1,6%
• Миелобласты – 0,2-1,7
Лимфоциты- 4,3-13,7
Промиелоциты – 1,0-4,1
Миелоциты – 7,0 – 12,2
Метамиелоциты – 8,0- 15,0
Палочкоядерные – 12,8-23,7
Сегментоядерные 13,1-24,1
Всего нейтрофильного ряда- 52,7-68,9
Эозинофилы – 0,5-5,8
Базофилы – 0-0,5
Эритробласты- 0,2-1,1
Пронормоциты- 0,1-1,2
Нормоциты базофильные -1,4-4,6
Нормоциты полихроматофильные 8,9-16,9
Нормоциты оксифильные - 0,8-5,6
Всего клеток эритроидного ряда – 14,5 – 26,5
• ЛЭС – 2,1 – 4,5
Моноциты – 0,7-3,1
83.
Этиология- ионизирующая радиация ( в том числе индуцированная
рентгенотерапией),
- воздействие бензола.
Патогенез
У 95–97% больных ХМЛ во всех опухолевых клетках
выявляется Ph-хромосома (22 аутосома с укороченным
длинным плечом). При этом происходит реципрокная
транслокация 9 и 22 хромосом: t(9;22) (q34; q11), в которой
участвуют 2 клеточных протоонкогена – ABL (Abelson leukemia)
и BCR (breakpoint claster region), расположенных соответственно
на 9 и 22 хромосомах.
На 22 хромосоме образуется химерный ген BCR/ABL,
кодирующий белок Р210, обладающий тирозинкиназной
активностью, что приводит к :
1)
увеличению
пролиферации
миелоидных
клетокпредшественниц с нарушением их дифференцировки;
2) блокаде апоптоза.
3) подавляется нормальное кроветворение.
84.
Клинические стадии ХМЛ – этапылейкозного процесса
• 1 - Хроническая – развернутая (ранняя и поздняя)
• 2 - Прогрессирующую (акселерации)
• 3 - Терминальная - бластный криз
85.
Хроническая = развернутая фаза ХМЛНачальная стадия
У большинства пациентов ХМЛ диагностируется в
хронической стадии, в 40-50% случаев – при отсутствии
каких-либо жалоб - по анализу крови,
- поводом к исследованию анализа крови могла
быть спленомегалия.
86.
Основные симптомы:Признаки
гиперметаболизма
потливость, анорексия);
Спленомегалия
подреберье;
и
ощущения
(снижение
массы
дискомфорта
в
тела,
левом
Нарастание частоты инфекционных заболеваний;
Анемический
синдром (общая слабость, повышенная
утомляемость, одышка при привычной физической нагрузке,
тахикардия, учащение стенокардии);
вторичная подагра;
Геморрагический синдром;
симптомы, обусловленные нарушением микроциркуляции на
фоне гиперлейкоцитоза
87.
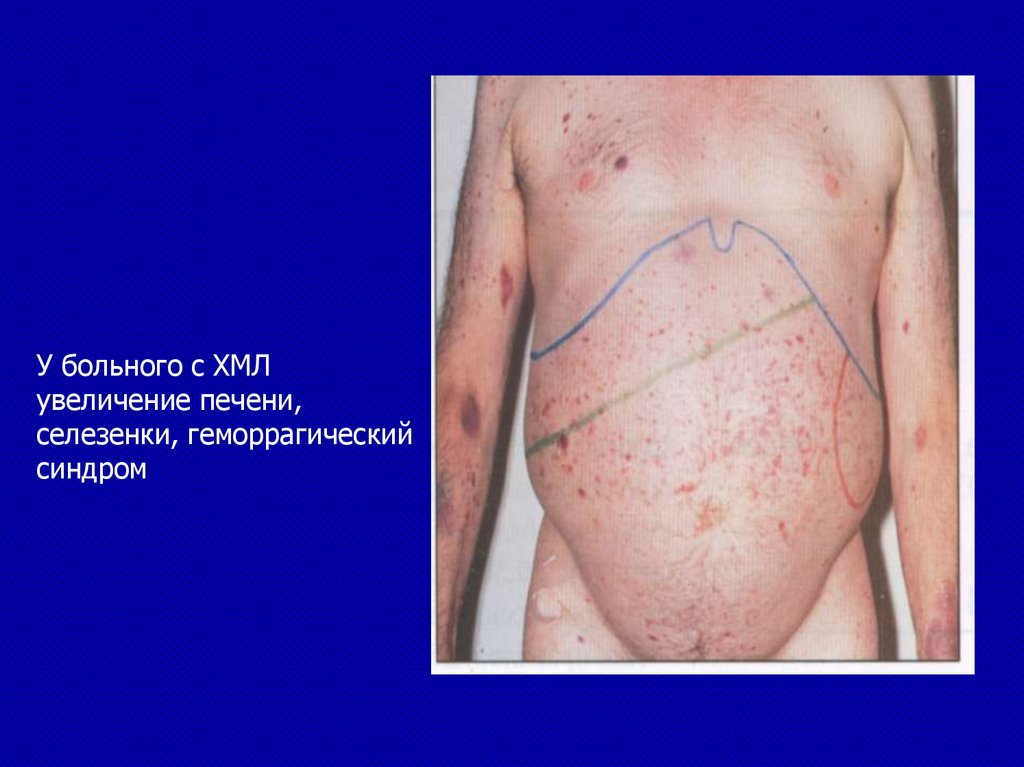
У больного с ХМЛувеличение печени,
селезенки, геморрагический
синдром
88.
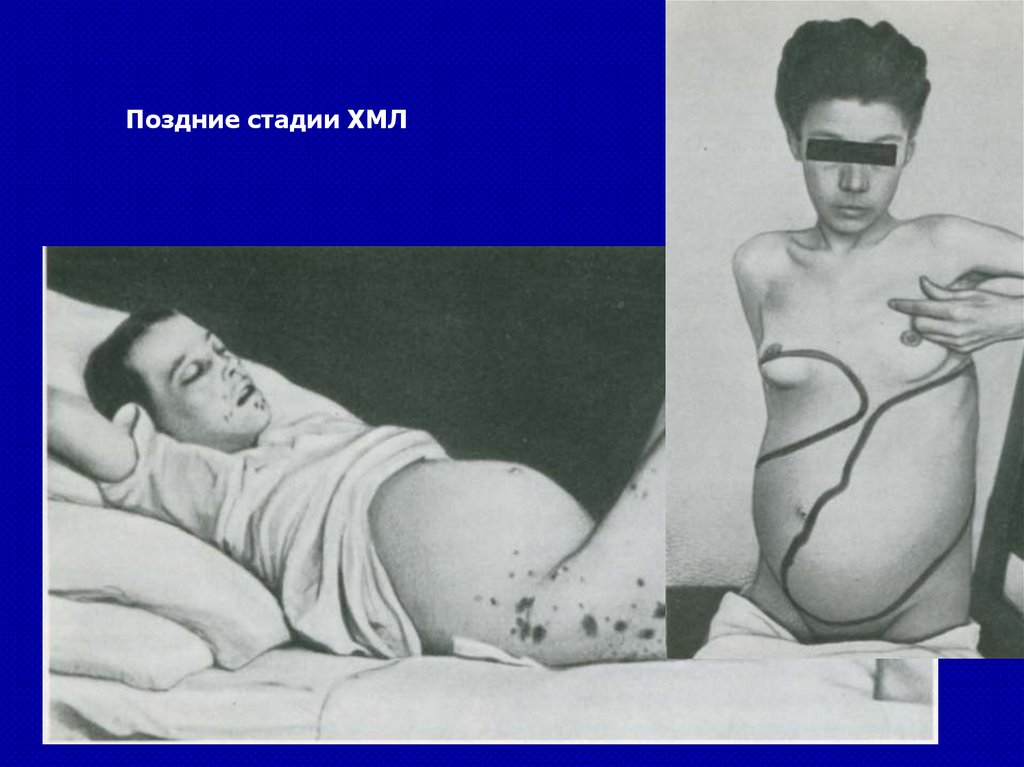
Поздние стадии ХМЛ89.
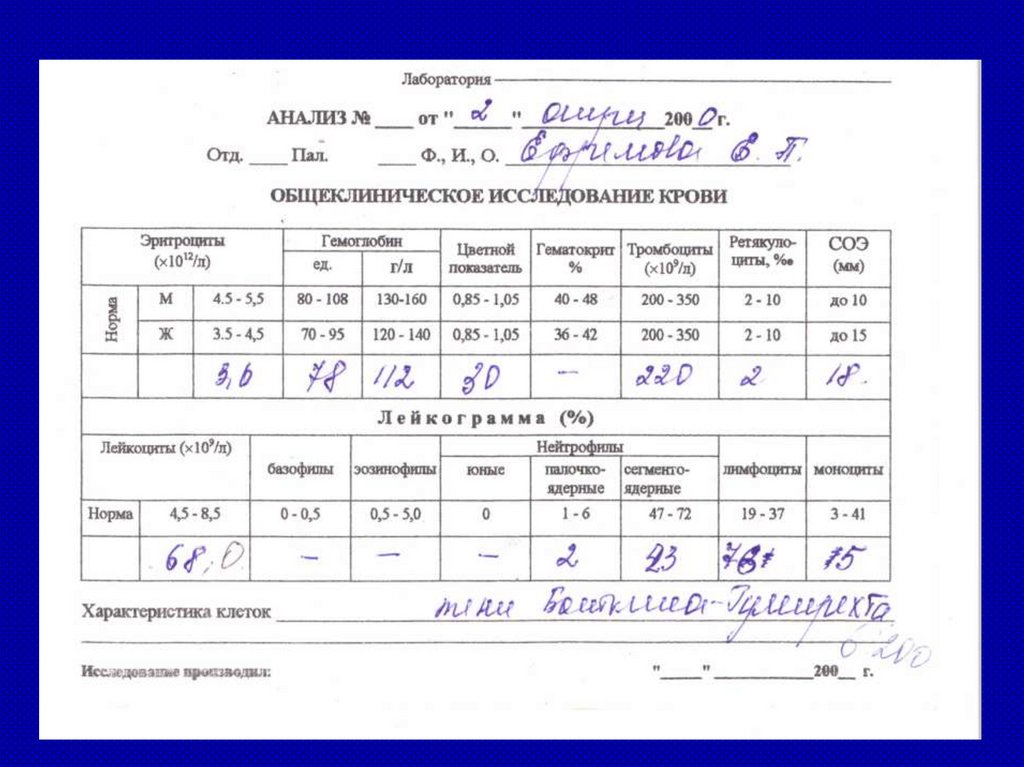
Клинический анализ кровиЛейкоцитоз - в среднем более 50х109/л (возможен и низкий
уровень лейкоцитов – 15–20х109/л);
Сдвиг
“влево”
за
счет
палочкоядерных
нейтрофилов,
метамиелоцитов, миелоцитов, редко – промиелоцитов;
Могут выявляться единичные бластные клетки (прогностически
неблагоприятный признак) ;
Характерна эозинофильно-базофильная ассоциация;
В 30% случаев – нормохромная, нормоцитарная анемия легкой
степени;
У 30% больных – тромбоцитоз; реже тромбоцитопения
(неблагоприятный признак)
90.
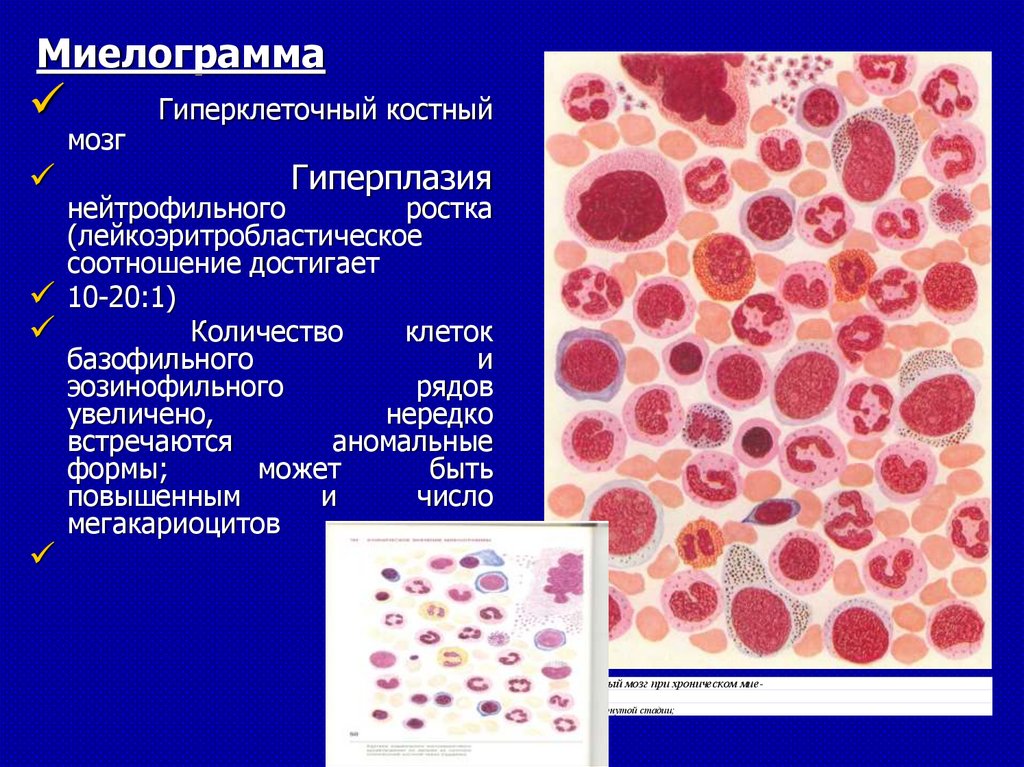
Миелограммамозг
Гиперклеточный костный
Гиперплазия
нейтрофильного
ростка
(лейкоэритробластическое
соотношение достигает
10-20:1)
Количество
клеток
базофильного
и
эозинофильного
рядов
увеличено,
нередко
встречаются
аномальные
формы;
может
быть
повышенным
и
число
мегакариоцитов
76. Костный мозг при хроническом миелолейкозе.
а — в развернутой стадии;
91.
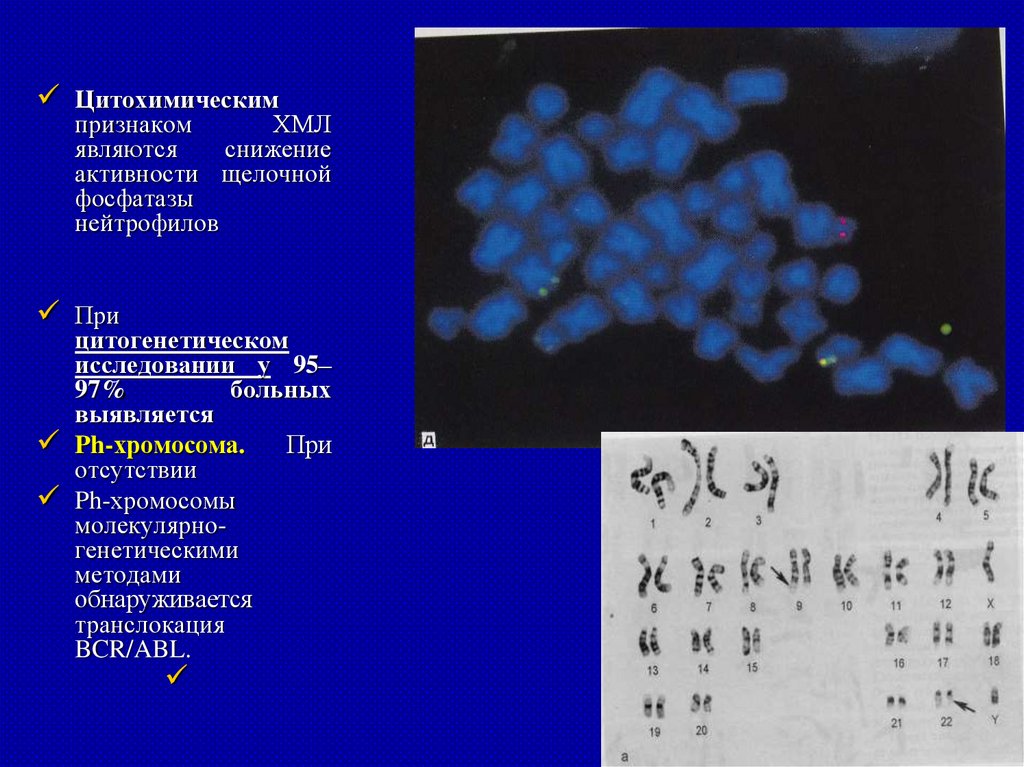
Цитохимическимпризнаком
ХМЛ
являются
снижение
активности щелочной
фосфатазы
нейтрофилов
При
цитогенетическом
исследовании у 95–
97%
больных
выявляется
Ph-хромосома.
При
отсутствии
Ph-хромосомы
молекулярногенетическими
методами
обнаруживается
транслокация
BCR/ABL.
92.
На фоне адекватной химиотерапии практически у всех
пациентов симптомы исчезают:
• - значительно уменьшается в размерах или перестает
определяться селезенка,
• - количество лейкоцитов и лейкоцитарная формула
приближаются к норме (при лечении миелосаном) или
нормализуются
(при
лечении
препаратами
гидроксимочевины).
93.
фаза акселерации ХМЛВ среднем через 3 года, несмотря на продолжающееся
лечение
цитостатиками,
происходит
трансформация
заболевания – опухолевая прогрессия).
У 2/3 пациентов развивается фаза акселерации,
которая характеризуется
прогрессирующей
спленомегалией
с
возможными
инфарктами селезенки,
гепатомегалией;
геморрагическим синдромом,
нарастанием количества гранулоцитов,
нарастанием анемии, тромбоцитоза или тромбоцитопении,
резистентностью к ранее эффективной терапии.
• Продолжительность фазы акселерации составляет 0,5–1
год.
94.
Основной лабораторный признак фазыакселерации и бластного криза – прогрессирующее
увеличение количества промиелоцитов и бластов в
периферической крови и костном мозге.
При цитохимическом исследовании бластов у
70% пациентов определяется миелоидный тип
бластного криза, у 30% – лимфоидный.
95.
Терминальная фаза ХМЛОбычно терминальная фаза протекает в форме бластного
криза
В редких случаях ХМЛ впервые выявляется в период бластного
криза
Клиника
бластного криза сходна с острым лейкозом. C
наличием большого количества бластов в костном мозге и
определенной клинической картиной.
У 10% пациентов в терминальной стадии развиваются
экстрамедуллярные очаги, состоящие из бластных клеток.
Лабораторные признаки бластного криза при этом могут
отсутствовать (так называемая гранулоцитарная саркома).
Медиана выживаемости больных в этой фазе ХМЛ – 3 месяца
96.
Критерии диагноза ХМЛ:• Лейкоцитоз со сдвигом лейкоцитарной формулы влево
• Наличие промежуточных форм нейтрофилов
• Наличие спленомегалии
• Эозинофильно-базофильная ассоциация
• Усиленный миелопоэз в костном мозге
• Низкий уровень щелочной фосфатазы в нейтрофилах
• Обнаружение Ph-хромосомы ( гена BCR|ABL)
97.
Принципы лечения ХМЛ1.
трансплантация аллогенных стволовых
кроветворных клеток
2. Химиотерапия: миелосан (бусульфан),
препаратами гидроксимочевины (литалир, гидреа),
интерферон-α
3. Гливек (иматиниб)
На стадии бластного криза лечение проводится по программе
лечения острых лейкозов.
98.
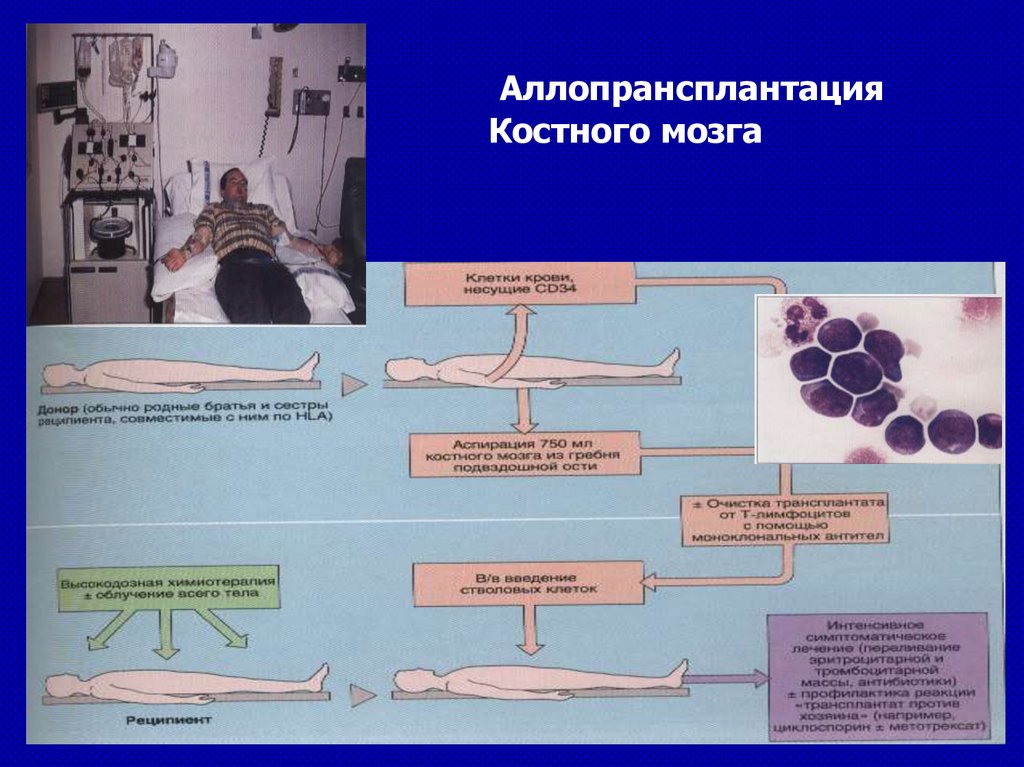
Трансплантация аллогенных стволовыхкроветворных клеток при ХМЛ
Аллогенная
миелотрансплантация в настоящее время
является единственной реальной возможностью излечить
больного ХМЛ.
После
проведения
трансплантации
HLA-совместимого
костного мозга в хронической фазе заболевания
пятилетняя безрецидивная выживаемость отмечается у 50–
70% больных.
При выполнении миелотрансплантации в более далеко
зашедших стадиях ХМЛ результаты заметно хуже (в фазе
акселерации пятилетняя безрецидивная выживаемость <
20%, при бластном кризе – < 10%).
99.
АллопрансплантацияКостного мозга
100.
Принципы лечения препаратамигидроксимочевины
Задача врача – снизить и поддерживать
уровень лейкоцитов в пределах 5–15х109/л
101.
Гливек (иматиниб)специфически ингибирует протеинкиназу,
продуцируемую химерным геном BCR-ABL, что
приводит к блокаде пролиферации и индукции апоптоза
в Ph-позитивных клетках
·
Гливек показан для лечения больных ХМЛ во
всех фазах болезни.
·
Полная или частичная цитогенетическая ремиссия
достигается у 50% больных в хронической фазе (при
резистентности к интерферону- ), 25% пациентов в
фазе акселерации и 15% – при бластном кризе
·
102.
103.
Прогноз при хроническом миелолейкозеМедиана
выживаемости
больных
ХМЛ
стандартной химиотерапии составляет 3,5–4 года.
при
Основные неблагоприятные
прогностические факторы в хронической фазе:
возраст в момент постановки диагноза > 60 лет
наличие бластных клеток в крови (> 3 %) и/или костном мозге (>
5%)
базофилия в крови (> 7 %) и/или костном мозге (> 3%)
тромбоцитоз > 700х109/л.
Развитие фазы акселерации, а тем более бластного криза резко
ухудшает прогноз
104.
Истинная полицитемия (эритремия)(болезнь Вакеза, polycythemia vera)
• - доброкачественная опухоль из
клеткипредшественницы миелопоэза, сохранившей
способность дифференцироваться по 3
росткам кроветворения, характеризующаяся
повышенной продукцией (неограниченной
пролиферацией) клеток красной крови, а также
лейкоцитов и тромбоцитов.
105.
Частота заболевания – 0,6 на 100 тыс населения.
Преимущественно болезнь людей старше 50 лет.
С одинаковой частотой болеют мужчины и женщины.
У лиц еврейской национальности заболевание встречается в 3 раза
чаще.
• Этиология болезни неясна, среди причин выделяют генетические
факторы.
• Основа патогенеза – хромосомные поломки (в 9
хромосоме), сходные во всей группе хронических
миелопролиферативных заболеваний (JAK2-мутации),
проявляющиеся мутацией гена , приводящая к
клональной пролиферации трансформированной
стволовой клетки с повышенной чувствительностью к
эритропоэтину и неконтролируемому их росту ,
вызывающие:
панмиелоз,
нарушение микроциркуляции,
тромбозы,
геморрагические осложнения.
• .
106.
Основные клинические синдромыистинной полицитемии
• 1) плеторический синдром;
• 2) генерализованный кожный зуд у 50% больных;
эритроцианоз кожи;
3) спленомегалия, особенно выраженная при
вторичном миелофиброзе;
4) тромбозы и тромбэмболии – причина летальных
исходов у 30-40% больных; раннее прогрессирование
ИБС;
5) геморрагический синдром у 30-40% больных
(наклонность к носовым кровотечениям;
кровоточивость десен на фоне лечения зубов);
6) неврологические нарушения в 50-60%
7)поражение периферических сосудов
(эритромелалгия).
107.
Плетора у больных с полицитемией108.
Окраска кожи ладоней при эритремии109.
110.
ЭритремияКожные расчесы
Вторичная
подагра
111.
• СТАДИИ ИСТИННОЙ ПОЛИЦИТЕМИИ:• 1 – начальная: умеренный эритроцитоз, панмиелоз
в костном мозге, небольшое увеличение селезенки.
Длительность – 5лет
2 – пролиферативная: выраженная плетора,
сплено- и гепатомегалия, рецидивирующие
тромбозы, тотальная гиперплазия костного мозга.
3 – анемическая: истощение больных,
нарастающая спленомегалия, нарастает
панцитопения, в костном мозге прогрессирует
постэритремический фиброз.
У 20-30% больных развивается вторичный острый
лейкоз.
Длительность жизни - 10-15 лет.
112.
Лабораторные и инструментальныеметоды
• Анализ крови: повышение гематокрита >55% у М, > 47% у Ж; Нв
> 175г/л у М, > 155 г/л у Ж, эритроцитов > 6,0 у М, >5,5
×10.12; лейкоцитоз, тромбоцитоз, снижение СОЭ
до 0 мм/час, дакриоцитоз (каплевидные эритроциты).
Повышение активности щелочной фосфатазы Н.
Увеличение концентрации витамина В12 сыворотки крови.
Миелограмма: 1) в пролиферативной стадии – гиперплазия 3
ростков кроветворения, отсутствие отложения железа, признаки
начинающегося фиброза; 2) в стадии истощения – неэффективный
гемопоэз, фиброз, скопление мегакариоцитов.
113.
Лабораторные данные (продолжение)• Трепанобиопсия (гиперклеточный костный мозг
– 60-100%, при сочетании эритроидной
гиперплазии с увеличением мегакариоцитов)
Концентрация эритропоэтина в норме.
рО2 не изменено.
Цитогенетическое исследование – наличие
«филадельфийской» хромосомы или других
хромосомных поломок (9 хромосома)
УЗИ для исключения эритропоэтинсекретирующих
опухолей.
Радиологическое исследование циркулирующей
массы эритроцитов (увеличена).
114.
Современные критерии диагностикиистинной полицитемии
• А1.Увеличение массы циркулирующих эритроцитов более чем на
25% или повышение гемоглобина более 185 г/л для мужчин и 165
г/л для женщин
А2. Отсутствие причин для вторичного эритроцитоза:
- отсутствие семейного эритроцитоза
- отсутствие повышение уровня эритропоэтина вследствие:
а) гипоксии (артериальное рО2 менее 92%);
б) неадекватной продукции опухолью
А3.Спленомегалия.
А4. Клональные цитогенетические аномалии (кроме Ph-хромосомы
или химерного гена BCR/ABL)
А5. Формирование эндогенных эритроидных колоний in vitro
115.
Критерии диагностики истиннойполицитемии (окончание)
• В1. Тромбоцитоз свыше 400 х 109/л
• В2. Количество лейкоцитов свыше 12 х 109/л
• В3. При трепанобиопсии обнаруживается
панмиелоз с
мегакариоцитарной
повышенной
эритроидной
и
пролиферацией
• В4. Низкий уровень эндогенного эритропоэтина.
• В5 Увеличение щелочной фосфатазы нейтрофилов.
Диагноз истинной полицитемии правомочен:
1) при наличии критериев А1+А2 в сочетании с любым
другим критерием категории А;
2) при наличии критериев А1+А2 в сочетании с любыми
двумя критериями категории В.
116.
117.
118.
Лечение истинной полицитемии• Начинают стационарно!!
• 1 Уменьшение объема циркулирующей крови с помощью
кровопусканий (250-500мл ч/д) 2-3 раза в неделю и
поддержание Нт на уровне 42-45%, тромбоцитов ниже 400×10.9
2 Профилактика тромбозов – назначение дезаггрегантов
(аспирин, клопидогрель, тромбо-асс, курантил)
3 При гиперурикемии назначение аллопуринола
4 При кожном зуде – антагонисты Н1-Н2рецепторов гистамина,
холестерамин, псорален
5 При необходимости проведения срочных операций –
предварительная флеботомия и эритроцитаферез
119.
Лечение истинной полицитемии• Цитостатики показаны больным пожилого возраста с
тяжелыми сердечно-сосудистыми осложнениями,
выраженной спленомегалией, лейкоцитозом выше
15000/мкл, тромбоцитозом более 1 000 000/мкл.
Используются гидроксимочевина (гидреа), интерферональфа, анагрелид (преимущественно угнетает
опухолевый рост в мегакариоцитарном ростке), имифос,
миелосан.
• Лечение радиоактивным фосфором.
120.
• Профилактика полицитемии: исключение стрессовыхнагрузок, антиаггреганты, малые дозы цитостатиков.
• Прогноз:
• продолжительность жизни при адекватном лечении
составляет 7-15 лет.
• (при отсутствии лечения – 18 месяцев).
• В 20% случаев – переход в постэритремический
миелофиброз (высвобождение тромбоцитарного
ростового фактора).
• У 20-30% больных ИП в терминальной стадии
развивается острый миелоидный лейкоз
Причины летальных исходов:
- тромбозы и тромбэмболии – 30-40%,
- геморрагические осложнения – 5-10%,
- неврологические расстройства – 60%,
- развитие вторичного острого лейкоза – 20-30%.
121.
Миеломная болезнь(болезнь Рустицкого-Калера)
122.
Миеломная болезнь –Прогрессирующее, неопластическое
заболевание с развитием
плазмоклеточных опухолей костного
мозга и гиперпродукцией
моноклонального иммуноглобулина (Ig
G, IgA, IgD, IgE) или белка БенсДжонса (свободных моноклональных
легких цепей).
123.
Эпидемиология миеломы:Проявляется обычно у людей после 40 лет.
Случаи заболевания в возрасте до 40 лет редки.
Частота миеломной болезни составляет 3 на 100000
населения в год.
Продолжительность жизни зависит от злокачественности
течения заболевания и в среднем составляет около 8 лет.
Этиология:
У 1/3 больных найдены хромосомные нарушения:
анеуплоидия в хромососмах 3,5,7,11,13,19,21,Х,
транслокация (11,14)(q13;q32)-основная наиболее
специфичная хромосомная аномалия. У больных с
аномальным кариотипом прогноз хуже, чем у больных с
нормальным кариотипом.
124.
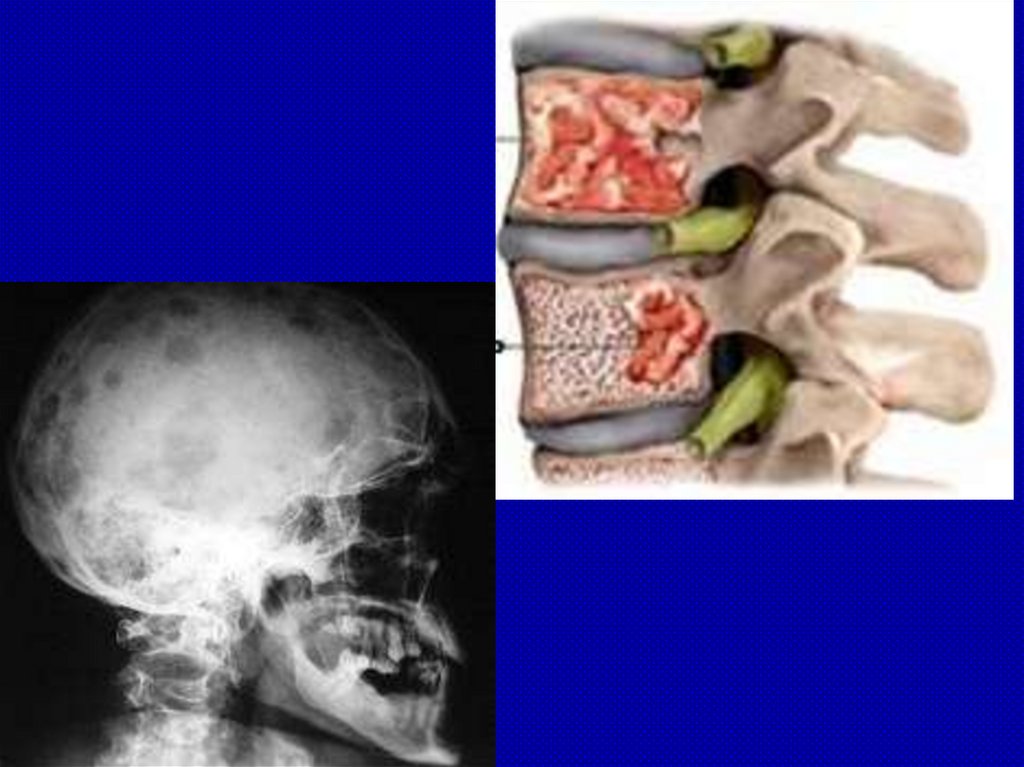
Клиническая картина: ПОРАЖЕНИЕ КОСТЕЙРазрушение кости при миеломе обусловлено пролиферацией
опухолевого клона и активацией остеокластов.
При диффузном разрастании опухолевой кроветворной ткани
наблюдается остеолизис и остеопороз – образование
гладкостенных, как бы штампованных дефектов и
развитие патологических переломов.
Опухолевые инфильтраты (экстрамедуллярные очаги) чаще
появляются в плоских костях (ребра, кости черепа),
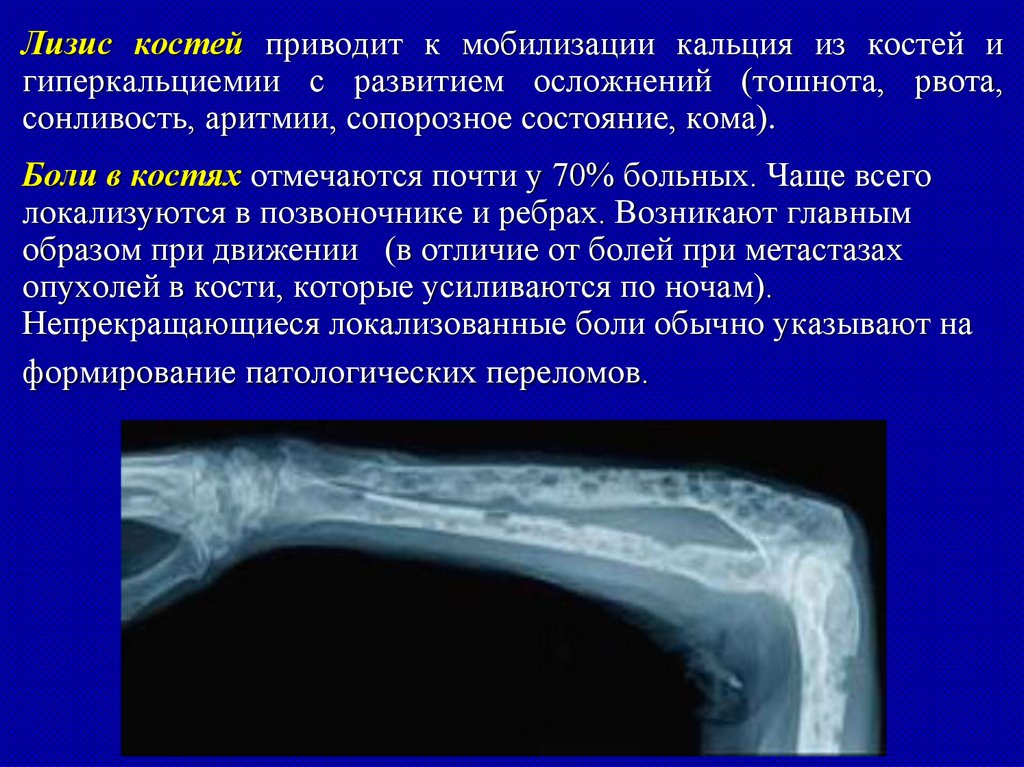
позвоночнике, реже – в трубчатых костях (плечевая,
бедренная кость). Тела позвонков уплощаются,
приобретают форму рыбьих позвонков, рост больного
уменьшается. Оседание позвонков обусловливает
появление признаков компрессии спинного мозга.
Опухолевые пролифераты могут пальпироваться.
125.
Лизис костей приводит к мобилизации кальция из костей игиперкальциемии с развитием осложнений (тошнота, рвота,
сонливость, аритмии, сопорозное состояние, кома).
Боли в костях отмечаются почти у 70% больных. Чаще всего
локализуются в позвоночнике и ребрах. Возникают главным
образом при движении (в отличие от болей при метастазах
опухолей в кости, которые усиливаются по ночам).
Непрекращающиеся локализованные боли обычно указывают на
формирование патологических переломов.
126.
127.
ПОРАЖЕНИЕ ПОЧЕК•Миеломная нефропатия. В основе лежит избыточное
накопление в канальцах и в строме мозгового, а затем и
коркового вещества парапротеина Бенс-Джонса, ведущее к
нефросклерозу. Такие почки получили название “миеломные
сморщенные почки.
•Нарушение функции канальцев проявляется в виде:
нарушение реабсорбции электролитов, глюкозы, аминокислот
, диспротеинурия
•Канальцевая протеинурия, характеризующаяся снижением
реабсорбции
незначительного
количества
белка,
профильтрованного нормальными клубочками и почти весь
теряемый через почку белок представлен легкими цепями
иммуноглобулинов.
•Следствием
гиперкальциемии
нефрокальцинатов.
может
быть
появление
128.
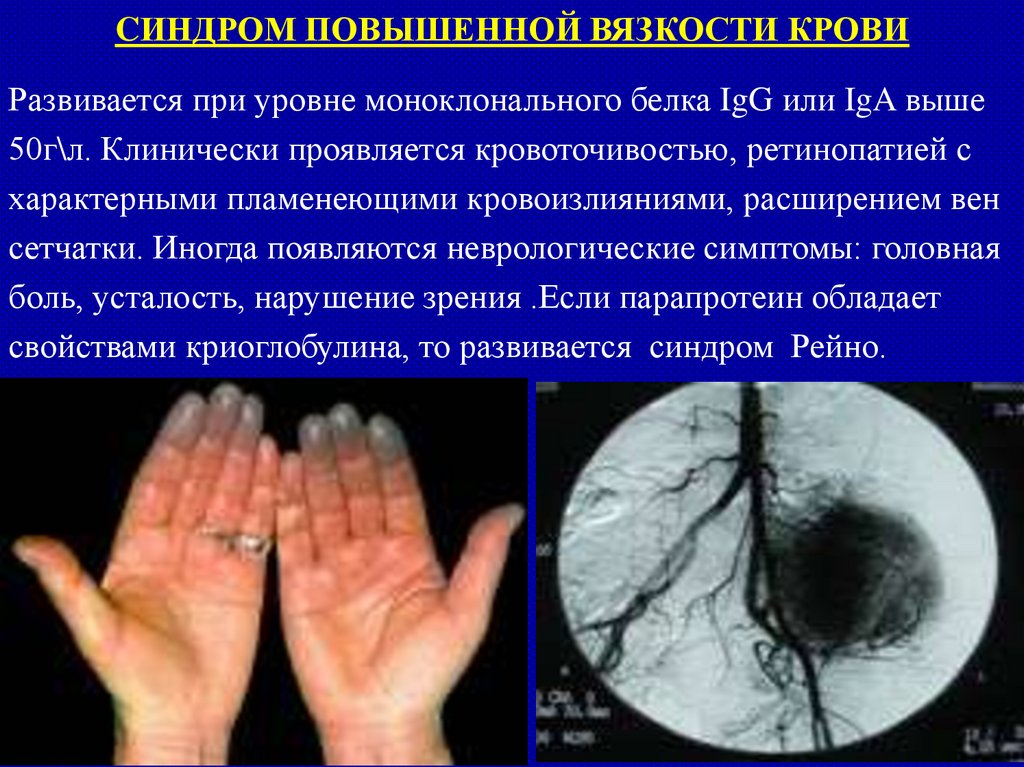
CИНДРОМ ПОВЫШЕННОЙ ВЯЗКОСТИ КРОВИРазвивается при уровне моноклонального белка IgG или IgA выше
50г\л. Клинически проявляется кровоточивостью, ретинопатией с
характерными пламенеющими кровоизлияниями, расширением вен
сетчатки. Иногда появляются неврологические симптомы: головная
боль, усталость, нарушение зрения .Если парапротеин обладает
свойствами криоглобулина, то развивается синдром Рейно.
129.
НАРУШЕНИЕ ИММУНИТЕТАВысокая частота бактериальных инфекций в связи с
гипогаммаглобулинемией, снижением продукции
нормальных антител.
АНЕМИЯ НОРМОЦИТАРНАЯ НОРМОХРОМНАЯ
Развитию способствуют: укорочение продолжительности
жизни эритроцитов, дефицит Fe вследствие повышенной
кровоточивости при синдроме гипервязкости.
130.
Диагностика миеломной болезниКлассической триадой симптомов миеломной болезни является
1. плазмоцитоз костного мозга (более 10%)
2. сывороточный или мочевой М-компонент
3. остеолитические повреждения и (или) диффузный
остеопороз.
Диагноз можно считать достоверным при выявлении двух
первых признаков.
Клинический анализ периферической крови: резкое и
стабильное увеличение СОЭ (до 80 – 90 мм/ч) , анемия
нормохромного типа, возможна лейкопения (нейтропения),
иногда в крови можно выявить миеломные клетки.
131.
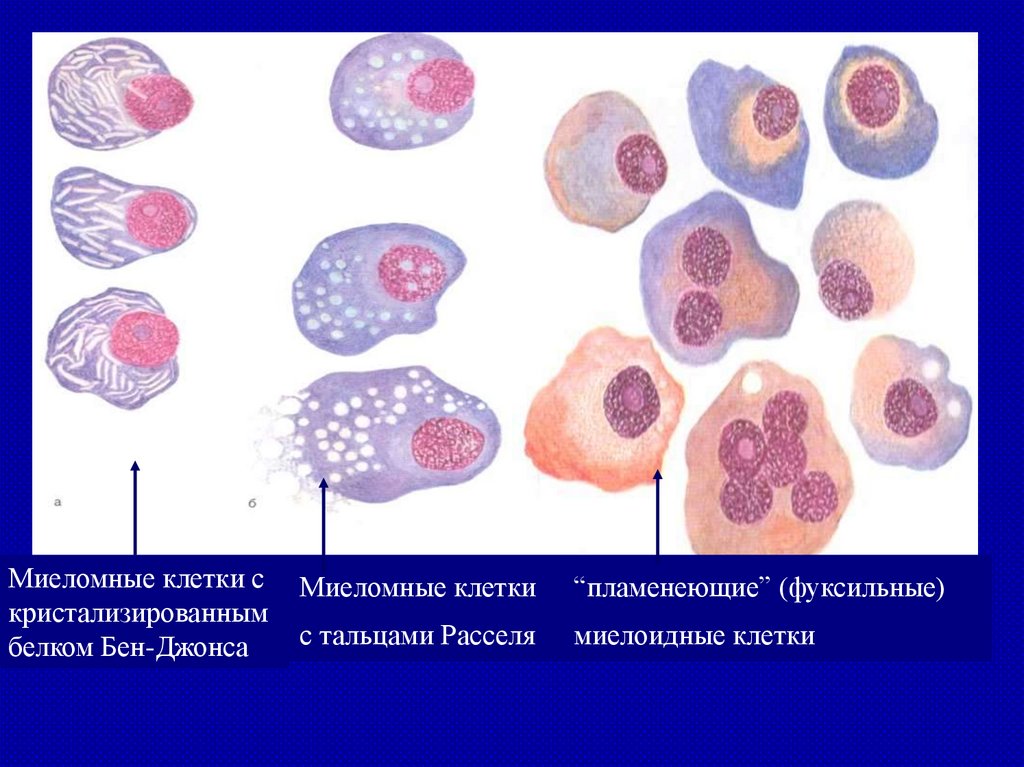
Миеломные клетки скристализированным
белком Бен-Джонса
Миеломные клетки
“пламенеющие” (фуксильные)
с тальцами Расселя
миелоидные клетки
132.
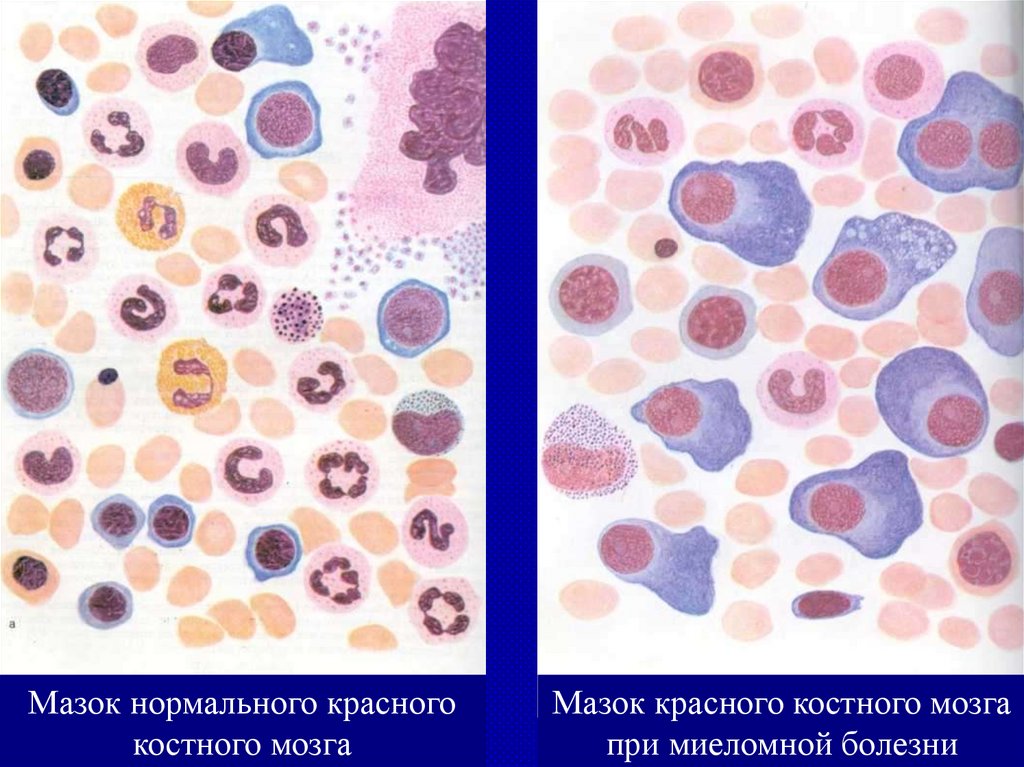
Мазок нормального красногокостного мозга
Мазок красного костного мозга
при миеломной болезни
133.
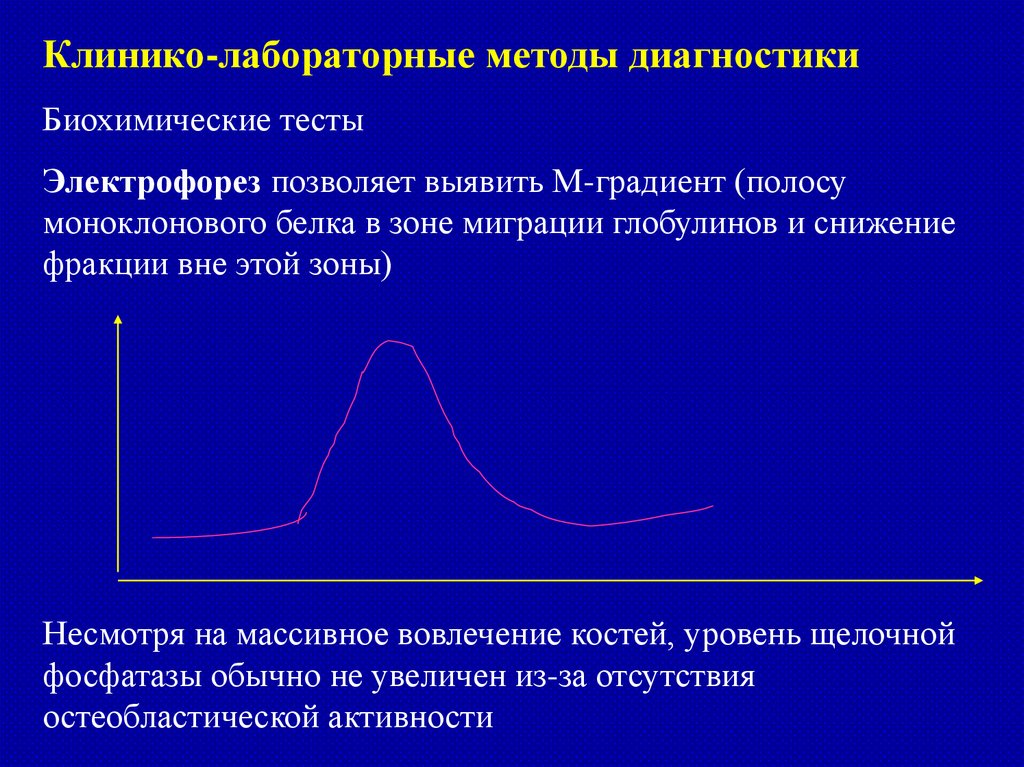
Клинико-лабораторные методы диагностикиБиохимические тесты
Электрофорез позволяет выявить М-градиент (полосу
моноклонового белка в зоне миграции глобулинов и снижение
фракции вне этой зоны)
Несмотря на массивное вовлечение костей, уровень щелочной
фосфатазы обычно не увеличен из-за отсутствия
остеобластической активности
134.
Лечение миеломной болезниВыбор лечения и его объем
(распространенности) процесса.
зависят
от
стадии
1.
У 10 % больных миеломой наблюдается медленное
прогрессирование болезни в течение многих лет, редко
требующее противоопухолевой терапии.
2.
У больных с солитарной миеломой эффективна лучевая
локальная терапия.
3.
У больных с начальными стадиями рекомендуется
выжидательная тактика, так как у части из них возможна
медленно развивающаяся форма болезни.
135.
Показанием для назначения лечения являютсяпризнаки прогрессирования заболевания:
отрицательная динамика показателей при повторных
исследованиях с интервалом 2 -4 недели
нарастает общий белок крови за счет нарастания
моноклонального белка (на 25%), а в моче более 2г в сутки.
увеличение количества плазматических клеток в костном
мозге,
нарастание остеодеструктивного синдрома.
136.
Этапы лечения множественной миеломы:I
Индукция ремиссии
II Период консолидации
III Поддерживающее лечение
IV Терапия в периоде рецидива
V Терапия резистентных и быстропрогрессирующих
форм множественной миеломы.
Лечение множественной миеломы:
Для индукции ремиссии используется химотерапия, которая
направлена на максимальное снижение массы опухолевых
клеток в организме больного вплоть до полной эррадикации
патологического клона. Химиотерапия всегда назначается во
2-3 стадии заболевания.
137.
Золотым стандартом является терапияалкилирующим препаратом мелфалан+преднизолон.
В режиме: мелфалан 0,25мг/кг внутрь натощак ежедневно 4 дня,
преднизолон 1-2 мг /кг внутрь после едыв течение 4 дней. Интервал
между курсами 4-6 недель. До достижения ремиссии необходимо
минимум 6-12 курсов. После достижения ремиссии проводят лечение
еще 4-6 мес (поддерживащая ХТ - увеличивает длительность первой
ремиссии, и кроме того, увеличивает риск развития лейкоза).
Если не эффективно это сочетание, то увеличивают дозу гормона
(преднизолона или дексаметазона), используют в комбинации с
цитостатиками - винкристин, рубомицин, циклофосфан.
Введение новых цитостатиков и наращивание доз гормонов
существенно не увеличивают выживаемость больных, поэтому
последнее десятилетие в лечении таких пациентов стали применять
высокие дозы цитостатиков под защитой трансплантации стволовых
клеток (ауто и аллотрансплантация). У части больных достигается
хороший эффект.




































































































 medicine
medicine