Similar presentations:
Катализ. Лекция 1
1.
ЛЕКЦИЯ 1. Содержание лекционного курсаI.
Исторические корни катализа и его феноменология.
Основные стадии каталитической реакции.
II. Роль катализа в становлении и развитии современной промышленности.
Катализ в решении проблем энергетики.
Катализ в решении проблем экологии.
III. Катализ кислотами и основаниями.
IV. Катализ металлами.
V. Типичная структура и технологическая схема нефтепереработки. Типичный
состав катализаторов нефтепереработки.
Каталитический крекинг.
VI. Процессы гидрообессеривания.
Каталитический риформинг.
VII. Изомеризация.
Алкилирование.
VIII. Процессы селективного гидрирования.
Синтез Фишера-Тропша.
IX. Каталитическая полимеризация олефинов.
Процессы полного и парциального окисления.
Катализ в нефтепереработке
1
2.
ЛЕКЦИЯ 1. Рекомендуемая литератураКниги
Периодические издания
• Чоркендорф И., Наймантсведрайт Х. Современный
катализ и химическая кинетика. М.: Интеллект,
2010
• Крылов О.В. Гетерогенный катализ. М.:
Академкнига. 2004
• Кузнецов В.И. Развитие учения о катализе.
М.:Наука. 1964
• Боресков Г.К. Катализ. Ч.1,2, Новосибирск, 1971
• Сетерфилд Ч. Практический курс гетерогенного
катализа, М.: Мир, 1984
• Панченков Г.М., Лебедев В.П. Химическая
кинетика и катализ. М.: Химия 1974
• Мастерс К. Гомогенный катализ переходными
металлами. М.: Мир, 1983
• Томас Ч.Л. Промышленные каталитические
процессы и эффективные катализаторы. М.: Мир,
1973
• Lloyd L. Handbook of Industrial Catalysts. Springer.
2011
• Серия «Промышленный катализ в лекциях». –
Калвис. 2006
Прикладная химия – М.: Наука
Кинетика и катализ – М.: Наука
Катализ в промышленности – М.: КАЛВИС
Технологии нефти и газа – М.: РГУ нефти и газа
им. И. М. Губкина
Нефтепереработка и нефтехимия – М.:
ЦНИИТЭНефтехим
Переработка и нефти – М.: ЦНИИТЭНефтехим.
Мир нефтепродуктов – ТЕХИНФОРМ.
Нефтегазовые технологии – Топливо и
энергетика.
Химия и технология топлив и масел. М.: Нефть и
газ.
Нефтехимия. М.: Наука
Applied Catalysis – Elsevier
Catalysis Letters – Springer
Journal of Catalysis – Amsterdam: Elsevier
Catalysis Review – Marcel Dekker Inc.
Petroleum Technology Quarterly – Crambeth Allen
Publ.
Oil and Gas Journal – Penn Well Corp.
Катализ в нефтепереработке
2
3.
ЛЕКЦИЯ 1. Исторические корни катализа.1480 год – Первая документированная дата о
«необычном» явлении. 1552 год:
" Купоросное
Спирт
Эфир
масло "
1669 год – Иоганн Иоахим Бехер (1635 – 1685 гг.):
• К началу XIX века " Купоросное
Спирт
" Маслородныйданные
газ "
" Масло "
масло
накопились
о"
существовании обширной
группы аномальных
1759 год – Карл-Вильгельм
Шееле (1742-1786 гг.):
реакций,
Глиняная
Спирт Уксусхарактеризующихся
Фруктовая эссенция
трубка
внестехиометрическим
1793 – Никола Клеман
(1779-1841реагентов.
гг.) и Шарль
соотношением
Глиняная
трубка
Дезорм (1777-1862 гг.):
" Красный
Сера Воздух Вода
" Купоросное масло "
оксид азота "
Катализ в нефтепереработке
3
4.
ЛЕКЦИЯ 1. Исторические корни катализа.1806 – Никола Клеман (1779-1841 гг.) и Шарль Дезорм (1777-1862 гг.):
NO2
2SO2 O2
2SO3
1811 – Константин Готлиб Сигизмундович Кирхгоф (1764-1823 гг.):
H 2 SO4
Крахмал
Сахар
Две эти работы имели огромное прикладное значение! Именно они
инициировали поиск веществ, стимулирующих превращения химических
соединений в реакциях с внестехиометрическим соотношением
реагентов.
Катализ в нефтепереработке
4
5.
ЛЕКЦИЯ 1. Исторические корни катализа.• 1813 год – Луи Тенар и Гемфри Дэви :
Fe , Cu , Ag , Pt
2 NH 3
N 2 3H 2
Гемфри Дэви (1778-1829 гг.)
• 1817 год – Гемфри Дэви:
Pt , воздух
CH 3CH 2OH
горение
Все– Луи
этиТенар:
открытия вызвали
• 1818•год
Луи Тенар (1777-1857 гг.)
Иоганн Вольфганг
Деберейнер (1780-1849 гг.)
потокFe,исследований
Cu , Ag , Pt , Pd , Rh
2 H 2O2
2 H 2O O2
каталитических явлений,
1821 год
– Иоганн Вольфганг
обусловленный
ихДеберейнер:
большим
Pt , воздух
CH 3практическим,
CH 2OH
техническим
CH 3COOH
и экономическим значением.
1822 год – Иоганн Вольфганг Дёберейнер:
Pt
2SO2 O2
2SO3
Катализ в нефтепереработке
5
6.
ЛЕКЦИЯ 1. Становление теории катализа.Эйльхард Альфред Митчерлих (1794 – 1863 гг.)
в 1833 году вводит понятие «контактной
реакции»
Йенс Якоб Берцелиус (1779 – 1848 гг.) в 1835
году предлагает новое слово catalysis, от
греческого καταλψσισ – разрушение.
Катализ в нефтепереработке
6
7.
ЛЕКЦИЯ 1. Определение катализа.Георгий Константинович Боресков
(1907-1984 гг.):
«Феноменологически катализ можно
определить как возбуждение
химических реакций или изменение их
скорости под влиянием веществ –
катализаторов, многократно
вступающих в промежуточное
химическое взаимодействие с
участниками реакции и
восстанавливающих после каждого
цикла промежуточных взаимодействий
свой состав».
1962 г.
Катализ в нефтепереработке
7
8.
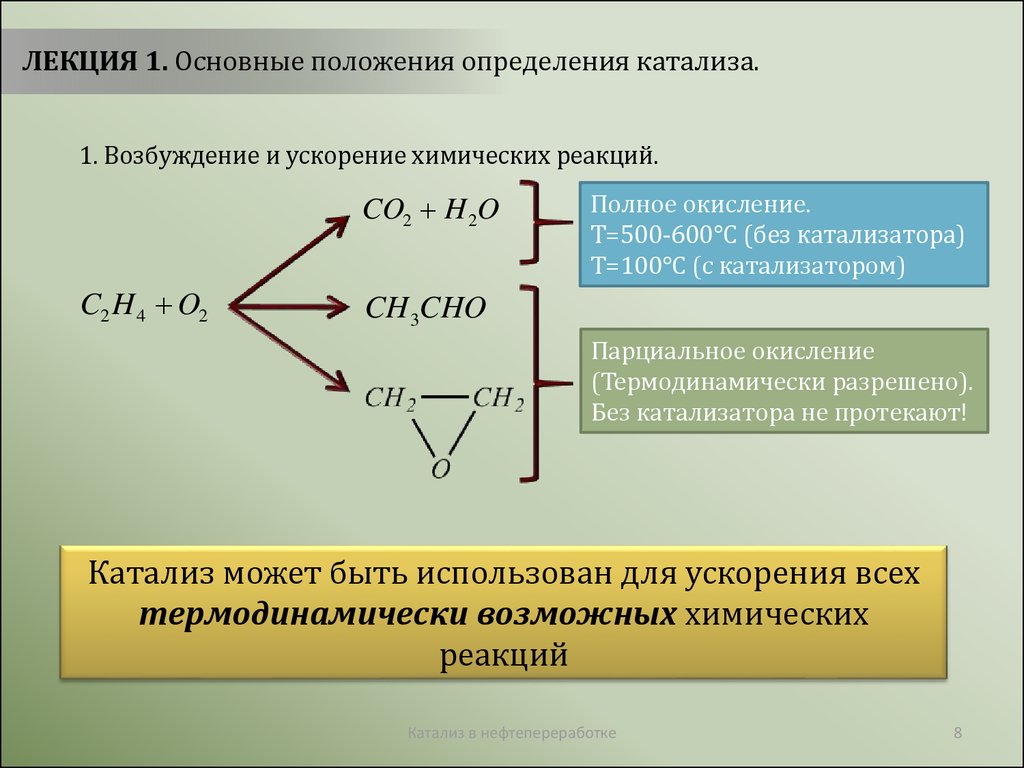
ЛЕКЦИЯ 1. Основные положения определения катализа.1. Возбуждение и ускорение химических реакций.
CO2 H 2O
C2 H 4 O2
Полное окисление.
Т=500-600°С (без катализатора)
Т=100°С (с катализатором)
CH 3CHO
Парциальное окисление
(Термодинамически разрешено).
Без катализатора не протекают!
Катализ может быть использован для ускорения всех
термодинамически возможных химических
реакций
Катализ в нефтепереработке
8
9.
ЛЕКЦИЯ 1. Основные положения определения катализа.2. Промежуточное химическое взаимодействие.
Катализ – явление химическое (в более полной форме – физико-химическое), но
не физическое!
3. Катализатор не расходуется в процессе реакции.
Это свойство отличает катализатор от инициатора. Катализатор не вносит свою
свободную энергию в химическую систему.
4. Катализатор может изменяться в ходе реакции.
При этом изменение свободной энергии при изменении катализатора не
является вкладом в свободную энергию реакции, а эти изменения – следствие
побочных процессов, не связанных с каталитическим действием.
Катализ в нефтепереработке
9
10.
ЛЕКЦИЯ 1. Основные положения определения катализа.5. Малое количество катализатора может преобразовать
громадные количества вещества.
Соотношения количества превращенного вещества к количеству
катализатора (фактор использования катализатора) в известных в
настоящее время примерах может достигать миллионов.
6. Катализатор не смещает термодинамическое равновесие
химической реакции.
Задача поиска катализатора для термодинамически запрещенного процесса
– бессмысленна!
Катализ в нефтепереработке
10
11.
ЛЕКЦИЯ 1. Катализатор.Катализатор – вещество (индивидуальное химическое соединение
или их смесь), присутствие которого в смеси реагентов приводит к
возбуждению или существенному ускорению термодинамически
разрешенной химической реакции между реагентами, в ходе
которой это вещество не расходуется.
Каталитическая активность не может рассматриваться как
некоторое универсальное свойство вещества, то есть нельзя
сказать, что одни вещества могут быть катализатором, а
другие нет.
Катализ в нефтепереработке
11
12.
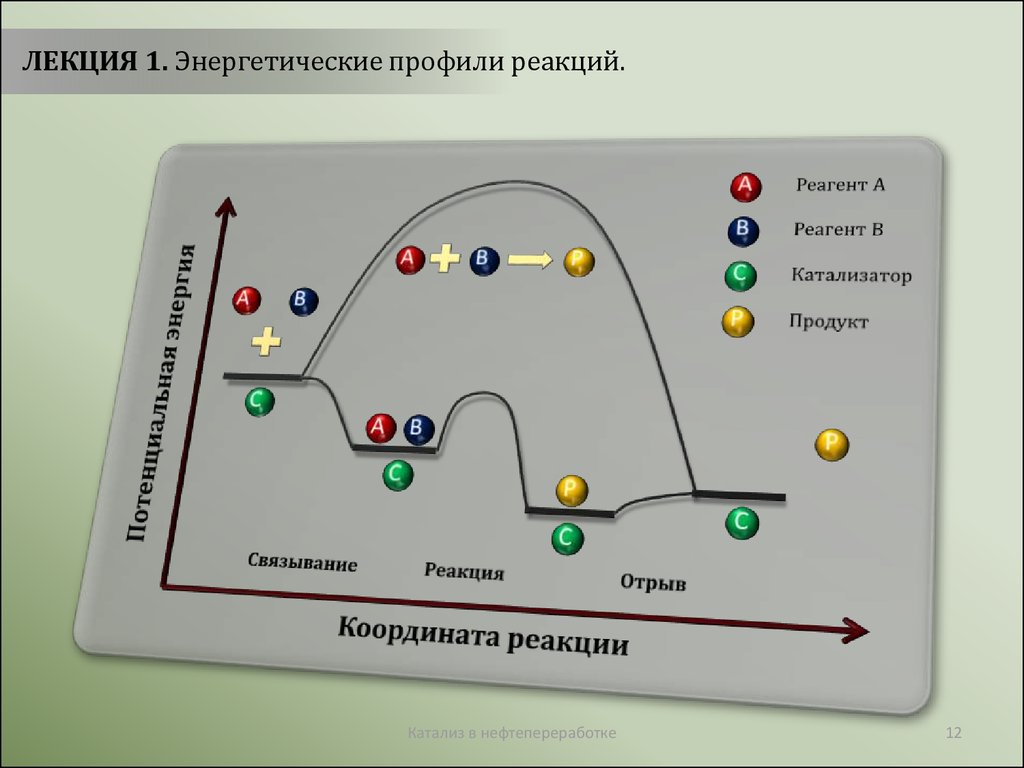
ЛЕКЦИЯ 1. Энергетические профили реакций.Катализ в нефтепереработке
12
13.
ЛЕКЦИЯ 1. Активный центр катализатора.Активный центр катализатора – это химическое соединение
(изолированное или агрегированное с другими молекулами или
атомами), имеющее состав и структуру, обеспечивающие его реакционную
способность в образовании промежуточных веществ (интермедиатов),
необходимых для превращения субстратов в продукты.
Выявление природы (состава и строения) активных центров
и разработка методов их получения является одной из
главных задач науки о катализе.
Катализ в нефтепереработке
13
14.
ЛЕКЦИЯ 1. Классификация катализаторов.1. Катализатор может быть как индивидуальным веществом, так и
смесью веществ.
однокомпонентные: металлы, окислы, сульфиды, кислоты
Ptчернь, Al2O3, H2SO4.
многокомпонентные: сплавы, смешанные оксиды и т.д.
Катализатор синтеза аммиака: Fe - 80%, FeO - 14%,Fe2O3 - 1%,
Al2O3 - 1%, K2O - 4%, CaO, SiO2, MgO.
2. Катализатор может находиться в различных агрегатных
состояниях.
газ (NO)
жидкость (раствор Со2(СО)8 в пентане)
аморфное тело (силикагель)
кристаллы (цеолит)
Катализ в нефтепереработке
14
15.
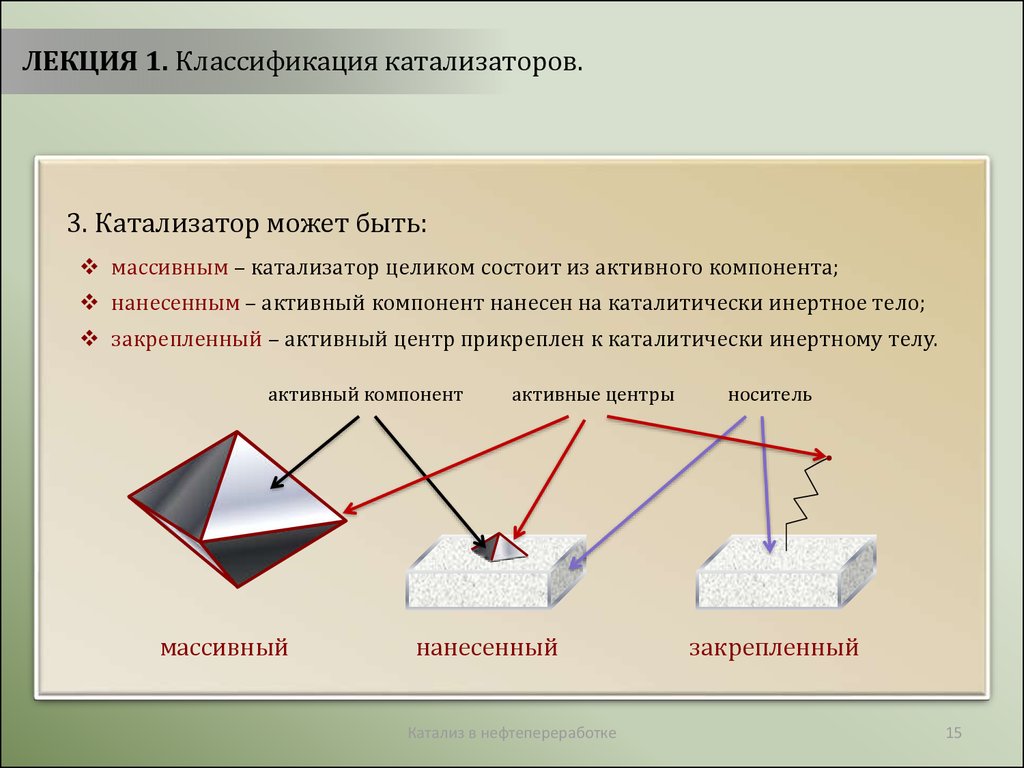
ЛЕКЦИЯ 1. Классификация катализаторов.3. Катализатор может быть:
массивным – катализатор целиком состоит из активного компонента;
нанесенным – активный компонент нанесен на каталитически инертное тело;
закрепленный – активный центр прикреплен к каталитически инертному телу.
активный компонент
массивный
активные центры
нанесенный
Катализ в нефтепереработке
носитель
закрепленный
15
16.
ЛЕКЦИЯ 1. Типы каталитических систем.Фазовое состояние
Реагенты
Катализатор
Примеры
Гомогенный катализ
газ
газ
жидкость*
жидкость*
CH3OH
газ**
жидкость
C2H4
твердое тело**
жидкость
PhC CPh
SO2
[NO]
O2
H2SO4
PdCl2
HOR
CoBr2
SO3
CH3OCH3
C2H3OR
PhC
O
H
Гетерогенный катализ
*
газ
жидкость
газ
твердое тело
жидкость
жидкость
жидкость
твердое тело
HCOOH
газ+жидкость
твердое тело
PhNO2+H2
C2H4+CO+H2 HRh(CO)L2
C2H4+H2
Pt
C3H7COH
C2H6
+
RCl2+NaJ
Fe 3
Rh
Pd
RJ+NaCl
CO2+H2
PhNH2+H2O
Смешивающиеся жидкости
Хорошо растворимы в жидкости
**
Катализ в нефтепереработке
16
17.
ЛЕКЦИЯ 1. Типы каталитических систем.Ферментативный катализ
Ферментативные системы, созданные природой,
являются вызовом для современной науки о катализе.
Катализ в нефтепереработке
17
18.
ЛЕКЦИЯ 1. Стадии каталитической реакции.1. Координация (адсорбция) исходных реагентов на
активном центре;
2. Активация субстратов и образование ими
химического соединения с катализатором;
3. Внутримолекулярная перегрупперовка химически
связанного вещества;
4. Диссоциация (десорбция) продуктов реакции с
активного центра.
Катализ в нефтепереработке
18
19.
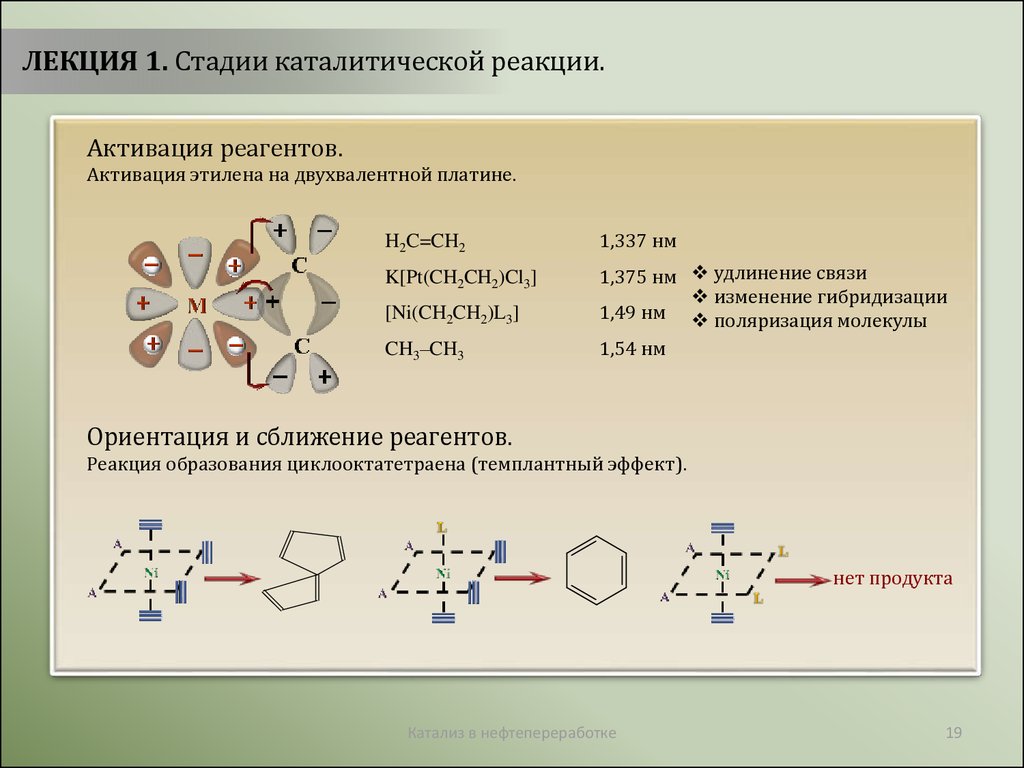
ЛЕКЦИЯ 1. Стадии каталитической реакции.Активация реагентов.
Активация этилена на двухвалентной платине.
H2C=CH2
1,337 нм
K[Pt(CH2CH2)Cl3]
1,375 нм удлинение связи
изменение гибридизации
1,49 нм поляризация молекулы
1,54 нм
[Ni(CH2CH2)L3]
CH3–CH3
Ориентация и сближение реагентов.
Реакция образования циклооктатетраена (темплантный эффект).
нет продукта
Катализ в нефтепереработке
19
20.
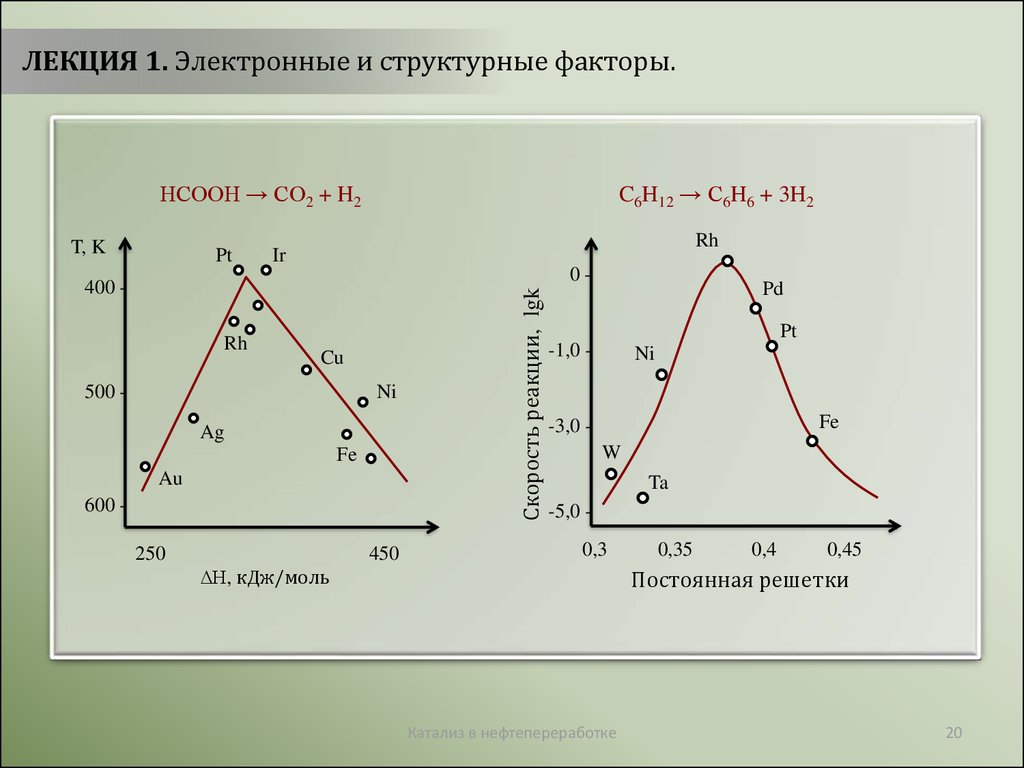
ЛЕКЦИЯ 1. Электронные и структурные факторы.HCOOH → CO2 + H2
T, K
Pt
C6H12 → C6H6 + 3H2
Rh
Ir
Rh
Cu
500 -
Ni
Ag
Fe
Au
600 250
450
Скорость реакции, lgk
0-
400 -
Pd
Pt
-1,0 -
Ni
Fe
-3,0 W
Ta
-5,0 0,3
∆H, кДж/моль
0,35
0,4
0,45
Постоянная решетки
Катализ в нефтепереработке
20
21.
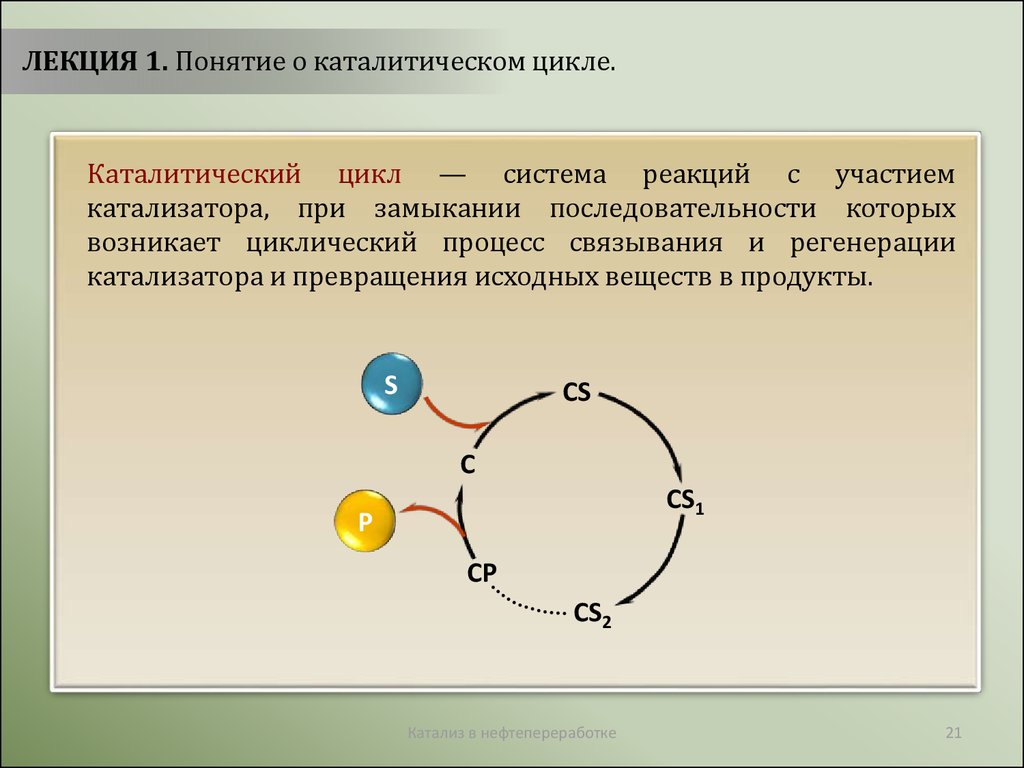
ЛЕКЦИЯ 1. Понятие о каталитическом цикле.Каталитический цикл — система реакций с участием
катализатора, при замыкании последовательности которых
возникает циклический процесс связывания и регенерации
катализатора и превращения исходных веществ в продукты.
S
CS
C
CS1
P
CP
CS2
Катализ в нефтепереработке
21
22.
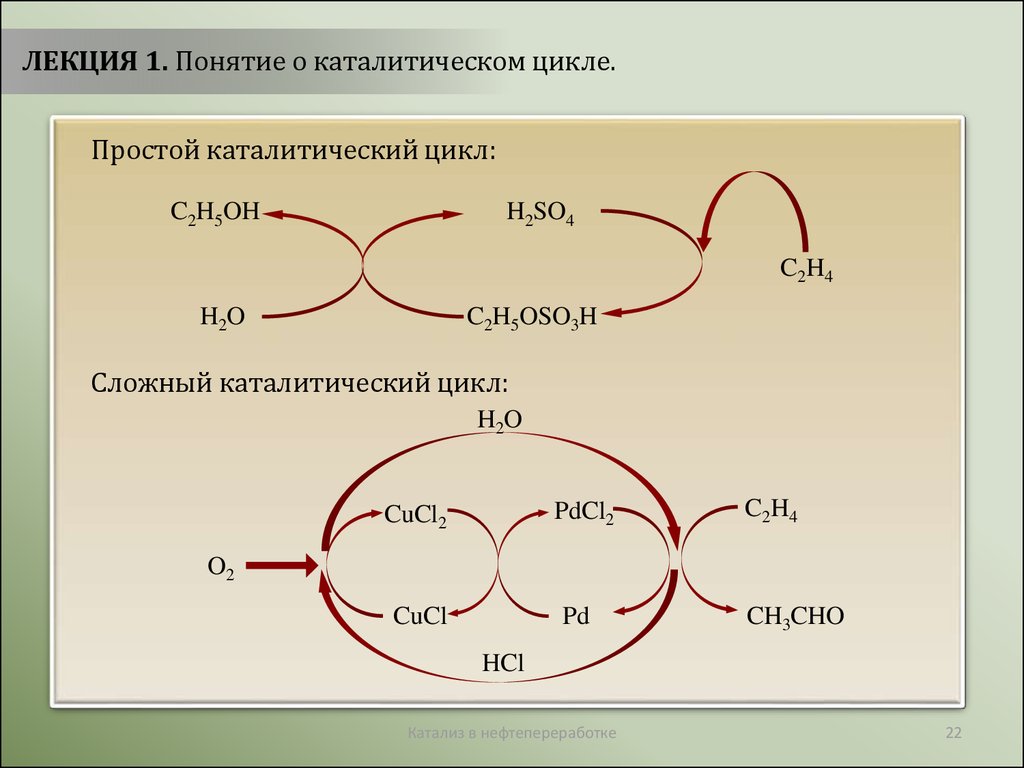
ЛЕКЦИЯ 1. Понятие о каталитическом цикле.Простой каталитический цикл:
C2H5OH
H2SO4
C2H4
H2O
C2H5OSO3H
Сложный каталитический цикл:
H2O
PdCl2
CuCl2
C2H4
O2
CuCl
Pd
CH3CHO
HCl
Катализ в нефтепереработке
22
23.
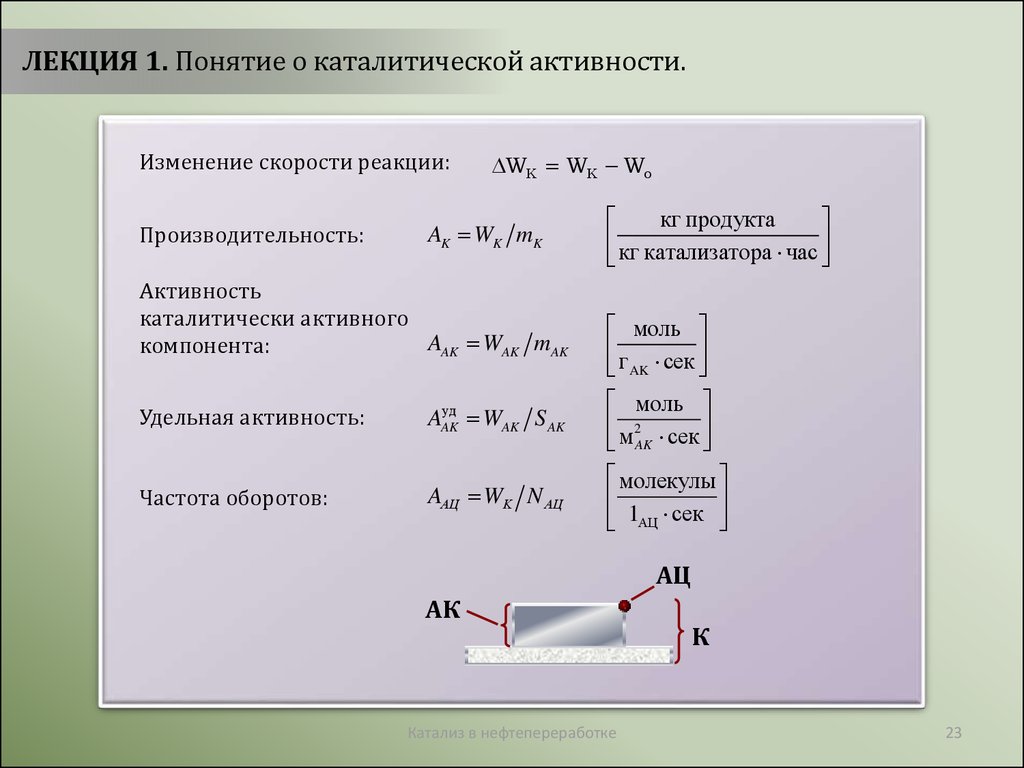
ЛЕКЦИЯ 1. Понятие о каталитической активности.Изменение скорости реакции:
Производительность:
WK WK Wo
AK WK mK
Активность
каталитически активного
AAK WAK mAK
компонента:
Удельная активность:
уд
AAK
WAK S AK
Частота оборотов:
AАЦ WK N АЦ
кг продукта
кг катализатора час
моль
г AK сек
моль
2
м
сек
AK
молекулы
1АЦ сек
АЦ
АК
Катализ в нефтепереработке
К
23
24.
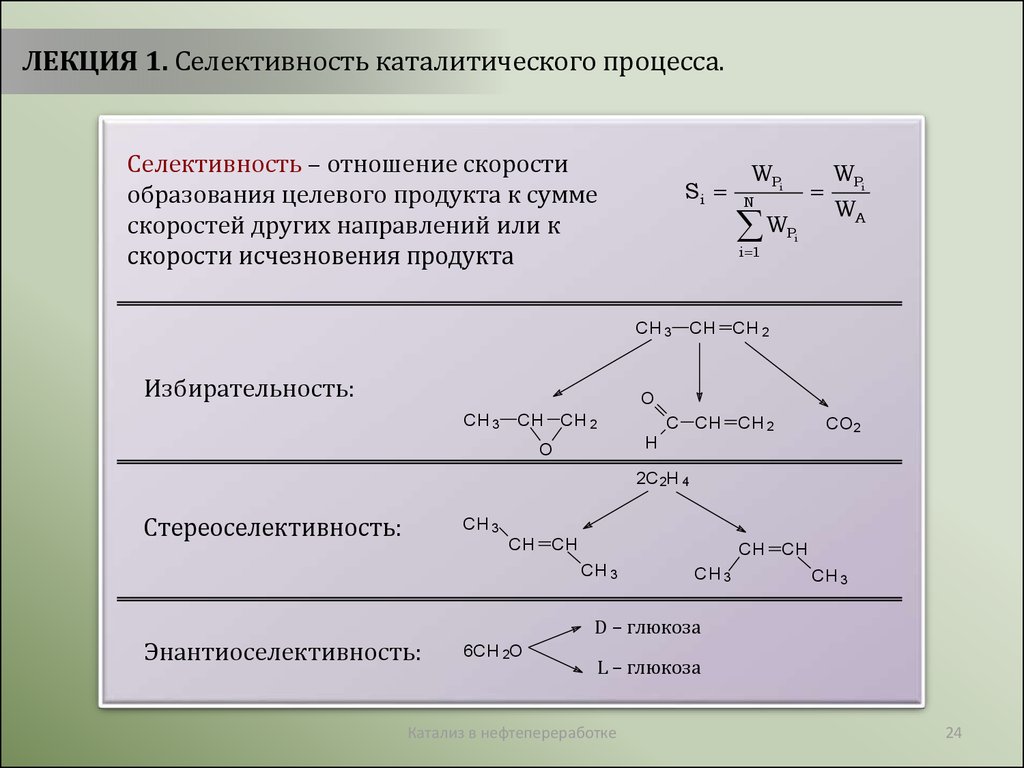
ЛЕКЦИЯ 1. Селективность каталитического процесса.Селективность – отношение скорости
образования целевого продукта к сумме
скоростей других направлений или к
скорости исчезновения продукта
Si
N
W
i 1
CH 3
Избирательность:
WPi
Pi
WPi
WA
CH CH 2
O
CH 3
CH CH 2
C CH CH 2
CO2
H
O
2C 2H 4
Стереоселективность:
CH 3
CH CH
CH CH
CH 3
Энантиоселективность:
CH 3
CH 3
D-ãëþêîçà
D – глюкоза
6CH 2O
L – глюкоза
L-ãëþêîçà
Катализ в нефтепереработке
24















 chemistry
chemistry








