Similar presentations:
Строение атома. Связь между электронами и спектральными линиям
1.
Строение атом. Связь междуэлектронами и спектральными
линиями
1. Модели строения атома.
2. Атомные спектры.
3. Связь между спектральными
линиями и энергиями
электронов.
2.
Модели строения атомаК концу XIX в. были накоплены сведения, подтверждающие
сложное строение атома.
В тот период был выдвинут целый ряд моделей строения
атома. Одна из первых моделей была предложена Джозефом
Томсоном в 1903 г. Томсоновская модель «сливового пудинга»
(в русском литературном переводе – «булочка с изюмом»)
уподобляла атом положительно заряженному сферическому
пудингу, в который вкраплены отрицательно заряженные
шарики
–
электроны
(рис.
1).
Рис. 1. Модель атома в виде «булочки с
изюмом» (Дж.Томсон, 1903 г.)
3.
Модели строения атомаВ жизни часто случается, что ученики продолжают путь, начатый
учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест
Резерфорд на основе данных подготовленного и проведенного им
эксперимента сделал вывод, что в атоме положительный заряд
сконцентрирован в малом объеме.
Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г.
они проводили эксперименты, в которых бомбардировали тонкие листы
золотой фольги пучком -частиц (ядер атомов гелия) (рис. 1.2). Толщина
золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе
эксперимента было обнаружено, что подавляющее большинство -частиц
совершенно свободно проходило через фольгу, причем некоторые из них
лишь незначительно отклонялись от первоначального направления. Однако
примерно одна из 10 000–100 000 частиц резко изменяла свое направление
на противоположное.
4.
Модели строения атомаВ жизни часто случается, что ученики продолжают путь, начатый
учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест
Резерфорд на основе данных подготовленного и проведенного им
эксперимента сделал вывод, что в атоме положительный заряд
сконцентрирован в малом объеме.
Ханс Гейгер и Эрнест Марсден были студентами Резерфорда. В 1910 г.
они проводили эксперименты, в которых бомбардировали тонкие листы
золотой фольги пучком α -частиц (ядер атомов гелия) (рис. 1.2). Толщина
золотой фольги варьировалась от 1000 до 10 000 атомов. В ходе
эксперимента было обнаружено, что подавляющее большинство α-частиц
совершенно свободно проходило через фольгу, причем некоторые из них
лишь незначительно отклонялись от первоначального направления. Однако
примерно одна из 10 000–100 000 частиц резко изменяла свое направление
на противоположное.
Рис. 2. Эксперимент Х. Гейгера и
Э. Марсдена
5.
Модели строения атомаЭто наблюдение заставило Резерфорда выдвинуть новую модель атома,
согласно которой положительно заряженное ядро окружено электронами
(рис. 3).
Рис. 3. Модель атома с положительно заряженным ядром
и вращающимися вокруг него электронами (Э.Резерфорд,
1911 г.)
Рассчитанный на основе данных проведенного эксперимента размер ядра атома
оказался примерно в 100 000 раз меньше размера самого атома. К примеру, если бы
диаметр ядра составлял 1 см, то диаметр атома был бы 1 км. И в этой малой части
пространства, занимаемого ядром, сосредоточено более 99,9% массы атома.
После этого Резерфорд предсказал существование протона и показал, что его масса
более чем в 1800 раз должна превышать массу электрона. Существование нейтрона
было предсказано Резерфордом в 1920 г. Экспериментально нейтрон был обнаружен в
1932 г.
Началом современной теории электронного строения атомов послужила его
планетарная квантовая модель, которую в 1913 г. выдвинул Нильс Бор. Обоснованием
этой и более поздних моделей атома служат главным образом три источника данных:
атомные спектры, энергии ионизации атомов, сродство атомов к электрону.
6.
Атомные спектрыВсякий спектр представляет собой развертку (разложение) излучения на
его составляющие. Для получения и измерения спектров используется
специальный прибор – спектрометр. На рис. 4 изображен полный спектр
электромагнитного излучения.
Видимый свет составляет только небольшую часть всего спектра
электромагнитного излучения и является примером непрерывного
(сплошного) излучения. В непрерывном излучении содержатся все длины
волн в пределах некоторого диапазона. Примером непрерывного спектра
может служить известное всем природное явление – радуга.
Рис. 4. Спектр электромагнитного излучения
7.
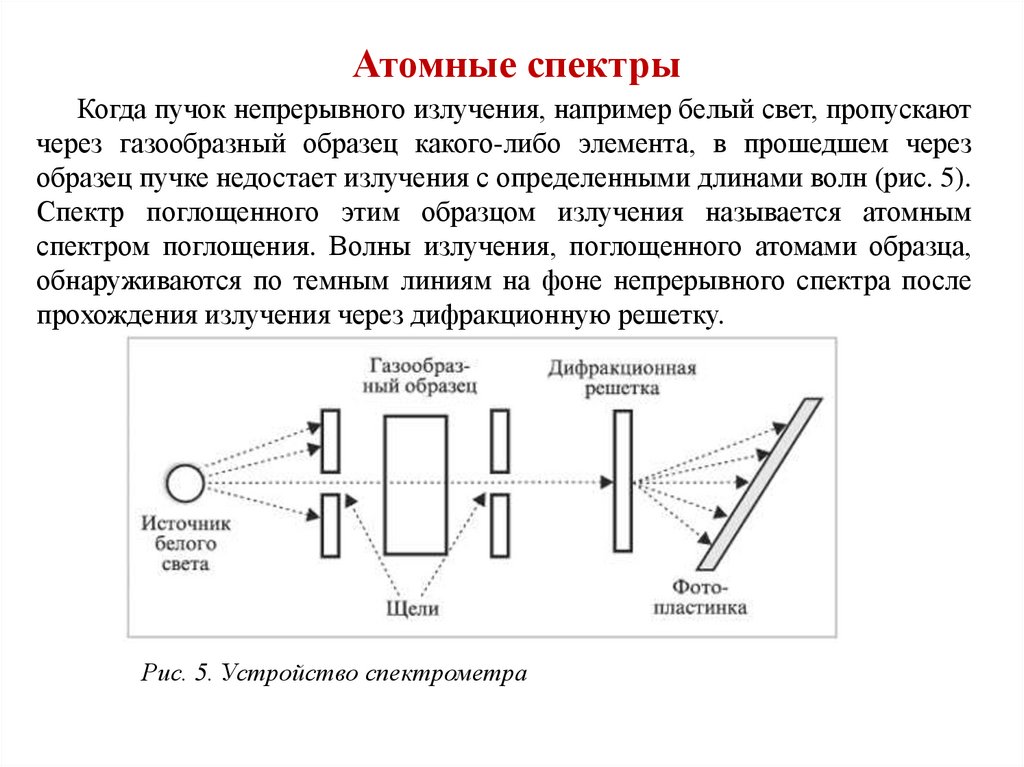
Атомные спектрыКогда пучок непрерывного излучения, например белый свет, пропускают
через газообразный образец какого-либо элемента, в прошедшем через
образец пучке недостает излучения с определенными длинами волн (рис. 5).
Спектр поглощенного этим образцом излучения называется атомным
спектром поглощения. Волны излучения, поглощенного атомами образца,
обнаруживаются по темным линиям на фоне непрерывного спектра после
прохождения излучения через дифракционную решетку.
Рис. 5. Устройство спектрометра
8.
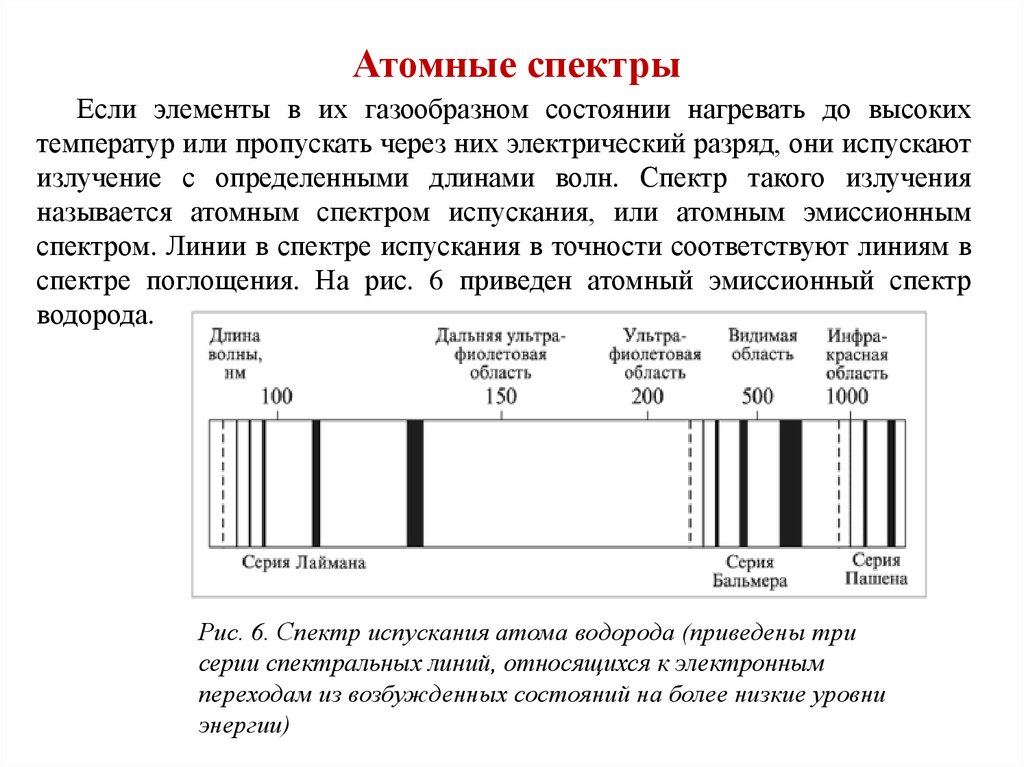
Атомные спектрыЕсли элементы в их газообразном состоянии нагревать до высоких
температур или пропускать через них электрический разряд, они испускают
излучение с определенными длинами волн. Спектр такого излучения
называется атомным спектром испускания, или атомным эмиссионным
спектром. Линии в спектре испускания в точности соответствуют линиям в
спектре поглощения. На рис. 6 приведен атомный эмиссионный спектр
водорода.
Рис. 6. Спектр испускания атома водорода (приведены три
серии спектральных линий, относящихся к электронным
переходам из возбужденных состояний на более низкие уровни
энергии)
9.
Связь между спектральными линиямии энергиями электронов
Одним из важнейших достижений Н. Бора стал ответ на вопрос, почему
атомы газообразных веществ поглощают или испускают излучение с
фиксированными длинами волн, а не излучение с непрерывным спектром.
Именно Бор установил соответствие между линиями атомного спектра и
энергиями электронов. На основе этого Бор предложил в 1913 г.
планетарную квантовую модель атома, согласно которой электроны
движутся вокруг ядра по стационарным круговым орбитам
(рис. 7).
Рис. 7. Планетарная квантовая модель атома
(Н. Бор, 1913 г.)
10.
Связь между спектральными линиямии энергиями электронов
Такая модель не согласовывалась с законами классической
электродинамики, применимыми к макрообъектам, согласно которым
электрон неизбежно терял бы энергию и упал бы на ядро. Это противоречие
Бор «устранил» следующим образом: предположив, что микрообъекты
существуют по своим, им присущим законам, он выдвинул два постулата.
1. Электроны способны находиться в атоме только на некоторых
разрешенных стационарных орбитах; по этим орбитам электроны
движутся,
не
испуская
и
не
поглощая
энергии.
2. Излучение или поглощение порции (кванта) энергии происходит при
переходе электрона с одной стационарной орбиты на другую.
11.
Связь между спектральными линиямии энергиями электронов
Атомный спектр испускания водорода представляет собой совокупность
линий, среди которых можно различить три группы или серии. Серия
линий, находящихся в ультрафиолетовой области, называется серией
Лаймана. Серия, находящаяся в видимой области, – серия Бальмера, а в
инфракрасной
–
серия
Пашена
(рис.
8).
Серии линий, лежащие в ультрафиолетовой, видимой и инфракрасной
областях, описываются единым уравнением:
1/λ = P∞(1/N2 – 1/n2), где λ – длина волны, P∞ – постоянная Ридберга, N
– номер электронного уровня, на который осуществляется переход
электрона (для серии Лаймана N = 1, для серии Бальмера N = 2, для серии
Пашена N = 3), n – целое число, номер электронного уровня, с которого
возбуждается электрон.
12.
Связь между спектральными линиямии энергиями электронов
Рис. 8. Соответствие между
электронными переходами
и спектральными линиями атома
водорода
Бор связал электронные переходы со спектральными линиями атомарного
водорода. Линии каждой серии (см. рис. 8) по мере уменьшения длины волны
постепенно приближаются к некоторому пределу сходимости. С увеличением номера
энергетических уровней наблюдается их сгущение. Так, переход с первого
энергетического уровня на второй требует большей энергии, чем со второго на
третий, а со второго на третий – большей энергии, чем с третьего на четвертый, и т. д.
Пределы сходимости спектральных линий соответствуют энергиям электронов,
находящихся на самых высоких энергетических уровнях.
13.
Д/З конспект,Ищенко А.А.
Аналитическая химия.
стр.212











 physics
physics








