Similar presentations:
Строение атома. Открытие радиоактивности
1.
Строение атома. Открытиерадиоактивности.
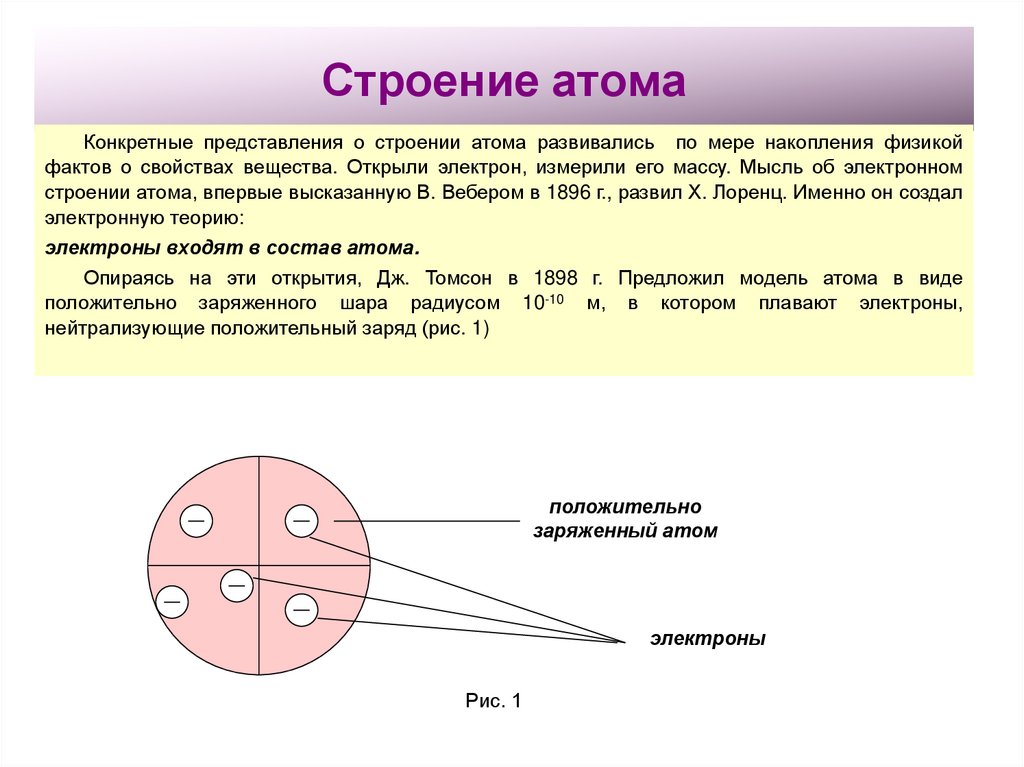
2. Строение атома
Конкретные представления о строении атома развивались по мере накопления физикойфактов о свойствах вещества. Открыли электрон, измерили его массу. Мысль об электронном
строении атома, впервые высказанную В. Вебером в 1896 г., развил Х. Лоренц. Именно он создал
электронную теорию:
электроны входят в состав атома.
Опираясь на эти открытия, Дж. Томсон в 1898 г. Предложил модель атома в виде
положительно заряженного шара радиусом 10-10 м, в котором плавают электроны,
нейтрализующие положительный заряд (рис. 1)
положительно
заряженный атом
электроны
Рис. 1
3.
ЭЛЕКТРОН+
+
+
+
+
+
+
ПОЛОЖИТЕЛЬНО
ЗАРЯЖЕННОЕ ОБЛАКО
«ПУДИНГ С
ИЗЮМОМ»
Д.Д. Томсон
1856 — 1940 гг
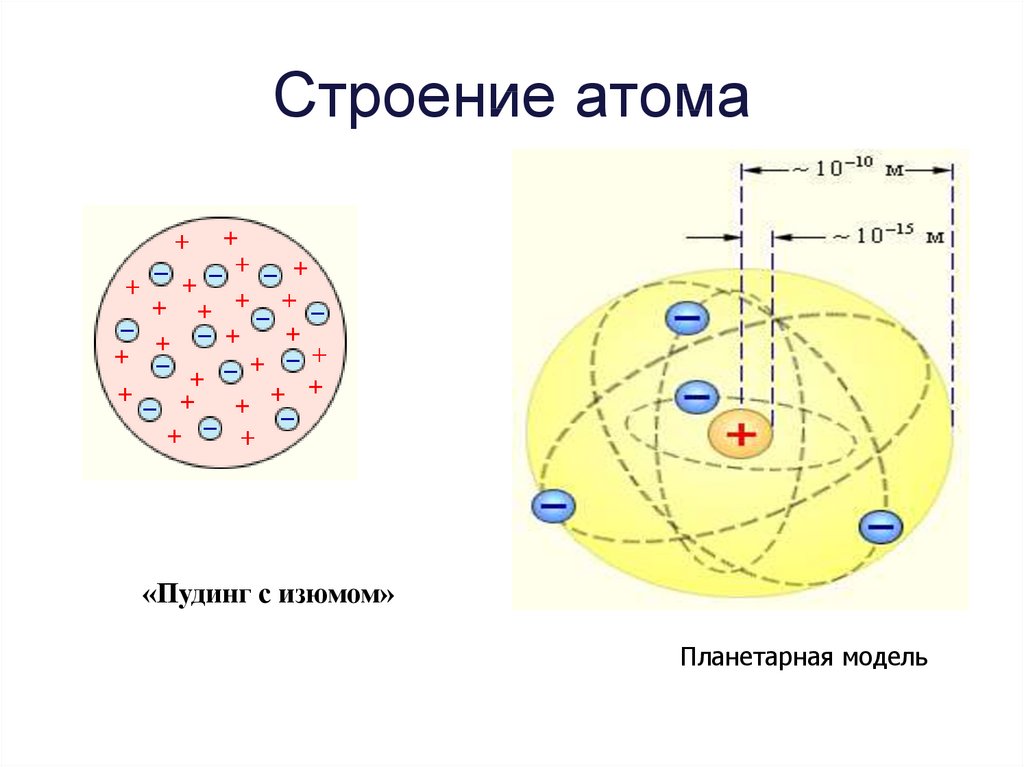
4. Строение атома
«Пудинг с изюмом»Планетарная модель
5. Беккерель Антуан Анри- 1897 г
• Радиоактивность –самопроизвольное
излучение
(действие солей урана
на фотопластинку).
6.
Мария Склодовская-Кюри иПьер Кюри.
Полоний
210 Ро
84
Радий (лучистый)
226
88
Rа
7.
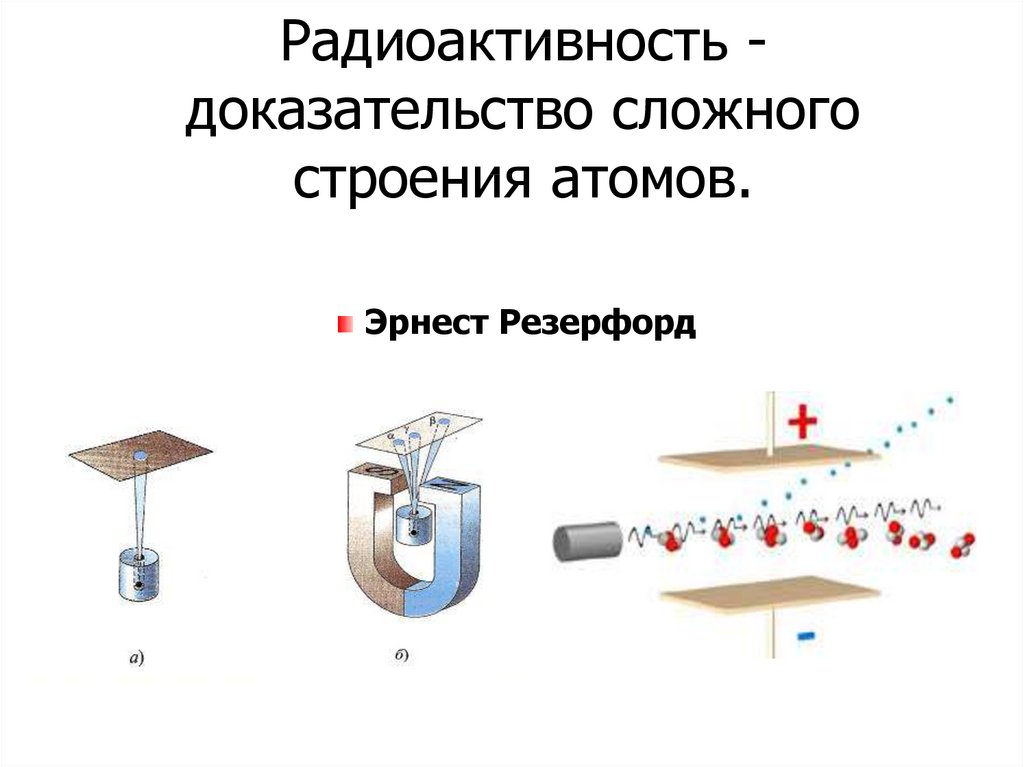
Радиоактивность доказательство сложногостроения атомов.
Эрнест Резерфорд
8.
1910 — 1911 ггЭ. РЕЗЕРФОРД
1871 — 1937 гг
ЦЕЛЬ ОПЫТА:
проверить, является
ли правильной
модель Томсона.
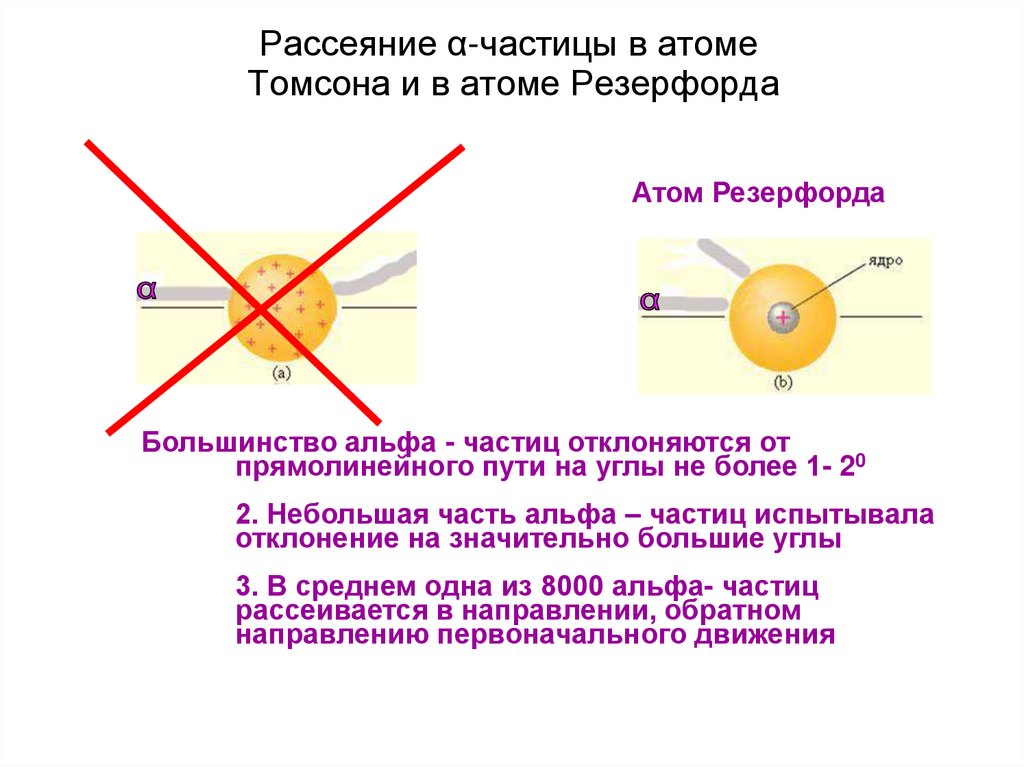
9. Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда
Атом Резерфордаат м омсона
Большинство альфа - частиц отклоняются от
прямолинейного пути на углы не более 1- 20
2. Небольшая часть альфа – частиц испытывала
отклонение на значительно большие углы
3. В среднем одна из 8000 альфа- частиц
рассеивается в направлении, обратном
направлению первоначального движения
10.
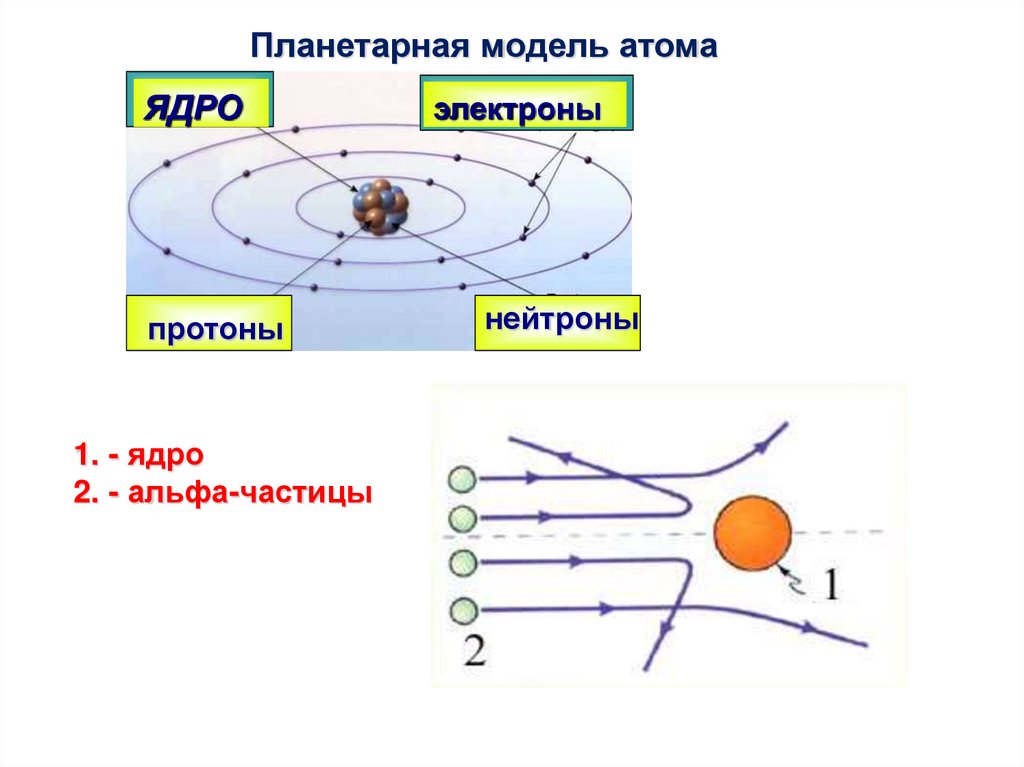
Планетарная модель атомаЯДРО
протоны
1. - ядро
2. - альфа-частицы
электроны
нейтроны
11.
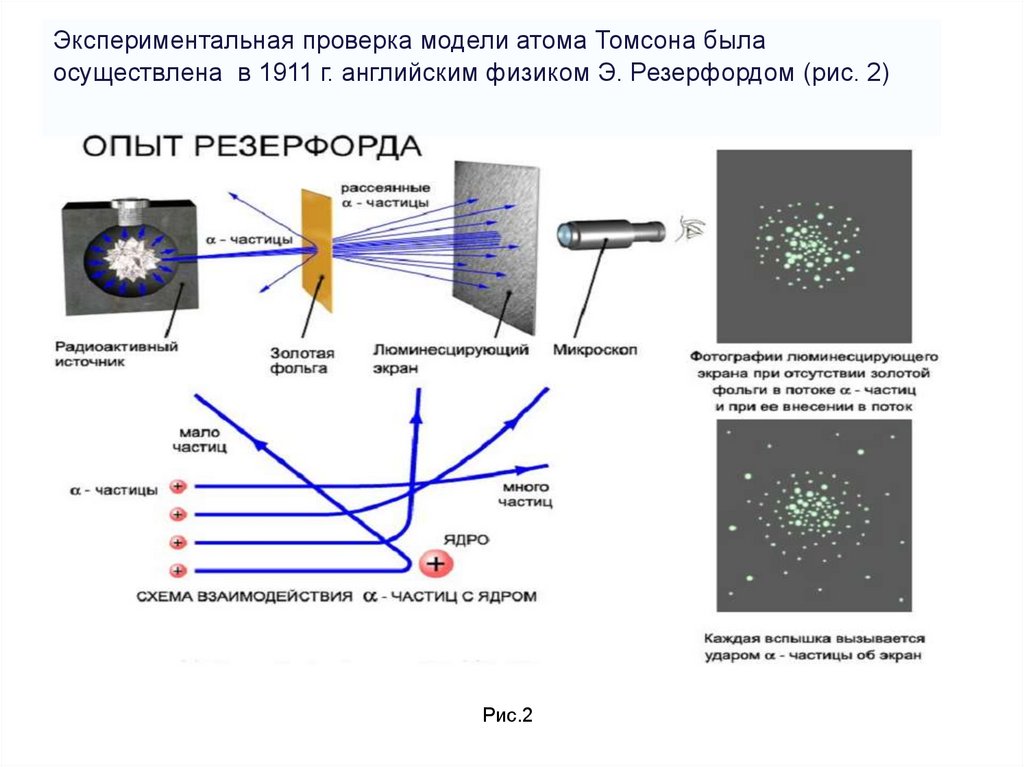
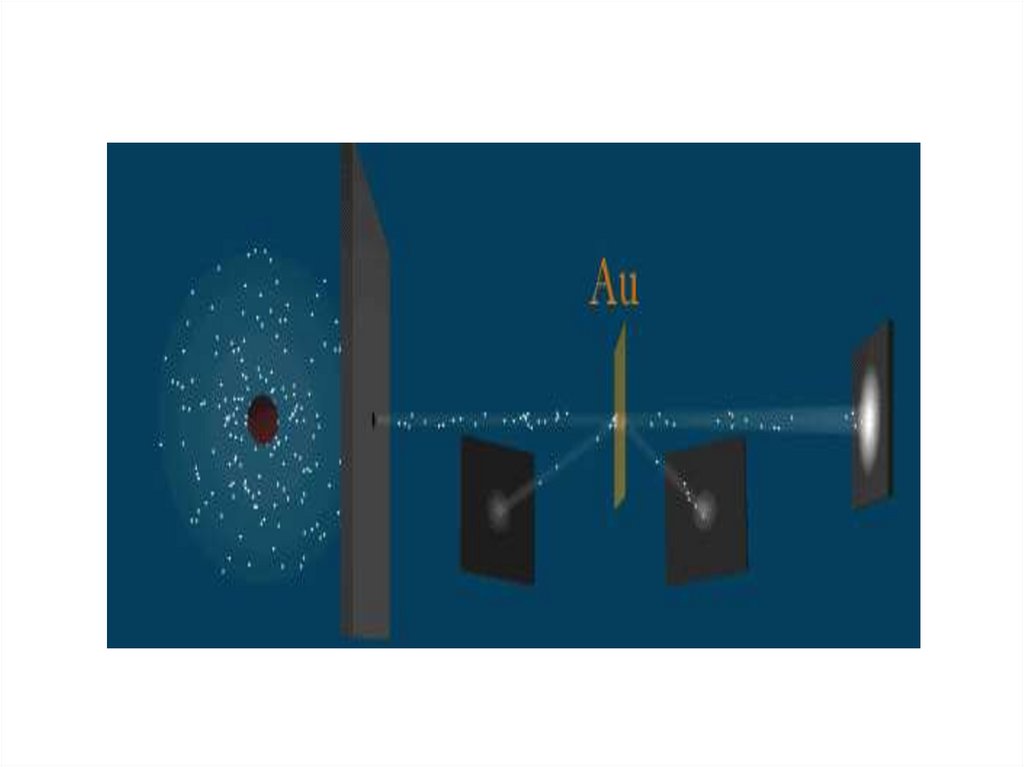
Экспериментальная проверка модели атома Томсона былаосуществлена в 1911 г. английским физиком Э. Резерфордом (рис. 2)
Рис.2
12.
13.
14.
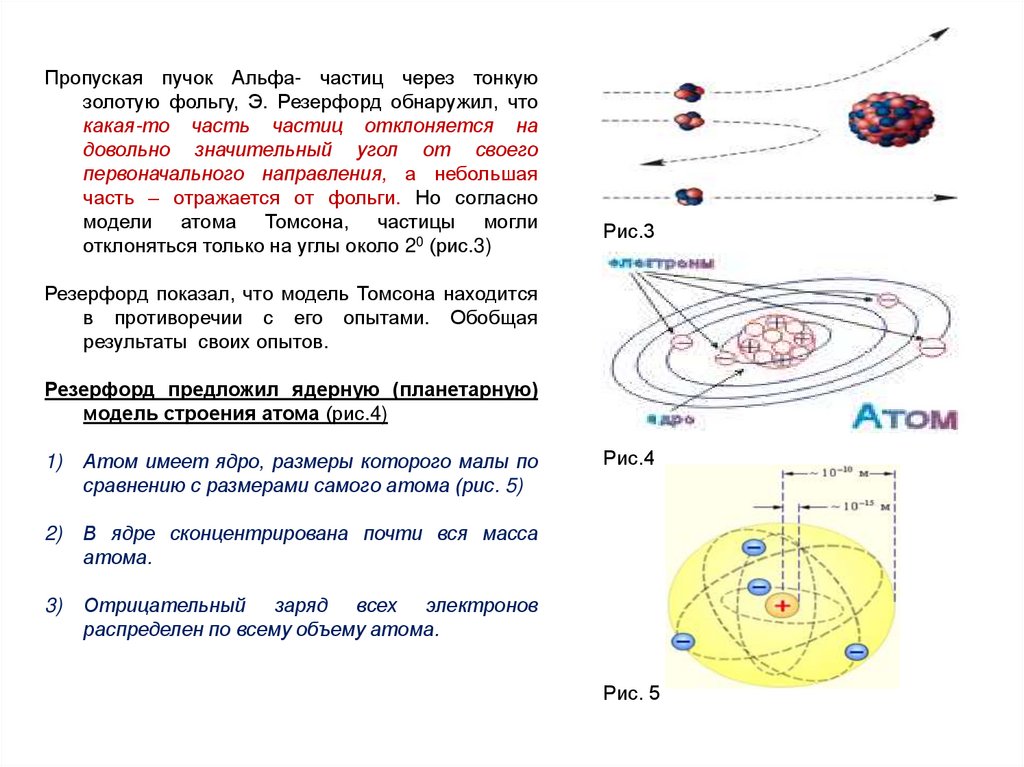
Пропуская пучок Альфа- частиц через тонкуюзолотую фольгу, Э. Резерфорд обнаружил, что
какая-то часть частиц отклоняется на
довольно значительный угол от своего
первоначального направления, а небольшая
часть – отражается от фольги. Но согласно
модели атома Томсона, частицы могли
отклоняться только на углы около 20 (рис.3)
Рис.3
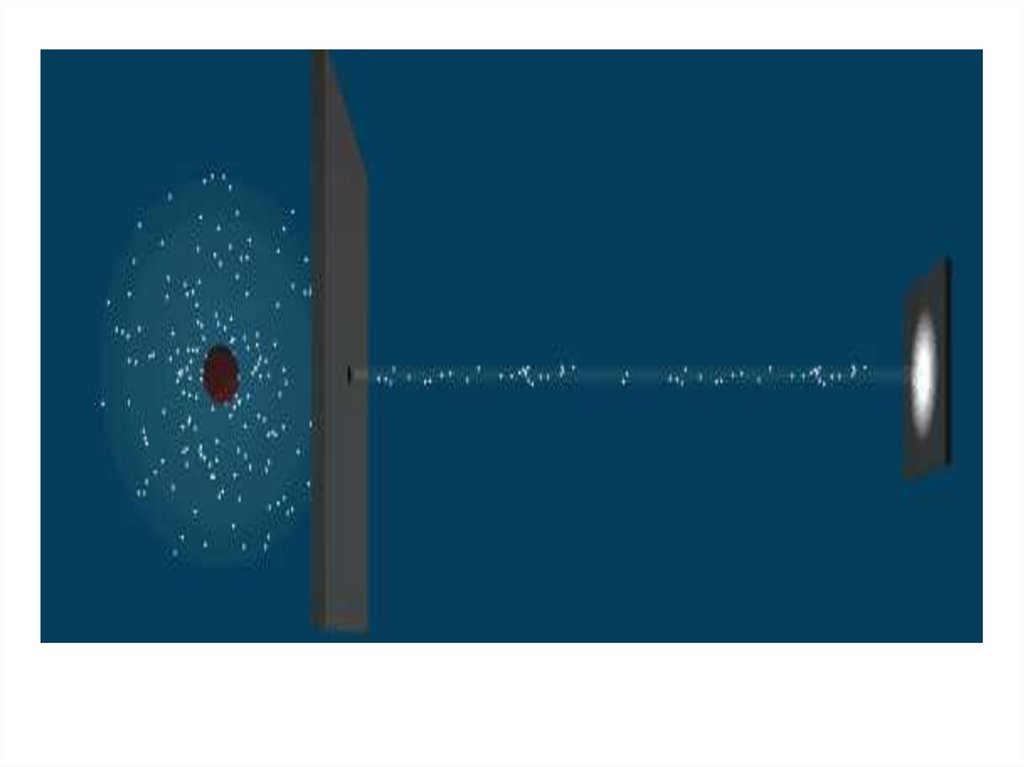
Резерфорд показал, что модель Томсона находится
в противоречии с его опытами. Обобщая
результаты своих опытов.
Резерфорд предложил ядерную (планетарную)
модель строения атома (рис.4)
1)
Атом имеет ядро, размеры которого малы по
сравнению с размерами самого атома (рис. 5)
2)
В ядре сконцентрирована почти вся масса
атома.
3)
Отрицательный заряд всех электронов
распределен по всему объему атома.
Рис.4
Рис. 5
15. АТОМ
Состоит из ядраВокруг ядра вращаются электроны
16.
Электрон заряженотрицательно
Заряд электрона равен е = -1,6 10 ¯
Заряд протона равен
по модулю заряду электрона
19
Кл
17. Строение атомного ядра.
мХz
Z
-зарядовое число - порядковый номер, заряд ядра,
количество протонов, количество электронов.
М
-массовое число - масса ядра, число нуклонов,
количество нейтронов М-Z.
18.
ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА ПРОТИВОРЕЧИЛАЗАКОНАМ КЛАССИЧЕСКОЙ ЭЛЕКТРОДИНАМИКИ
— электрон должен был непрерывно излучать
электромагнитные волны.
ТАКОЙ АТОМ НЕ МОГ СУЩЕСТВОВАТЬ !!!
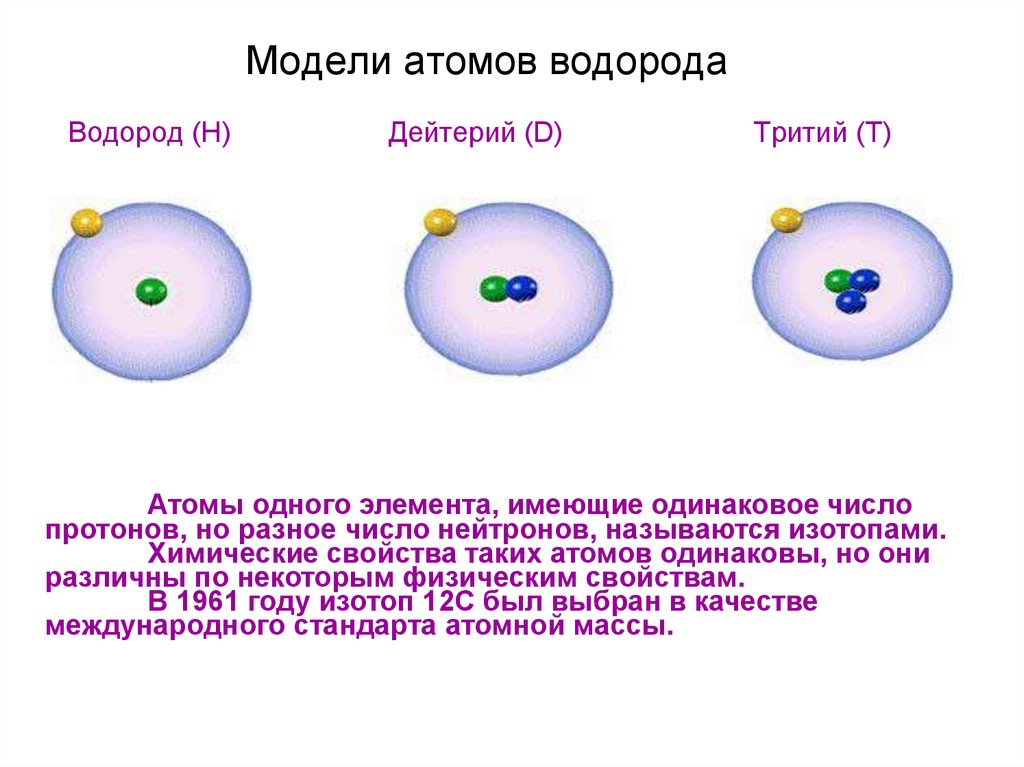
19. Модели атомов водорода
Водород (H)Дейтерий (D)
Тритий (T)
Атомы одного элемента, имеющие одинаковое число
протонов, но разное число нейтронов, называются изотопами.
Химические свойства таких атомов одинаковы, но они
различны по некоторым физическим свойствам.
В 1961 году изотоп 12С был выбран в качестве
международного стандарта атомной массы.
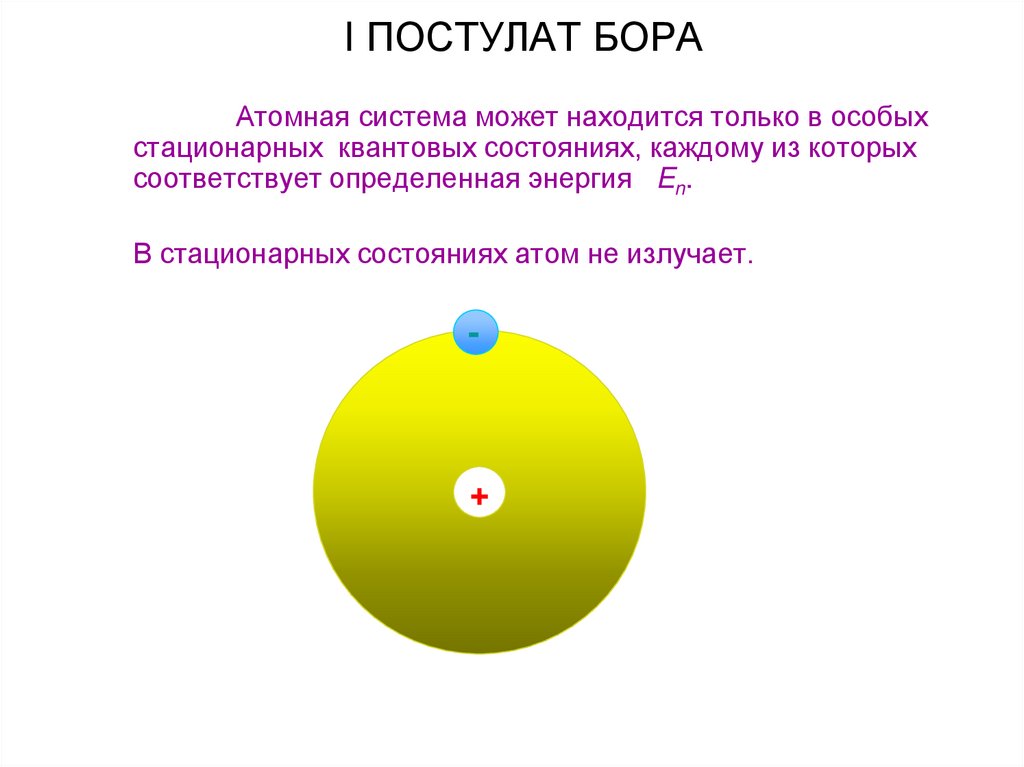
20. I ПОСТУЛАТ БОРА
Атомная система может находится только в особыхстационарных квантовых состояниях, каждому из которых
соответствует определенная энергия En.
В стационарных состояниях атом не излучает.
-
+
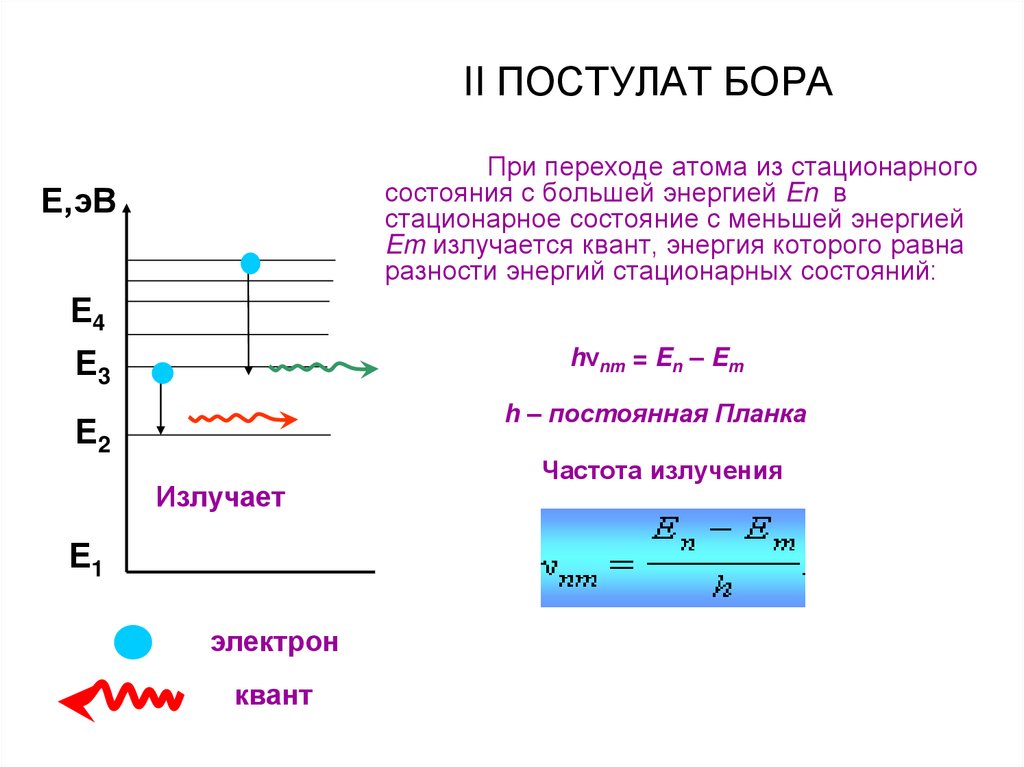
21. II ПОСТУЛАТ БОРА
При переходе атома из стационарногосостояния с большей энергией En в
стационарное состояние с меньшей энергией
Em излучается квант, энергия которого равна
разности энергий стационарных состояний:
Е,эВ
Е4
hνnm = En – Em
Е3
h – постоянная Планка
Е2
Излучает
Е1
электрон
квант
Частота излучения
22. Недостатки теории Бора
1. Не смогла объяснить интенсивностьспектральных линий.
2. Справедлива только для водородоподобных
атомов и не работает для атомов, следующих за ним
в таблице Менделеева.
3. Теория Бора логически противоречива: не
является ни классической, ни квантовой. В системе
двух уравнений, лежащих в её основе, одно —
уравнение движения электрона — классическое,
другое — уравнение квантования орбит — квантовое.
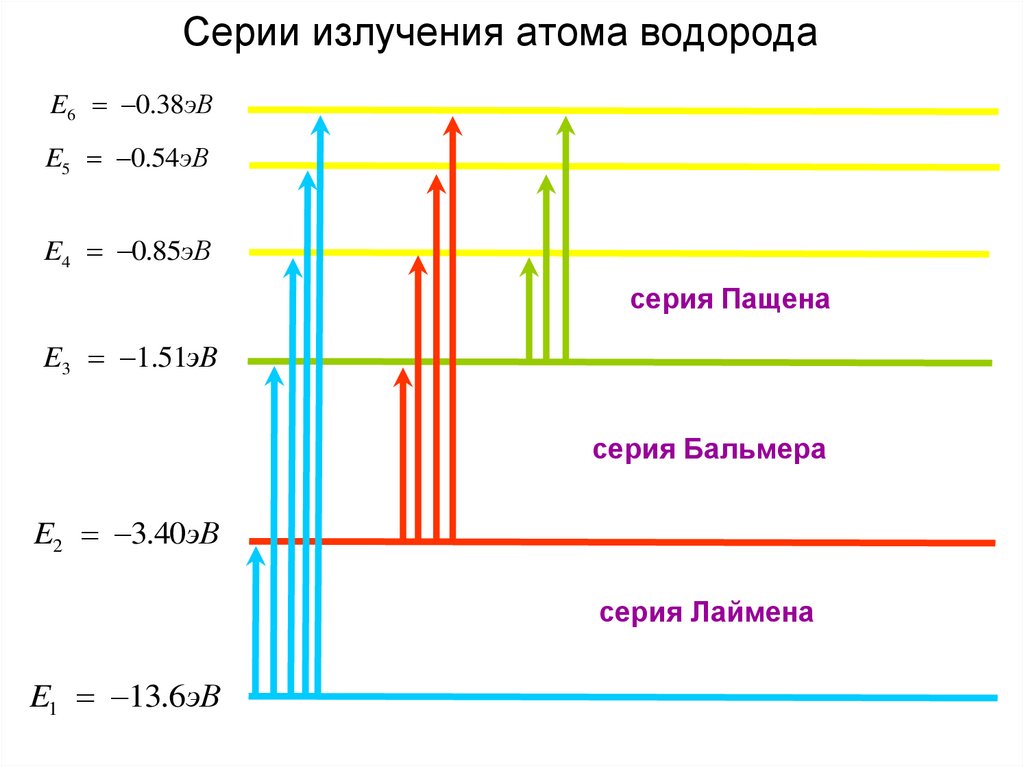
23. Серии излучения атома водорода
E6 0.38эВE5 0.54эВ
E4 0.85эВ
серия Пащена
E3 1.51эВ
серия Бальмера
E2 3.40эВ
серия Лаймена
E1 13.6эВ
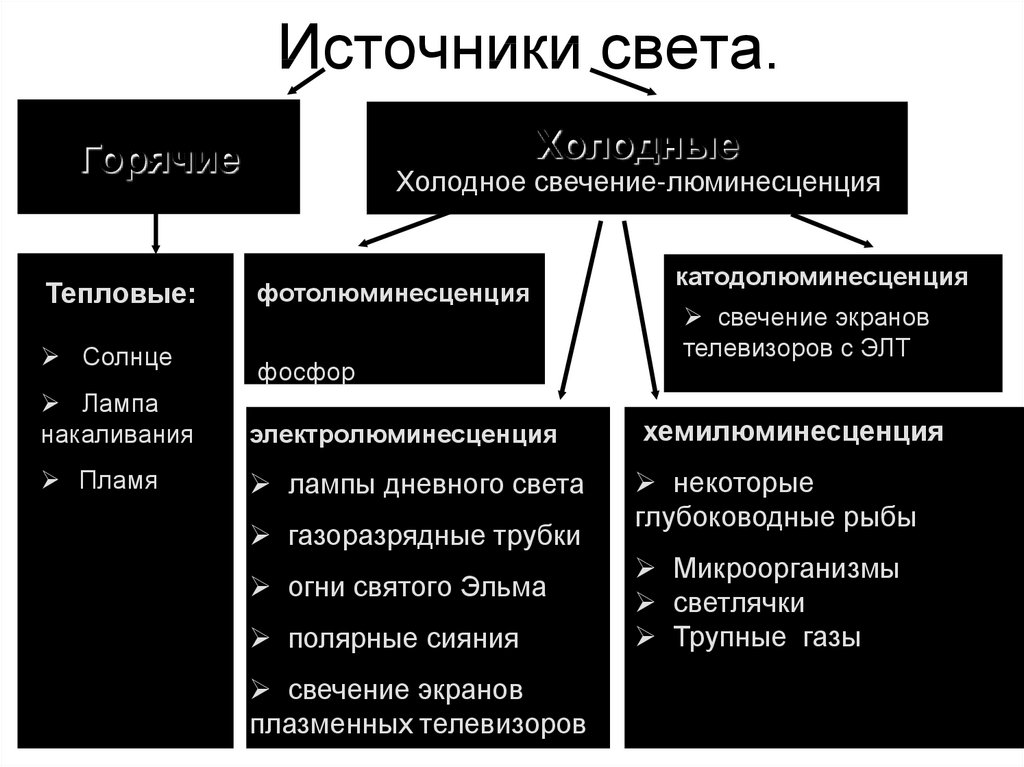
24. Источники света.
ХолодныеГорячие
Холодное свечение-люминесценция
Тепловые:
фотолюминесценция
Солнце
фосфор
Лампа
накаливания
электролюминесценция
Пламя
лампы дневного света
газоразрядные трубки
огни святого Эльма
полярные сияния
свечение экранов
плазменных телевизоров
катодолюминесценция
свечение экранов
телевизоров с ЭЛТ
хемилюминесценция
некоторые
глубоководные рыбы
Микроорганизмы
светлячки
Трупные газы
25.
Огни святого Эльма26.
Полярное сияние27.
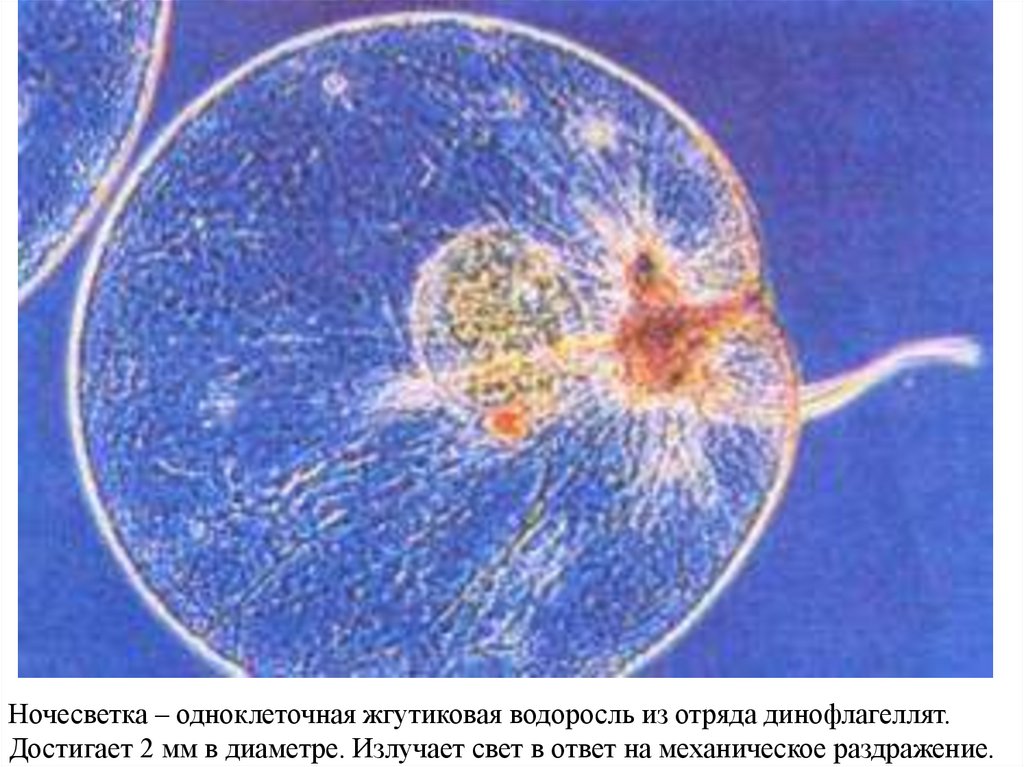
Ночесветка – одноклеточная жгутиковая водоросль из отряда динофлагеллят.Достигает 2 мм в диаметре. Излучает свет в ответ на механическое раздражение.
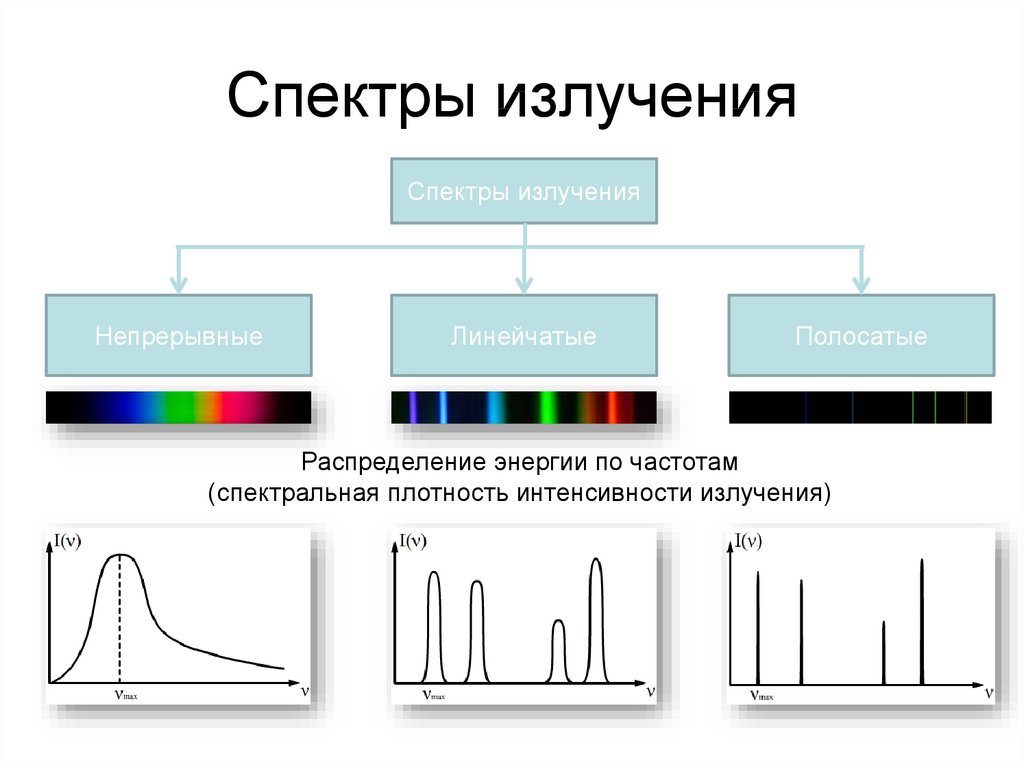
28. Спектры излучения
Спектры излученияНепрерывные
Линейчатые
Полосатые
Распределение энергии по частотам
(спектральная плотность интенсивности излучения)
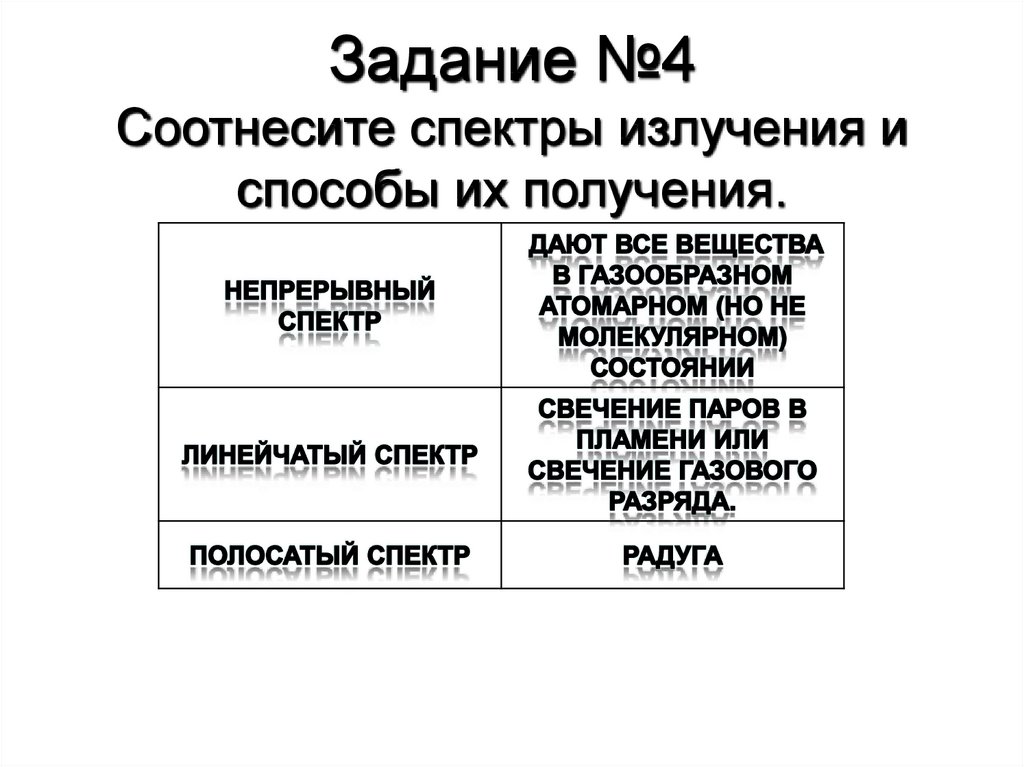
29. Непрерывный спектр
• Дают тела, находящиеся в твердом,жидком состоянии, а также плотные газы.
• Чтобы получить, надо нагреть тело до
высокой температуры.
• Характер спектра зависит не только от
свойств отдельных излучающих атомов,
но и от взаимодействия атомов друг с
другом.
• В спектре представлены волны всех
длин и нет разрывов.
• Непрерывный спектр цветов можно
наблюдать на дифракционной решетке.
Хорошей демонстрацией спектра
является природное явление радуги.
30. Линейчатый спектр
• Дают все вещества в газообразном атомарном (но не молекулярном)состоянии (атомы практически не взаимодействуют друг с другом).
• Изолированные атомы данного химического элемента излучают волны
строго определенной длины.
• Для наблюдения используют свечение паров вещества в пламени или
свечение газового разряда в трубке, наполненной исследуемым газом.
• При увеличении плотности атомарного газа отдельные спектральные
линии расширяются.
31. Полосатый спектр
• Спектр состоит из отдельных полос, разделенных темнымипромежутками.
• Каждая полоса представляет собой совокупность большого числа очень
тесно расположенных линий.
• Создаются молекулами, не связанными или слабосвязанными друг с
другом.
• Для наблюдения используют свечение паров в пламени или свечение
газового разряда.
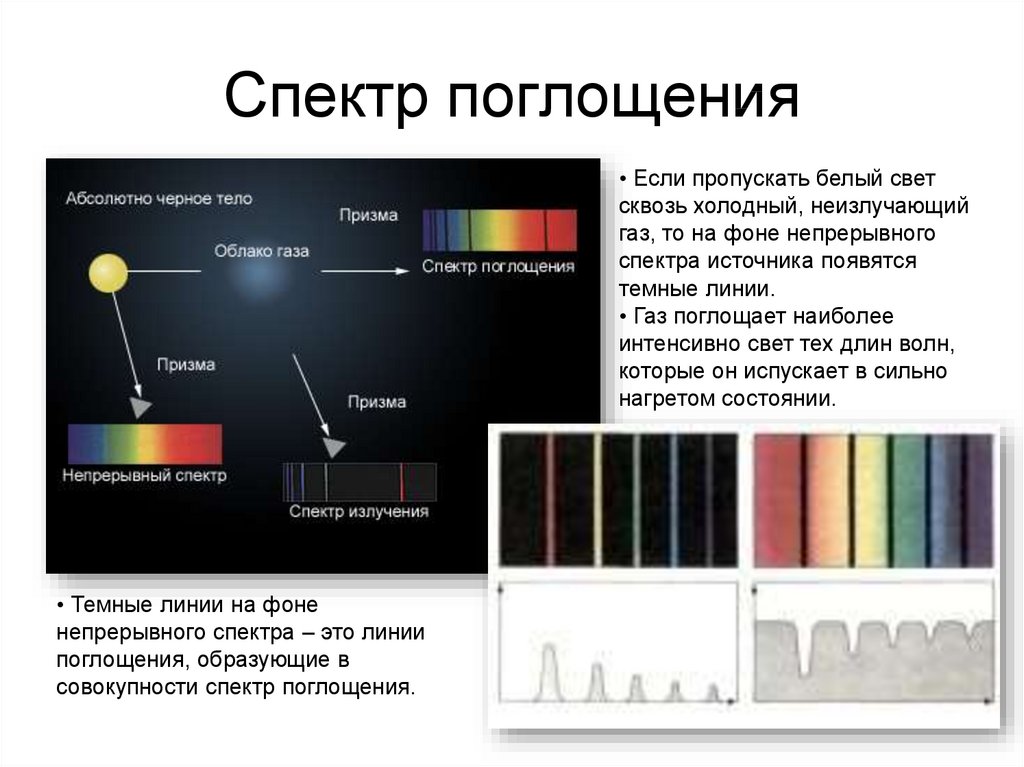
32. Спектр поглощения
• Если пропускать белый светсквозь холодный, неизлучающий
газ, то на фоне непрерывного
спектра источника появятся
темные линии.
• Газ поглощает наиболее
интенсивно свет тех длин волн,
которые он испускает в сильно
нагретом состоянии.
• Темные линии на фоне
непрерывного спектра – это линии
поглощения, образующие в
совокупности спектр поглощения.
33. Спектральный анализ
Спектральный анализ – метод определения химического состава веществапо его спектру. Разработан в 1859 году немецкими учеными Г. Р. Кирхгофом
и Р. В. Бунзеным.
Роберт Вильгельм Бунзен
1811 - 1899
Густав Роберт Кирхгоф
1824 - 1887
34. Применение Спектрального анализа
Открываются новые элементы: рубидий, цезий идр;
35. Применение Спектрального анализа
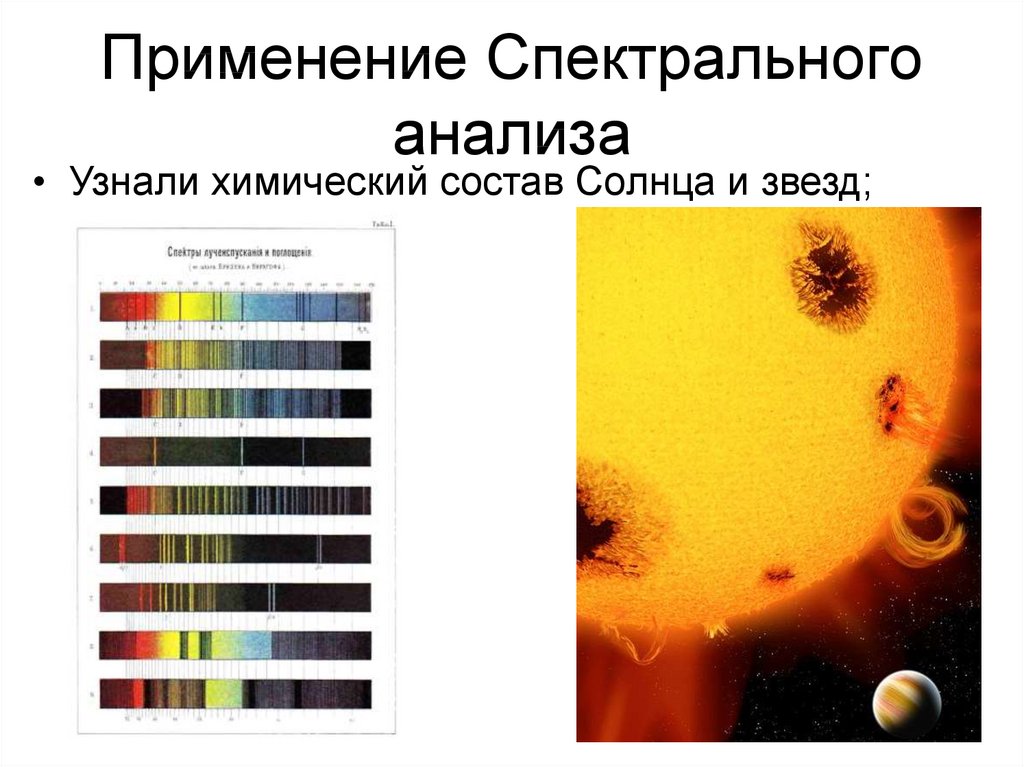
• Узнали химический состав Солнца и звезд;36. Применение Спектрального анализа
• Определяют химический состав руд иминералов;
• Метод контроля состава вещества в
металлургии, машиностроении, атомной
индустрии.
Состав сложных смесей анализируется по их
молекулярным спектрам.
37. СПЕКТРАЛЬНЫЕ АППАРАТЫ
• Для точного исследования спектров такиепростые приспособления, как узкая щель,
ограничивающая световой пучок, и призма,
уже недостаточны. Необходимы приборы,
дающие четкий спектр, т. е. приборы, хорошо
разделяющие волны различной длины и не
допускающие перекрытия отдельных
участков спектра. Такие приборы называют
спектральными аппаратами. Чаще всего
основной частью спектрального аппарата
является призма или дифракционная
решетка.
38. Спектральные аппараты
39.
Для получения спектров используют специальные приборыСПЕКТРОСКОПЫ
40.
Задание №1На рисунке изображены спектры излучения водорода
(1), гелия (2), натрия (3). Какие из этих элементов
содержатся в смеси веществ? (4)
1
2
3
4
41.
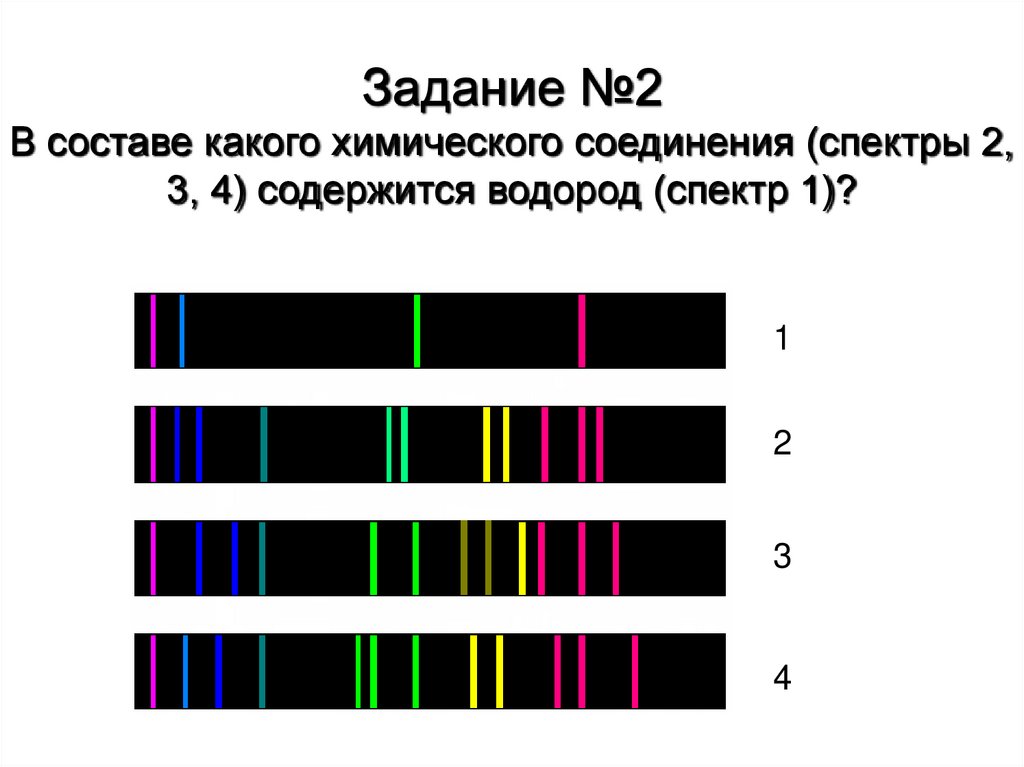
Задание №2В составе какого химического соединения (спектры 2,
3, 4) содержится водород (спектр 1)?
1
2
3
4
42.
Задание №3В какой смеси газов (спектры 1, 3, 4) содержится
гелий (2)?
1
2
3
4
43.
Задание №4Соотнесите спектры излучения и
способы их получения.
44.
Задание №5Соотнесите спектры излучения и способы их
получения.
45. Принцип действия и использования лазера.
46. Что такое лазер?
Лазер или оптический квантовыйгенератор — это устройство, преобразующее
энергию накачки (световую, электрическую,
тепловую, химическую и др.) в энергию
когерентного, монохроматического,
поляризованного и узконаправленного потока
излучения.
Существует большое количество видов
лазеров, использующих в качестве рабочей
среды все агрегатные состояния вещества.
Некоторые типы лазеров могут генерировать
целый набор частот в широком спектральном
диапазоне.
Классификация и типы лазеров:
1Газовые лазеры
2Лазеры на красителях
3Лазеры на парах металлов
4Твердотельные лазеры
5Полупроводниковые лазеры
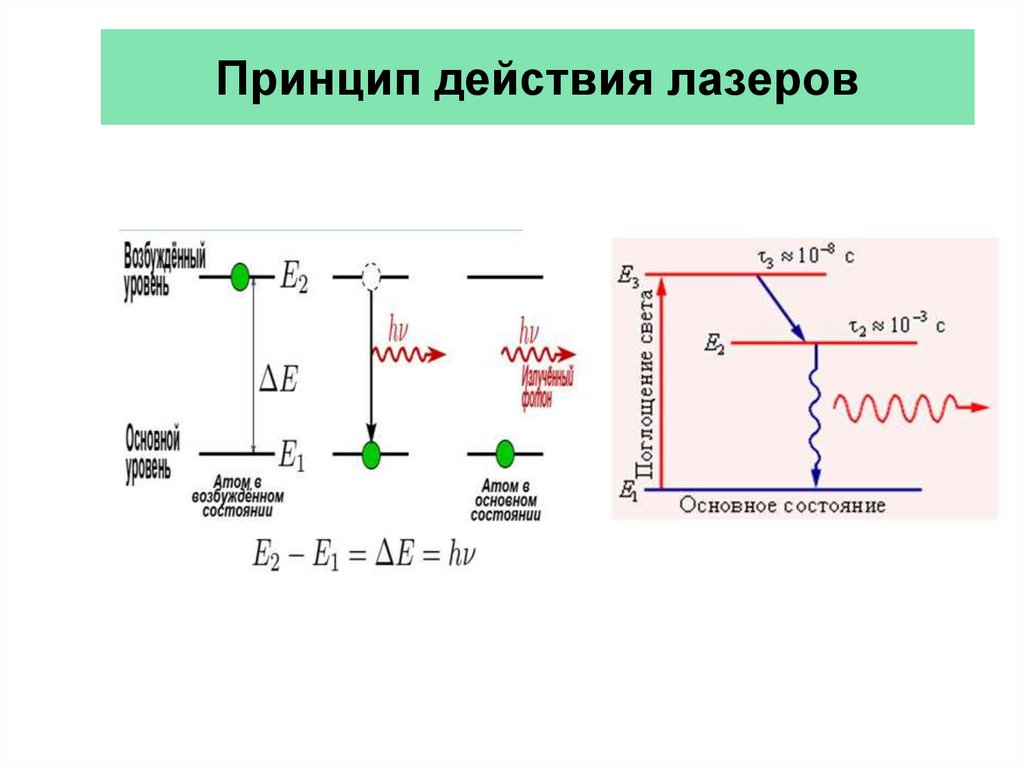
47. Индуцированное (вынужденное) излучение лазера возникает при переходе атомов из высшего энергетического состояния в низшее, но
несамопроизвольно, а под влиянием внешнего воздействия.
Возникшая при индуцированном излучении световая
волна не отличается от волны, падающей на атом, ни
частотой, ни фазой, ни поляризацией.
48. Свойства лазерного излучения
• Малый угол расхождения лазерного пучка.• Исключительная монохроматичность.
• Лазеры - самое мощные источники света.
49. Принцип действия лазеров
50. Применение лазеров
1.Наука
2.
Вооружение
3.
Промышленность
4.
Медицина
5.
В связи и информационных
технологиях
6.Культура
7.Быт
51. Наука
1. Для осуществления связи, особенно в той частикосмического пространства, где отсутствует
поглощение света.
2. Для локации различных объектов,
обеспечивающей возможность определения
расстояния до них с точностью до миллиметра
3. Для осуществления управляемой термоядерной
реакции
4. Для проведения химических реакций, которые
иными способами провести невозможно
5. Для повысить качество изображения
астрономических объектов
6. Для сверхбыстрого управления магнитным
состоянием среды (лазерное намагничивание)
7. Для достижения сверхнизких температур
(лазерное охлаждение)
52. Вооружение
1. Лазерное оружие для борьбы с наземными ивоздушными целями
2. Целеуказатели
3. Для облегчения прицеливания с помощью
какого-нибудь оружия (лазерный прицел)
4. Системы обнаружения снайперов
5. Для постановки помех путём «сканирования»
лазерным лучом местности
6. Лазерное стрелковое оружие
53. Промышленность
ФотолитографияЭкологический мониторинг
Лазерная маркировка и гравировка
Лазерное разделение материалов
Лазерная сварка (соединение мельчайших
деталей между собой)
6. Поверхностная лазерная обработка
7. Получение химически чистых материалов
8. Пробивание отверстий в особо хрупких
материалах
1.
2.
3.
4.
5.
54. Медицина
1. Косметическая хирургия (удаление татуажа ипр.)
2. Коррекция зрения
3. Хирургия (гинекология, урология, лапароскопия)
4. Стоматология
5. Диагностика заболеваний
6. Удаление опухолей, особенно мозга и спинного
мозга
55. Связь и информационные технологии
1. Хранение информации на оптических носителях(компакт-диск, DVD и т. д.)
2. Оптическая связь
3. Оптические компьютеры
4. Голография, лазерные дисплеи
5. Лазерные принтеры, цифровые минилабы
6. Считыватели штрих-кодов
56. культура
1.2.
3.
4.
5.
6.
Лазерное шоу на концертах и дискотеках
Мультимедийные демонстрации и презентации
В световом дизайне
Лазерные субтитры на киноэкранах
ЭМИ «лазерная арфа»
Объемное гравирование прозрачных
материалов
57. быт
1.2.
3.
4.
5.
6.
Лазерные указки
Лазерный дальномер
Системы слежения
Лидары
Системы навигации (напр. Лазерный гироскоп)
Проецирование изображений на сетчатку;
58. В заключение…
В наши дни невозможно представить себе жизньчеловечества без лазеров. Лазерные технологии настолько
глубоко проникли в различные сферы жизни, что обойтись
без них уже, видимо, не удастся. Лазеры нашли применение
в самых различных областях — от коррекции зрения до
управления транспортными средствами, от космических
полётов до термоядерного синтеза. Лазер стал одним из
самых значимых изобретений XX века.
59.
60. Используемые ресурсы
1.2.
Виртуальная школа «Кирилла и Мефодия»
Г.Я.Мякишев учебник для 11 класса
3.
«Открытая физика», часть 2, «Физика атома и атомного
ядра».





































 physics
physics








