Similar presentations:
Загадочная медь
1.
«Загадочнаямедь»
Выполнили:
Руководитель:
Вольвах Валерия
Шушпанова Мария
Ветров Артем
Заичко Галина Николаевна
ГБОУ «Школа №1900»
2.
3.
4.
В работе решаются следующие задачи:изучение литературы о меди и ее соединениях;
выявление новых для нас свойств меди и ее
соединений;
экспериментальная проверка этих свойств и их
объяснение;
создание учебного демонстрационного
материала
5.
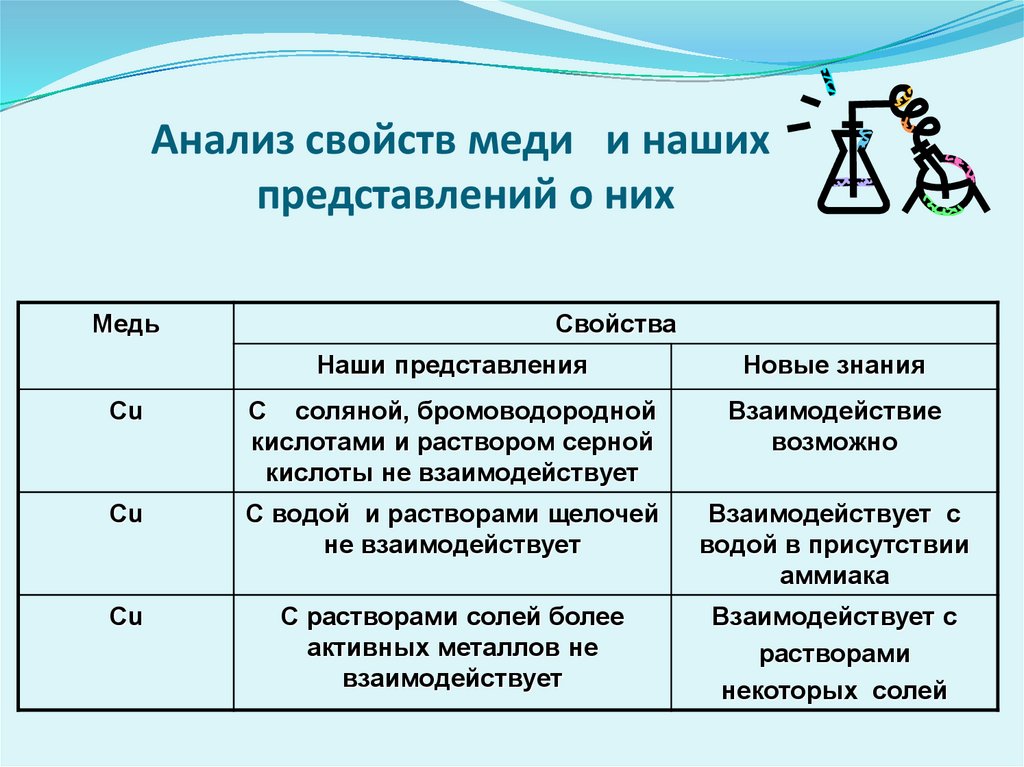
Анализ свойств меди и нашихпредставлений о них
Медь
Свойства
Наши представления
Новые знания
Cu
С соляной, бромоводородной
кислотами и раствором серной
кислоты не взаимодействует
Взаимодействие
возможно
Cu
С водой и растворами щелочей
не взаимодействует
Взаимодействует с
водой в присутствии
аммиака
Cu
С растворами солей более
активных металлов не
взаимодействует
Взаимодействует с
растворами
некоторых солей
6.
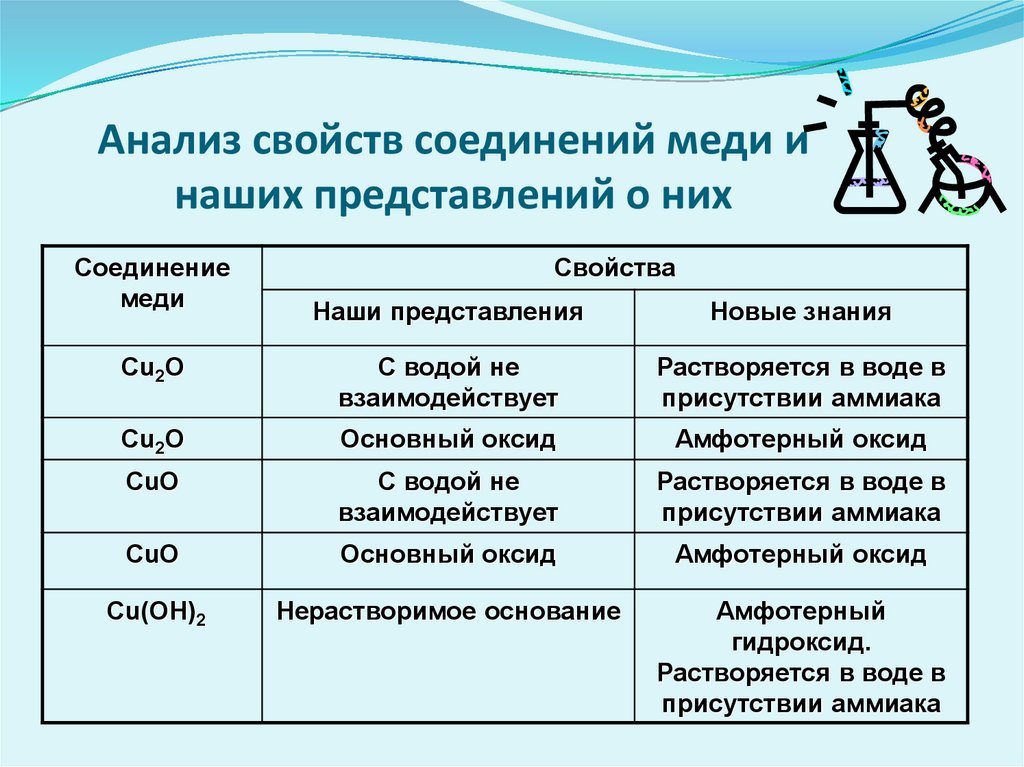
Анализ свойств соединений меди инаших представлений о них
Соединение
меди
Свойства
Наши представления
Новые знания
Cu2O
С водой не
взаимодействует
Растворяется в воде в
присутствии аммиака
Cu2O
Основный оксид
Амфотерный оксид
CuO
С водой не
взаимодействует
Растворяется в воде в
присутствии аммиака
CuO
Основный оксид
Амфотерный оксид
Cu(OH)2
Нерастворимое основание
Амфотерный
гидроксид.
Растворяется в воде в
присутствии аммиака
7.
В работе были выполнены следующиеопыты :
Растворение меди в растворе аммиака
Взаимодействие меди с кислотами и
хлоридом железа(III)
Изучение амфотерных свойств оксида меди(I),
оксида меди(II), гидроксида меди(II):
Растворение в соляной кислоте, растворах
аммиака и гидроксида натрия
8.
Экспериментальная частьПолучение реактивов
9.
Получение свежеосажденной медиCuSO4 + Zn = ZnSO4 + Cu
10.
Получение оксида меди(I)t
2C6H12O6 + 2Cu(OH)2 → 2C6H12O7 + 2CuOH + H2O
t
2CuOH → Cu2O + H2O
11.
Получение бромоводородной кислотыВзаимодействие
KBr с H2SO4
конц. ~96 % (1),
~65 % (2)
и H3PO4 конц. (3)
KBr + H2SO4 (р-р)
= KHSO4
KBr + H3PO4 = KH2PO4
+ HBr↑
+
HBr↑
12.
Изменение цвета лакмусовой бумагив продуктах взаимодействия кислот с
бромидом калия
2HBr + H2SO4 (конц.) =
Br2
+
SO2↑
+
2H2O
13.
Обнаружение бромид-ионав продуктах взаимодействия бромида калия
с 65%-ной серной кислотой
14.
Опыты с металлической медью15.
Взаимодействие меди с раствором аммиака1, 2. – медь в
растворе аммиака;
3. раствор сульфата
тетраамминмеди(II);
4. раствор сульфата
меди(II)
16.
Доказательство участия кислорода вреакции меди с раствором аммиака
2Cu + 8NH3 + O2 + 2H2O = 2[Cu(NH3)4]2(ОН)2
Гидроксид тетраамминмеди(II)
17.
Взаимодействие меди с концентрированнойHCl (А) и разбавленной H2SO4 (Б)
А
1.
2.
3.
4.
5.
Б
До начала реакции;
После окончания реакции;
После разбавления полученного раствора водой;
После добавления к раствору 3 раствора аммиака;
После добавления к раствору 3 раствора гексацианоферрата(II)
калия
18.
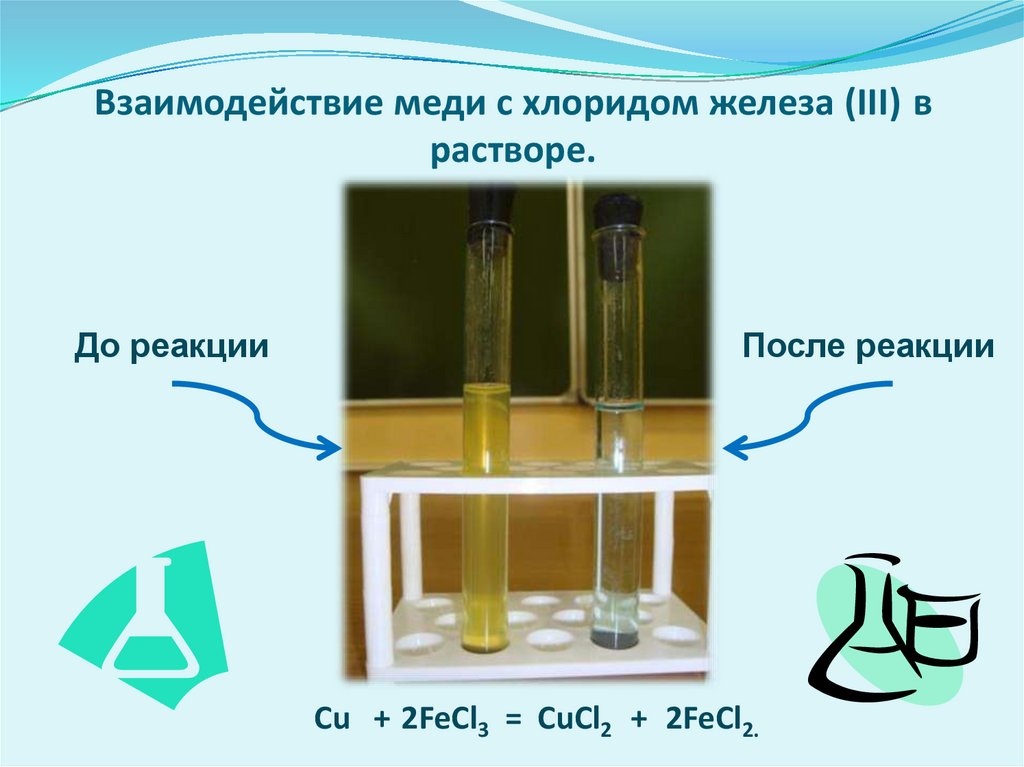
Взаимодействие меди с хлоридом железа (III) врастворе.
До реакции
После реакции
Сu + 2FeCl3 = CuCl2 + 2FeCl2.
19.
Обнаружение катионовFe2+ (1) и Cu2+(2)
после реакции меди с раствором хлорида железа(III)
20.
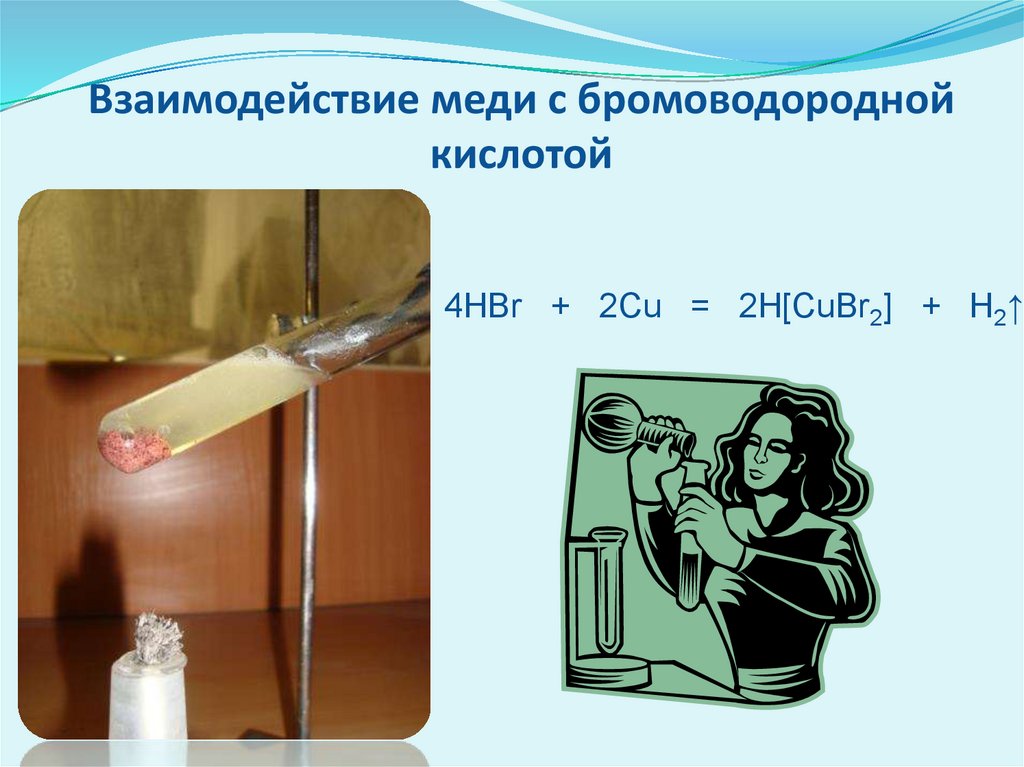
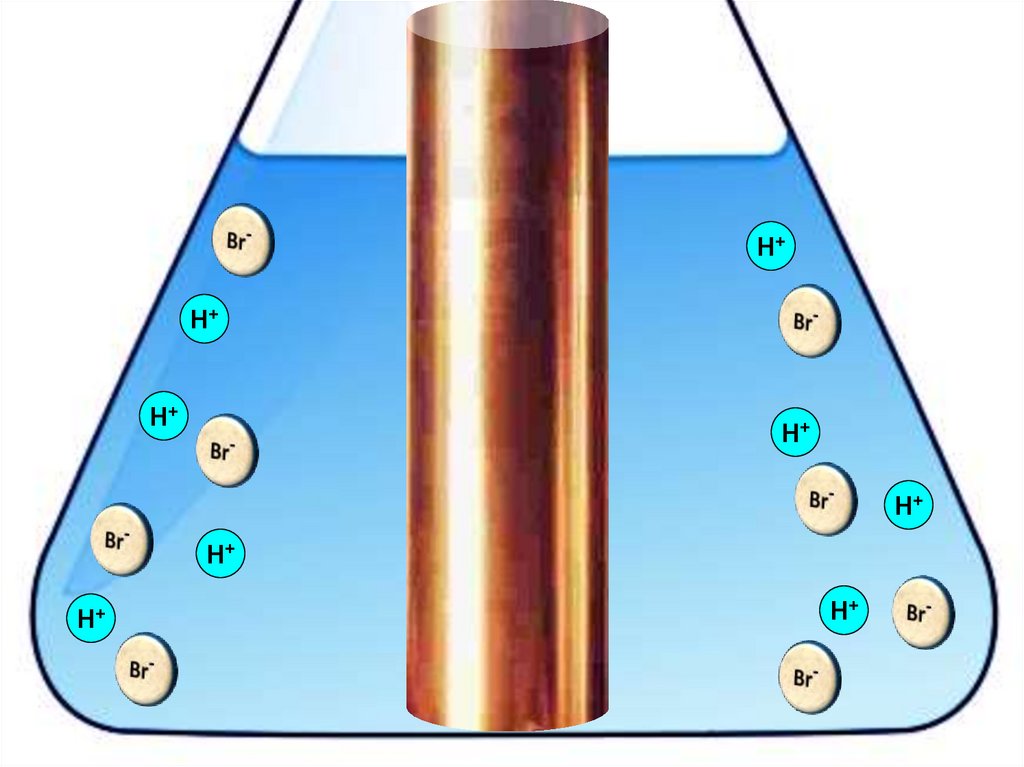
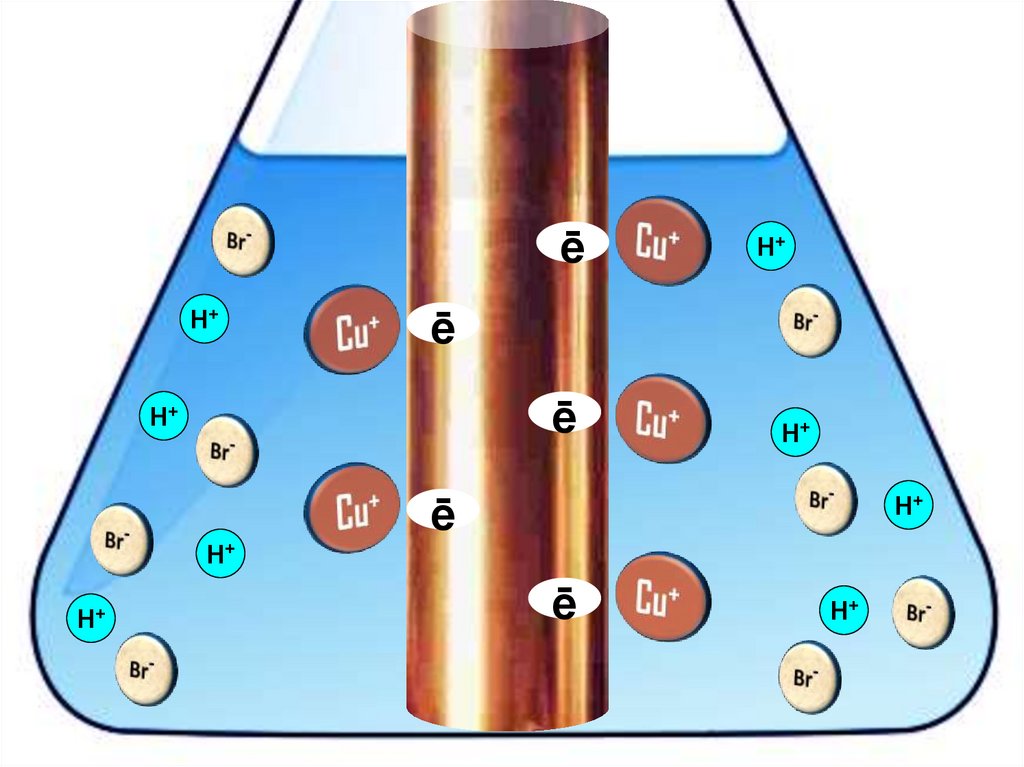
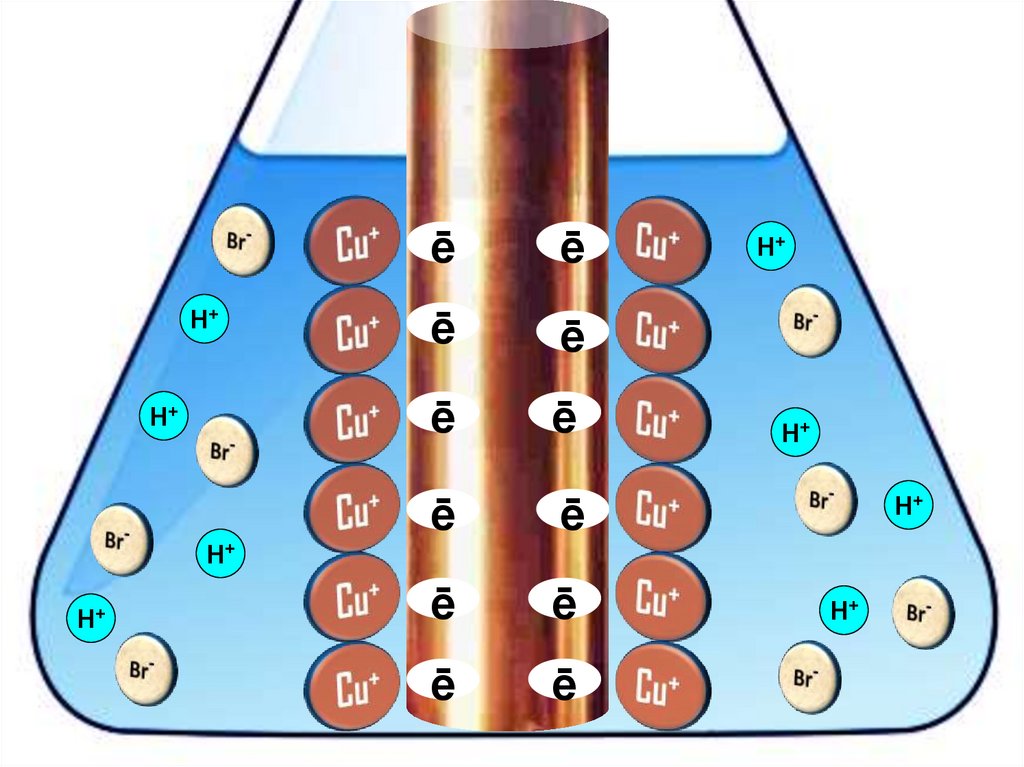
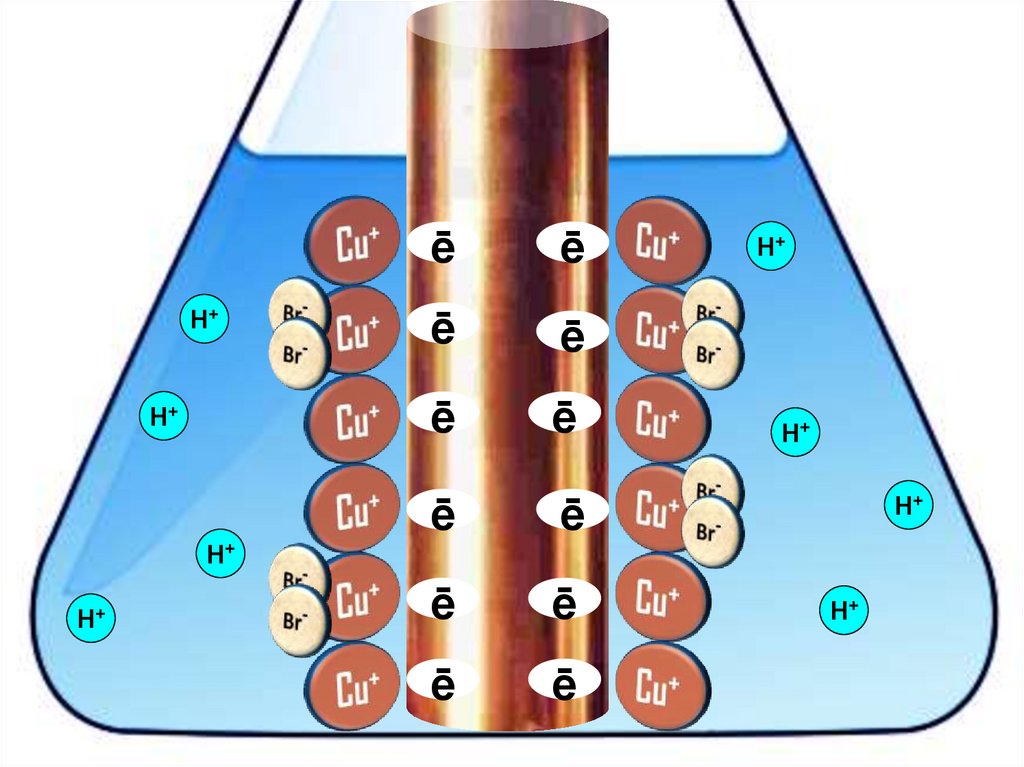
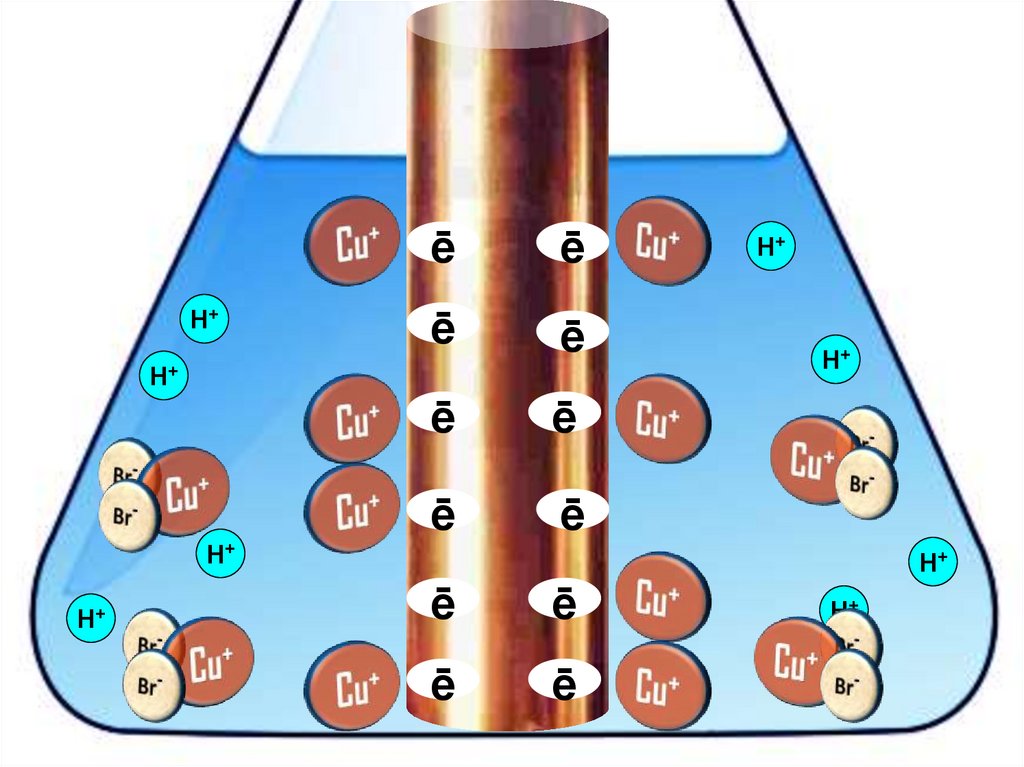
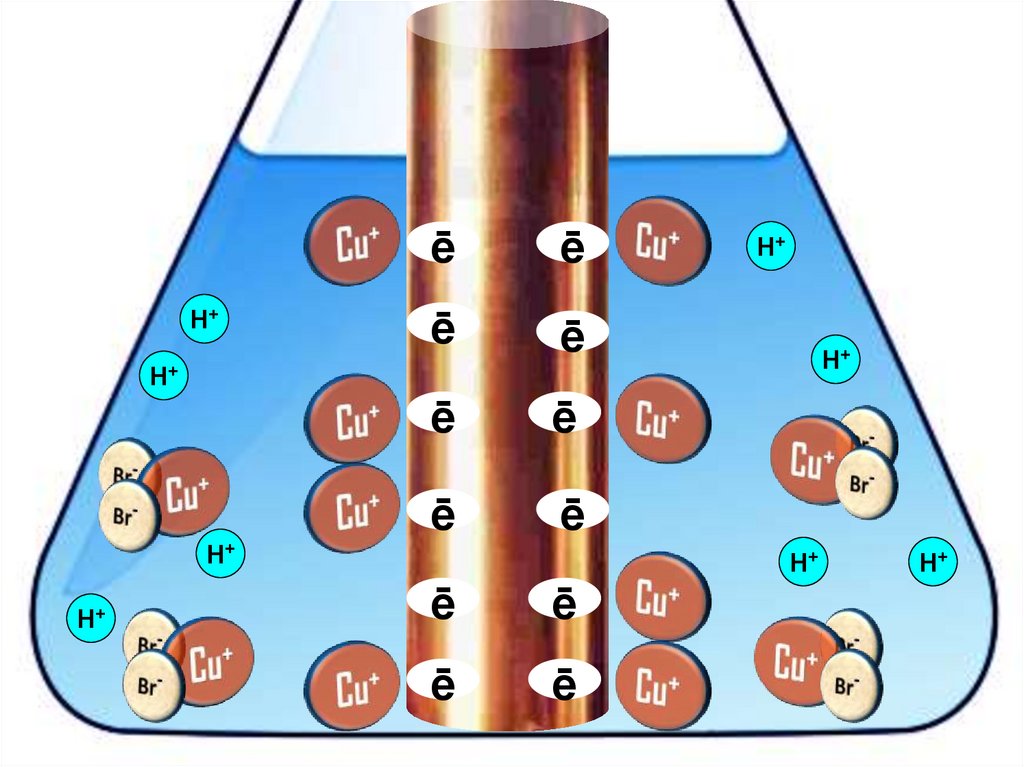
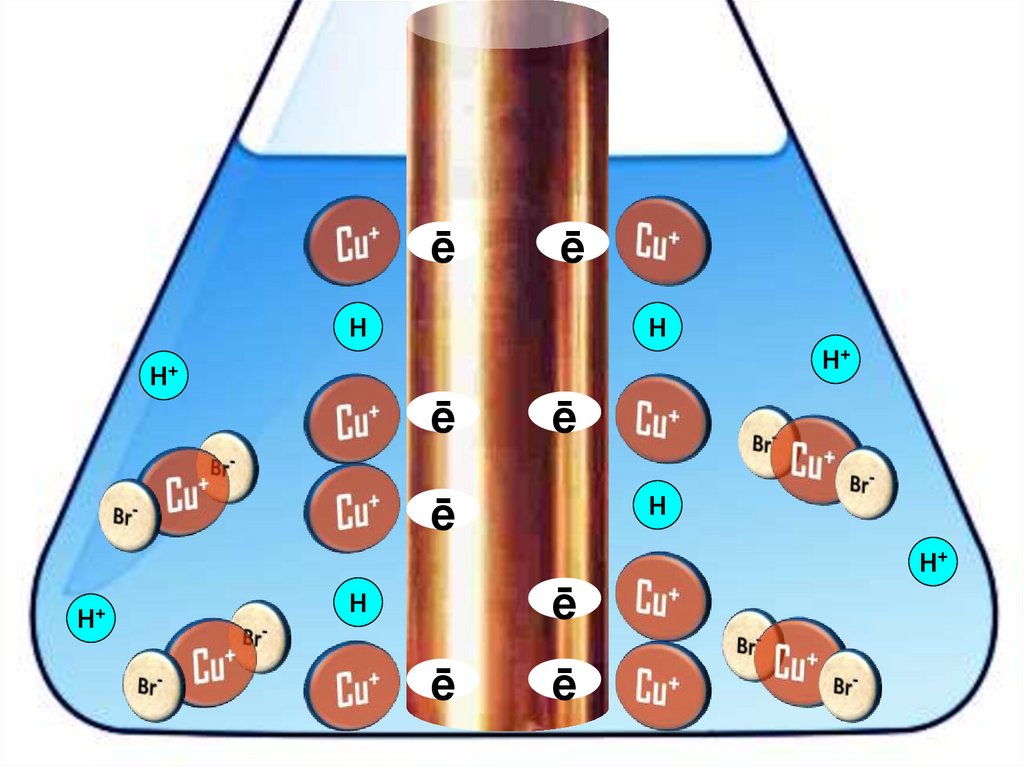
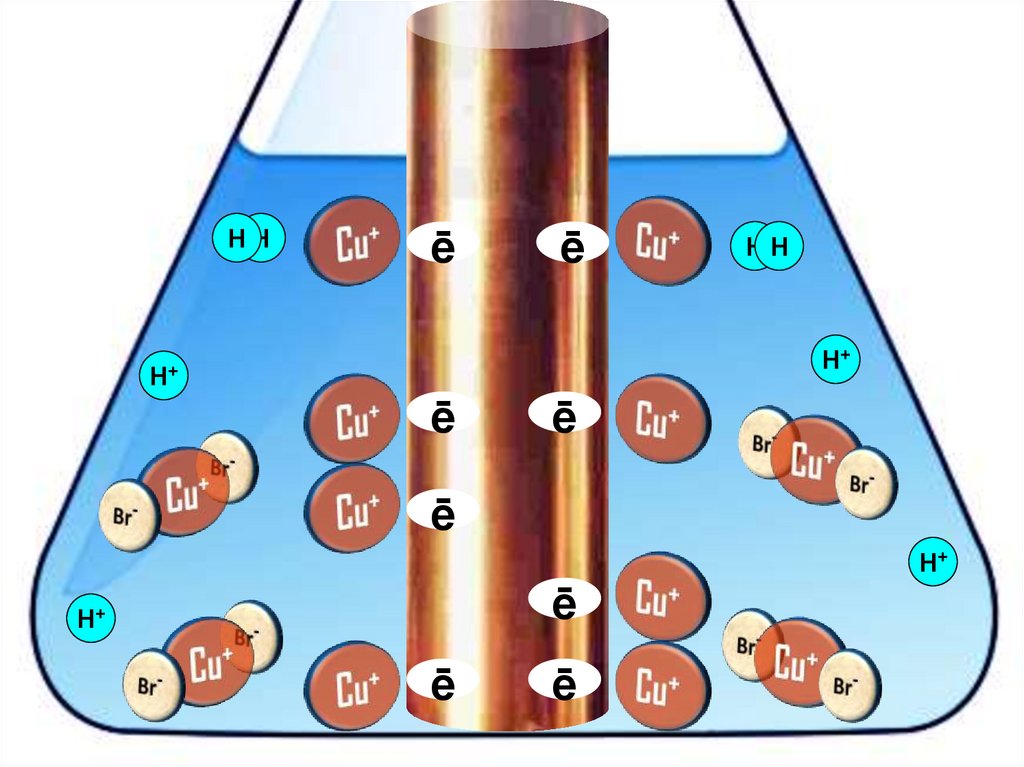
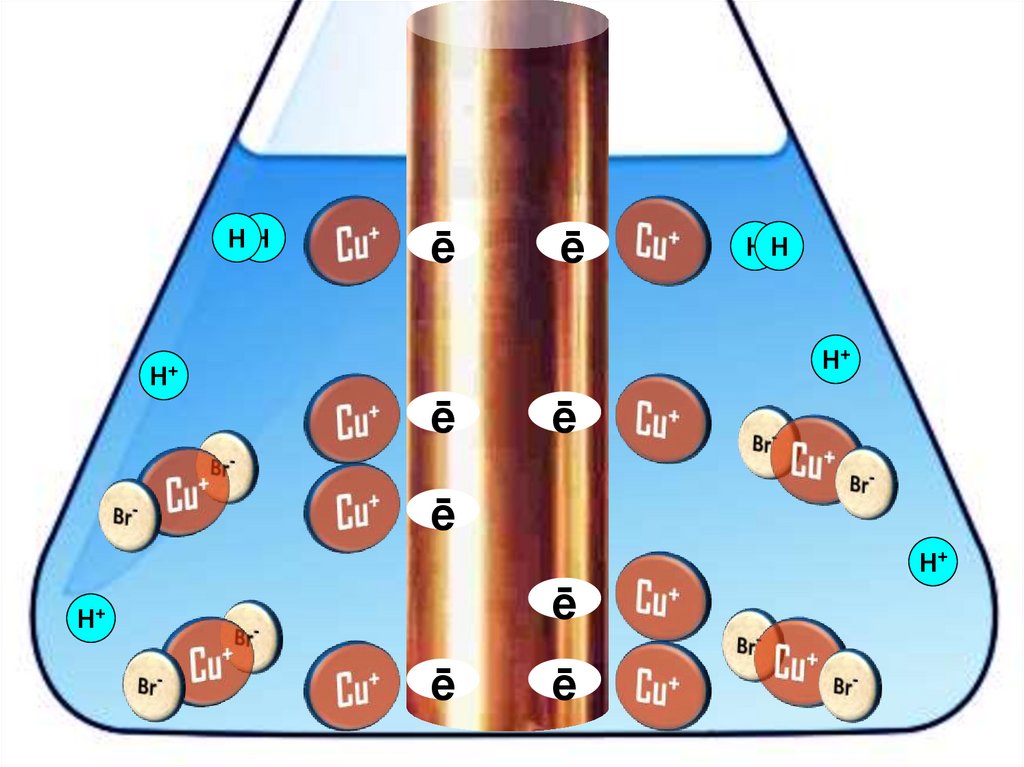
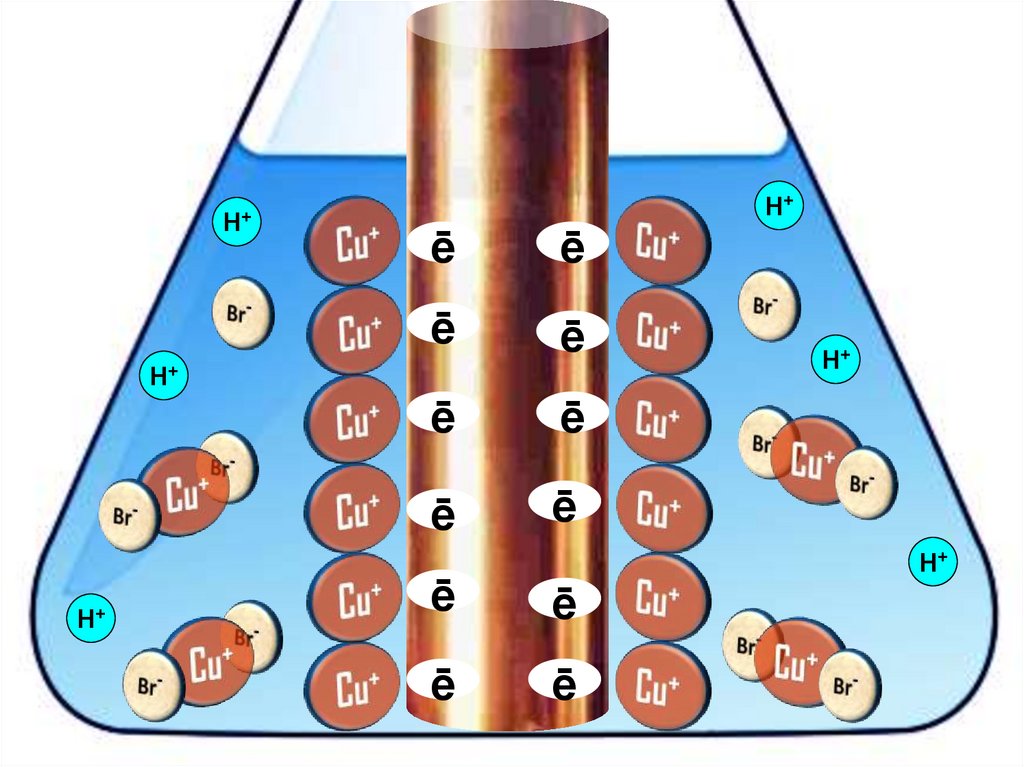
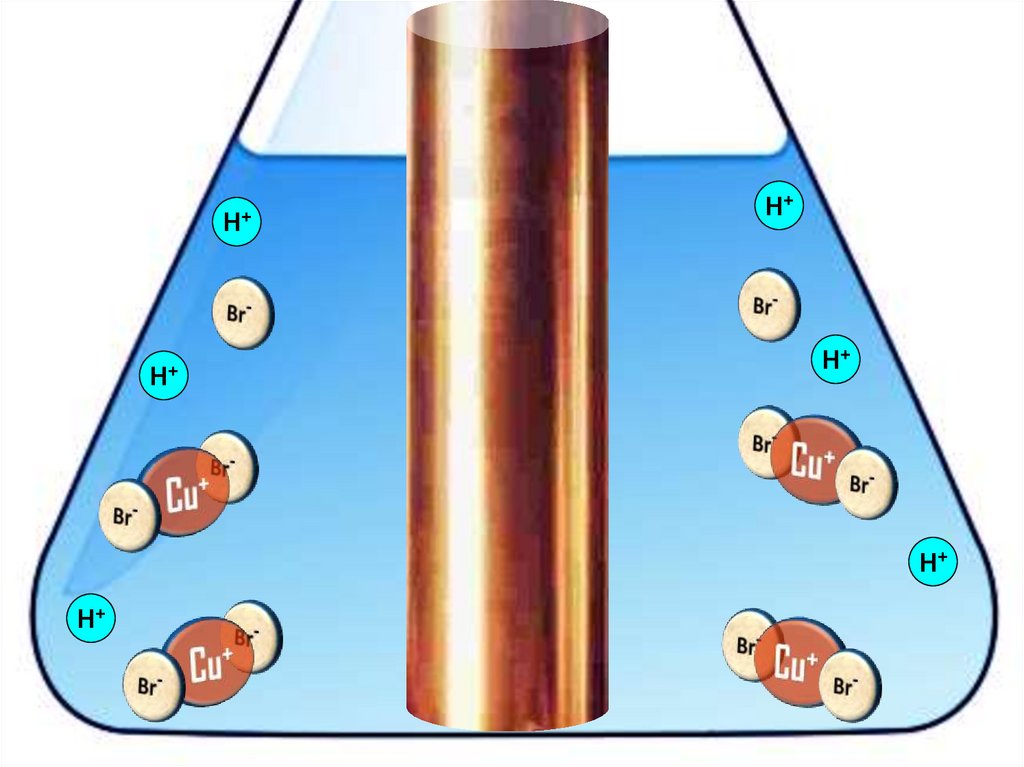
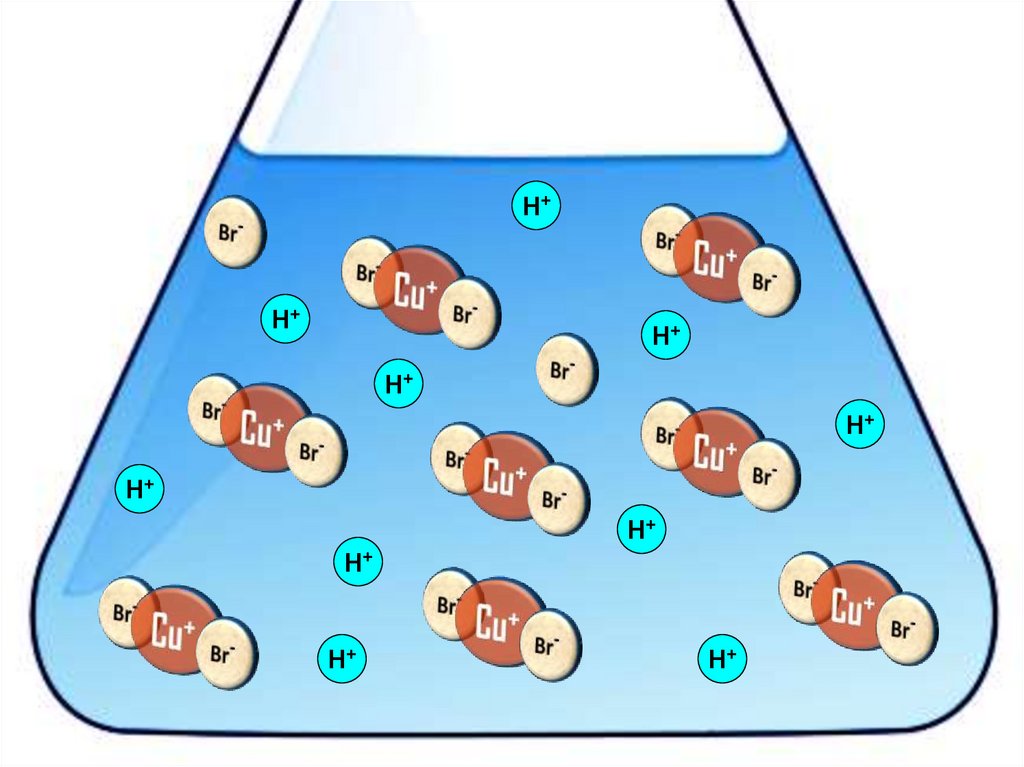
Взаимодействие меди с бромоводороднойкислотой
4HBr + 2Сu = 2H[CuBr2] + H2↑
21.
22.
H+H+
H+
H+
H+
H+
H+
H+
23.
ēH+
H+
ē
ē
H+
H+
ē
H+
H+
H+
ē
H+
24.
H+H+
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
H+
H+
H+
H+
H+
H+
25.
H+H+
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
ē
H+
H+
H+
H+
H+
H+
26.
H+ē
ē
ē
ē
ē
ē
ē
ē
H+
H+
H+
H+
H+
H+
ē
ē
ē
ē
H+
27.
H+ē
ē
ē
ē
ē
ē
ē
ē
H+
H+
H+
H+
H+
H+
ē
ē
ē
ē
H+
28.
ēē
H
H
H+
H+
ē
ē
ē
H
H+
H+
ē
H
ē
ē
29.
HHē
ē
HH
H+
H+
ē
ē
ē
H+
ē
H+
ē
ē
30.
HHē
ē
HH
H+
H+
ē
ē
ē
H+
ē
H+
ē
ē
31.
H+H+
ē
ē
ē
ē
ē
ē
ē
ē
H+
H+
H+
H+
ē
ē
ē
ē
32.
H+H+
H+
H+
H+
H+
33.
H+H+
H+
H+
H+
H+
H+
H+
H+
H+
34.
Соединения медиИзучение амфотерных свойств
35.
Взаимодействие оксида меди(I) с соляной кислотой (1),гидроксидом аммония (2)
и гидроксидом натрия(3):
исходные образцы
начало опыта
через 20 мин
1) Cu2Oт + 2HClр = 2CuCl т + H2O
СuClт + HClр = H[CuCl2]р
2) Cu2Oт + 4NH3.H2Oж = 2[Cu(NH3)2]OHр
3) Cu2O т + 2NaOHр + H2Oж = 2Na[Cu(OH)2]р
36.
Взаимодействие оксида меди(II) с соляной кислотой (1),гидроксидом аммония (2)
и гидроксидом натрия(3):
исходные образцы
1)
2)
3)
после добавления реактивов
CuO т + 2HCl р = CuCl2 ж + H2O ж
CuO т + 4NH3.H2O ж = [Cu(NH3)4](OH)2 р
CuO т + 2NaOH р + H2O = Na2[Cu(OH)4]
р
37.
Взаимодействие гидроксида меди(II) с солянойкислотой (1), гидроксидом аммония (2)
и гидроксидом натрия(3):
исходные образцы
1) Cu(OH)2 т + 2HCl р =
после добавления реактивов
CuCl2 ж + 2H2O ж
2) Cu(OH)2 т + 4NH3.H2O ж = [Cu(NH3)4](OH)2
3) Cu(OH)2 т + 2NaOH р = Na2[Cu(OH)4] р
р
+ 4H2O
38.
Выводы:39.
Выводы:1. В условиях школьной лаборатории
выбраны и освоены методики, проведены
опыты и получены данные, подтверждающие:
- взаимодействие меди с разбавленной H2SO4 и
концентрированной HCl, c HBr;
- растворение меди в водных растворах
аммиака и хлорида железа(III);
- амфотерные свойства Сu2O, CuO и Cu(OH)2, а
также растворение этих соединений в водном
растворе аммиака.
40.
Показана возможность развитиянаших представлений об окружающих
предметах и явлениях.
41.
Создан информационный ресурсдля проведения уроков по теме
«Медь и ее соединения».























 chemistry
chemistry








