Similar presentations:
Подгруппа Меди
1.
ПОДГРУППА МЕДИ2.
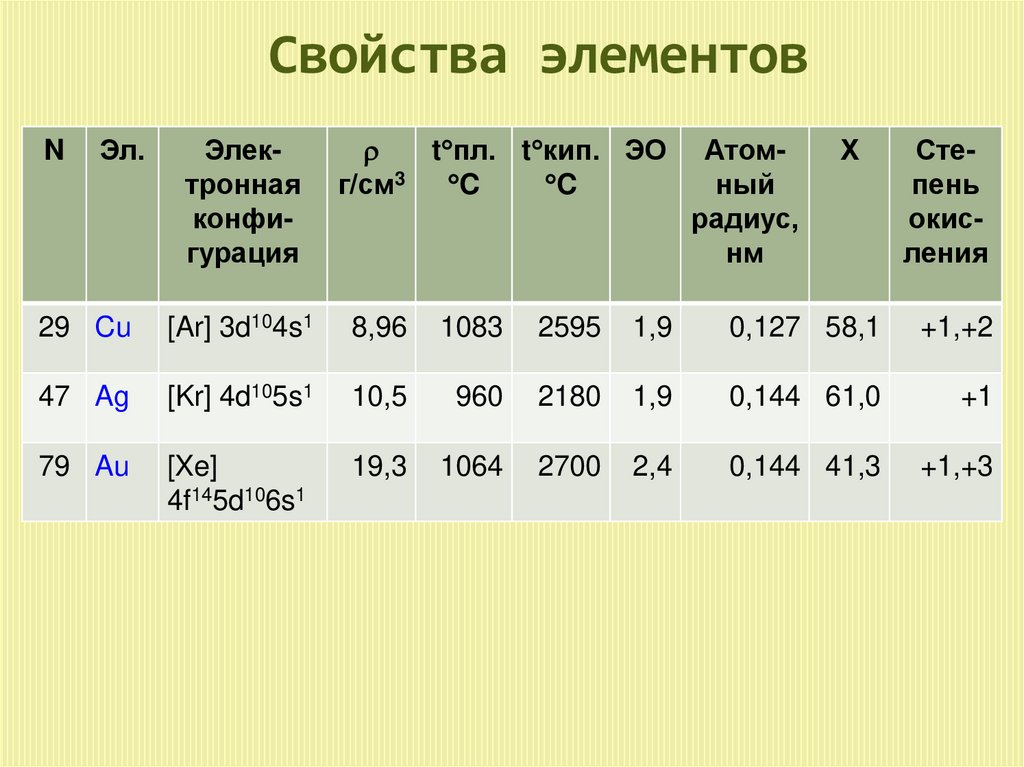
Свойства элементовN
Эл.
Электронная
конфигурация
t пл. t кип. ЭО
r
г/см3 C
C
Атомный
радиус,
нм
Χ
Степень
окисления
29 Cu
[Ar] 3d104s1
8,96
1083
2595
1,9
0,127 58,1
+1,+2
47 Ag
[Kr] 4d105s1
10,5
960
2180
1,9
0,144 61,0
+1
79 Au
[Xe]
4f145d106s1
19,3
1064
2700
2,4
0,144 41,3
+1,+3
3.
Медь, серебро и золото относятся к d-элементам.Электронная формула ...(n-1)s2p6d10ns1. Хотя
предпоследний уровень полностью заполнен, он не
достаточно стабилен и поэтому элементы могут
проявлять различные валентности и степени
окисления.
По сравнению с щелочными металлами притяжение
наружных электронов к ядру сильнее, т.к. радиус
атомов меньше и химическая активность (идет
заполнение предыдущего уровня) значительно ниже.
В ряду напряжения все эти элементы стоят после
водорода, т.е. не вытесняют его из кислот. Серебро и
золото на воздухе не окисляются, гидридов все три
элемента не образуют. Являются хорошими
комплексообразователями. Склонны к образованию
интерметаллических соединений.
4.
МедьВ природе встречается в виде следующих соединений:
Cu2S – медный блеск, Cu2O - куприт,
CuFeS2 - медный колчедан, Cu2(OH)2CO3 - малахит.
Получение
Для производства меди значение имеют сульфидные руды.
Переработка основана на том, что сульфиды переводят в
оксиды обжигом , затем оксид восстанавливают.
Cu2S+2О2=2CuO+SO2
- Пирометаллургия:
CuO + C = Cu + CO
CuO + CO = Cu + CO2
- Гидрометаллургия:
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
Полученная "черновая" медь содержит в качестве примесей
Fe, Zn, Pb, Bi, Sb.
5.
Для получения чистой электротехнической медиее подвергают рафинированию, т.е. в
электролизную ванну в качестве анода помещают
"черновую" медь, в качестве катода - чистую медь,
Электролит - раствор сульфата меди. Процесс
электролиза ведут таким образом, чтобы на
катоде шло восстановление только меди, а
примеси уходили в шлам. В чистом виде медь металл красного цвета, вязкий, пластичный, с
высокой тепло- и электропроводностью.
Электролиз:
2CuSO4 + 2H2O = 2Cu
+
(на катоде)
O2 + 2H2SO4
(на аноде)
6.
Халькози́ н (греч. χαλχοζ — медь), ме́дный блеск7.
Куприт8.
МАЛАХИТ9.
Медный колчедан10.
Химические свойстваВзаимодействует с неметаллами при высоких температурах.
Фтор, хлор, бром реагируют с медью, образуя галогениды:
Cu+Сl2= CuСl2
При взаимодействии иода с нагретым порошком меди
получается иодид одновалентной меди:
2Cu+I2= 2CuI
Медь горит в парах серы:
Cu+S = CuS
Медь стоит в ряду напряжений правее водорода, поэтому не
реагирует с разбавленными соляной и серной кислотами, но
растворяется в кислотах – окислителях:
3Cu + 8HNO3(р) = 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 +2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
11.
При прокаливании на газовой горелке медьпокрывается черным налетом оксида меди (II)
CuO:
2Cu+O2=2CuO
Если быстро опустить в воду раскаленный
докрасна кусок меди, то на его поверхности
образуется ярко-красная пленка Cu2O:
4Cu+O2=2Cu2O
Оба оксида в воде не растворимы.
Соответствующие основания:
CuOH - желтого цвета,
Cu(OH)2 - голубого цвета.
12.
Медь химически малоактивна и в чистом сухомвоздухе не изменяется. Однако атмосфера, в
которой мы живем, содержит водяные пары и
углекислый газ, поэтому со временем медь
покрывается зеленоватым налетом основного
карбоната меди (ядовитое):
2Cu+O2+СО2+Н2О=Cu(ОН)2•CuСО3
13.
Белград14.
Соединения одновалентной медиВстречаются либо в нерастворимых соединениях
(Cu2O, Cu2S, CuCl), либо в виде растворимых
комплексов (координационное число меди – 2):
CuCl + 2NH3 = [Cu(NH3)2]Cl
Оксид меди (I) – также можно получать
восстановлением соединений меди (II),
например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH =
Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Гидроксид меди CuOH (желтого цвета) получают:
CuCl + NaOH = CuOH + NaCl
15.
Соединения двухвалентной медиОксид меди (II) восстанавливается под действием
сильных восстановителей (например, CO) до меди.
Обладает основным характером, при нагревании
растворяется в кислотах:
CuO + H2SO4 = CuSO4 + H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде
вещество светло-голубого цвета. Образуется при
действии щелочей на соли меди (II):
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 = CuO + H2O
16.
Амфотерное основание. Растворяется в кислотах ищелочах:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Растворяется в растворе аммиака с образованием
комплексного соединения (координационное число
меди – 4) василькового цвета (реактив Швейцера,
растворяет целлюлозу):
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3 искусственно можно
получить по реакции:
2CuSO4 + 2Na2CO3 + H2O =
Cu2(OH)2CO3 + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 = 2CuO + CO2 + H2O
17.
Соли меди в водных растворах, как правило,окрашены в зелено-голубой цвет, многие из
них образуют кристаллогидраты:
CuSO4.5H2O, CuCl2.4H2O, Cu(CH3COO)2.2H2O.
Используются как средство борьбы с
вредителями и для протравки семян.
Медь имеет большое значение в технике при
производстве сплавов, это латуни, бронзы и
медно-никелевые.
18.
Приблизительный состав некоторых наиболееизвестных сплавов на основе меди:
бронза (обычная) - 90% Сu + 10% Sn
томпак - 90 % Cu + 10 % Zn
манганин - 86 % Сu + 12 % Мn + 2 % Ni;
мельхиор - 68 % Cu + 30 % Ni + 1 % Мn + 1 % Fе
нейзильбер - 65 % Сu +20 % Zn +15 % Ni
латунь (обычная) - 60 % Сu + 40 % Zn
константан - 59 % Сu +40 % Ni +1 % Мn.
19.
Для выделки украшений пригодензолотистый сплав, состоящий из 85 % Сu,
13 % Zn и 2 % Sn. Еще более похож на
золото сплав состава 90 % Сu, 7,5 % Al и 2 %
Au. Разменная монета СССР содержала 95
% Сu и 5 % Аl (до 5 коп.) или 80 % Сu и 20 %
Ni (10 коп. и выше). Легко растирающийся в
порошок сплав состава 50 % Cu, 45 % Al, 5
% Zn («сплав Деварда») иногда
применяется в качестве восстановителя.
Из воды сплав этот выделяет водород уже
на холоду.
20.
СЕРЕБРОВ природе встречается в самородном состоянии,
в виде минерала аргентита - Ag2S, до 1% серебра
содержится в свинцовых рудах.
Получают серебро из сульфидной руды
гидрометаллургическим способом переводом
его в цианид с последующим восстановлением
цинком:
Ag2S +4KCN = 2K[Ag(CN)2] + K2S
2K[Ag(CN)2] + Zn = 2Ag + K2[Zn(CN)4]
Серебро - белый, блестящий металл с высокой
пластичностью. Обладает самой высокой
электропроводностью.
21.
Аргентит22.
Название элемента происходит отдревнегреческого слова argentos
(происходящий от света).
В честь серебра названа целая страна
– Аргентина. Первое использование
имени “Аргентина”, может быть
найдено в отчетах первых
путешествий испанских и
португальских завоевателей в Рио-дела-Плата (что означает “Серебряная
река”), в начале 16 века.
23.
Химические свойстваБлагородный металл, устойчивый на воздухе.
При потускнении серебра происходит реакция
Гепара:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Ag2 S -наиболее труднорастворимая соль серебра
В ряду напряжений находится правее водорода,
поэтому растворяется только в кислотах окислителях:
3Ag + 4HNO3(р) = 3AgNO3 + NO + 2H2O
Ag + 2HNO3(к) = AgNO3 + NO2 + H2O
2Ag + 2H2SO4(к) = Ag2SO4 + SO2 + 2H2O
24.
В соединениях серебро обычно проявляет степеньокисления +1. Растворимый нитрат серебра
AgNO3 используется как реактив для качественного
определения галоген-ионов:
Ag+ + Cl- = AgCl ↓
белый
Ag+ + Br- = AgBr ↓ светло-жёлтый
Ag+ + I- = AgI ↓ тёмно-жёлтый
Способность этих осадков образовывать
растворимые комплексные соединения
уменьшаются в ряду AgCl – AgBr – AgI. На свету
галогениды серебра постепенно разлагаются с
выделением серебра.
При добавлении растворов щелочей к раствору
AgNO3 образуется тёмно-коричневый осадок
оксида серебра Ag2O:
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
25.
Осадки AgCl и Ag2O растворяются в растворахаммиака с образованием комплексных соединений
(координационное число серебра – 2):
AgCl + 2NH3 = [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH
Коричневый осадок Ag2O плохо растворим в воде,
однако при добавлении фенолфталеина раствор
окрашивается в розовый цвет за счет образования
гидроксида серебра:
Ag2O + H2O = 2AgOH
Равновесие этой реакции сильно сдвинуто влево.
Ag2O - хороший восстановитель и с глюкозой дает
реакцию "серебряного зеркала":
Ag2O + C6H12O6 = 2Ag + C6H12O7 (глюконовая кислота)
26.
Из солей серебра в воде растворима только AgNO3.Серебро хороший комплексообразователь,
образует аммиачные, циано- и тиосульфатные
комплексы:
AgCl + 2NH3 = [Ag(NH3)2]Cl
AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
На последней реакции основано действия
закрепителя в фотографии, когда незасвеченные
участки на фотопленке, содержащие AgBr
растворяются тиосульфатом натрия.
85% всего добываемого серебра идет на
изготовление светочувствительных слоев для
фото- и кинопромышленности. Серебро
используется в электро- и радиотехнической
промышленности, в ювелирном деле, медицине.
27.
ЗОЛОТОВ природе встречается в самородном состоянии и в виде
минералов AuTe2 - калаверит, AgAuTe4 - сильванит.
Золото - мягче Cu и Ag, ковкий металл; легко образует
тончайшую фольгу; благородный металл, устойчив как в
сухом, так и во влажном воздухе.
Золото является основой денежной системы большинства
стран. Помимо этого, золото применяется в
электротехнической промышленности, употребляется для
выделки различных предметов роскоши, золочения других
металлов и т. и. Соединения золота используются главным
образом в фотографии и в медицине.
Мировая добыча золота составляла в 1800 г. - 18 т,
в
1900 г. - 400 т. В настоящее время ежегодно добывают
около 1500 т. Золотой запас всех зарубежных стран
оценивается в 50 тыс. т.
28.
Калаверит29.
Сильванит30.
Для извлечения Au размолотуюзолотосодержащую породу обрабатывают при
доступе воздуха очень разбавленным (0,03–
0,2%) раствором NaCN. При этом золото по
уравнению:
4Au + 8NaCN + 2H2O + О2 = 4Na[Au(CN)2] + 4NaOH
переходит в раствор, из которого затем
выделяется действием металлического цинка:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Очистка полученного тем или иным
путем золота от примесей («аффинаж»)
производится чаще всего обработкой его горячей
концентрированной H2SO4 или при
помощи электролиза.
31.
Золото — самый инертный металл, стоящий в рядунапряжений правее всех других металлов, при
нормальных условиях оно не взаимодействует с
большинством кислот и не образует оксидов,
благодаря чему было отнесено к благородным
металлам. Затем была открыта способность царской
водки растворять золото, что поколебало
уверенность в его инертности:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 = 2AuCl3
Соединения термически не очень устойчивы и
разлагаются при нагревании с выделением
металла. Комплексообразователь (комплексы
золота (III) обладают координационными числами 4,
5 и 6).
32.
Наиболее устойчивая степень окислениязолота в соединениях +3, в этой степени
окисления оно легко образует с
однозарядными анионами (F−, Cl−. CN−)
устойчивые плоские квадратные комплексы
[AuX4]−. Относительно устойчивы также
соединения со степенью окисления +1, дающие
линейные комплексы [AuX2]−. Высшая из
возможных степеней окисления золота
Au+5 (фторид AuF5, соли комплекса [AuF6]−):
2Au + 5KrF2 → 2AuF5 + 5Kr↑
Соединения золота(V) стабильны лишь со
фтором и являются сильнейшими
окислителями.
33.
Степень окисления +2 для золота нехарактерна,в веществах, в которых она формально равна 2,
половина золота, как правило, окислена до +1, а
половина — до +3, например, правильной
ионной формулой сульфата золота(II)
AuSO4 будет не Au2+(SO4)2−, а Au1+Au3+(SO4)2−2.
Из чистых кислот золото растворяется только в
горячей концентрированной селеновой кислоте:
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Золото сравнительно легко реагирует
с кислородом и другими окислителями при
участии комплексобразователей. Так, в водных
растворах цианидов при доступе кислорода
золото растворяется, образуя цианоаураты:
4Au + 8КCN + 2H2O + O2 → 4К[Au(CN)2] + 4КOH
34.
В случае реакции с хлором возможностькомплексообразования также значительно облегчает
ход реакции: если с сухим хлором золото реагирует
при ~200 °С с образованием хлорида золота(III), то в
водном растворе золото растворяется с образованием
хлораурат-иона уже при комнатной температуре:
Au + Cl2 + 2Cl− = [AuCl4]−
Золото легко реагирует с жидким бромом и его
растворами в воде и органических растворителях,
давая трибромид золота - AuBr3.
Со фтором золото реагирует в интервале температур
300−400°C, при более низких реакция не идёт, а при
более высоких фториды золота разлагаются.
Золото также растворяется во ртути, фактически
образуя легкоплавкий сплав (амальгаму).

































 chemistry
chemistry








