Similar presentations:
Теория горения и взрывов. Горючее вещество. Лекция 1
1.
Лекция 1Теория горения и
взрывов
доктор технических наук, профессор
Лепешкин Олег Михайлович
2.
• Горением называется физико-химический процесс, при которомгорючие вещества под воздействием высоких температур
вступают в химическое взаимодействие с окислителем
превращаясь в продукты горения.
• Горение сопровождается интенсивным выделением теплоты и
световым излучением.
• По этим признакам горение можно отличить от других явлений.
Например, горение электрической лампочки нельзя назвать горением,
хотя при этом выделяется теплота и излучается свет. В этом явлении
нет одного из главных признаков горения — химической реакции,
приводящей к выделению огромного количества теплоты с последующим образованием пламени.
• Горение в большинстве случаев сложный химический процесс,
состоящий из реакций окислительно-восстановительного типа. Для
возникновения горения необходимы определенные условия.
3.
Условия для возникновения горения.Для возникновения, развития и распространения
процесса горения и его длительного существования
необходимо выполнение определенных условий, без
которых этот процесс невозможен.
Для возникновения горения необходимы:
* наличие горючей смеси, т. е. определенное
сочетание горючего вещества с окислителем (обычно
кислородом воздуха);
* инициация реакции между горючим веществом и
окислителем.
Основными факторами, определяющими возникновение
реакции между горючим веществом и окислителем,
являются:
* нагревание горючей смеси до температуры
самовоспламенения или самовозгорания;
* воздействие внешнего источника зажигания (ИЗ).
4.
При возникновении горения в случае нагревания горючейсмеси
до
температуры
самовоспламенения
или
самовозгорания процесс горения осуществляется в режиме
самовоспламенения (самовозгорания). При возникновении
горения от источника зажигания происходит вынужденное
воспламенение или вынужденное зажигание горючей смеси.
Основными условиями вынужденного зажигания являются:
* наличие горючего вещества или горючей смеси веществ;
* наличие окислителя;
* наличие источника зажигания, под воздействием
которого начинается протекание химических реакций
горения между компонентами горючей смеси.
5.
ГОРЮЧЕЕ ВЕЩЕСТВОГорючее вещество — это вещество, способное к горению. Горючие
вещества характеризуются горючестью.
Горючесть — это способность вещества или материала к
распространению пламенного горения или тления.
Горючесть веществ характеризуется физико-химическими
свойствами, агрегатным состоянием, особенностями загорания и
горения.
По горючести вещества или материалы подразделяются на три
группы:
*
негорючие (несгораемые);
*
трудногорючие (трудносгораемые);
*
горючие (сгораемые).
6.
Негорючие вещества не могут гореть на воздухе (металлы, ихсплавы, керамические материалы и др.).
Трудногорючие вещества и материмы могут загораться на
воздухе от источника зажигания, но не способны
самостоятельно гореть после его удаления. К таким веществам
относятся полихлорвиниловая плитка, фенолформальдегидный
стеклопластик,
древесина,
подвергнутая
поверхностной
огнезащитной обработке и др.
Горючие вещества и материалы способны самовозгораться
или возгораться от источника зажигания и самостоятельно
гореть после его удаления (древесина, торф, уголь,
нефтепродукты, органические химические вещества и пр.)
7.
Горючее вещество и окислитель образуют горючую смесь —горючую систему.
Горючие вещества или системы могут быть химически
однородными и химически неоднородными.
Химически однородные горючие системы — это смеси
горючих газов, паров или пылей с воздухом, в которых
равномерно перемешаны горючее вещество и воздух. Горение
таких горючих смесей называется гомогенным.
Хищнически неоднородные горючие системы — это системы,
в которых горючее вещество и воздух не перемешаны и имеют
границу раздела фаз. Чаще всего химически неоднородные
системы - это твердые вещества. Однако такими системами
могут быть и жидкости, находящиеся в воздухе, струи горючих
газов и паров, поступающие в воздух.
Горение таких веществ называется гетерогенным.
8.
Горючие вещества представляют собой сложные химическиесоединения. Элементный химический состав горючего вещества
включает углерод (С), водород (Н), серу (S), а также кислород
(О), азот (N).
Кроме того, в смеси горючих веществ (например, в нефти, мазуте и
др.)
могут
присутствовать
минеральные
примеси,
превращающиеся при сжигании в золу (А) и влагу (W).
Горючая смесь сложного состава, используемая для сжигания с
целью получения теплоты, называется топливом. В общем виде
элементный химический состав топлив может быть представлен
следующим образом:
Ср+ Hp + Op+Np + Sp + Ap + Wp = 100%,
где индекс р означает рабочую массу топлива (%), поступающего к
потребителю.
Например, рабочая масса древесины имеет состав: 49 % С, 6 % Н,
43 % О и 2 % других примесей, включая влагу.
9.
Важное значение имеет содержание в составе топлив золы(А) и влаги (W), так как эти составляющие определяют
качество и теплотехнические характеристики топлив. Для
сравнительной теплотехнической оценки топлив ввели
условные понятия сухой, горючей и органической масс
топлив, Содержание сухой горючей, органической масс
выражается в процентах (%) и обозначается соответственно
индексами «с», «г», «о» вместо рабочей массы «р».
Сухое горючее вещество не содержит влаги, и такое топливо
называется обезвоженным. Элементный состав сухого
горючего топлива записывается с индексом «с» следующим
выражением:
Cc + Hc + Oc + Nc+Sc + Ac= 100 %.
10.
Топливо, которое содержит влагу либо приобретает влагу прихранении, транспортировке, называется воздушно-сухими, и
состав такого топлива записывается с индексом «а»:
Са + H а + О а + Na + S а + A а + W а = 100%.
Безводная и беззольная масса топлив называется горючей, и
состав ее отмечается индексом « г»:
Сг+ Hr + Or + Nr + Sr = 100 %.
Топлива с органической массой - это особый вид топлив, в
которых присутствует сера в виде органических соединений и
отсутствует сера в неорганической форме (например, нет
примесей серного колчедана). Уравнение таких топлив
записываются с индексом «о», указывающим на органическую
массу:
С°+ H° + О о + N o + S°= 100 %.
11.
ОкислителиГорение - сложный химический процесс, состоящий из окислительновосстановительных химических реакций.
В качестве окислителей могут выступать не только кислород или воздух, но и
множество других соединений: хлор, бром, сера, марганцевокислый калий, различные
перекиси и другие кислород о содержащие вещества.
Однако на практике чаще всего горение протекает в атмосфере воздуха.
Воздух представляет собой смесь газов, основными компонентами которого являются:
азот -78,084 %; кислород - 20,948 %, аргон - 0,934 %.
В незначительных количествах присутствуют неон, гелий, криптон, аммиак,
диоксиды углерода и серы и др.
Аргон, содержащийся в воздухе, является инертным газом и в процессе горения
участия не принимает.
Азот также не участвует в химическом взаимодействии с горючим веществом. Однако
азот оказывает существенное влияние на скорость протекания процесса горения.
Присутствие азота следует учитывать, так как он участвует во многих физических процессах, сопровождающих горение: участвует в диффузии воздуха в горючее вещество;
выступает в качестве инертного разбавителя горючего и окислителя (кислорода); влияет
на скорость нагревания и скорость горения горючей смеси.
При составлении уравнения реакции горения вещества в воздухе необходимо
учитывать присутствие азота следующим образом: горючее вещество и участвующий в
горении воздух пишутся в левой части уравнения, а после знака равенства образующиеся продукты реакции..
12.
На примере горения метана (природного газа) составим уравнениегорения.
Для простоты расчетов принимаем, что воздух состоит из 21 %
кислорода и 79 % азота с другими инертными газами, т. е. на
один объем кислорода приходится 79 : 21 = 3,76 объема азота,
или на каждую молекулу кислорода приходится 3,76 молекулы
азота.
Таким образом, состав воздуха может быть представлен
следующим выражением: 03 + 3,76N2.
Исходя из этого выражения, уравнение горения природного газа с
учетом коэффициентов перед формулами будет иметь
следующий вид:
СН4 + 202 + 2 - 3,76 N2 = С02 + 2Н20 + 2 ■ 3,76 N2
Кроме продуктов сгорания: углекислого газа и воды, остается 3,76
молекулы азота. Азот воздуха в процессе горения участия не
принимает, он целиком переходит в продукты сгорания.
13.
Источники воспламенения (зажигания)Для возникновения горения горючее вещество и окислитель должны быть
нагреты до определенной температуры источником теплоты, источником
воспламенения или зажигания.
Источник зажигания (воспламенения) - это любой источник теплоты,
способный нагреть горючее вещество до определенной температуры
(температуры воспламенения или самовоспламенения).
Наиболее распространенными источниками зажигания являются:
*
искры различного происхождения: появляющиеся при неисправности
электрооборудования; при соударении металлических тел, при сварке,
кузнечных работах и т. д.;
*
нагретые тела;
*
теплота, возникающая в результате трения;
*
аппараты огневого действия;
*
искровые заряды статического электричества;
*
теплота адиабатического сжатия;
*
перегрев электрических контактов;
*
химические реакции, протекающие с выделением теплоты;
*
пламя и др.
14.
Полное и неполное горениеПри горении веществ и материалов образуются продукты сгорания. Состав
продуктов сгорания зависит от состава горючего вещества и условий
протекания горения.
Горение может быть полным и неполным, В том случае, когда в зону
горения окислительная среда поступает в количестве, достаточном для
полного окисления компонентов горючего вещества, образуются продукты
полного сгорания. При полном сгорании веществ образуются продукты, не
способные к дальнейшему горению: диоксид углерода, вода, азот,
сернистый ангидрид.
В условиях пожара окислительной средой является воздух. Поэтому в
состав продуктов сгорания будет входить азот, поступающий в зону горения
вместе с кислородом воздуха. В том случае когда в зону горения поступает
воздуха больше, чем требуется по стехиометрии реакции, в состав
продуктов сгорания будет входить и избыток кислорода.
Полное сгорание на практике происходит при избытке кислорода,
15.
Если в зону горения поступает воздуха меньше, чем требуется постехиометрии реакции горения, или когда горение осуществляется при
низкой температуре, кроме продуктов полного сгорания, образуются
продукты неполного сгорания. При неполном сгорании горючих веществ
образующиеся продукты способны к дальнейшему горению. Продуктами
неполного сгорания являются оксид углерода (угарный газ), сажа, продукты
термоокислительной деструкции спиртов, кетоновов и других органических
соединений. Неполное сгорание горючих веществ, происходит при
недостатке кислорода.
Состав продуктов термоокислительной деструкции зависит от природы
горючего вещества, температуры и условий взаимодействия горючей смеси
с окислителем. Если в состав горючего вещества входят С, Н, О, CL, N, то
ими являются углеводороды, диоксины, (хлор- содержащие органические
соединения), синильная кислота, спирты, альдегиды, кислоты, оксиды азота
и т. л. При сгорании древесины, например, образуется более 200
компонентов продуктов сгорания, а при сгорании поливинилхлорида
(полимер ПВХ) образуется более 75 различных компонентов.
Если сгорают неорганические вещества, в составе которых есть Р (фосфор),
Na (натрий), К (калий), Са (кальций), А| (алюминий), Mg (магний), то
продуктами сгорания будут оксиды этих веществ, нахо
16.
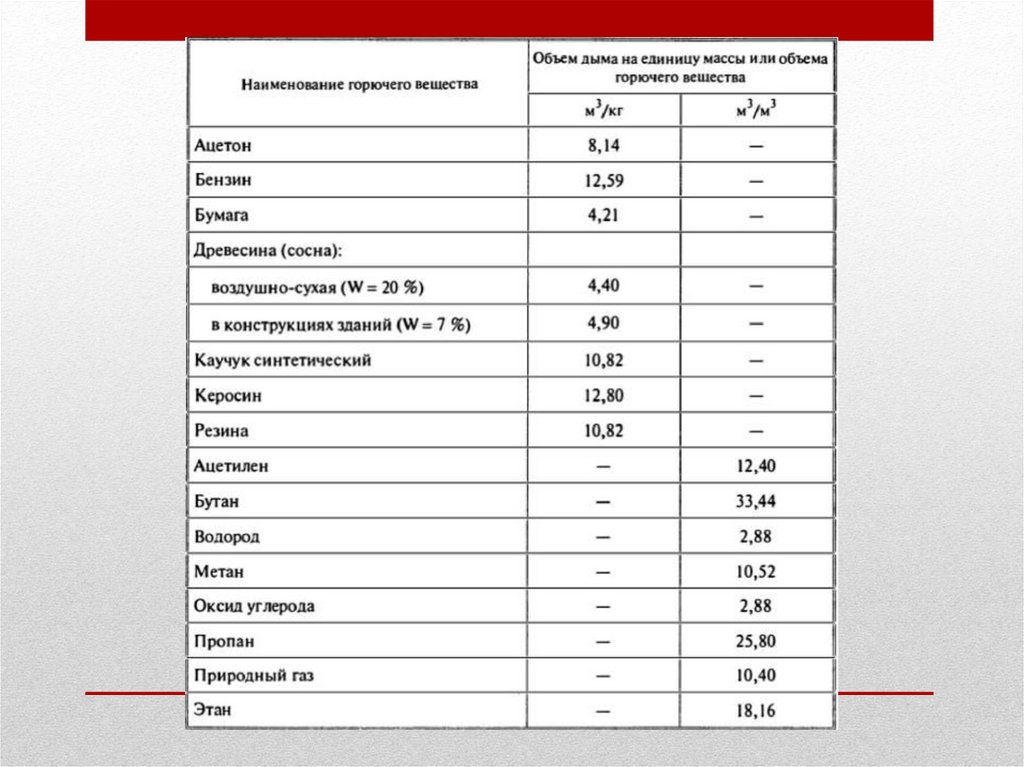
17.
18.
Продукты неполного сгорания, как при термической, так ипри
термоокислительной
деструкции,
являются
токсичными.
Под токсичностью обычно понимают степень вредного
воздействия химического вещества на живой организм. К
числу наиболее опасных соединений в составе продуктов
сгорания которых образуются вещества, характеризующиеся
высокой токсичностью, относятся полимерные материалы,
строительные
материалы
(линоллиум,
пенопласты),
резинотехнические изделия.
При сгорании этих материалов образуются монооксид угрерода
(угарный газ), циановодород, хрористый водород, оксиды
азота, акролеин, фосген и другие опасные вещества. Угарный
газ является наиболее распространенымм продуктом неполного
сгорания. Это бесцветный газ без запаха и вкуса, с плотностью
1,25 кг/м слабо растворимый в воде, который горит синим
пламенем с образованием С02.

















 life safety
life safety warfare
warfare








