Similar presentations:
Лікарські засоби, що діють переважно на Центральну нервову систему (ЦНС). Частина 3. Анальгетики. Лекція 12
1.
Лекція 12. Лікарські засоби, що діютьпереважно на Центральну нервову
систему (ЦНС). Частина 3.
Анальгетики
Література до лекції : Курс лекцій «Фармацевтична хімія»
стор. 90-100.
2.
Анальгетичні (знеболювальні)препарати
Анальгетики поділяють на 2 основні групи:
1. Наркотичні анальгетики – морфін і близькі до нього алкалоїди (опіати)
та синтетичні сполуки, які мають подібні властивості (опіоїди).
2. Ненаркотичні анальгетики, антипіретики та нестероїдні протизапальні
препарати.
3.
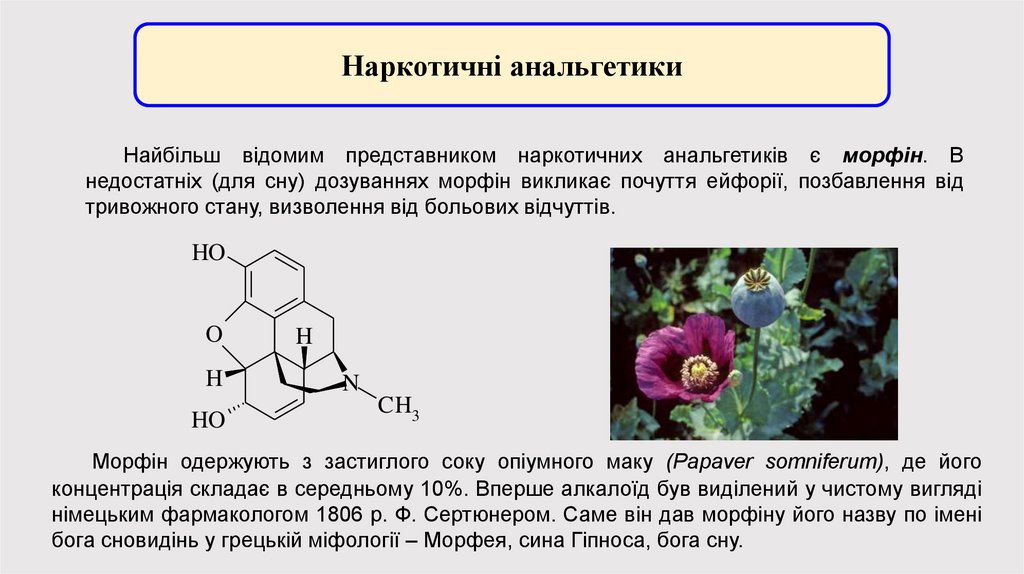
Наркотичні анальгетикиНайбільш відомим представником наркотичних анальгетиків є морфін. В
недостатніх (для сну) дозуваннях морфін викликає почуття ейфорії, позбавлення від
тривожного стану, визволення від больових відчуттів.
HO
O
H
HO
H
N
CH3
Морфін одержують з застиглого соку опіумного маку (Papaver somniferum), де його
концентрація складає в середньому 10%. Вперше алкалоїд був виділений у чистому вигляді
німецьким фармакологом 1806 р. Ф. Сертюнером. Саме він дав морфіну його назву по імені
бога сновидінь у грецькій міфології – Морфея, сина Гіпноса, бога сну.
4.
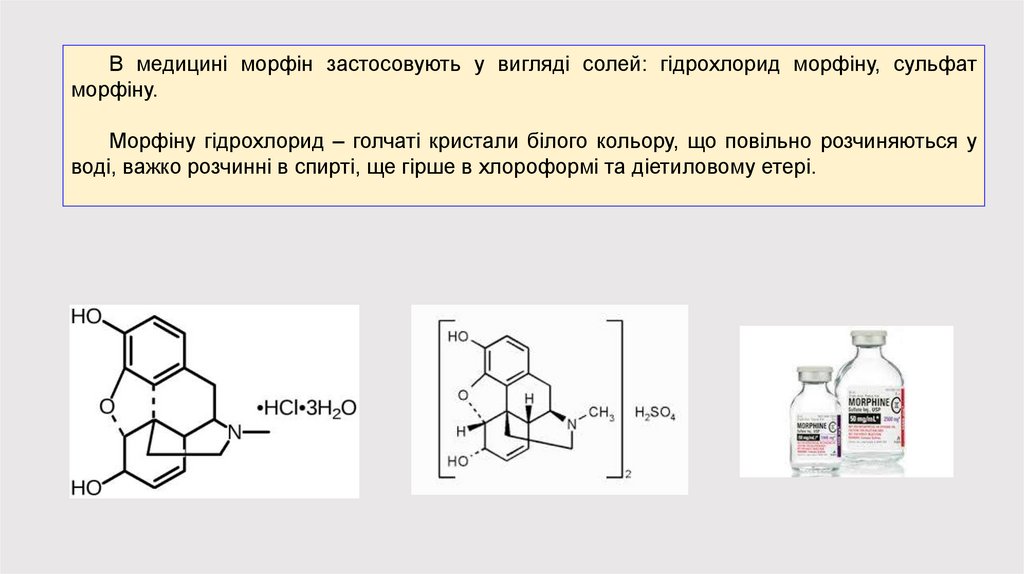
В медицині морфін застосовують у вигляді солей: гідрохлорид морфіну, сульфатморфіну.
Морфіну гідрохлорид – голчаті кристали білого кольору, що повільно розчиняються у
воді, важко розчинні в спирті, ще гірше в хлороформі та діетиловому етері.
5.
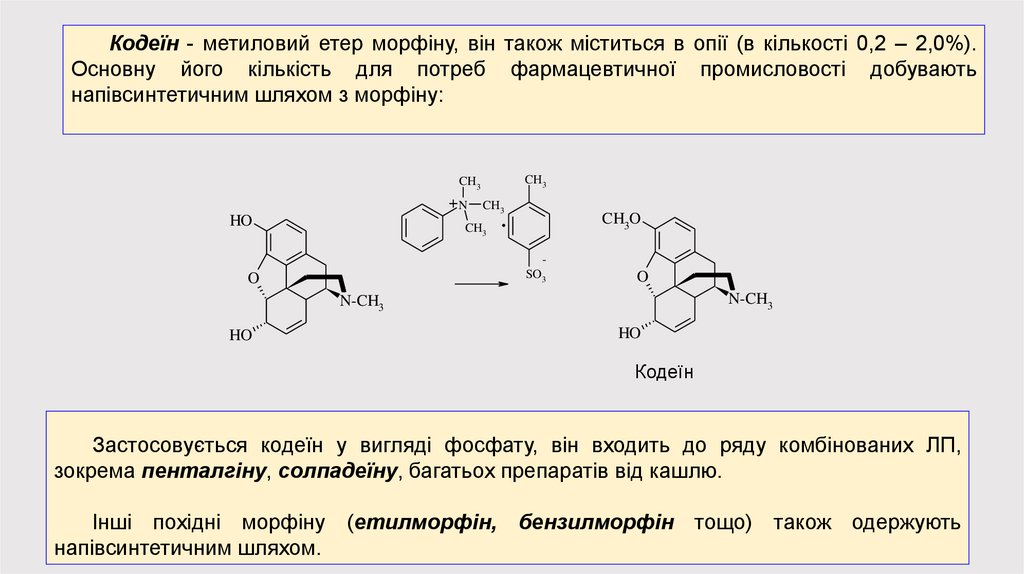
Кодеїн - метиловий етер морфіну, він також міститься в опії (в кількості 0,2 – 2,0%).Основну його кількість для потреб фармацевтичної промисловості добувають
напівсинтетичним шляхом з морфіну:
CH3
CH3
+N
HO
CH3
CH3
.
CH3O
-
SO3
O
O
N-CH3
N-CH3
HO
HO
Кодеїн
Застосовується кодеїн у вигляді фосфату, він входить до ряду комбінованих ЛП,
зокрема пенталгіну, солпадеїну, багатьох препаратів від кашлю.
Інші похідні морфіну (етилморфін, бензилморфін тощо) також одержують
напівсинтетичним шляхом.
6.
• Методи визначення морфіну• ТШХ
• УФ, ІЧ-спектроскопія
• Морфін та його похідні аналізують за хімічними властивостями та наявними
в молекулі функціональними групами:
• наявність фенольного гідроксилу в молекулі доводять реакцією з реактивом
Маркі – утворюється пурпурове забарвлення, яке швидко переходить в синьофіолетове (на відміну від кодеїну);
• реакцією з хлоридом феруму (ІІІ) – утворення синього забарвлення (кодеїн
не містить фенольного гідроксилу, тому цієї реакції не дає);
• утворенням осадів різного кольору с алкалоїдними осаджуючими реактивами.
реактивы Бушарда, Драгендорфа, Майєра, Зонненшейна тощо.
Препарати морфіну та його похідних належать до наркотичних засобів,
тому їх обіг суворо контролюється (Список № 1 «Наркотичні засоби, обіг
яких обмежено»).
7.
Ненаркотичні анальгетики (нестероїдніпротизапальні засоби)
Ненаркотичні
анальгетики
виявляють
знеболювальну,
жарознижуючу
(антипіретичну) дію та протизапальний ефект різної сили. Засоби, що мають яскраво
виражену протизапальну активність називають нестероїдними протизапальними
засобами.
За хімічною будовою ненаркотичні анальгетики поділяють на:
•похідні саліцилової кислоти (натрію саліцилат, ацетилсаліцилова кислота
(аспірин), метилсаліцилат, фенілсаліцилат (салол);
•похідні піразолону (антипірин, анальгін тощо);
•похідні пара-амінофенолу (парацетамол);
•похідні фенілоцтової, фенілпропіонової, індолілоцтової та інших карбонових
кислот (ібупрофен, напроксен, індометацин тощо).
8.
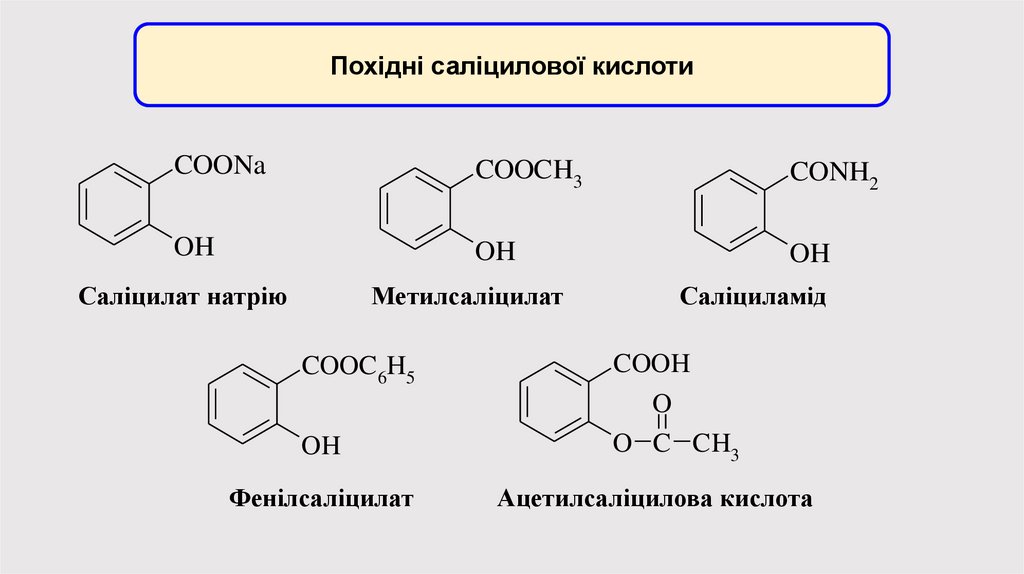
Похідні саліцилової кислотиCOONa
COOCH3
CONH2
OH
OH
OH
Саліцилат натрію
Метилсаліцилат
COOC 6H5
OH
Фенілсаліцилат
Саліциламід
COOH
O
O C CH3
Ацетилсаліцилова кислота
9.
Метод синтезу аспірину (МНН ацетилсаліцилова кислота)COOH (CH CO) O
3
2
OH
60-70oC
COOH
+ CH3COOH
O
O C CH3
1897 р Ф. Хоффман, А. Ейхенгрюн, Г. Дрезер
1982 р. Д. Вейн, С. Бергстрем, Б. Самуельсон
Нобелівська премія:
механізм дії - ацетилсалицилова кислота
пригнічує синтез простгландинів та
тромбоксанів.
1950 р. препарат було занесено до Книги рекордів Гіннесса як анальгетик з
найбільшим об’ємом продажу
10.
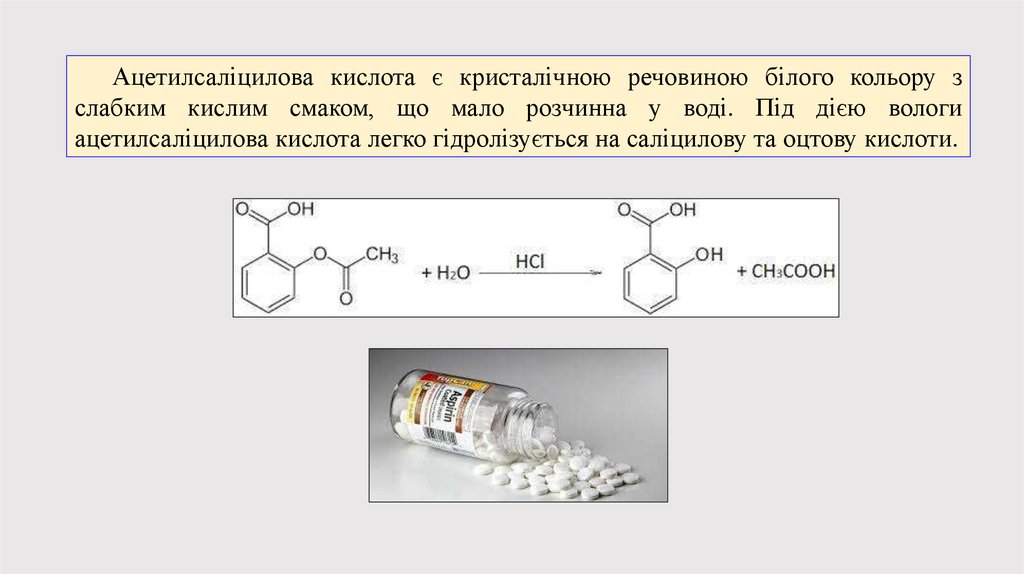
Ацетилсаліцилова кислота є кристалічною речовиною білого кольору зслабким кислим смаком, що мало розчинна у воді. Під дією вологи
ацетилсаліцилова кислота легко гідролізується на саліцилову та оцтову кислоти.
11.
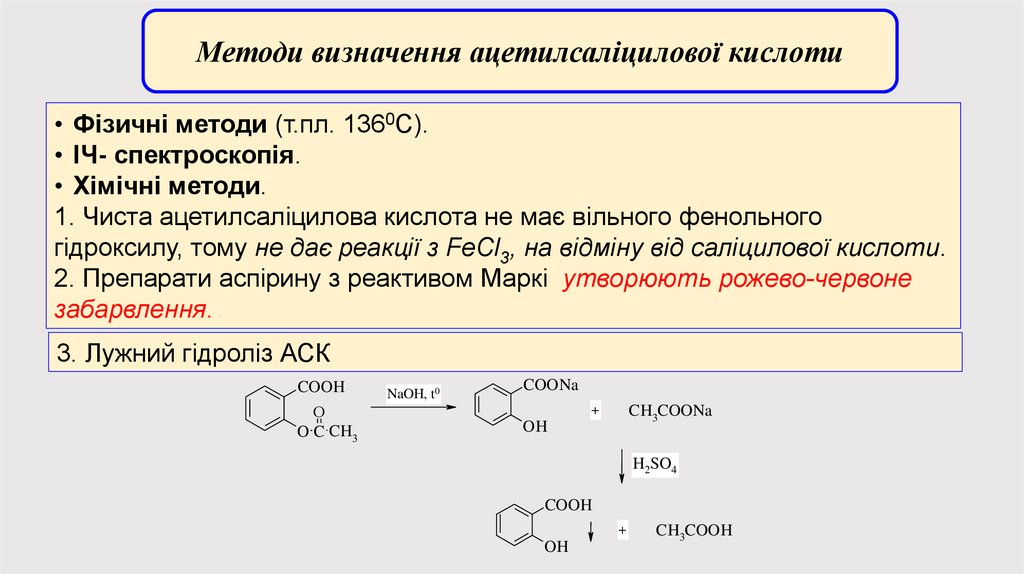
Методи визначення ацетилсаліцилової кислоти• Фізичні методи (т.пл. 1360С).
• ІЧ- спектроскопія.
• Хімічні методи.
1. Чиста ацетилсаліцилова кислота не має вільного фенольного
гідроксилу, тому не дає реакції з FeCl3, на відміну від саліцилової кислоти.
2. Препарати аспірину з реактивом Маркі утворюють рожево-червоне
забарвлення.
3. Лужний гідроліз АСК
COOH
O
O C CH3
NaOH, t0
COONa
CH3COONa
+
OH
H2SO4
COOH
+
OH
CH3COOH
12.
Похідні піразолонуH3C
H3C
H3C
CH3
N CH3
N
N
Антипірін
O
H3C
N
N
O
Амідопірин (пірамідон)
CH3
N CHSO3Na
H3C
H3C
N
N
O
Анальгін (метамізол натрію)
13.
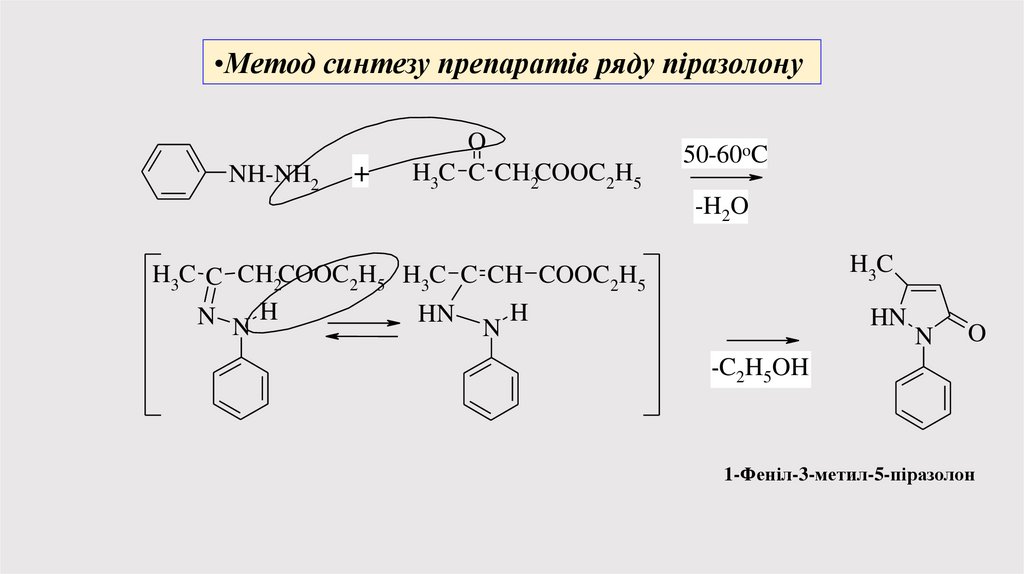
•Метод синтезу препаратів ряду піразолонуNH-NH2
+
O
H3C C CH2COOC2H5
50-60oC
-H2O
H3C
H3C C CH2COOC2H5 H3C C CH COOC2H5
H
HN
N NH
N
HN
N
O
-C2H5OH
1-Феніл-3-метил-5-піразолон
14.
CH3O
N
NH
CH3
CH3
CH3Cl
+
O
NH
N
CH3
Cl -
NaOH
O
N CH
3
N
Антипірин
15.
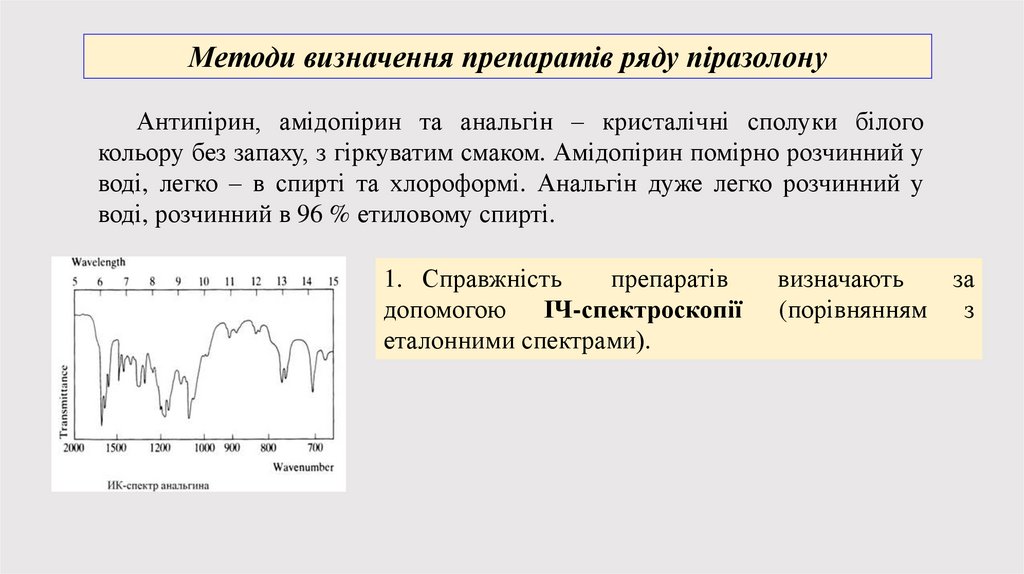
Методи визначення препаратів ряду піразолонуАнтипірин, амідопірин та анальгін – кристалічні сполуки білого
кольору без запаху, з гіркуватим смаком. Амідопірин помірно розчинний у
воді, легко – в спирті та хлороформі. Анальгін дуже легко розчинний у
воді, розчинний в 96 % етиловому спирті.
1. Справжність
препаратів
допомогою ІЧ-спектроскопії
еталонними спектрами).
визначають
(порівнянням
за
з
16.
2. Хімічні реакції по визначенню похідних піразолону ґрунтуються на здатностісполук окиснюватись з утворенням забарвлених продуктів:
• окиснення препаратів Н2О2 – з'являється синє забарвлення, яке швидко зникає і
через декілька хвилин переходить в інтенсивне червоне;
• забарвлення при реакції з FeCl3 (амідопірин – фіолетове забарвлення, яке
згодом зникає, після чого випадає бурий осад, а при додаванні мінеральних кислот
фіолетове забарвлення знову з'являється; анальгін – спочатку синє забарвлення,
яке переходить в червоне, а потім зникає).
• реакція анальгіну на іон натрію – взаємодія з K[Sb(OH)6]. Утворюється осад
білого кольору, який розчиняється в мінеральних кислотах і в розчинах лугів:
Na+ + [Sb(OH)6]– → Na[Sb(OH)6]↓
17.
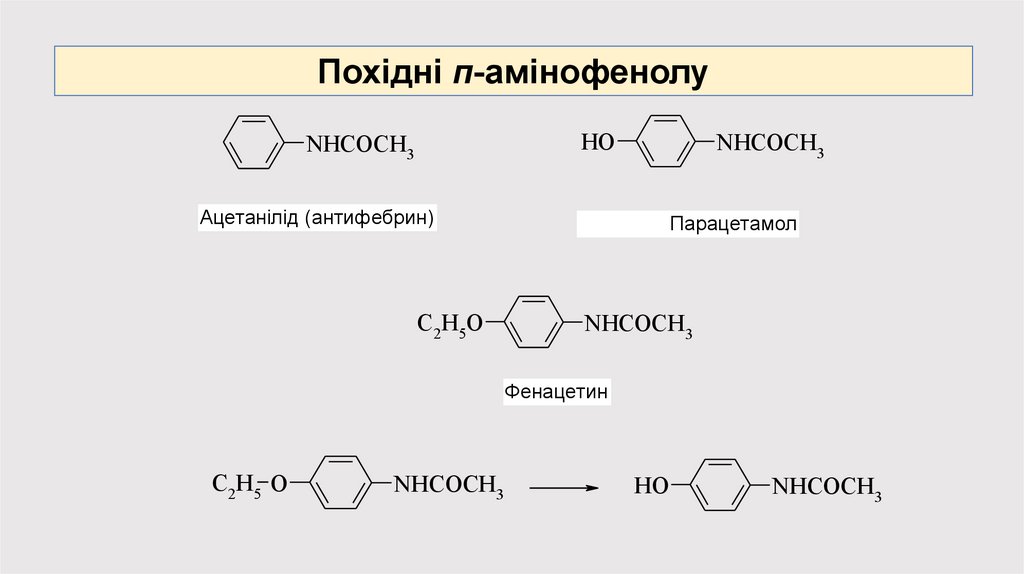
Похідні п-амінофенолуHO
NHCOCH3
NHCOCH3
Ацетанілід (антифебрин)
C2H5O
Парацетамол
NHCOCH3
Фенацетин
C2 H5 O
NHCOCH3
HO
NHCOCH3
18.
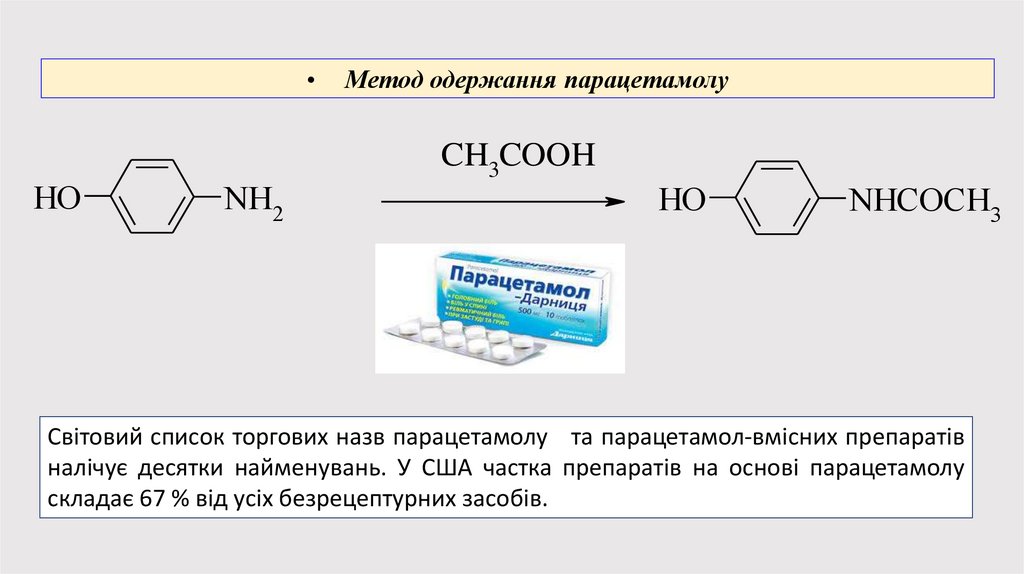
HO
NH2
Метод одержання парацетамолу
CH3COOH
HO
NHCOCH3
Світовий список торгових назв парацетамолу та парацетамол-вмісних препаратів
налічує десятки найменувань. У США частка препаратів на основі парацетамолу
складає 67 % від усіх безрецептурних засобів.
19.
20.
• Методи визначення парацетамолуПарацетамол – білий або з кремовим відтінком порошок без запаху, важко
розчинний у воді, проте легко розчиняється у спирті та ацетоні.
Справжність препарату визначають за
1. Температурою плавлення (від 168 до 172°С)
2. Хімічними реакціями:
• реакція на фенольний гідроксил – з розчином FeCl3 утворюється синьо-фіолетове
забарвлення;
• кислотний гідроліз амідної групи з подальшим окисненням аміногрупи та
утворенням фіолетового барвника
21.
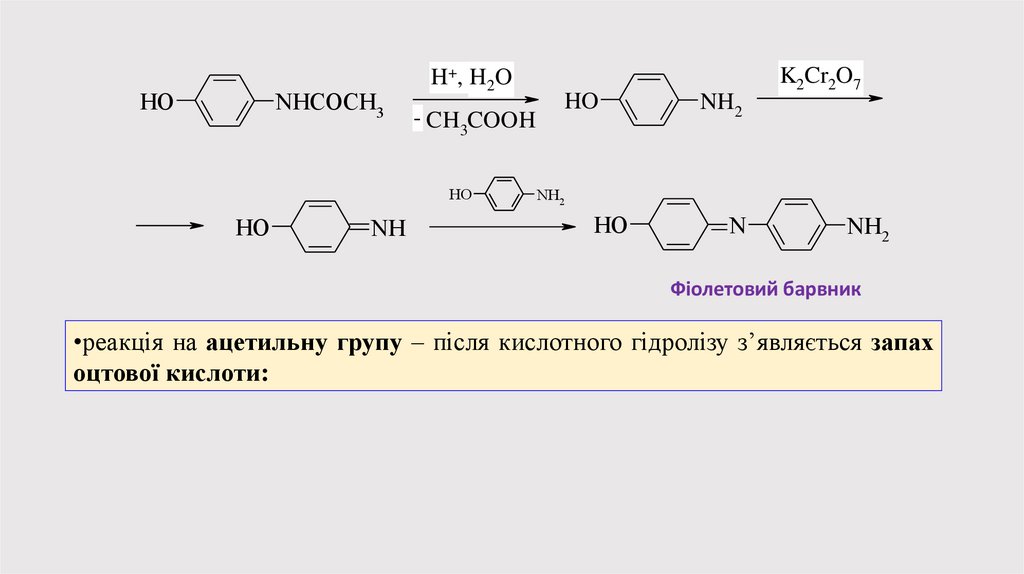
HONHCOCH3
H+ , H2 O
- CH COOH
3
HO
HO
NH
HO
NH2
K2Cr2O7
NH2
HO
N
NH2
Фіолетовий барвник
•реакція на ацетильну групу – після кислотного гідролізу з’являється запах
оцтової кислоти:










 medicine
medicine chemistry
chemistry