Similar presentations:
Углерод и его соединения
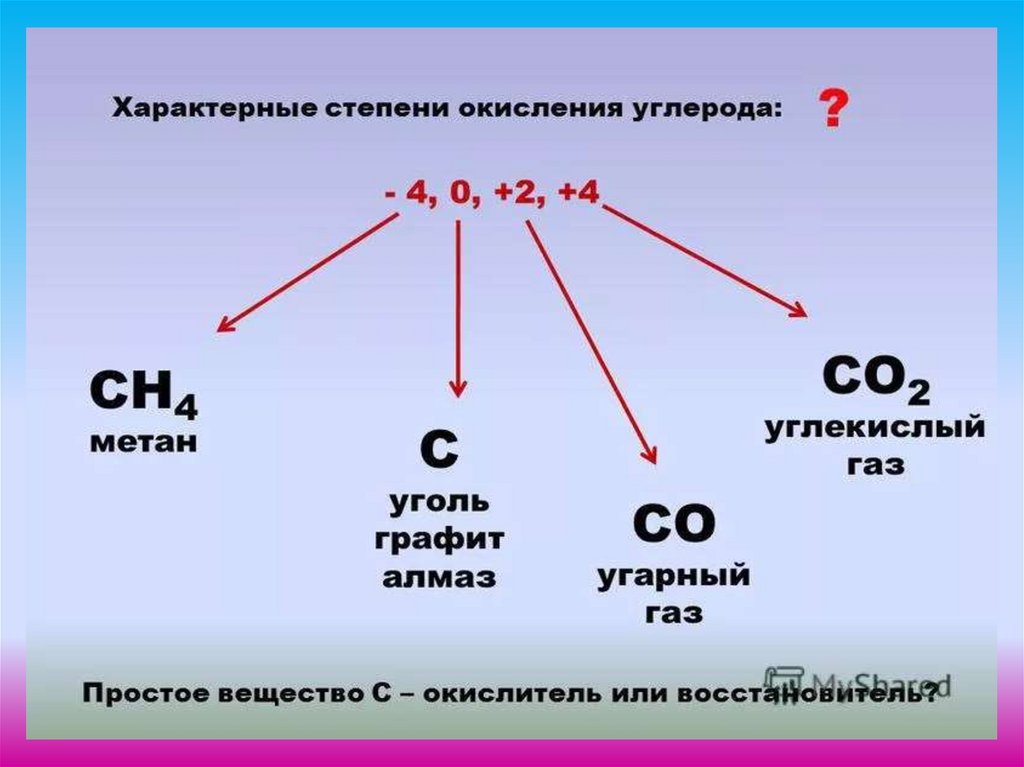
1. Углерод и его соединения
2.
3.
ФИ
З
И
Ч
Е
С
К
И
Е
С
В
О
Й
С
Т
В
А
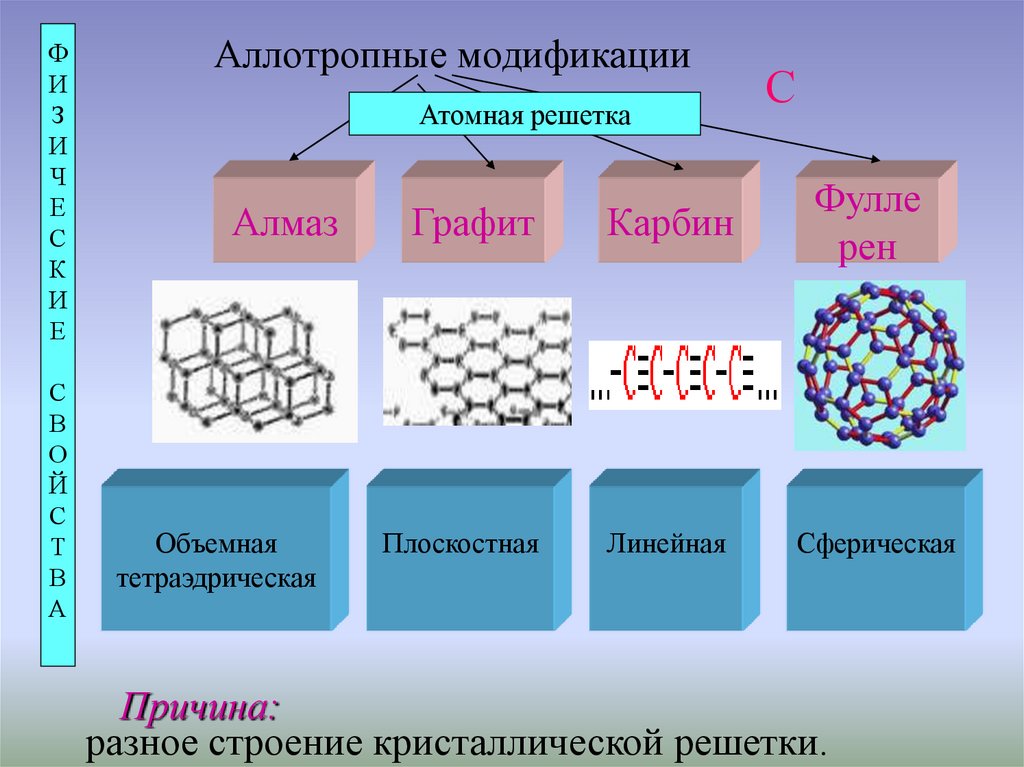
Аллотропные модификации
Атомная решетка
Алмаз
Объемная
тетраэдрическая
С
Графит
Карбин
Фулле
рен
Плоскостная
Линейная
Сферическая
Причина:
разное строение кристаллической решетки.
4.
АлмазПри сгорании –
углекислый газ
• Бесцветный
• Прозрачный
• Не проводит
эл. ток
• Прочный
• Твердый
О
Б
Л
А
С
Т
И
П
Р
И
М
Е
Н
Е
Н
И
Я
5.
Графит•Темно-серый
•Непрозрачный
•Проводит эл. ток
•Мало прочный
•Мягкий
•Металлический
блеск
•Оставляет след на
бумаге
•Жирный на ощупь
При сгорании –
углекислый газ
6. Карбин
Карбин представляет собойпорошок глубокого чёрного
цвета с вкраплением более
крупных частиц.По
электрической
проводимости карбин
занимает промежуточное
положение между алмазом и
графитом.
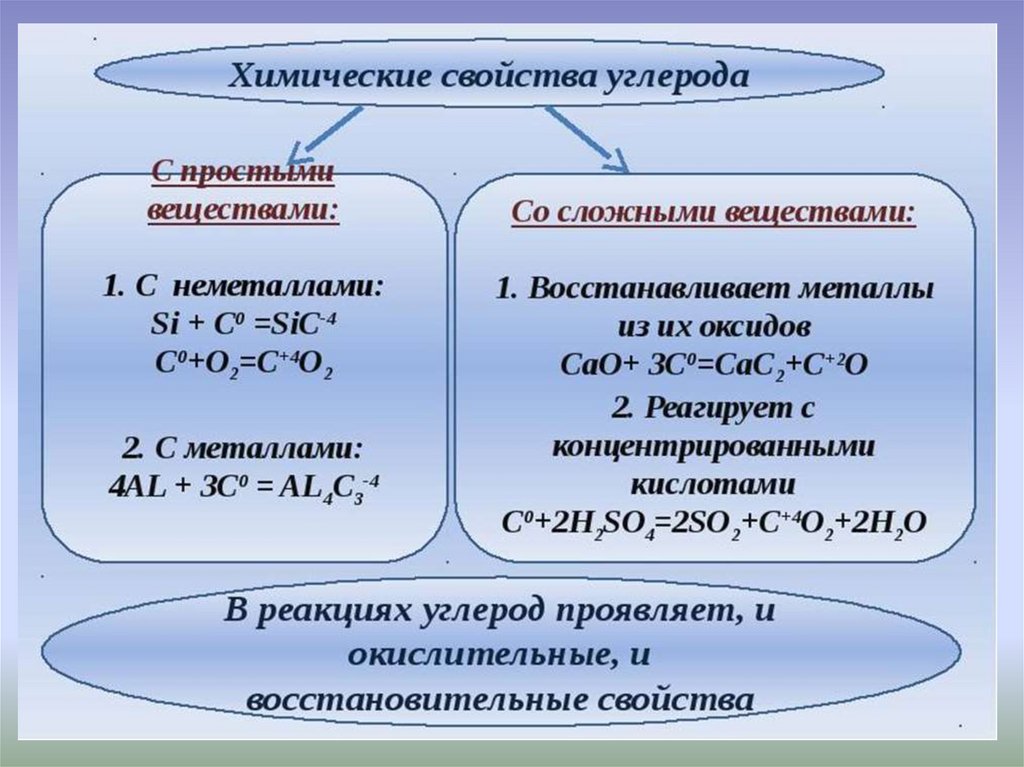
7.
ХИ
М
И
Ч
Е
С
К
И
Е
С
В
О
Й
С
Т
В
А
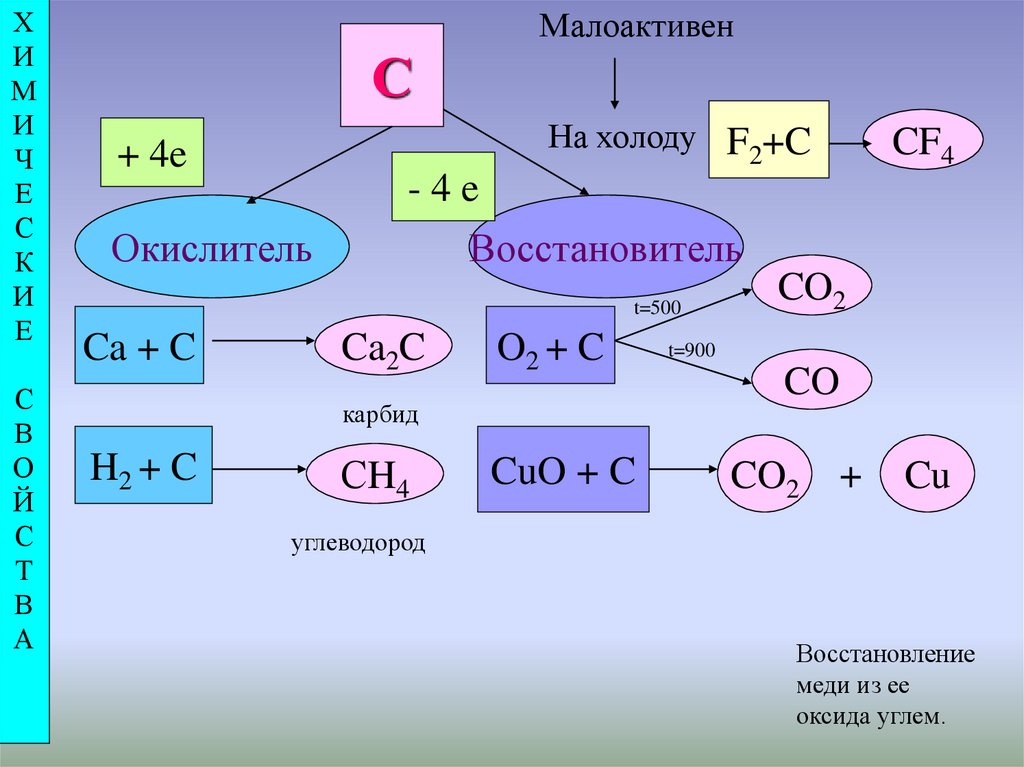
Малоактивен
С
На холоду F2+C
+ 4e
-4e
Окислитель
Восстановитель
t=500
Ca + C
Ca2C
O2 + C
карбид
H2 + C
CF4
СH4
CuO + C
CO2
t=900
CO
CO2
+
Cu
углеводород
Восстановление
меди из ее
оксида углем.
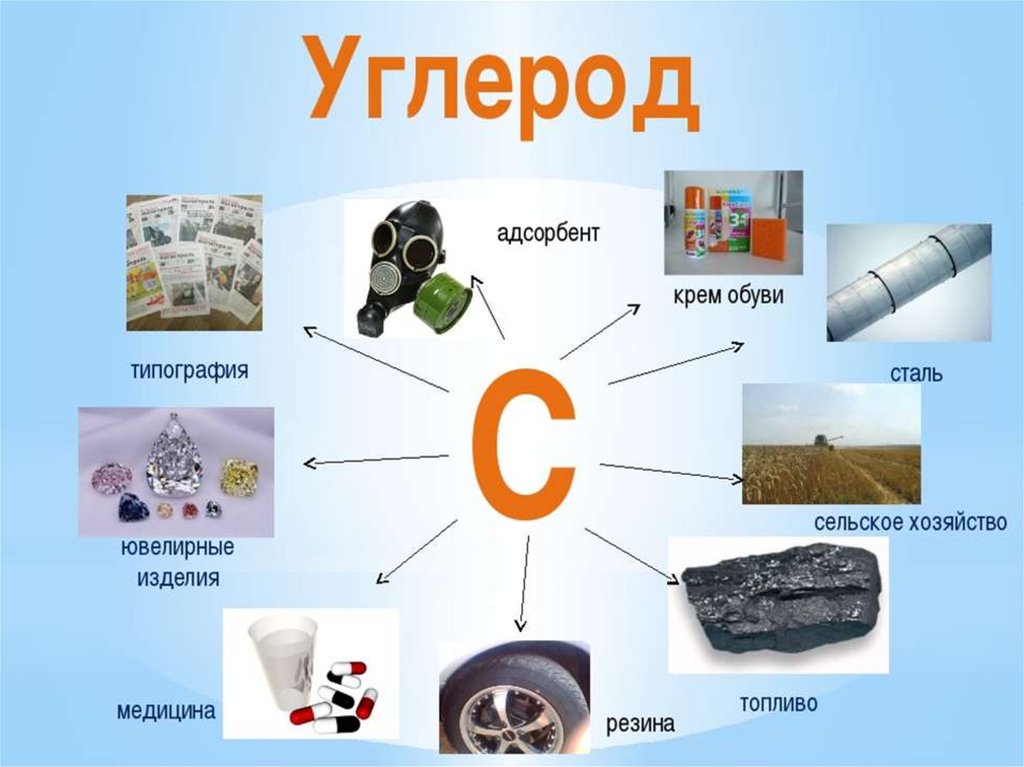
8.
9.
Адсорбция- свойство углерода удерживать на
пористой поверхности растворенные
вещества и газы
Н. Д. Зелинский
На основе адсорбционных
свойств угля
разработал
10.
11.
12.
13.
14.
15. Угольная кислота
Угольная
кислота
Химическая формула - H CO
2
3
• Структурная формула – все связи ковалентные полярные
• Кислота слабая, существует только в водном растворе, очень
непрочная, разлагается на углекислый газ и воду:
• CO2 + H2O ↔ H2CO3
• В ионных уравнениях записываем
• H2CO3 ↔ H2O + CO2
16. Угольная кислота
• Двухосновная, образует соли:• -средние – карбонаты (ионы CO32-)
• - кислые – гидрокарбонаты (ионы НCO3-)
17. Качественная реакция
Качественная реакция на CO32карбонат – ион "вскипание" придействии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑












 chemistry
chemistry








