Similar presentations:
Углерод и его соединения
1.
Углерод и его соединенияПодготовила: учитель химии Окунева В.Е.
2.
1. Углерод: строениеатома, физические и
химические свойства
2. Оксиды углерода
3. Угольная кислота:
физические и
химические свойства
4. Карбонаты.
Гидрокарбонаты
План урока
2
3.
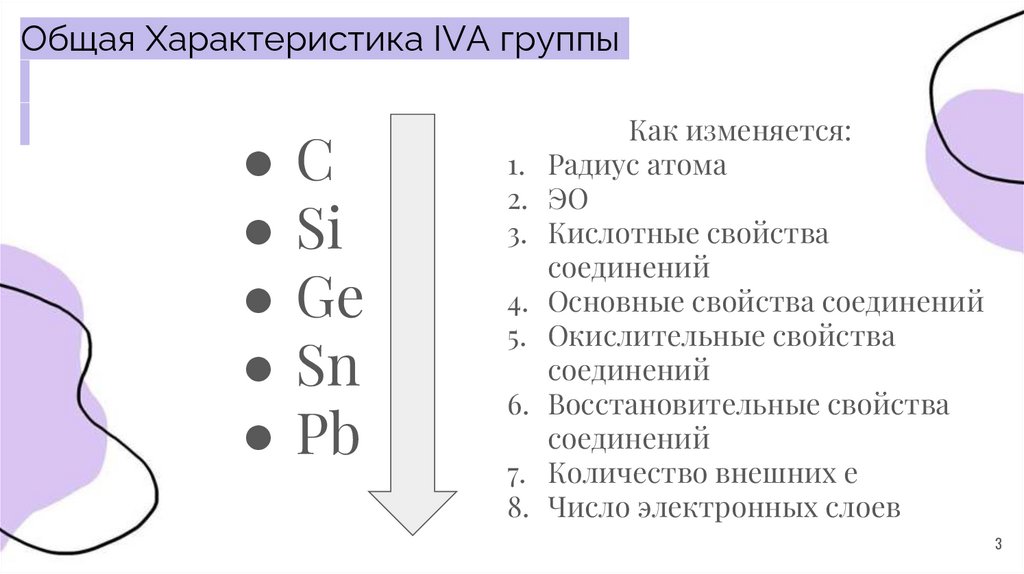
Общая Характеристика IVA группы●С
● Si
● Ge
● Sn
● Pb
Как изменяется:
1. Радиус атома
2. ЭО
3. Кислотные свойства
соединений
4. Основные свойства соединений
5. Окислительные свойства
соединений
6. Восстановительные свойства
соединений
7. Количество внешних e
8. Число электронных слоев
3
4.
Характеристика атома углерода1.
Электронная формула __________
2. Электронно-графическая формула внешнего слоя в основном состоянии
3. Электронно-графическая формула внешнего слоя в возбужденном
состоянии
4. Количество неспаренных электронов ______
5.
Количество неподеленных электронных пар _____
6. Валентности __________
7. Степени окисления __________
8. Формула высшего оксида __________
9. Формула летучего водородного соединения __________
4
5.
Аллотропные модификации углеродаСравнение физических свойств
Алмаз
Графит
Карбин
Фуллерен
5
6.
Аллотропные модификации углеродаСравнение физических свойств
Алмаз
Графит
● атомная КР
● самое твердое
вещество
● прозрачный
● плохо
проводит
электрический
ток и тепло
Карбин
● Состоит из
атомы связаны в
цепочек и циклов,
плоские слои
в которых атомы
мягкое вещество
углерода
серо-стального
соединены
цвета
двойными и
с металлическим
тройными связями
блеском
● мелкокристалличе
Хорошо проводит
ский порошок
электрический
серого цвета.
ток
Жирный на
[=C=C=C=C=C=C=]n или [–
C≡C–C≡C–C≡C–]n
ощупь
Фуллерен
выпуклые
многогранники
С60, С70.
черные
вещества с
металлическим
блеском
полупроводники
6
7.
Аллотропные модификации углеродаСравнение физических свойств
7
8.
Химические свойства углерода1) С кислородом:
1) С галогенами:
1) С серой:
1) C металлами:
C + O2 нед →
C + O2 изб →
C
+ F2 →
C
+ S →
C + Ca →
C + Al →
C + Na →
8
9.
Химические свойства углерода5) Не реагирует с фосфором:
P+C≠
6) С окислителями:
HNO3 (к) + C →
C + H2SO4 (к) →
7) С кремнием:
Si + C →
8) С азотом:
2С + N2 → N≡C–C≡N
9
10.
Химические свойства углерода9) восстанавливает многие металлы из основных и амфотерных
оксидов:
ZnO + C → Zn + CO
С + Fe3O4 →
10) с оксидами активных металлов образует карбиды:
С + СаО → СаС2 + СО
С + Al2O3 → Al4C3 + CO
11) с водяным паром:
C + H2O → CO + H2
10
11.
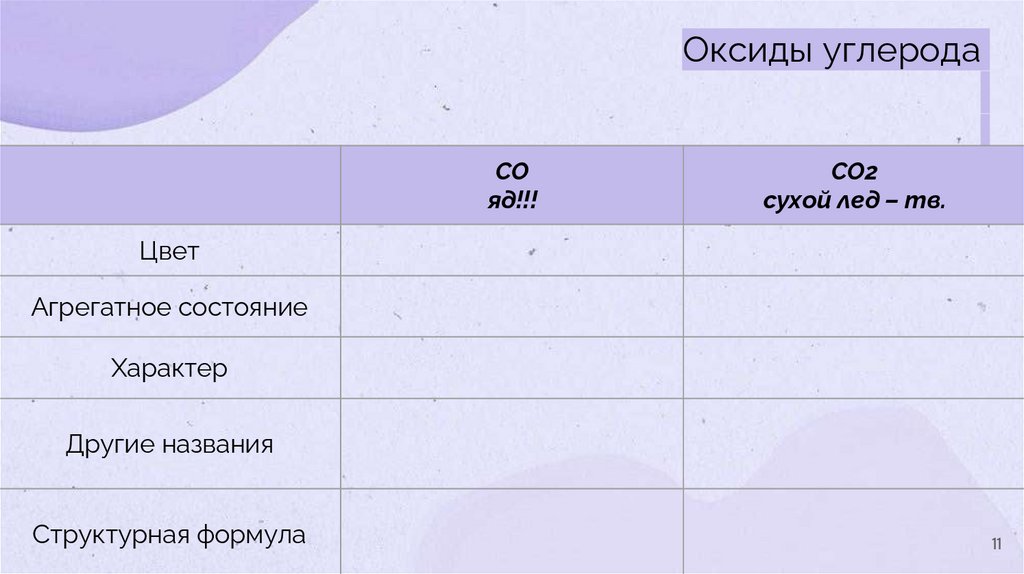
Оксиды углеродаCO
яд!!!
CO2
сухой лед – тв.
Цвет
Агрегатное состояние
Характер
Другие названия
Структурная формула
11
12.
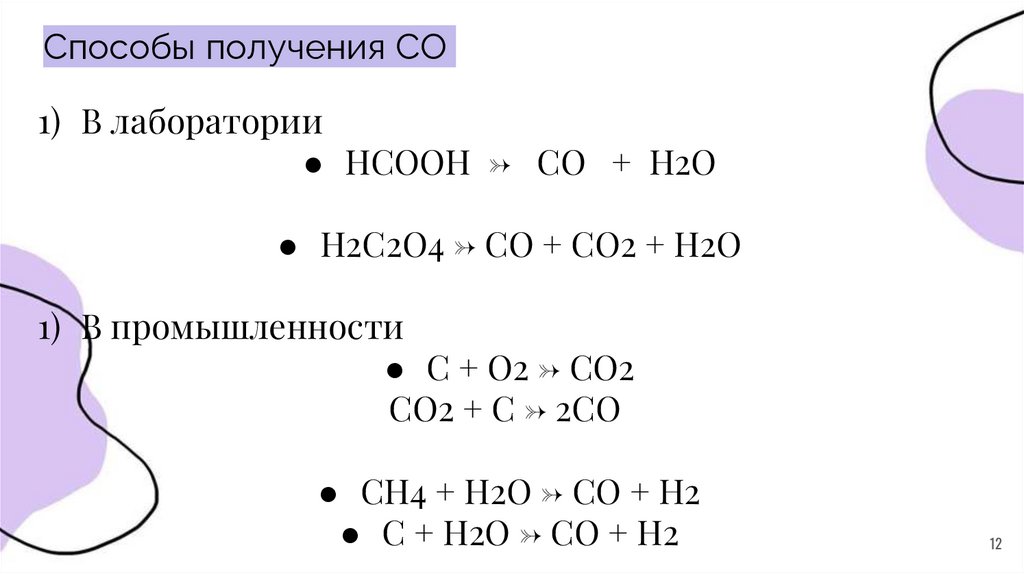
Способы получения CO1) В лаборатории
● НСООН → CO + H2O
● H2C2O4 → CO + CO2 + H2O
1) В промышленности
● C + O2 → CO2
CO2 + C → 2CO
● СН4 + Н2O → СО + Н2
● C + H2O → CO + H2
12
13.
Химические свойства CO1) горение
СO + O2 →
1) окисляется хлором
CO + Cl2 → COCl2
1) с водородом
СО + Н2 → СН3ОН
1) с щелочами
CO + NaOH → HCOONa
1) восстанавливает металлы из оксидов
3CO + Fe2O3 →
СО + CuO →
1) окисляется углекислого газа или карбонатов
CO + Na2O2 → Na2CO3
13
14.
Способы получения CO21) карбонат + кислота
CaCO3 + HCl →
NaHCO3 + HBr →
1) разложение нерастворимых карбонатов и
растворимых гидрокарбонатов.
CaCO3 →
NaHCO3 →
14
15.
Химические свойства CO21) С водой
CO2 + H2O ↔ H2CO3
1) С основными оксидами и основаниями
KOH + CO2 изб →
KOH изб + CO2 →
Помутнение
известковой воды —
качественная реакция
на углекислый газ:
Ca(OH)2 + CO2 → CaCO3 + H2O
15
16.
Химические свойства CO23) С карбонатами.
Na2CO3 + CO2 + H2O → 2NaHCO3
4) С некоторыми восстановителями.
CO2 + C →
2Мg + CO2 →
CO2 + Na2O2 → Na2CO3 + O2
16
17.
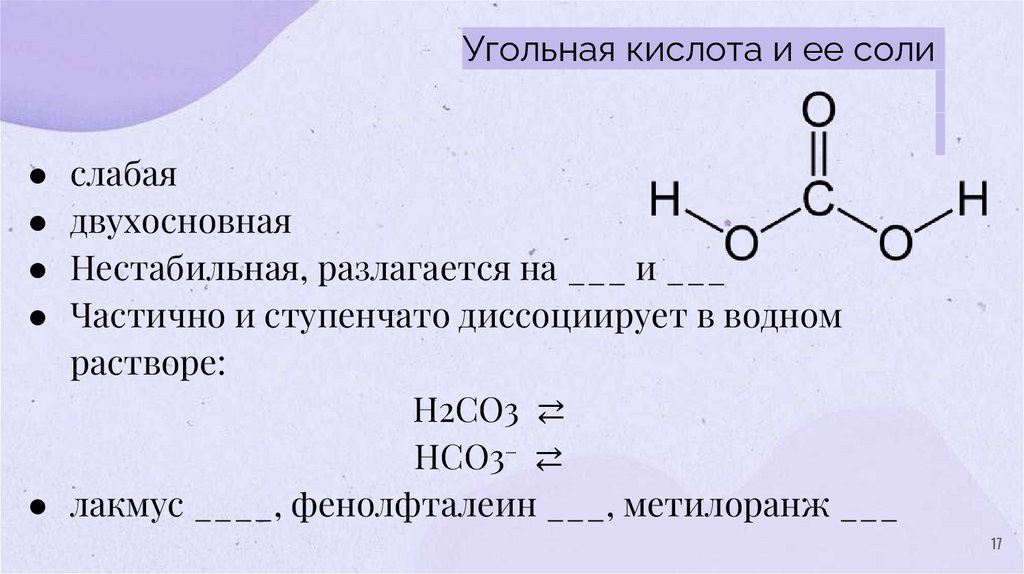
Угольная кислота и ее соли● слабая
● двухосновная
● Нестабильная, разлагается на ___ и ___
● Частично и ступенчато диссоциирует в водном
растворе:
H2CO3 ⇄
HCO3– ⇄
● лакмус ____, фенолфталеин ___, метилоранж ___
17
18.
Карбонаты и гидрокарбонаты● При нагревании (все, кроме карбонатов щелочных
металлов и аммония) разлагаются до оксидов.
Гидрокарбонаты переходят в карбонаты.
CaCO3 →
(NH4)2CO3 → 2NH3 + 2H2O + CO2
2NaHCO3 →
● Качественная реакция на ионы СО32─ и НСО3−
Na2CO3 + HCl →
NaHCO3 + HCl →
18
19.
Карбонаты и гидрокарбонатыНапишите уравнения гидролиза Na2CO3, Al2(SO4)3
19
20.
Домашнее задание● Цепочки:
20
















 chemistry
chemistry








