Similar presentations:
Основы общей химии
1.
ФГБОУ ВО Челябинскийгосударственный университет
Курс: Химия
Дисциплина: Общая химия
Лектор: Ярошенко Федор Александрович,
старший преподаватель
Основы общей химии
Основы
общей химии
2.
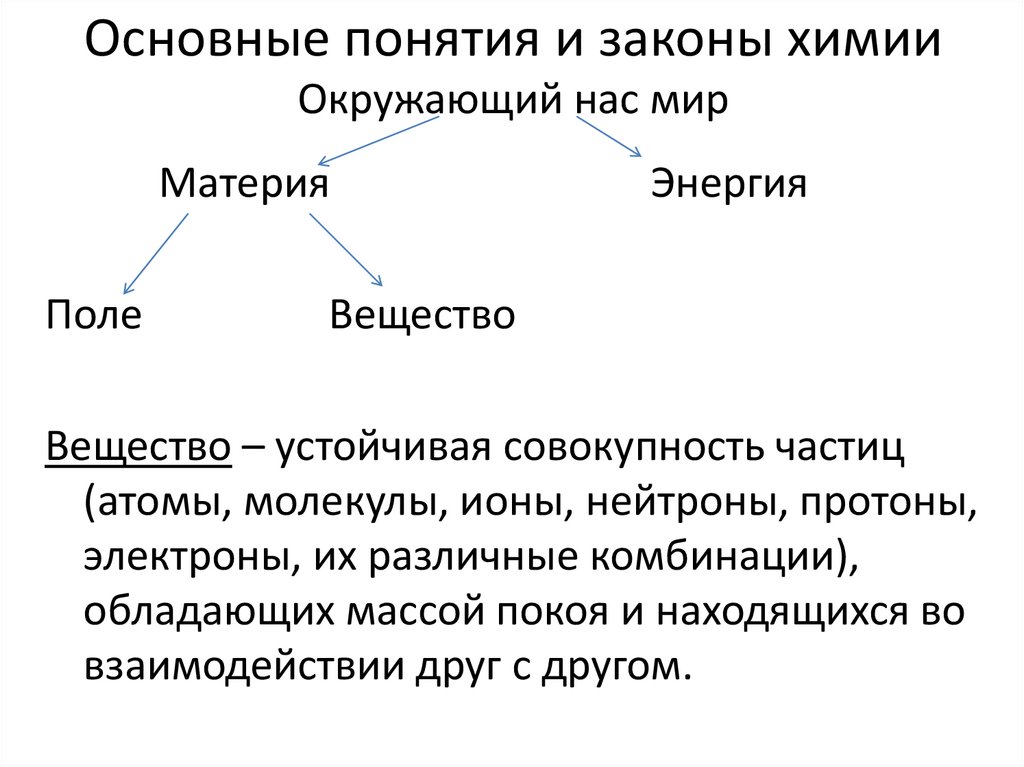
Основные понятия и законы химииОкружающий нас мир
Материя
Поле
Энергия
Вещество
Вещество – устойчивая совокупность частиц
(атомы, молекулы, ионы, нейтроны, протоны,
электроны, их различные комбинации),
обладающих массой покоя и находящихся во
взаимодействии друг с другом.
3.
Из различных веществ построены окружающие настела.
Тело – это все то, что имеет массу и объем.
Микроскопический уровень:
понятия – электрон, атом, ион, молекула;
свойства – масса иона, атома, молекулы, степень
окисления, электроотрицательность.
Макроскопический уровень:
понятия – вещество, металл, неметалл, минерал,
смесь веществ;
свойства – агрегатное состояние, цвет, твердость,
плотность, темп. плавления, темп. кипения, эл.
проводимость, молярная масса.
4.
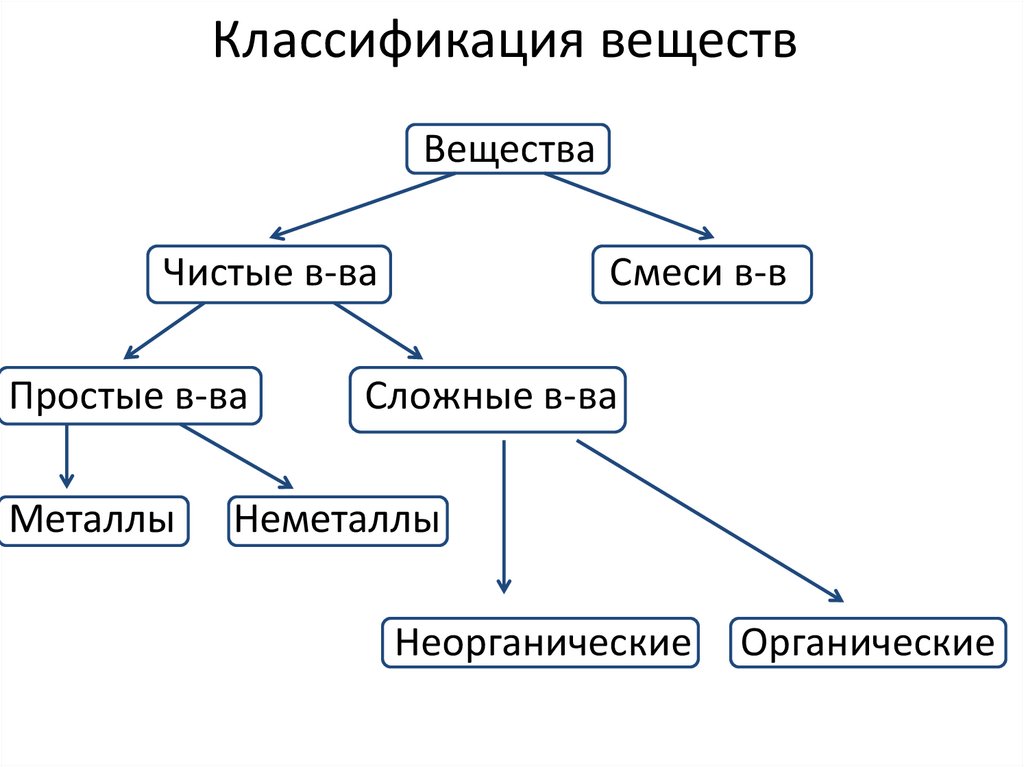
Классификация веществВещества
Чистые в-ва
Простые в-ва
Металлы
Смеси в-в
Сложные в-ва
Неметаллы
Неорганические
Органические
5.
Чистое вещество (простое или сложное) состоит изодинаковых частиц – формульных единиц.
Формульная единица – атом, молекула, радикал, ион,
группа катионов и анионов или любая
совокупность частиц (реально существующая как
единое целое).
Простое вещество – вещество, состоящее из частиц
только одного химического элемента.
Сложное вещество – вещество, состоящее из частиц
нескольких элементов, химически связанных друг с
другом в определенном массовом отношении.
Аллотропия – существование одного и того же хим.
эл-та в виде нескольких простых веществ,
отличающихся строением, составом и
свойствами (аллотропные модификации).
6.
Молекула – наименьшая частица вещества,обладающая его химическими свойствами.
Ион – электрозаряженная частица, образующаяся
вследствие потери или присоединения электронов
атомом или группой атомов.
Атом – сложная электромагнитная система,
состоящая из протонов и нейтронов,
заключенных в ядре, а также электронов.
Радикал – молекула (ион), содержащая хотя бы один
неспаренный электрон.
Химическая реакция – процесс превращения
веществ, связанный с превращением энергии,
сопровождающийся образованием новых веществ
с другими свойствами.
Исх. в-ва (реагенты)
Прод. реакции
7.
ЯвленияФизические явления
Изменение формы или
агрегатного состояния веществ,
в результате которых не
образуются новые вещества
(плавление льда, испарение
йода, ковка металла).
Смесь веществ
Химические явления
Изменения при которых одни
вещества превращаются в
другие (вода в чай, вода в сироп,
дрова в золу и т.д.) химическое
явление = химическая реакция.
Химическое соединение
8.
Отличие смеси от хим. соед.• состав смеси переменный, а химических соед. –
постоянный;
• вещества, входящие в состав смесей, сохраняют
свои свойства, а вещества, образующие хим.
соед., не сохраняют;
• вещества, входящие в состав смесей, раздел.
физ. способами, а хим. соед. можно разложить
только с помощью хим. реакций;
• образование смесей не сопровождается выдел.
или поглощ. теплоты или др. признаками хим.
реакц., а при образовании хим. соед. всегда
проявляются какие-либо признаки хим. реакц.
(выпадение осадка, изменение окраски и др.)
9.
Стехиометрические законы химииЗакон сохранения массы веществ. Масса веществ,
вступающих в реакцию, равна массе веществ,
образующихся в результате реакции.
Например:
P2O5 + 3H2O = 2H3PO4
142г 3*18г 2*98г
196г
196г
Закон постоянства состава. Качественный и
количественный состав индивидуального хим.
соединения строго постоянен и не зависит от
способа его получения.
10.
Основные величины и единицыАбсолютная масса атома хим. эл-та (ma) – масса
атома элемента, выраженная в стандартных
единицах массы (кг, г): ma = Ar * 1 а.е.м.
Атомная единица массы (а.е.м.) – единица массы,
равная 1/12 массы атома изотопа углерода 126С:
1 а.е.м. = 1,66*10-27 кг = 1,66*10-24 г.
Относительная атомная масса хим. эл-та (Ar) –
величина, равная отношению средней массы
атома эл-та естественного изотопного состава к
1/12 массы атома изотопа углерода 126С, т.е. к
атомной единице массы (а.е.м.):
Ar (Х) = ma / 1 а.е.м.
11.
Относительная молекулярная масса (Mr) –безразмерная величина, показывающая, во
сколько раз масса формульной единицы больше
1 а.е.м.: Mr(X) = mf / 1 а.е.м.
Массовая доля хим. эл-та в формульной единице
в-ва равна отношению отн. атомной массы
данного эл-та, умноженной на число его атомов
в молекуле, к относительной молекулярной
массе в-ва:
ω(Х) = Ar (Х) * n / Mr(в-ва) * 100%
где ω(Х) – массовая доля элемента Х; Ar (Х) – относительная атомная масса
элемента Х; n – число атомов элемента Х в формульной единице вещества;
Mr(в-ва) - относительная молекулярная масса вещества.
12.
Кол-во в-ва (n или ν(ню)) – физ. вел-на, введеннаядля оценки числа структурных единиц (атомы,
молекулы, ионы, электроны и др.) в порции в-ва.
Моль – единица кол-ва в-ва, определяющая кол-во
в-ва системы, которая состоит из такого числа
отдельных частиц, сколько содержится атомов в
12 г изотопа 126С.
Молярная масса в-ва (М) – это отношение массы
вещества к количеству в-ва:
М = m / n (г/моль, кг/кмоль),
где m – масса вещества (г, кг), n – кол-во в-ва (моль, кмоль).
Молярная масса численно равна относительной молекулярной
массе Mr
13.
Молярный объем (Vm) – отношение объема в-ва ккол-ву в-ва:
Vm = V / n
При нормальных условиях молярный объем
газообразного вещества – вел-на постоянная:
Vm = 22,4 л/моль
Норм. условия (н.у.): р = 101325 Па, Т = 273.15 К.
Постоянная Авогадро (NA) показывает число частиц
в одном моле в-ва:
NA = 6.02*1023 моль-1
→ 1 моль в-ва содержит реальных или условных
структурных единиц.
n(X) = N(X) / NA
14.
Выход продукта реакции (η) – это отношениепрактически полученного кол-ва в-ва (массы,
объема) продукта к количеству в-ва (массе,
объему) этого же продукта, теоретически
рассчитанному по уравнению реакции, исходя из
предположения о полном превращении
исходного в-ва в продукт:
η = nпр / nт * 100% ;
η = mпр / mт * 100% ;
η = Vпр / Vт * 100% ;
15.
Газовые законыЗакон Бойля – Мариотта – для данной массы газа
при Т – const произведение давления газа и его
объема остается пост. вел-ной:
p1V1 = p2V2 или pV = const (m - const, T - const)
Закон Гей – Люссака – для данной массы газа при р
– const отношение объема газа к его абсолютной
температуре остается постоянным:
V1/T1 = V2/T2 или V/T = const (m – const, p - const)
Уравнение Клапейрона:
p1V1
p2V2 или pV = const
T1
T2
T
16.
Уравнение Клапейрона – Менделеева:pV = nRT
Закон объемных отношений газов – объемы вступающих
в реакцию газов и образующихся газообразных
продуктов, измеренные в одинаковых условиях,
относятся друг к другу как небольшие целые числа.
Закон Авогадро – в равных объемах газов при
одинаковых условиях (Т и р) содержится одинаковое
число молекул.
Относительная плотность одного газа по другому:
D = M 1 / M2
Объемная доля ϕ(Х) – отношение объема данного
компонента к общему объему системы:
ϕ(Х) = V(X) / V
17.
Следствия из закона АвогадроОдинаковое число молекул различных газов при
одинаковых условиях занимает одинаковый объем.
Один моль различных газов при одинаковых условиях
занимает одинаковый объем.
Отношение объемов реагирующих газов, измеренных
при одинаковых условиях, равно отношению
стехиометрических коэффициентов, т.е. равно
отношению количеств веществ.
При одинаковых Т и р отношение масс равных
объемов газов равно отношению их молярных масс:
m1/m2 = M1/M2


















 chemistry
chemistry