Similar presentations:
Буферные системы. Классификация буферных растворов
1. Буферные системы
26.11.162.
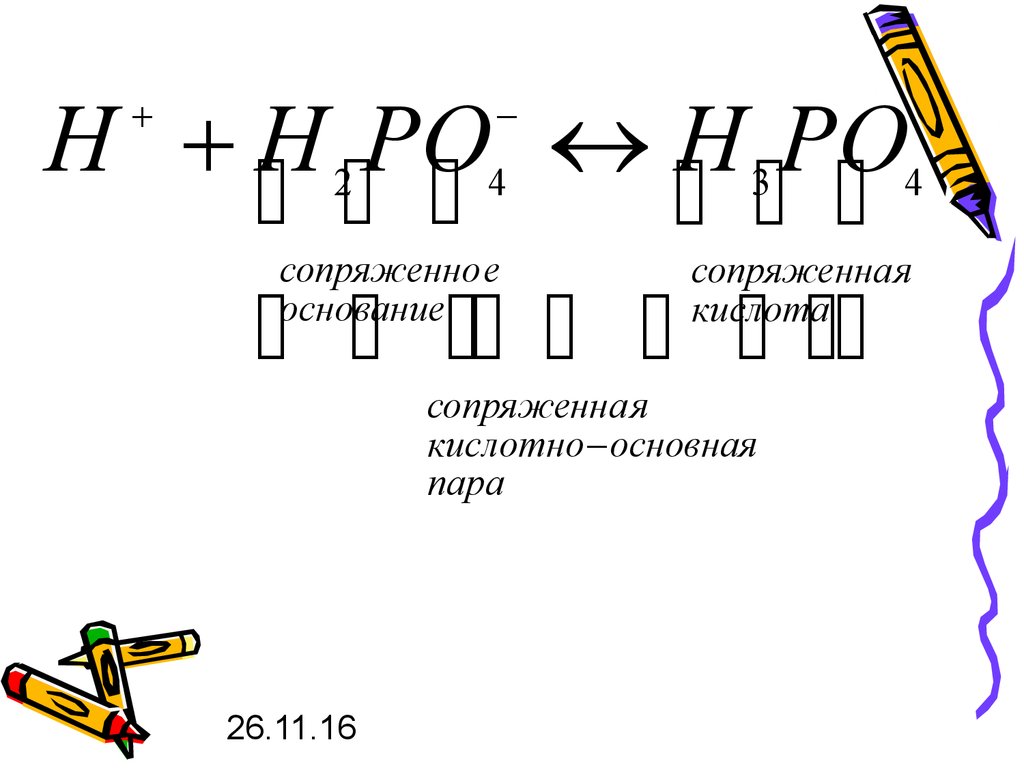
Н H PO H PO2
4
сопряженно е
основание
3
сопряженна я
кислота
сопряженна я
кислотно основная
пара
26.11.16
4
3.
Буферный раствор – это раствор,содержащий сопряженную кислотноосновную пару (буферную систему),
способную поддерживать практически
постоянное значение рН при
разбавлении или при добавлении
небольших количеств кислоты или
щелочи.
26.11.16
4.
Классификация буферных растворов:1. слабая кислота и ее соль - кислотная
буферная система
(СН3СООН+СН3СООNa, H2CO3+KHCO3)
2. слабое основание и его соль - основная
буферная система
(NH4OH+NH4Cl)
26.11.16
5.
3. кислая и средняя соли или две кислыхсоли - относят к кислотным буферным
системам (более кислая соль
выполняет функцию слабой кислоты)
(Na2HPO4+NaH2PO4)
4. растворы амфолитов (аминокислот,
белков) проявляют буферное
действие, при добавлении некоторого
количества кислоты или щелочи.
26.11.16
6.
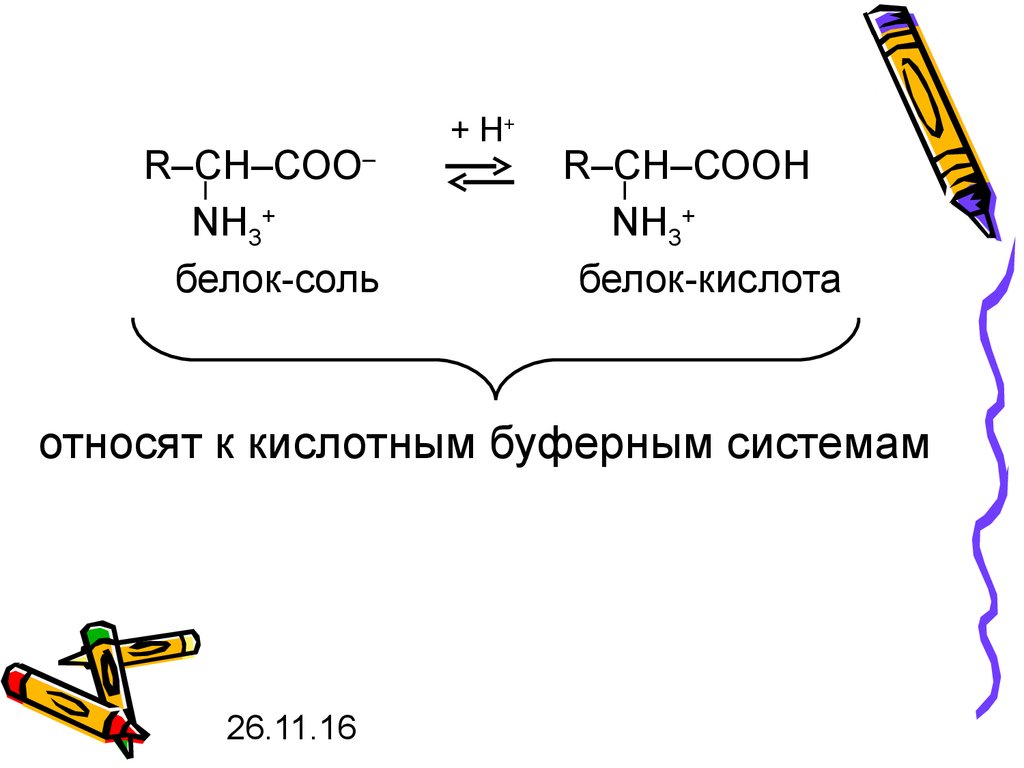
R–СН–СОО–NH3+
белок-соль
+ Н+
R–СН–СООН
NH3+
белок-кислота
относят к кислотным буферным системам
26.11.16
7.
R–СН–СОО–NH3+
белок-соль
+ ОН–
R–СН–СОО–
NH2
белок-основание
относят к основным буферным системам
26.11.16
8.
Расчет рН буферных растворовпроизводят по уравнению
Гендерсона-Гассельбаха
26.11.16
9.
для кислотных буферных растворов:[соли ]
рН рK a lg
[к ты]
Ссоли Vсоли
рН рK a lg
Ск ты Vк ты
26.11.16
10.
где рК а – показатель константыдиссоциации кислоты рК а lg K a ,
[соли] и [кислоты] – молярные
равновесные концентрации соли и
кислоты соответственно,
Ссоли, Скислоты, Vсоли, Vкислоты – концентрации и
объемы соли и кислоты, взятых для
приготовления БР
26.11.16
11.
для основных буферных растворов:[соли ]
рН 14 рK b lg
[осн]
Ссоли Vсоли
рН 14 рK b lg
Сосн Vосн
26.11.16
12.
где рК b – показатель константыдиссоциации кислоты рК b lg K b ,
[соли] и [осн] – молярные равновесные
концентрации соли и основания
соответственно,
Ссоли, Сосн, Vсоли, Vосн – концентрации и
объемы соли и основания, взятых для
приготовления БР
26.11.16
13.
Буферные растворы, состоящие издвух солей, одна из которых (более
кислая) выполняет роль
сопряженной кислоты, относят к
кислотным буферным растворам, рН
рассчитывают по формуле для
кислотных буферных растворов.
26.11.16
14.
При разбавлении буферныхрастворов концентрации всех
компонентов уменьшаются, но
их соотношение остается прежним,
поэтому согласно формулам
Гендерсона-Гассельбаха рН
растворов не меняется.
26.11.16
15.
[CH 3COONa ]4 моль / л
рН рK a lg
4,76 lg
4,76
[CH 3COOH ]
4 моль / л
[CH 3COONa ]
2 моль / л
рН рK a lg
4,76 lg
4,76
[CH 3COOH ]
2 моль / л
26.11.16
16.
Расчет рН при добавлении кислоты HAn:• в кислотной буферной системе:
Ссоли Vсоли СHAn VHAn
рН рK a lg
Cк ты Vк ты СHAn VHAn
• в основной буферной системе:
Ссоли Vсоли СHAn VHAn
рН 14 рK b lg
Сосн Vосн СHAn VHAn
26.11.16
17.
Расчет рН при добавлении щелочи:• в кислотной буферной системе:
Ссоли Vсоли СЩ VЩ
рН рK a lg
Cк ты Vк ты СЩ VЩ
• в основной буферной системе:
Ссоли Vсоли СЩ VЩ
рН 14 рK b lg
Сосн Vосн СЩ VЩ
26.11.16
18.
При добавлении небольшогоколичества кислоты, выделившиеся
ионы водорода связываются
сопряженным основанием буферной
системы, при добавлении небольшого
количества щелочи, выделившиеся
гидроксид-ионы связываются
сопряженной кислотой буферной
системы.
26.11.16
19.
при добавлении небольшогоколичества соляной кислоты к
ацетатному буферному раствору ионы
водорода связываются ацетат-ионами,
образовавшимися в результате
диссоциации ацетата натрия:
СH3COONa = CH3COO– + Na+
CH3COO– + H+ = CH3COOH
26.11.16
20.
концентрация ацетата натрияуменьшается, а концентрация уксусной
кислоты увеличивается, соотношение
концентраций компонентов
[соли ] изменяется, но для того чтобы
[кислоты]
рН раствора изменился на единицу,
соотношение компонентов должно
изменится в 10 раз.
26.11.16
21.
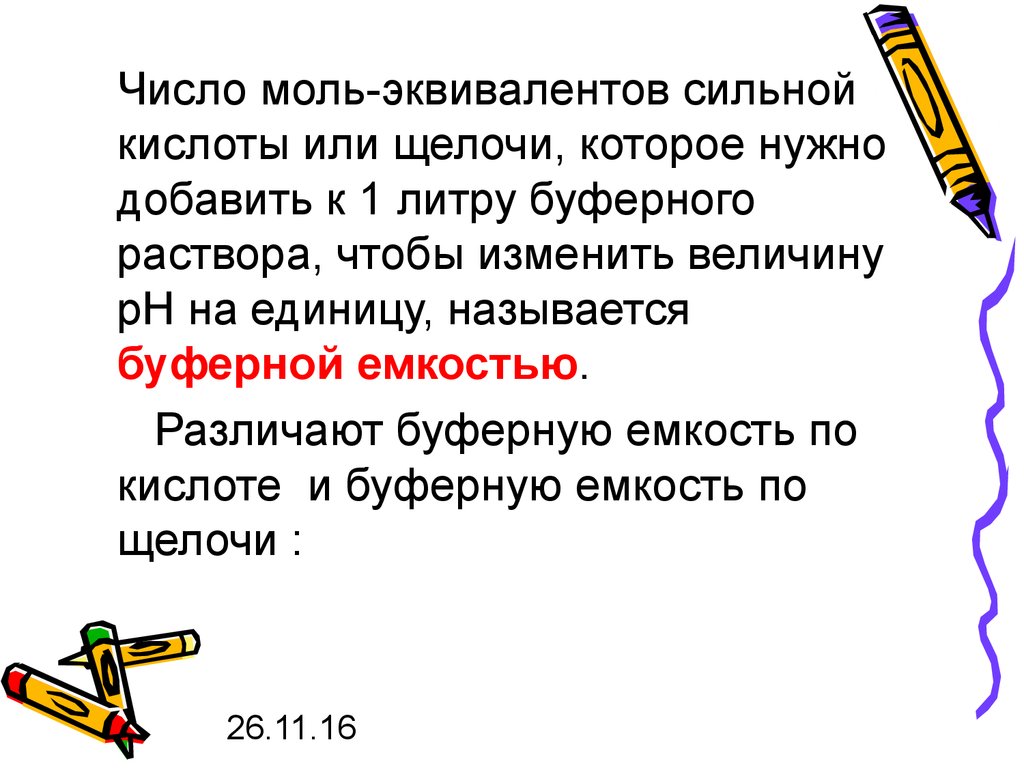
Число моль-эквивалентов сильнойкислоты или щелочи, которое нужно
добавить к 1 литру буферного
раствора, чтобы изменить величину
рН на единицу, называется
буферной емкостью.
Различают буферную емкость по
кислоте и буферную емкость по
щелочи :
26.11.16
22.
Cн (кислоты) V (кислоты)Bа
рН V (б. р.)
Cн (щелочи ) V (щелочи )
Bb
рН V (б. р.)
26.11.16
23.
CН(кислоты) и CН(щелочи) – эквивалентныеконцентрации кислоты и щелочи
соответственно;
V(кислоты) и V(щелочи) – объемы добавленных
кислоты и щелочи соответственно;
V(б.р.) – объем буферного раствора;
|ΔрН| - изменение значения рН, вызванное
добавлением кислоты или щелочи.
26.11.16
24.
Буферная емкость зависит от:• концентраций компонентов
• соотношения концентраций
компонентов
Максимального значения буферная
емкость достигает при равенстве
концентраций компонентов буферной
системы.
26.11.16
25.
Кислотно-основный гомеостаз ворганизме обеспечивается несколькими
буферными системами.
1. Гидрокарбонатная (бикарбонатная,
водородкарбонатная) буферная
система состоит из угольной кислоты
(раствора СО2 в воде) и НСО3–.
26.11.16
26.
устанавливается равновесие:атмосфера СО2 ( г )
воздушное пространство легких
3
СО2 ( p )
Н 2СО3 Н НСО
Н 2О
плазма крови
26.11.16
27.
Уравнение Гендерсона-Гассельбаха[ НСО3 ]
рН рK a lg
[ Н 2СО3 ]
или
рН=6,36+lg[НСО3–] – lg р(СО2),
где р(СО2) – парциальное давление СО2
в альвеолах легких,
6,36 – рКа угольной кислоты с поправкой
на константу Генри.
26.11.16
28.
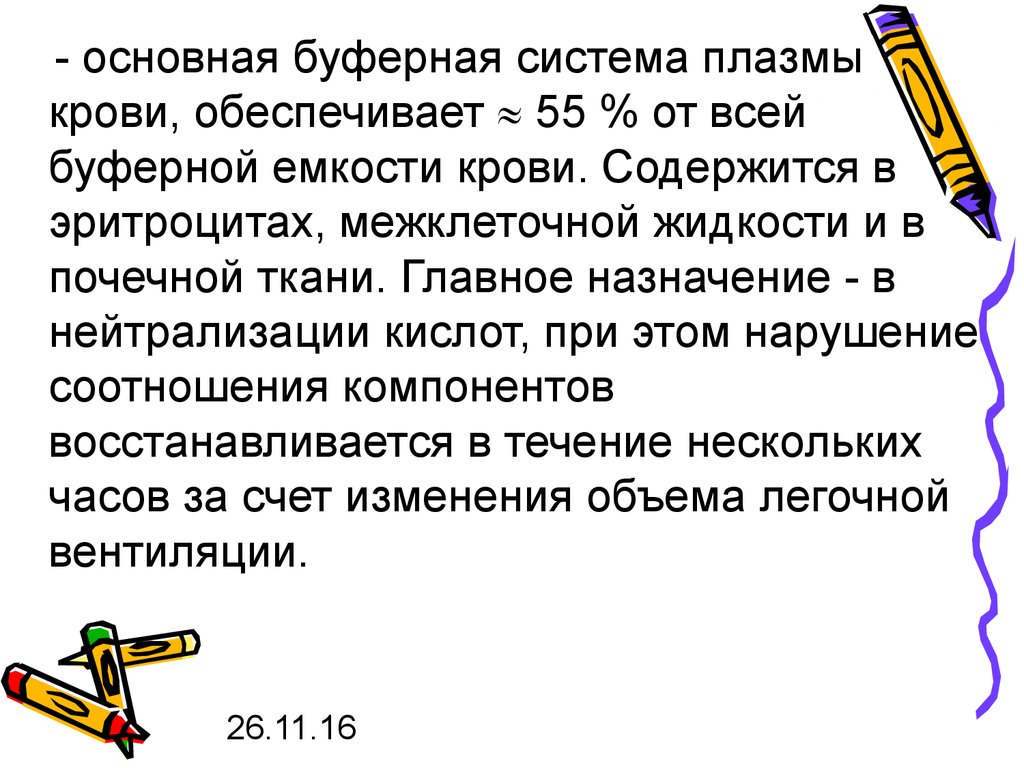
- основная буферная система плазмыкрови, обеспечивает 55 % от всей
буферной емкости крови. Содержится в
эритроцитах, межклеточной жидкости и в
почечной ткани. Главное назначение - в
нейтрализации кислот, при этом нарушение
соотношения компонентов
восстанавливается в течение нескольких
часов за счет изменения объема легочной
вентиляции.
26.11.16
29.
Гидрофосфатная буферная системав клетках представлена К2HPO4 и
KH2PO4, а в плазме крови и в
межклеточной жидкости Na2HPO4 и
NaH2PO4.
2
4
4
[ НPО ]
рН рK a lg
[ Н 2 PО ]
26.11.16
30.
Буферная емкость по кислотебольше, чем по основанию.
Избыточные компоненты
гидрофосфатной буферной системы
выводятся почками, при этом полное
восстановление соотношения
происходит только через 2-3 суток.
26.11.16
31.
Гемоглобиновая буферная системасодержится в эритроцитах,
представляет собой две
сопряженные кислотно-основные
пары: гемоглобин HHb и его анион
Hb- и оксигемоглобин HHbO2 и его
анион HbO2- .
26.11.16
32.
Механизм действия этой системыоснован на реакциях:
HHb ↔ H+ + Hb–
H+ + HbO2– ↔ HHbO2 ↔ HHb + O2
26.11.16
33.
играет значительную роль впроцессах дыхания, транспорта
кислорода в ткани и поддержании
постоянства рН внутри эритроцитов, а
также в крови. Эффективно
взаимодействует только в сочетании с
другими буферными системами
организма.
26.11.16
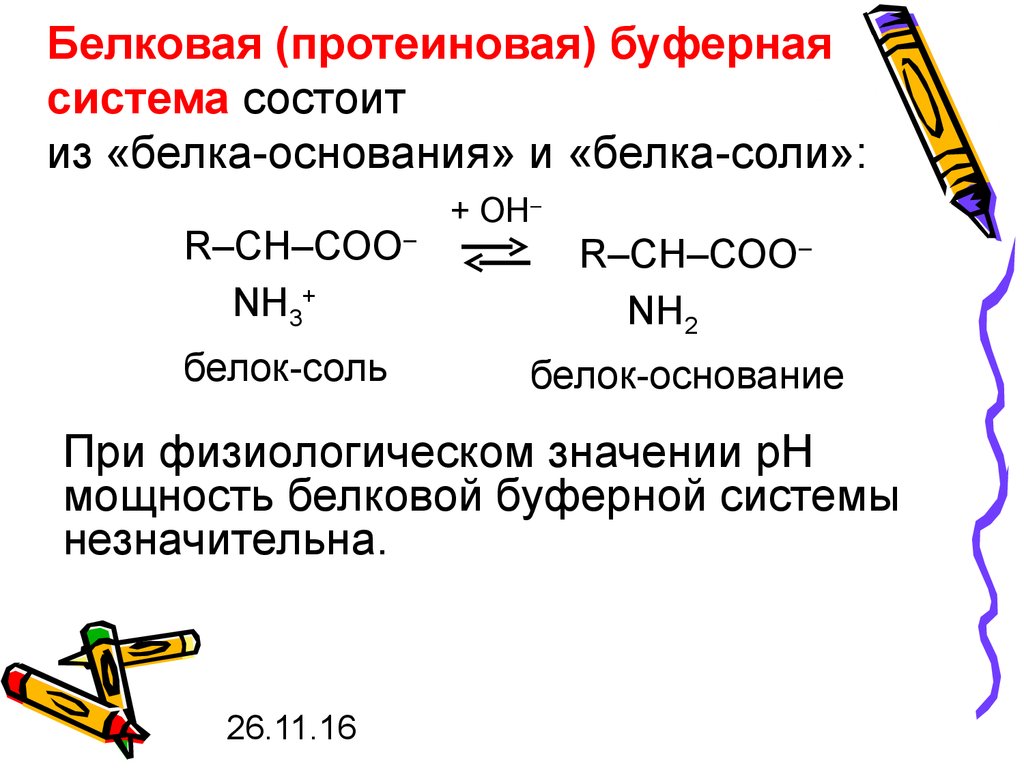
34. Белковая (протеиновая) буферная система состоит из «белка-основания» и «белка-соли»:
R–СН–СОО–NH3+
белок-соль
+ ОН–
R–СН–СОО–
NH2
белок-основание
При физиологическом значении рН
мощность белковой буферной системы
незначительна.
26.11.16
35.
Все буферные системы в организмевзаимосвязаны и для всех них
буферная емкость по кислоте
больше, чем по основанию. Это
связано с особенностями
метаболизма человеческого
организма, образующего больше
кислотных продуктов, чем основных.
26.11.16
36.
Важным показателем дляфизиологических сред является
кислотная буферная ёмкость. При
различных заболеваниях, отравлениях,
голодании и т. п. могут наблюдаться
изменения буферной ёмкости по кислоте
по сравнению с нормой, т. е.
патологические явления: ацидоз и
алкалоз.
26.11.16
37.
Ацидоз– это уменьшение кислотной
буферной ёмкости
физиологической системы по
сравнению с нормой и, как
следствие, увеличение продуктов
кислого характера в организме.
26.11.16
38.
Алкалоз– это увеличение кислотной
буферной ёмкости
физиологической системы по
сравнению с нормой и, как
следствие, увеличение продуктов
основного характера в организме.
26.11.16
39.
Ацидоз или алкалоз могут бытьвызваны нарушением процессов
дыхания (респираторный ацидоз или
алкалоз) или процессов пищеварения
и выделения (метаболический ацидоз
или алкалоз).
26.11.16
40.
при недостатке О2 или избытке СО2в атмосфере, равновесие
атмосфера СО2 ( г )
воздушное пространство легких
3
СО2 ( ж )
Н 2СО3 Н НСО
Н 2О
плазма крови
сдвигается вправо, появляется избыток Н+
в крови, развивается ацидоз
26.11.16
41.
при избыточной вентиляции легкихатмосфера СО2 ( г )
воздушное пространство легких
3
СО2 ( ж )
Н 2СО3 Н НСО
Н 2О
плазма крови
равновесие сдвигается влево, содержание
Н+ в крови становиться меньше нормы,
развивается алкалоз
26.11.16



































 biology
biology chemistry
chemistry








