Similar presentations:
Алканы, алкены, алкины
1.
2.
3.
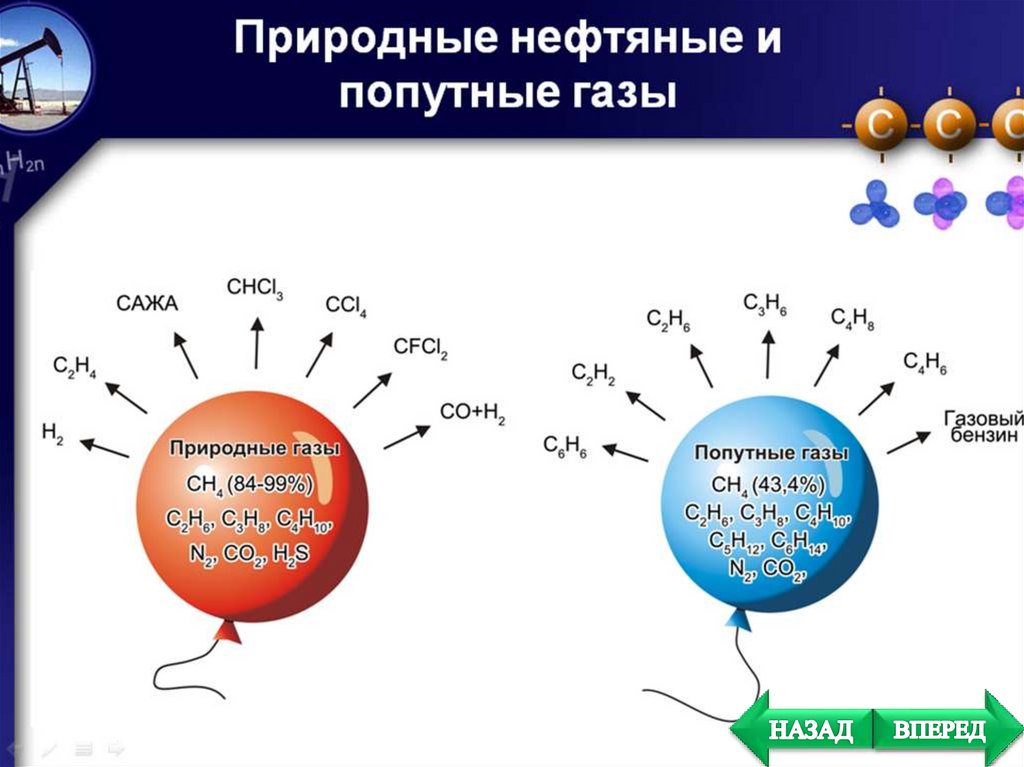
Газообразные
алканы
получают
из
природного и попутного нефтяных газов;
Жидкие и твердые – из нефти.
4.
называют ещё иболотным газом. Образуется
в результате
Природный газ на 95%
состоит из метана
Рудничный газ состоит из
5.
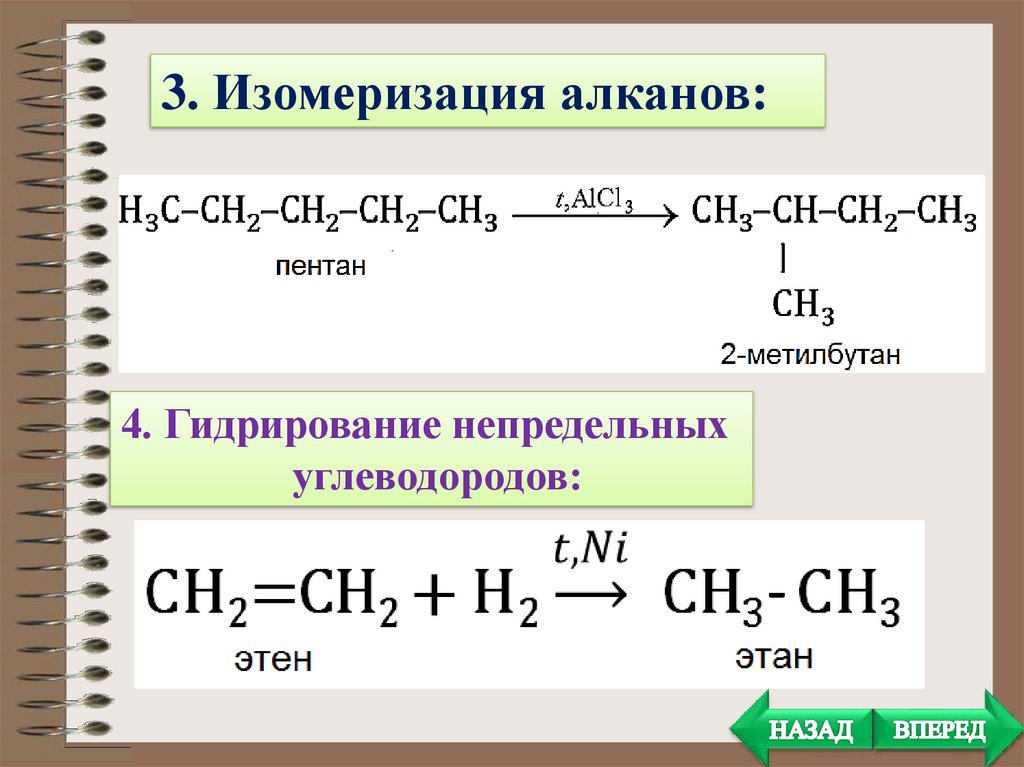
3. Изомеризация алканов:4. Гидрирование непредельных
углеводородов:
6.
7.
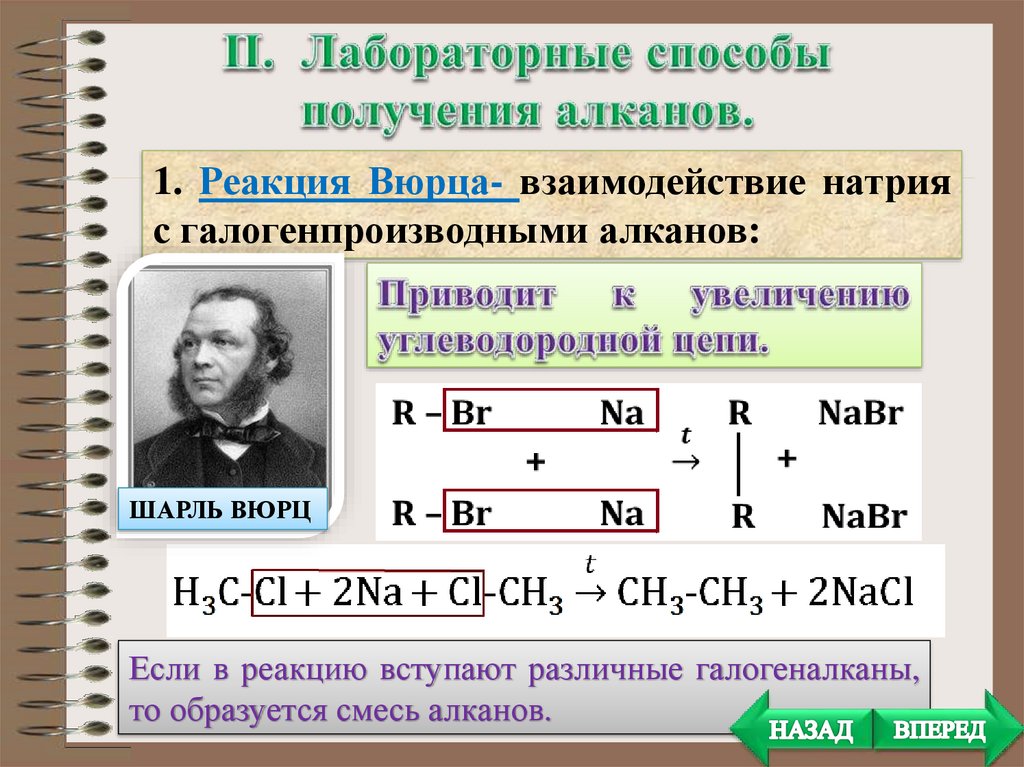
1. Реакция Вюрца- взаимодействие натрияс галогенпроизводными алканов:
ШАРЛЬ ВЮРЦ
Если в реакцию вступают различные галогеналканы,
то образуется смесь алканов.
8.
9.
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑карбид
алюминия
10.
11.
12.
тетрахлорметан – растворитель, для гашения пламени;фтор-, хлор- углеводороды (фреоны) – хладагенты,
производство аэрозолей, производство тефлона.
13.
Метан– получение сажи для типографскойкраски, резины, синтез водорода, производство
ацетилена, формальдегида.
14.
15.
Основные источники–
составляет основную массу природного газа, в нем
присутствуют также в небольших количествах этан,
пропан и бутан.
содержится в выделениях болот и
угольных пластов. Наряду с легкими гомологами метан
присутствует в попутных
Эти газы
растворены в нефти под давлением и находятся также над
ней.
составляют значительную часть продуктов
Содержатся в нефти и
– они называются нафтенами
(от греч. naphtha –
).
16.
17.
В природе широко распространены такжегазовые гидраты алканов, в основном метана, они
залегают в осадочных породах на материках и на
дне океанов. Их запасы, вероятно, превышают
известные запасы природного газа и в будущем
могут случить источником метана и его
ближайших гомологов.
18.
19.
20.
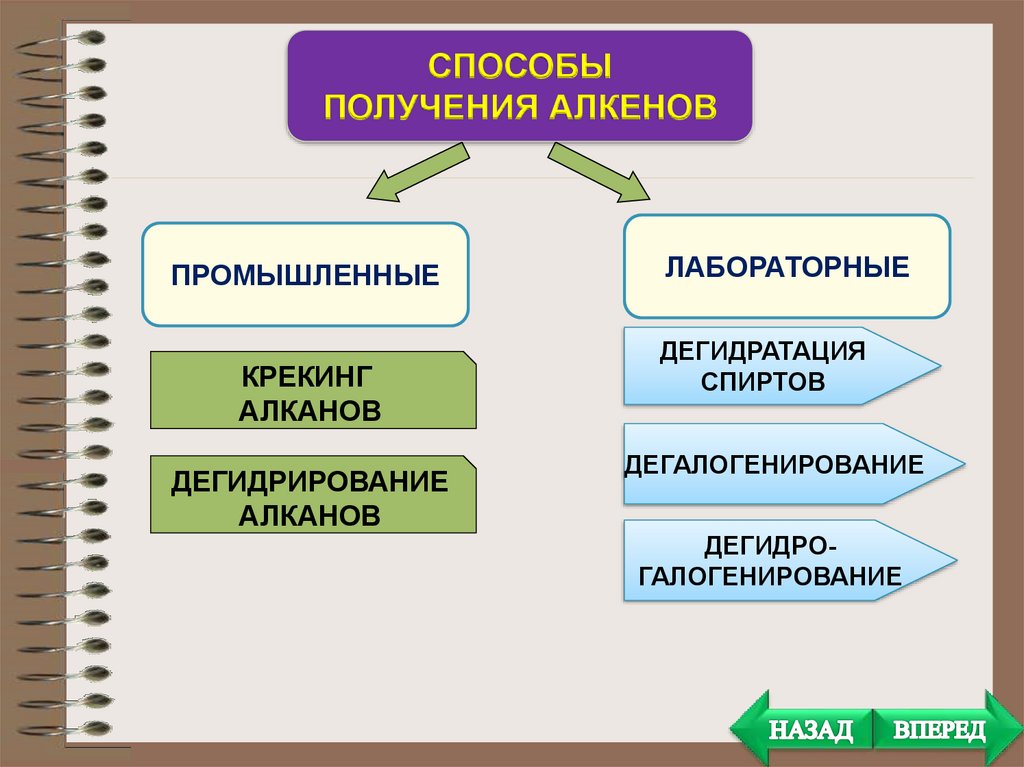
СПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВ
ПРОМЫШЛЕННЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ЛАБОРАТОРНЫЕ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИРОВАНИЕ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
21.
КРЕКИНГ АЛКАНОВАЛК
→ АЛК
С БОЛЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
+ АЛК
С МЕНЕЕ ДЛИНОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
t=400-700C
С10Н22
дек
→
C5H12 + C5H10
пент
пент
22.
ДЕГИДРИРОВАНИЕ АЛКАНОВАЛК
→ АЛК
+ ВОДОРОД
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
эт
эт
(эт
)
23.
СПИРТ → АЛКПРИМЕР:
+ ВОДА
t≥140C,
Н Н Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН
эт
(эт
)
24.
ДЕГАЛОГЕНИРОВАНИЕt
Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
Br Br
этен
1,2-дибромэтан
(этилен)
25.
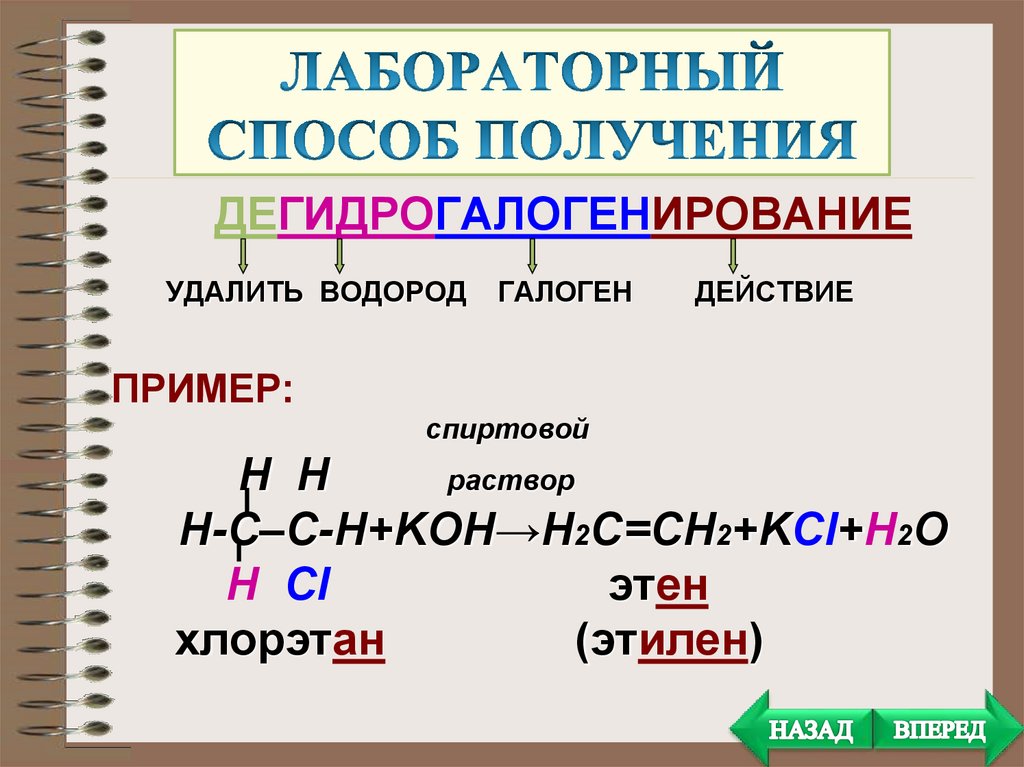
ДЕГИДРОГАЛОГЕНИРОВАНИЕУДАЛИТЬ ВОДОРОД
ГАЛОГЕН
ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H
раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl
этен
хлорэтан
(этилен)
26.
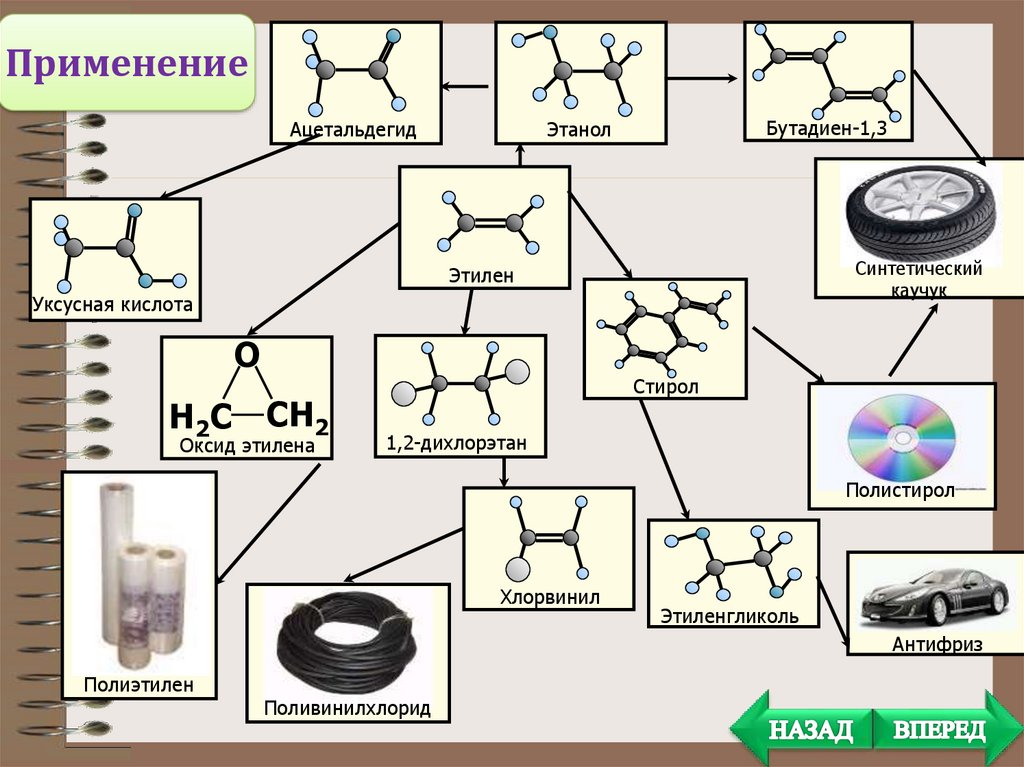
ПрименениеАцетальдегид
Бутадиен-1,3
Этанол
Синтетический
каучук
Этилен
Уксусная кислота
О
Н2С СН2
Оксид этилена
Стирол
1,2-дихлорэтан
Полистирол
Хлорвинил
Этиленгликоль
Антифриз
Полиэтилен
Поливинилхлорид
27.
28.
29.
1) В промышленности ацетилен получаютвысокотемпературным пиролизом метана.
1500ºС
2CH4 → HC≡CH + 3H2
2) Дегидрирование алканов
CH3 – CH3 (Ni, t)↔ 2H2 + CH CH
30.
4) Алкины можно получитьдегидрогалогенированием
дигалогенопроизводных парафинов. Атомы
галогена при этом могут быть расположены как у
соседних атомов углерода, так и у одного
углеродного атома.
CH3–C(Br2)–CH2–CH3+2KOH→CH3–C≡C–CH3+
спирт. р-р
2KBr + 2H2O
31.
32.
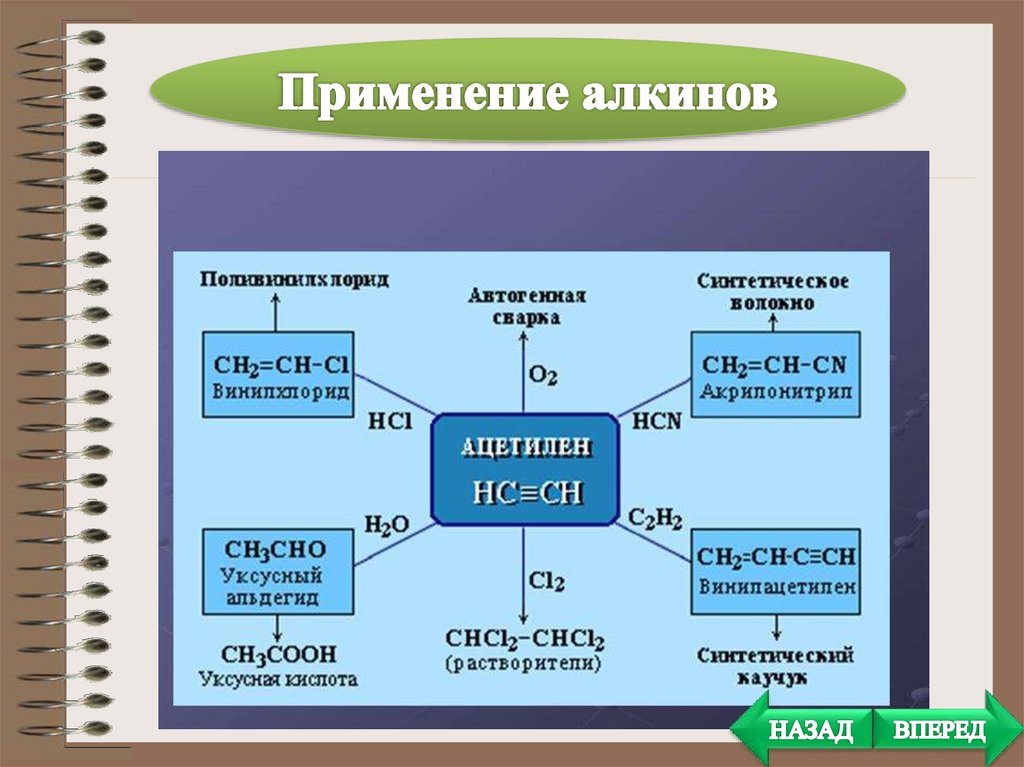
• Получение растворителей. При присоединениихлора к ацетилену получается тетрахлорэтан а
отщеплением от последнего молекулы
хлороводорода — 1,1,2-трихлорэтен. Оба этих
вещества являются весьма ценными и широко
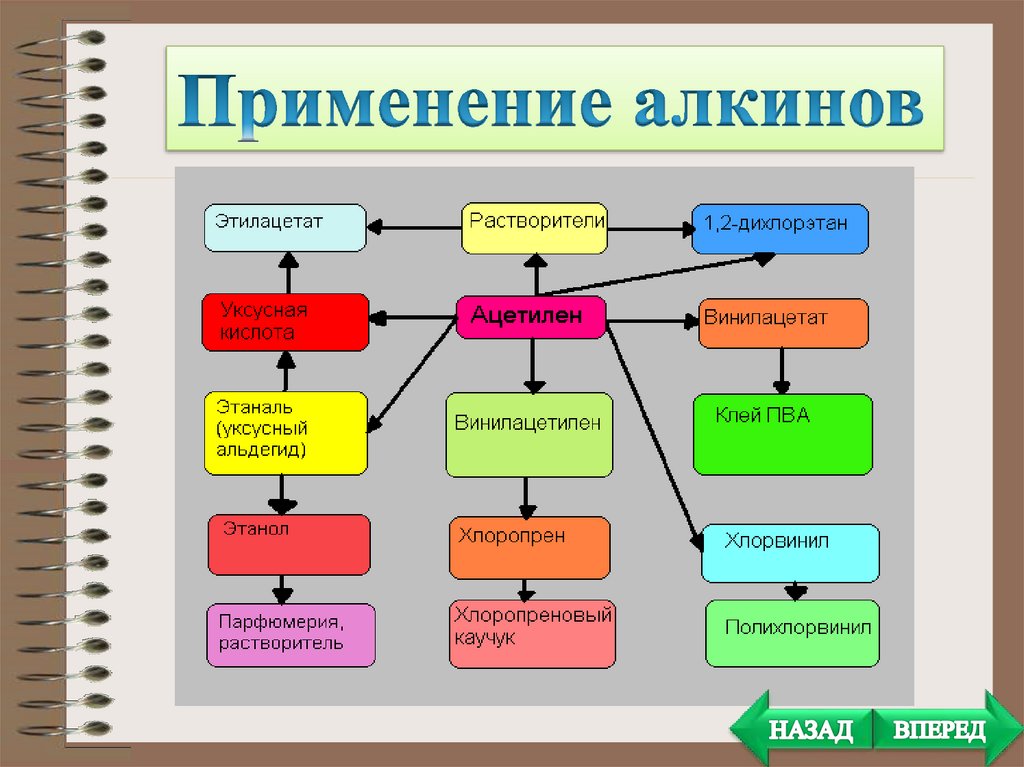
применяемыми растворителями.
• Полимеры. Из ацетилена получают, в частности,
поливинил-хлорид.
Поливинил-хлорид очень широко применяется в
промышленности и в быту.
























 chemistry
chemistry








