Similar presentations:
Газовые законы
1.
С помощьюуравнения состояния
идеального газа
можно исследовать
процессы, в которых
масса газа и один
из трёх параметров —
давление, объём
или температура —
остаётся постоянным.
2.
Газовые законы — количественныезависимости между двумя параметрами
газа прификсированном значении
третьего.
3.
Изопроцесс — это идеализированнаямодель реального процесса, которая
только приближённо отражает
действительность.
4.
Лишь в лабораторных условиях удаётсяподдерживать постоянство того или иного
параметра с высокой точностью.
5.
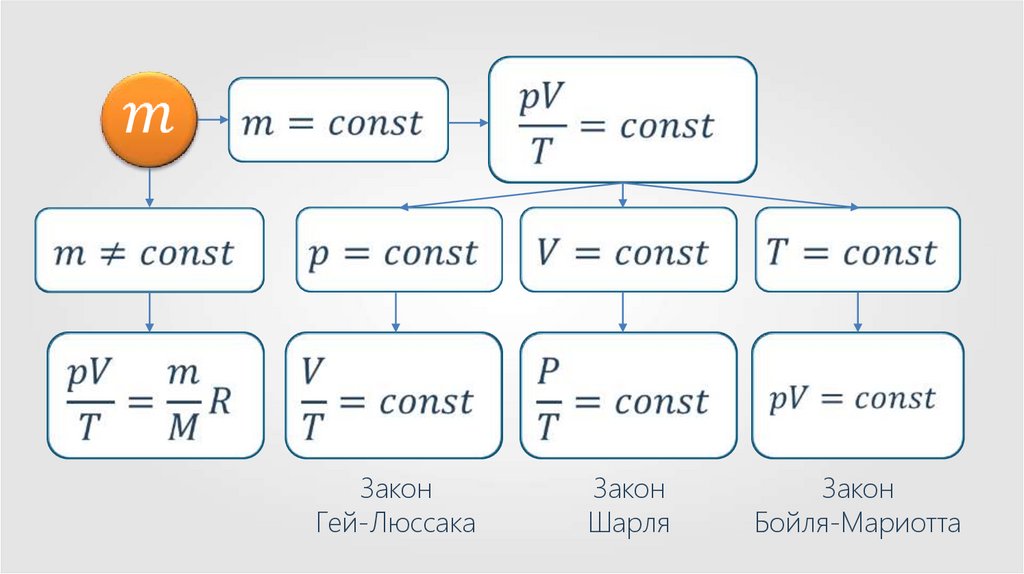
Уравнение состояния идеальногогаза.
6.
Уравнение состояния идеальногогаза.
7.
Уравнение Клапейрона8.
Изотермический процесс — процессизменения состояния системы
при постоянной температуре.
9.
Для изотермического процессапроизведение давления газа
на его объём постоянно.
10.
Закон Бойля-Мариоттасправедлив обычно для любых
газов, а также и для их смесей,
например, для воздуха.
Роберт Бойль
1627–1691 гг.
11.
Давление газа обратнопропорционально его объёму.
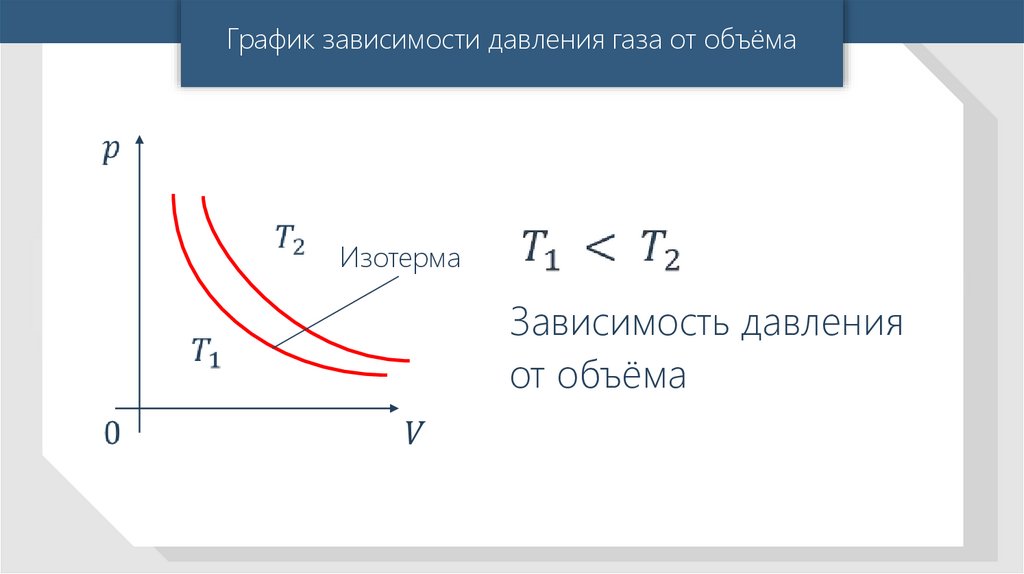
12.
График зависимости давления газа от объёмаИзотерма
Зависимость давления
от объёма
13.
График зависимости объёма газа от температурыЧем выше температура,
тем выше давление.
14.
График зависимости давления газа от температурыЧем выше температура,
тем выше давление.
15.
16.
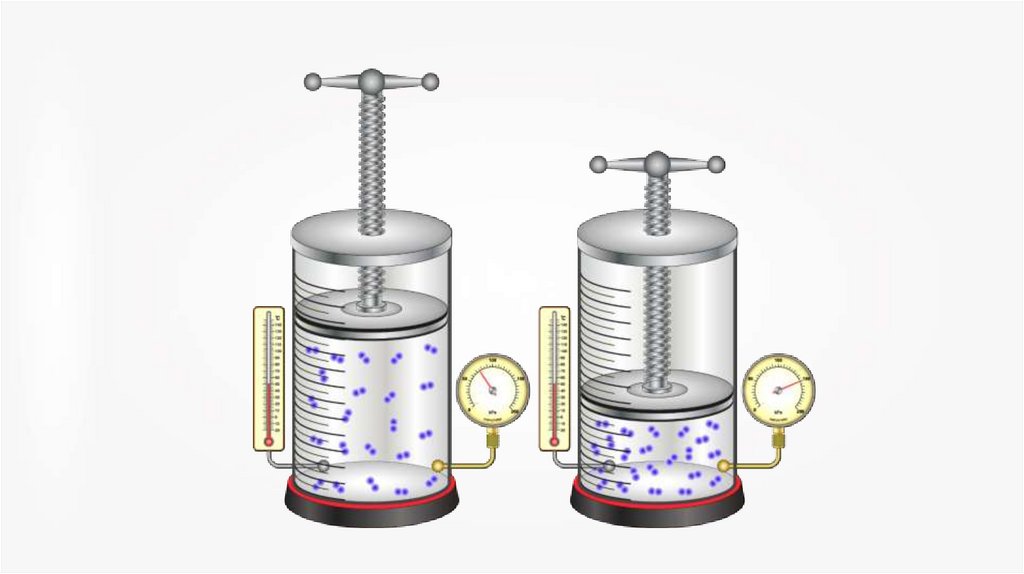
При сжатии газ нагревается,так как при движении
поршня в сосуде скорость
молекул после ударов
о поршень увеличивается,
а, следовательно,
увеличивается
и температура газа.
17.
Поэтому для реализацииизотермического процесса
надо после небольшого
смещения поршня
подождать, когда
температура газа в сосуде
опять станет равной
температуре окружающего
воздуха.
18.
При быстром сжатиидавление под поршнем
сразу становится больше,
чем во всём сосуде.
Если систему предоставить
самой себе, то температура
и давление постепенно
выравниваются, система
приходит в равновесное
состояние.
19.
20.
Процесс, при которомвсе промежуточные состояния газа
являются равновесными, называют
равновесным процессом.
21.
Процесс, при которомвсе промежуточные состояния газа
являются равновесными, называют
равновесным процессом.
22.
Изохорный процесс — процессизменения состояния системы
при постоянном объёме.
23.
Для данной массы газа отношениедавления газа к его температуре
остаётся постоянным, если объём газа
не меняется.
Этот газовый закон был установлен
в 1787 г. и носит название закона
Шарля.
Жак Шарль
1746–1823 гг.
24.
Закон Шарля не соблюдаетсяв области низких температур,
близких к температуре сжижения
(конденсации) газов.
25.
Графики изохорного процесса.Изохора
Чем больше объём
сосуда, тем меньшее
давление газ будет
оказывать на стенки
сосуда.
26.
Графики изохорного процесса.С ростом объёма газа
при постоянной
температуре давление
его согласно закону
Бойля-Мариотта падает.
27.
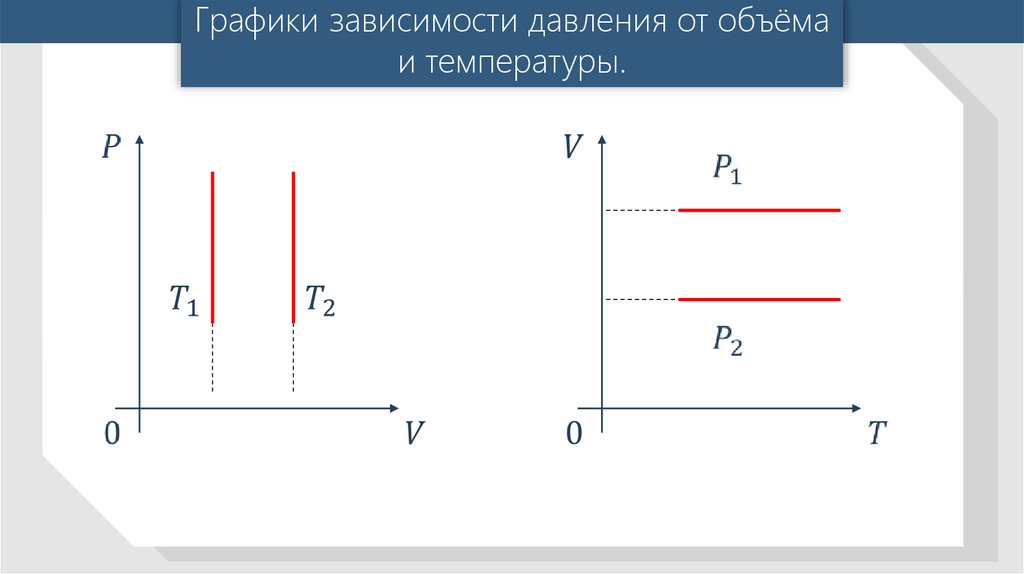
Графики зависимости давления от объёмаи температуры.
28.
29.
Изобарный процесс — процессизменения состояния системы
при постоянном давлении.
30.
Ж.Л. Гей-Люссак1778–1850 гг.
Для газа данной массы отношение
объёма газа к его температуре
остаётся постоянным, если давление
газа не меняется.
Согласно закону Гей-Люссака, объём
газа прямо пропорционален
его температуре.
Если увеличить объём,
то и температура тоже возрастёт
в такое же число раз.
31.
Графики изобарного процесса.Изобара
32.
33.
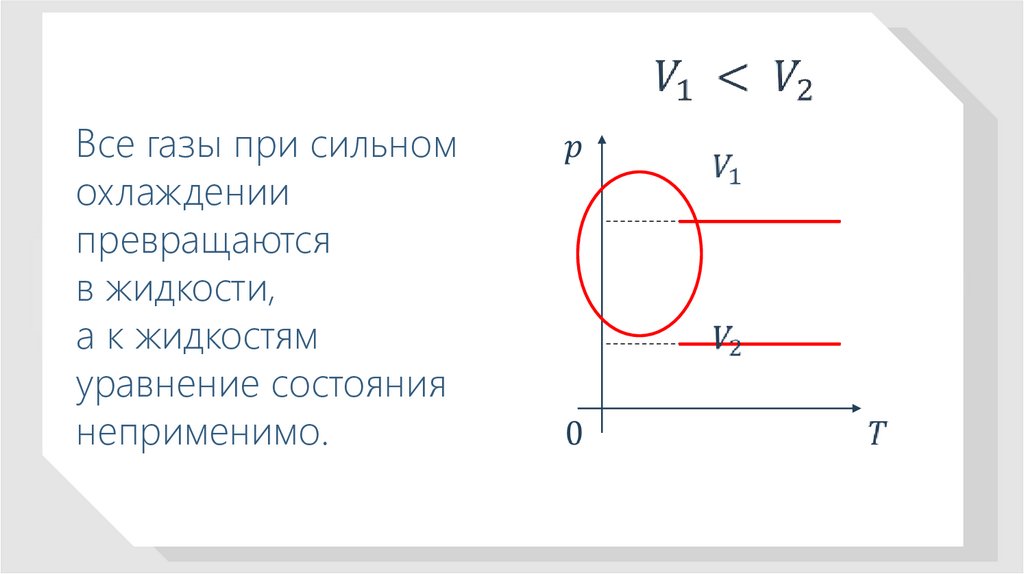
Все газы при сильномохлаждении
превращаются
в жидкости,
а к жидкостям
уравнение состояния
неприменимо.
34.
Изобарным можно считатьрасширение газа
при нагревании его
в цилиндре с подвижным поршнем,
если внешнее давление постоянно.
Постоянство давления
в цилиндре обеспечивается
атмосферным давлением
на внешнюю поверхность поршня.
35.
Роберт Бойль1627–1691 гг.
Жак Шарль
1746–1823 гг.
Ж.Л. Гей-Люссак
1778–1850 гг.
36.
Отношение произведениядавления газа и объёма
к температуре для данной
массы газа — величина
постоянная.
37.
ЗаконГей-Люссака
Закон
Шарля
Закон
Бойля-Мариотта
































 physics
physics








