Similar presentations:
Простые эфиры и перекиси
1.
Министерство науки и высшего образования РФ ФГБОУ ВО«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Направление подготовки
18.03.01 «Химическая
технология»
04.03.02 «Химия, физика и
механика материалов»
Органическая химия
Тема: Простые эфиры и перекиси
Преподаватель: д.х.н., профессор Климочкин Ю.Н
2.
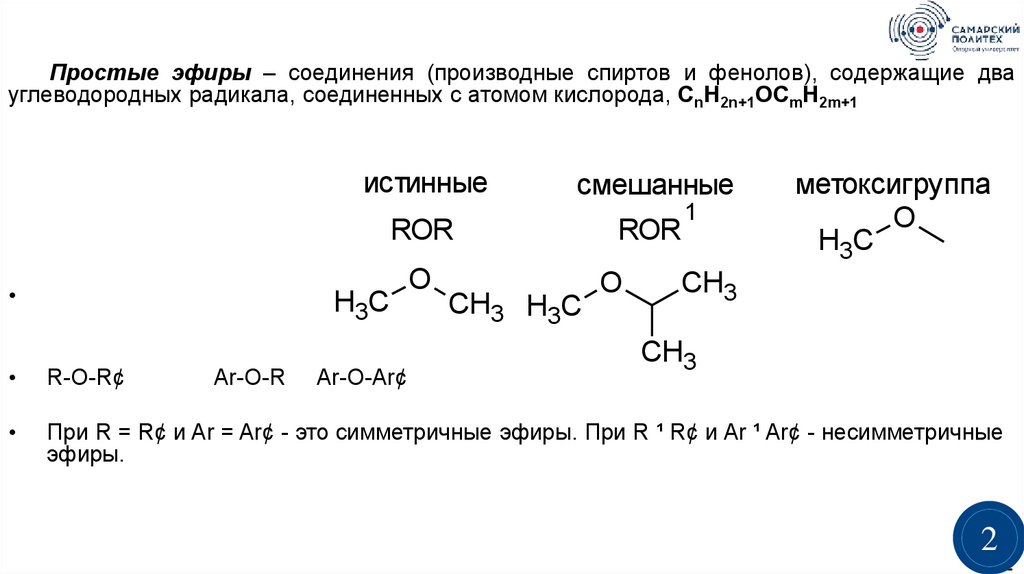
Простые эфиры – соединения (производные спиртов и фенолов), содержащие двауглеводородных радикала, соединенных с атомом кислорода, CnH2n+1OCmH2m+1
истинные
смешанные
ROR
H3C
O
CH3 H3C
ROR
O
1
метоксигруппа
O
H3C
CH3
CH3
R-O-R¢
При R = R¢ и Ar = Ar¢ - это симметричные эфиры. При R ¹ R¢ и Ar ¹ Ar¢ - несимметричные
эфиры.
Ar-O-R
Ar-O-Ar¢
23
2
3.
Классификация
Различают:
Простые эфиры, содержащие связь Сsp3-O
– Диалкиловые и дициклоалкиловые эфиры R-O-R¢.
СН3СН2ОСН2СН3
диэтиловый эфир (этоксиэтан)
дициклогексиловый эфир
– Циклические эфиры различаются по величине цикла и числу атомов
кислорода в цикле.
Трехчленные циклы с одним О-атомом называются эпоксидами или
оксиранами. Четырехчленные – оксетанами.
Простые эфиры, содержащие связь Сsp2-O
– Алкилариловые эфиры Ar-O-R.
метоксибензол (анизол)
этоксибензол (фенетол)
– Диариловые эфиры
Ar-O-Ar’. Д ифенилоксид
– Алкилалкениловые эфиры (виниловые эфиры) С=С-OR.
33
4.
ИзомерияДля простых эфиров характерны все виды структурной и пространственной изомерии. Изомерия углеводородной цепи и
величины радикалов.
Следует отметить, что простые эфиры относятся к спиртам как
межклассовые изомеры.
Примером межклассовых изомеров являются диметиловый эфир
СН3ОСН3 и этанол СН3СН2ОН (брутто-формула С2Н6О).
Метамерия: CH3-O-CH2-CH2-CH3 и C2H5-O-C2H5
43
5.
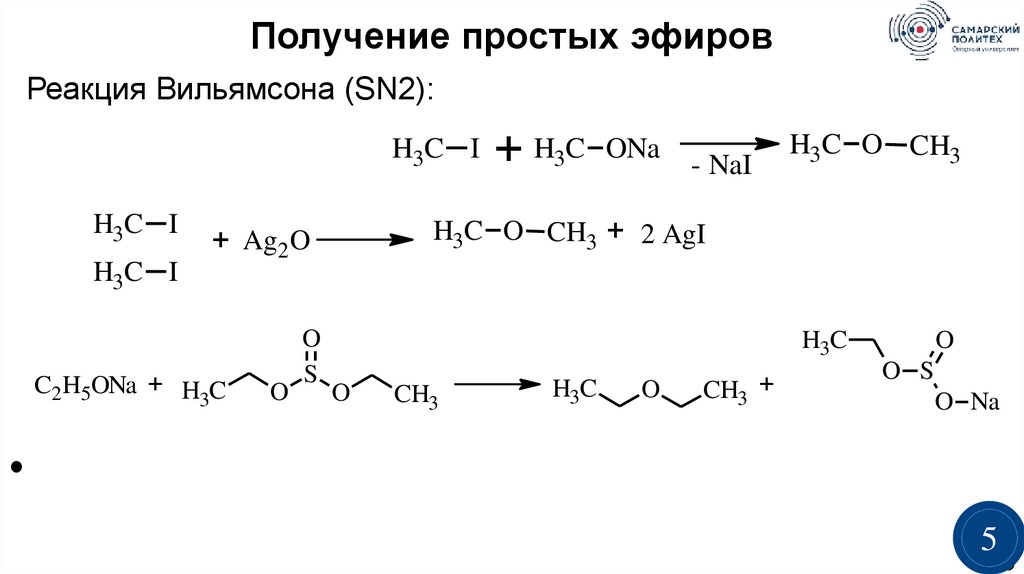
Получение простых эфировРеакция Вильямсона (SN2):
H3C I
H3C I
H3C I
C2H5ONa + H C
3
O
ONa
- NaI
H3C O CH3
H3C O CH3 + 2 AgI
+ Ag2 O
O
S
+ H3C
H3C
O
CH3
H3C
O
CH3 +
O
O S
O Na
53
5
6.
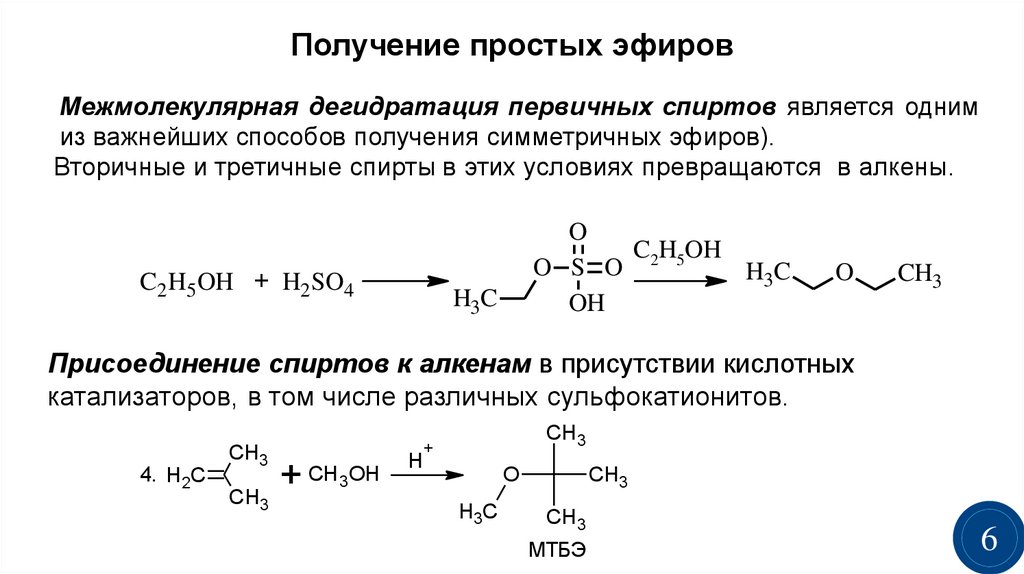
Получение простых эфировМежмолекулярная дегидратация первичных спиртов является одним
из важнейших способов получения симметричных эфиров).
Вторичные и третичные спирты в этих условиях превращаются в алкены.
C2 H5 OH + H2 SO4
O
C H OH
O S O 2 5
H3C
OH
H3C
O
CH3
Присоединение спиртов к алкенам в присутствии кислотных
катализаторов, в том числе различных сульфокатионитов.
4. H2C
CH3
CH3
CH3
+
+ CH 3OH
H
O
H3C
CH3
CH3
МТБЭ
63
7.
Получение анизола:OH
O
+ CH 2N2
CH3
+
N2
анизол
OH
+
H3C OH
Краун-эфиры:
O
175-225оС, Al2O3
+ H2O
O
O
O
O
CH3
O
O
O
O
O
O
O
15-краун-5
18-краун-6
73
7
8.
ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ ПРОСТЫХ ЭФИРОВДиметиловый эфир – газ остальные - бесцветные, подвижные, летучие жидкости с
характерным приятным запахом.
Простые эфиры легче воды; низшие - плохо, а высшие - не растворимы в воде. В 100
мл воды растворяется 7,5 г диэтилового эфира.
Длина связи С-О составляет 0,142 нм, дипольный момент 1,2-1,3 D, валентный угол
С-О-С 109-112°,
Диариловые эфиры - твердые вещества, плохо растворимы в воде, легче воды.
Температуры кипения простых эфиров значительно ниже температур кипения
соответствующих спиртов и близки к алканам с таким же числом С-атомов, так как в
эфирах нет межмолекулярной водородной связи.
CH3OCH3
C2H5OH
Ткип, °С
-24, нет водородных связей
78
83
9.
Химические свойства:Характерны реакции с участием:
1) О-атома и его неподеленных электронных пар;
2) С-О связи;
3) углеводородного-радикала.
00C
HJ
1. H3C
O
O4
H
2S
.
ц
кон
2. H3C
O
2
C2 H5I
CH3
нагрев
H3C
C2 H5 OH +
2 C 2 H5 I + H2O
O
O S OH + H2O
O
CH3
оле
ум
H3C
O
O S O
O
CH3
+ H2O
93
9
10.
3. H3CO
CH3 + 2 Na
C2H5ONa +
C2H5Na
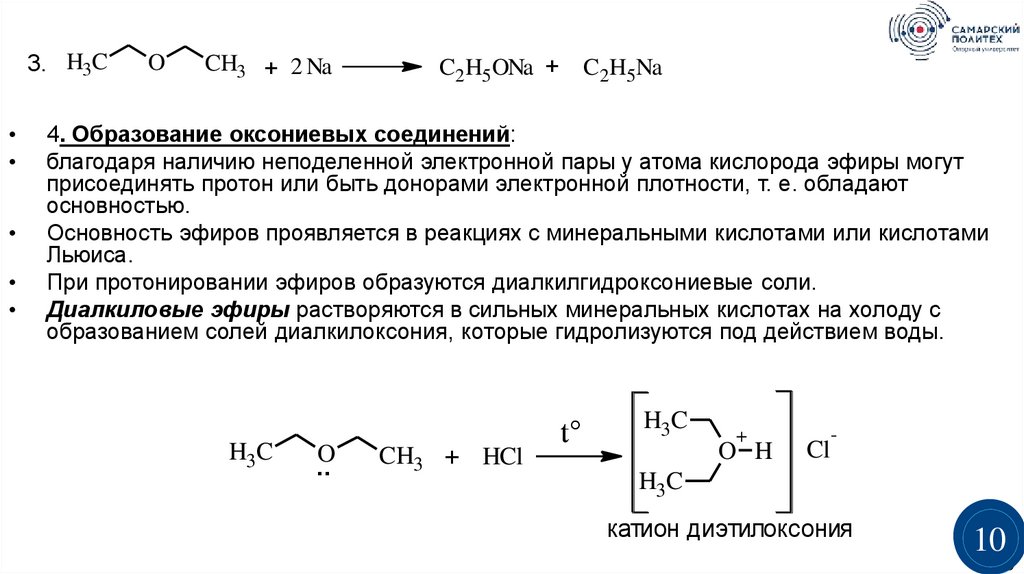
4. Образование оксониевых соединений:
благодаря наличию неподеленной электронной пары у атома кислорода эфиры могут
присоединять протон или быть донорами электронной плотности, т. е. обладают
основностью.
Основность эфиров проявляется в реакциях с минеральными кислотами или кислотами
Льюиса.
При протонировании эфиров образуются диалкилгидроксониевые соли.
Диалкиловые эфиры растворяются в сильных минеральных кислотах на холоду с
образованием солей диалкилоксония, которые гидролизуются под действием воды.
H3C
O
..
CH3 + HCl
t°
H3C
+
O H
Cl
-
H3C
катион диэтилоксония
10
3
10
11.
Реакции по углеводородному остаткуВ диалкиловых эфирах реакции (например, хлорирование при облучении) идут
по aльфа С-атому, т. к. образующиеся свободные радикалы более стабильны,
чем алкильные.
Диалкиловые эфиры на свету медленно окисляются кислородом воздуха с
образованием гидропероксидов.
Последние при хранении полимеризуются в полимерные пероксиды.
Реакции алкилариловых эфиров по ароматическому кольцу.
Алкокси-группа как электронодонорный заместитель активирует бензольное
кольцо в SE-реакциях, является о-, п-ориентантом (ориентантом I-го рода).
Реакции виниловых эфиров обусловлены наличием поляризованной двойной
углерод-углеродной связи.
Характерны реакции присоединения и полимеризации.
Направление реакции присоединения контролируется неравномерным
распределением электронной плотности вследствие действия +M-эффекта
алкоксигруппы.
11
3
12.
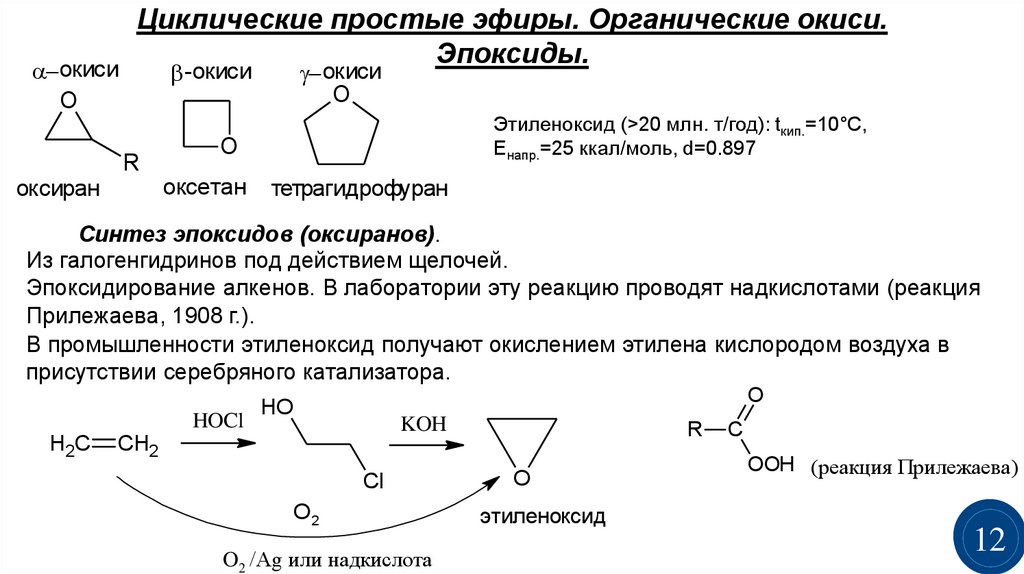
Циклические простые эфиры. Органические окиси.Эпоксиды.
- окиси
-окиси
- окиси
O
O
R
оксиран
Этиленоксид (>20 млн. т/год): tкип.=10°С,
Енапр.=25 ккал/моль, d=0.897
O
оксетан
тетрагидрофуран
Синтез эпоксидов (оксиранов).
Из галогенгидринов под действием щелочей.
Эпоксидирование алкенов. В лаборатории эту реакцию проводят надкислотами (реакция
Прилежаева, 1908 г.).
В промышленности этиленоксид получают окислением этилена кислородом воздуха в
присутствии серебряного катализатора.
HOCl
H2C
O
HO
KOH
CH2
Cl
O2
O2 /Ag или надкислота
R
O
этиленоксид
C
OOH (реакция Прилежаева)
12
3
13.
Химические свойства:Трехчленный цикл оксиранов характеризуется высокой степенью
различных видов напряжений . Кроме того, в трехчленном цикле оксирана
имеются две полярные связи С-О.
Эти факторы обусловливают высокую реакционную способность
оксиранов, которые могут подвергаться атаке электрофилов по О- атому
или нуклеофилов по С-атомам цикла
O
Изомеризация
400 °C
O
через CH2=CH-OH
или [H+]
Реакция с реактивами Гриньяра
1) RMgX
O
2) H3O+
H3C
H
R
OH
13
3
13
14.
O+
H X
HO
NH
H+, H2O
Br
OH
HO
OH
C 2H 5
HB
r
3
HO
NH2
X
O
HO
NH
OH
O
HO
HO
OH
O
...
ПЭГ
O C2 H5
N
этилцеллозольв
HO
триэтаноламин
OH
14
3
14
15.
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПРОСТЫХ ЭФИРОВ– Диэтиловый эфир
Диэтиловый эфир — бесцветная жидкость с приятным запахом, очень летуч, легко
воспламеняется. Получают из этилового спирта. Плохо растворим в воде (7% при
20°С), легче воды. Применяется как растворитель, в медицине.
– Эфиры этиленгликоля
• Целлозольвы - моноэфиры этиленгликоля RCH2CH2OH:
R = CH3, метилцеллозольв;
R = CH2CH3, этилцеллозольв.
Целлозольвы - хорошие растворители, особенно для сложных эфиров целлюлозы;
используются для отделки кож, тканей, как присадки к ракетным топливам, в качестве
пластификаторов.
• Диметиловый эфир этиленгликоля (1,2-диметоксиэтан)
CH3ОCH2CH2OCH3 является хорошим растворителем.
• Карбитолы - моноалкиловые эфиры диэтиленгликоля, на-пример, нC4H9ОCH2CH2OCH2CH2OH - бутилкарбитол.
• Полиглимы - диметиловые эфиры ди- и триэтиленгликоля.
• Диглим - CH3ОCH2CH2OCH2CH2OCH3 - диметиловый эфир диэтиленгликоля;
используется как хороший растворитель, сильно сольватирует катионы
металлов.
15
3
16.
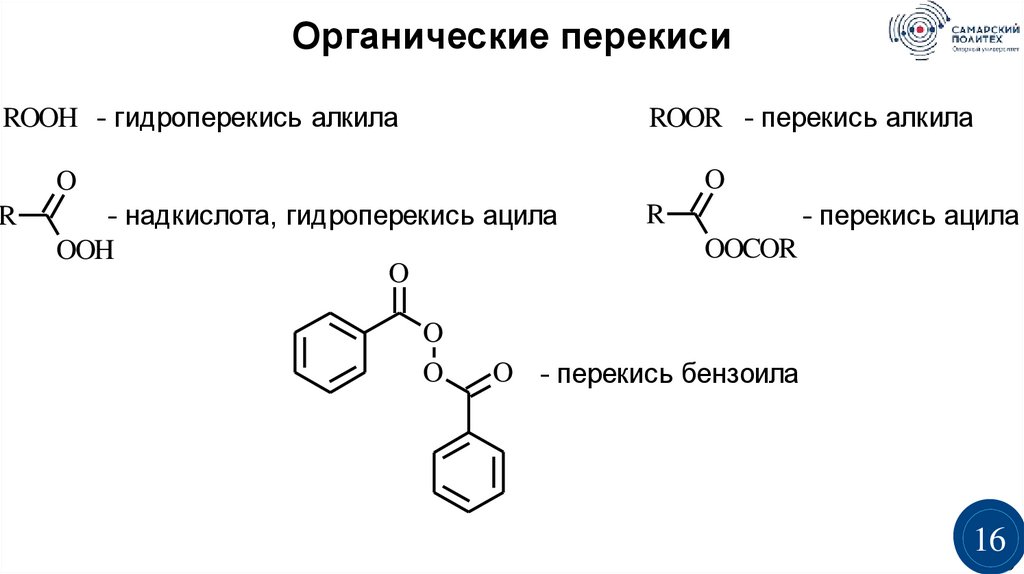
Органические перекисиROOH - гидроперекись алкила
R
ROOR - перекись алкила
O
O
- надкислота, гидроперекись ацила
OOH
O
O
O
- перекись ацила
R
OOCOR
O - перекись бензоила
16
3
16
17.
Получение.1.Действие спиртов (кислот) на H2O2:
+
H2 O2
R OH
O
H2O2
R
OH - H O
2
O
R O
OH
+ H2O
R
O OH
Окислители при нагревании распадаются до свободных радикалов.
CH3
H3C
O
CH3 OH
t°
- OH
O
H3C
t°
O
O
CH3
.
CH3
H3C
O
CH3
- (CH3)2CO
CH3
O
2 H3C
CH3
O
- 2 CO2
O
Инициаторы радикальных процессов и полимеризации
17
3
17











 chemistry
chemistry








