Similar presentations:
Превращения веществ в окружающей среде и живых организмах
1. Превращения веществ – сущность процессов в окружающей среде и живых организмах.
Химия, 10 класс, реальный профиль.ПРЕВРАЩЕНИЯ ВЕЩЕСТВ –
СУЩНОСТЬ ПРОЦЕССОВ В
ОКРУЖАЮЩЕЙ СРЕДЕ И ЖИВЫХ
ОРГАНИЗМАХ.
Гурэу В.А., учитель химии,
высшая дидактическая категория.
2. Вспомните! Что называется химической реакцией?
Многиехимические
реакции
являются
окислительно
востановительными
(ОВР).
3. Что будет с яблоком, если его надрезать и оставить на некоторое время?
Яблоко темнеет из-заокисления железа.
Происходит ОВР
(окислительновосстановительная реакция).
4. После изучения этой темы вы будете способны:
объяснятьи
применять
понятия,
относящиеся к
химическим реакциям,
окислительно-восстановительным процессам;
идентифицировать некоторые химические
реакции, применяемые в повседневной жизни
и деятельности человека как ОВ процессы,
объяснять их химическую сущность.
5. Значение ОВР
Окислительно-восстановительныепроцессы принадлежат к числу
наиболее распространенных
химических реакций и имеют огромное
значение в теории и практике.
6. Значение ОВР
С ними связаны процессы обмена веществ,протекающие в живом организме, гниение и
брожение, фотосинтез.
Окислительно-восстановительные процессы
сопровождают круговороты веществ в
природе. Их можно наблюдать при горении
топлива, в процессах коррозии металлов, при
электролизе и выплавке металлов.
7. Значение ОВР
Окислительно-восстановительные реакциилежат в основе преобразования энергии
взаимодействующих химических веществ в
электрическую энергию в гальванических и
топливных элементах.
8. В чем же заключается суть ОВР?
Окислительно-восстановительные реакциипредставляют собой единство двух
противоположных процессов - окисления и
восстановления.
В этих реакциях число электронов, отдаваемых
восстановителями, равно числу электронов,
присоединяемых окислителями.
При этом независимо от того, переходят ли
электроны от одного атома к другому
полностью или лишь частично, оттягиваются
к одному из атомов, условно говорят только об
отдаче или присоединении электронов.
9.
«Окислитель как отъявленный грабительКак пират, бандит, агрессор, Бармалей
Отнимает электроны - и ОК!
Потерпев урон, восстановитель
Восклицает: «Вот я, помогите!
Электроны мне мои верните!»
Но никто не помогает и ущерб
Не возмещает…»
10.
Атомы, молекулы или ионы, которыеотдают
электроны,
называются
восстановителями.
Атомы, молекулы или ионы, которые
присоединяют электроны, называются
окислителями.
Окислением
называют
процесс
потери
электронов
атомом,
молекулой
или ионом.
Восстановлением
называют
процесс
присоединения
электронов к
атомам,
молекулам или
ионам.
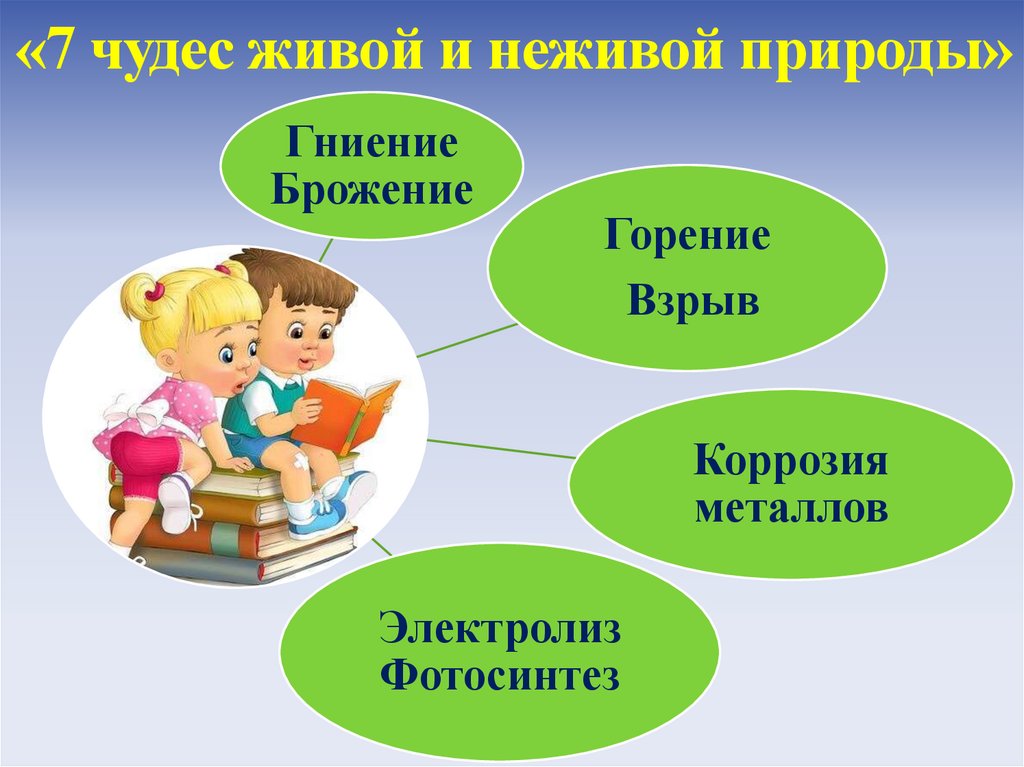
11. «7 чудес живой и неживой природы»
ГниениеБрожение
Горение
Взрыв
Коррозия
металлов
Электролиз
Фотосинтез
12.
Корро́зия металлов(от лат. corrosio разъедание) - это
самопроизвольное
разрушение металлов в
результате химического
или физико-химического
взаимодействия с
окружающей средой. В
общем случае это
разрушение любого
материала, будь то
металл или керамика,
дерево или полимер.
13.
Гние́ние(аммонификация) процесс разложения
азотсодержащих
органических
соединений (белков,
аминокислот), в
результате их
ферментативного
гидролиза под действием
анаэробных
микроорганизмов
(аэробы принимают
меньшее участие в
процессах гниения)
с образованием
токсичных для человека
конечных продуктов аммиака,сероводорода,
а также первичных и
вторичных аминов.
14.
Горе́ние - сложныйфизико-химический
процесс превращения
компонентов горючей
смеси в продукты
сгорания с выделением
теплового излучения,
света и лучистой
энергии. Приближенно
можно описать
природу горения как
бурно идущее
окисление.
15.
Горе́ние спички.Природу горения
спички упрощенно
можно описать как
ОВР:
2КСlO3 + 3S = 2КСl + 3SO2
16.
Состав намазки дляспичечной головки
Бертолетова соль KClO3,
дихромат калия K2Cr2O7
Окислители
Сера S
Восстановитель (горючее
вещество)
Свинцовый сурик Pb3O4,
железный сурик Fe2O3
Пигменты
Костный клей
Связующее
Оксид цинка ZnO
измельченное стекло
Наполнители:
для снижения реакционной
способности
для увеличения силы
трения
17.
Состав намазки спичечнойкоробки
Бертолетова соль KCLO3,
сульфид сурьмы Sb2S3
Восстановители (горючие
вещества)
Свинцовый сурик Pb3O4,
железный сурик Fe2O3
Пигменты
Костный клей
Связующее
Оксид цинка ZnO
Мел CaCO3
измельченное стекло
Наполнители:
для снижения реакционной
способности
для увеличения силы
трения
18.
Взрыв - физическийи/или химический
быстропротекающий
процесс с выделением
значительной энергии в
небольшом объёме (по
сравнению с
количеством
выделяющейся энергии),
приводящий к ударным,
вибрационным и
тепловым воздействиям
на окружающую среду и
высокоскоростному
расширению газов.
19.
Взрыв нитроглицерина(входит в состав
динамита, пороха):
4C3H5N3O9 =6N2+12CO2+O2+10H2O
При химическом взрыве, кроме
газов, могут образовываться и
твёрдые высокодисперсные
частицы, взвесь которых
называют продуктами взрыва.
20.
Электро́лиз - физико-химическое явление,
состоящее в выделении
на электродах составных
частей растворённых или
расплавленных веществ,
являющихся результатом
реакций на электродах,
которое возникает при
прохождении
электрического тока
через раствор либо
расплав электролита.
21.
Электро́лизрасплава хлорида натрия:
2NaCl = 2Na + Cl2
Электро́лиз
раствора
хлорида меди (II):
CuCl2 = Cu + Cl2
22.
Фотосинтез (от греч. φωτοсвет и σύνθεσις - синтез,совмещение) - процесс
образования органических
веществ из углекислого газа
и воды на свету при участии
фотосинтетических
пигментов
(хлорофилл у растений,
бактериохлорофилл и
бактериородопсин у
бактерий).
В современной физиологии
растений под фотосинтезом
понимается совокупность
процессов поглощения,
превращения и
использования энергии
квантов света в различных
реакциях.
23.
Фотосинтез- процесс
образования органических
веществ из углекислого газа и
воды на свету при участии
биокатализаторов:
6CO2 + 6H2O = C6H12O6 + 6O2
24.
Броже́ние(сбра́живание, фермента́ция)
- «это такой метаболический
процесс, при котором
регенерируется АТФ, а
продукты расщепления
органического субстрата
могут служить одновременно
и донорами, и акцепторами
водорода».
По выражению Луи Пастера:
«брожение - это жизнь без
кислорода».
25.
Броже́ние- это анаэробный (без
участия кислорода)
метаболический распад
молекул питательных
веществ, например
глюкозы:
С6H12O6 = 2C2H5OH+2CO2
Большинство типов
брожения
осуществляют
микроорганизмы.
26.
По горизонтали:1. Какой процесс отражает схема:
3. Реакция N2 (г.) + 3Н2 (г.)=2NН3 (г.) + Q
является окислительно-восстановительной,
обратимой, гомогенной, … .
4. … углерода(II) – типичный восстановитель.
5. Какой процесс отражает схема:
6. Для подбора коэффициентов в уравнениях окислительновосстановительных реакций используют метод
электронного … .
7. Согласно схеме
алюминий отдал … электрона.
8. В реакции: Н2 + Сl2 = 2НCl водород Н2 – … .
9. Реакции какого типа всегда только окислительновосстановительные?
10. Степень окисления простых веществ равна … .
11. В реакции: Zn + S = ZnS восстановитель – это… .
27.
По горизонтали:восстановление
экзотермическая.
оксид
окисление
баланса
три
восстановитель
замещения
ноль
цинк
О
К
И
С
Л
И
Т
Е
Л
И
28. Выводы:
«Семь чудес живой и неживой природы»:горение, гниение, коррозия, брожение, взрыв,
электролиз и фотосинтез.
Это окислительно-восстановительные
процессы.
Они окружают нас и играют
огромную роль в
нашей жизни.
29. Чтобы еще лучше разобраться в изучаемой теме, выполните самостоятельно задание :
сделайте описание трёх природных явленийили бытовых процессов, которые являются
окислительно - восстановительными
процессами;
сделайте вывод о практическом значении
ОВР.
30.
31. Желаю успехов в изучении химии! Спасибо за внимание!
32.
33.
Использованные ресурсы:№
Ресурс
Источник ресурса
1.
Основы
Национального https://mecc.gov.md/sites/default/files/cadrul_de_referinta_final_rus_tipa
Куррикулума
r.pdf
2.
3.
Куррикулум по химии
4.
Modele de proiecte didactice https://mecc.gov.md/sites/default/files/chimie_cl._vii_2019de lungă durată
2020_final.pdf
5.
Repere metodologice privind plasate pe pagina web: www.mecc.gov.md
organizarea
peocesului
educațional la disciplina
şcolară Chimie în anul de
studii 2020-2021, aprobate de
MECC
6.
Приказ №591 «О внедрении https://mecc.gov.md/sites/default/files/ordin_591_din_26.06.2020_imple
Куррикулума в 2020-2021 mentarea_curriculai_a.s.2020-2021.pdf
учебном году»
7
8
Картинки
https://mecc.gov.md/sites/default/files/c-chimialiceuru.pdf
Гид
по
внедрению https://mecc.gov.md/sites/default/files/ghid-chimialiceuru.pdf
куррикулума-2019
https://www.yandex.ru
https://www.google.com
































 chemistry
chemistry








