Similar presentations:
Типы химической связи. ковалентная полярная и неполярная связи
1.
ХИМИЯ,7 КЛАССТипы химической связи.
Ковалентная
неполярная и полярная
связи.
Н. БОЗАДЖИ
УЧИТЕЛЬ ХИМИИ
ВЫСШАЯ ДИД. КАТЕГОРИЯ
2. ПОСЛЕ ИЗУЧЕНИЯ ДАННОЙ ТЕМЫ ВЫ БУДЕТЕ СПОСОБНЫ
1.Оперироватьпонятиями
химическая
связь,
электроотрицательность, ковалентная неполярная связь,
ковалентная полярная связь, спаренные и неспаренные
электроны, общая электронная пара.
2. Характеризовать способ образования ковалентной
связи.
3.Определять типы
соединениях.
химической связи в химических
3.
А почему атомысвязываются между собой?
Атомы благородных газов имеют завершённый
внешний энергетический уровень. Он наиболее
устойчив и стабилен. Атомы других элементов
пытаются приобрести конфигурацию (такое же
строение) ближайшего благородного газа и
перейти в наиболее устойчивое состояние. Такое
состояние атомы приобретают, взаимодействуя
между собой, в результате между ними возникает
химическая связь
4.
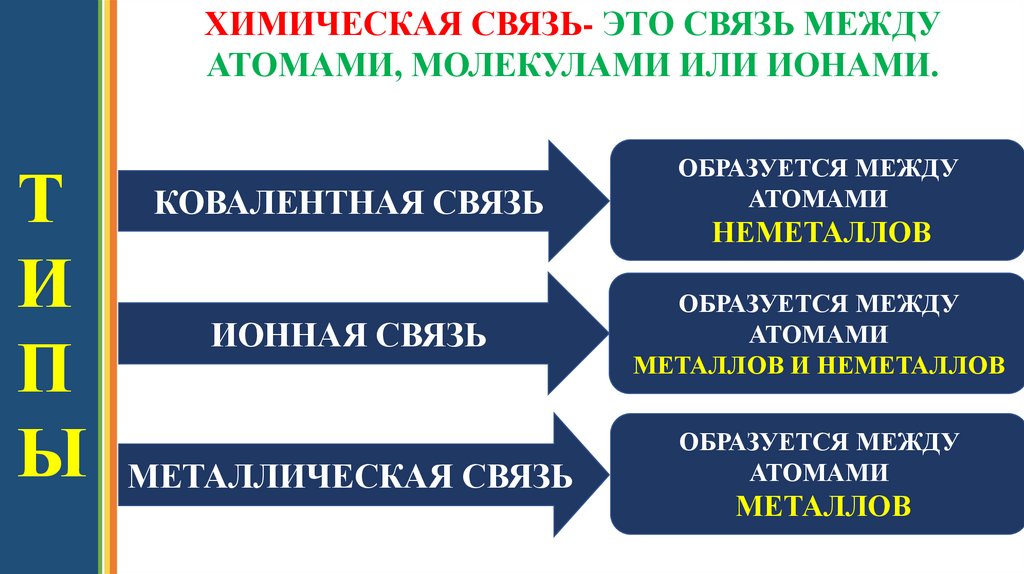
ХИМИЧЕСКАЯ СВЯЗЬ- ЭТО СВЯЗЬ МЕЖДУАТОМАМИ, МОЛЕКУЛАМИ ИЛИ ИОНАМИ.
Т КОВАЛЕНТНАЯ СВЯЗЬ
И
ИОННАЯ СВЯЗЬ
П
Ы МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
ОБРАЗУЕТСЯ МЕЖДУ
АТОМАМИ
НЕМЕТАЛЛОВ
ОБРАЗУЕТСЯ МЕЖДУ
АТОМАМИ
МЕТАЛЛОВ И НЕМЕТАЛЛОВ
ОБРАЗУЕТСЯ МЕЖДУ
АТОМАМИ
МЕТАЛЛОВ
5.
ОЙ! ОЙ!ВСПОМНИЛ!
А КАК
ОПРЕДЕЛИТЬ
КОЛИЧЕСТВО
ЭЛЕКТРОНОВ
МОЖНО ОПРЕДЕЛИТЬ
НА ВНЕШНЕМ
ПО
НОМЕРУУРОВНЕ?
ГРУППЫ
В ОБРАЗОВАНИИ ХИМИЧЕСКОЙ СВЯЗИ
УЧАСТВУЮТ ЭЛЕКТРОНЫ
ВНЕШНЕЙ/ПОСЛЕДНЕЙ ОБОЛОЧКИ
:
:
·
·
Na· Ca· ·C· ·N· :S·
·
·
·
ВАЛЕНТНЫЕ /НЕСПАРЕННЫЕ
ЭЛЕКТРОНЫ
А ЧТОБЫ ПРИОБРЕСТИ УСТОЙЧИВОЕ СОСТОЯНИЕ АТОМЫ
ЭЛЕМЕНТОВ МОГУТ ПРИТЯГИВАТЬ ИЛИ ОТДАВАТЬ ЭЛЕКТРОНЫ
НО СПОСОБНОСТЬ ПРИТЯГИВАТЬ ИЛИ ОТДАВАТЬ
ЭЛЕКТРОНЫ У АТОМОВ РАЗНАЯ
МЕТАЛЛЫ
НЕМЕТАЛЛЫ
ЛЕГКО ОТДАЮТ ЭЛЕКТРОНЫ
ЛЕГКО ПРИНИМАЮТ ЭЛЕКТРОНЫ
6.
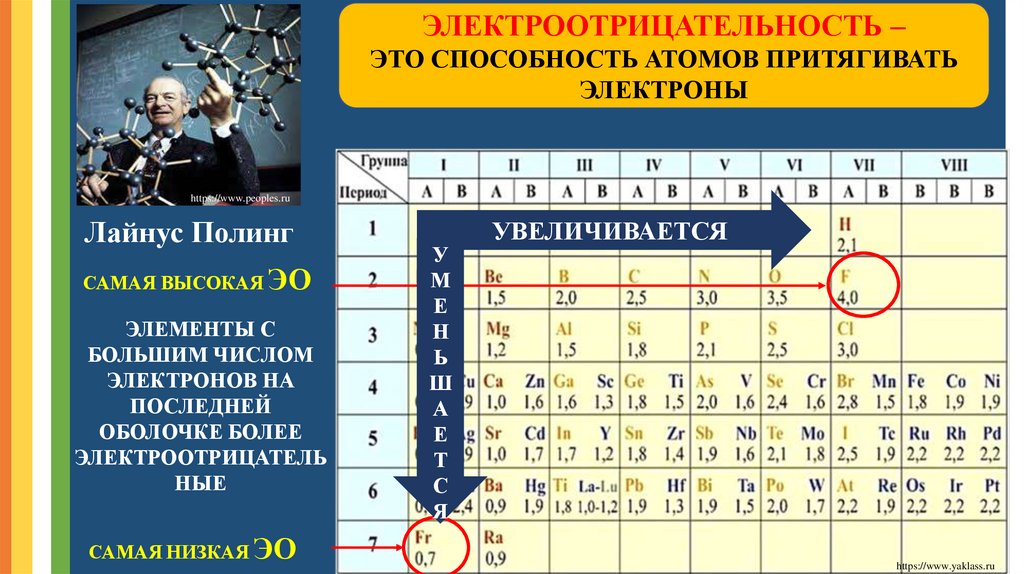
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ –ЭТО СПОСОБНОСТЬ АТОМОВ ПРИТЯГИВАТЬ
ЭЛЕКТРОНЫ
https://www.peoples.ru
Лайнус Полинг
САМАЯ ВЫСОКАЯ ЭО
ЭЛЕМЕНТЫ С
БОЛЬШИМ ЧИСЛОМ
ЭЛЕКТРОНОВ НА
ПОСЛЕДНЕЙ
ОБОЛОЧКЕ БОЛЕЕ
ЭЛЕКТРООТРИЦАТЕЛЬ
НЫЕ
САМАЯ НИЗКАЯ ЭО
У
М
Е
Н
Ь
Ш
А
Е
Т
С
Я
УВЕЛИЧИВАЕТСЯ
https://www.yaklass.ru
7.
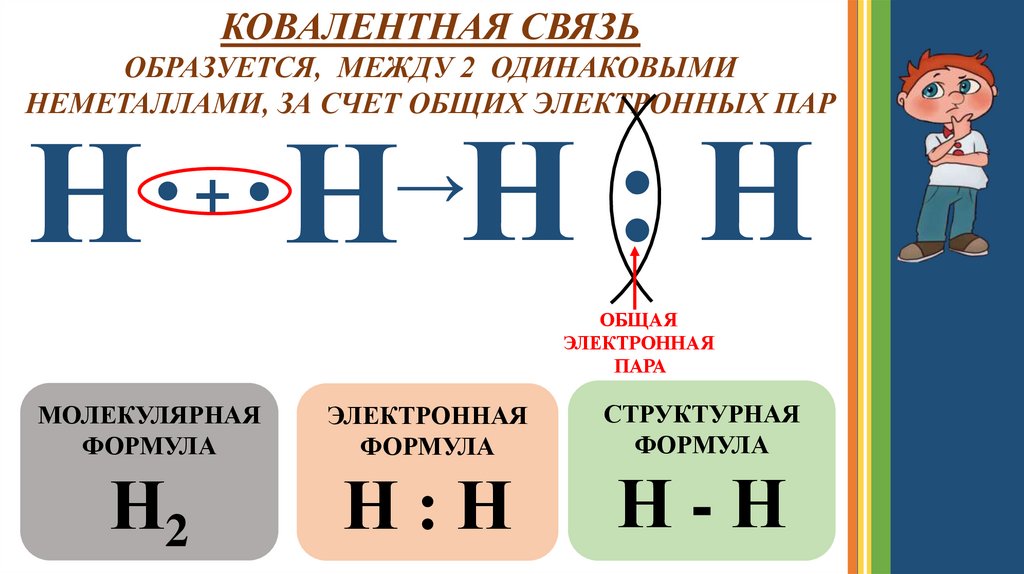
КОВАЛЕНТНАЯ СВЯЗЬОБРАЗУЕТСЯ, МЕЖДУ 2 ОДИНАКОВЫМИ
НЕМЕТАЛЛАМИ, ЗА СЧЕТ ОБЩИХ ЭЛЕКТРОННЫХ ПАР
Н· ·Н Н : Н
+
→
ОБЩАЯ
ЭЛЕКТРОННАЯ
ПАРА
МОЛЕКУЛЯРНАЯ
ФОРМУЛА
ЭЛЕКТРОННАЯ
ФОРМУЛА
СТРУКТУРНАЯ
ФОРМУЛА
Н2
Н:Н
Н-Н
8.
КОВАЛЕНТНАЯНЕПОЛЯРНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ
ПОЛЯРНАЯ СВЯЗЬ
МЕЖДУ АТОМАМИ ОДНОГО НЕМЕТАЛЛА
ТАК, ТАК…
А В ЧЕМ
ОТЛИЧИЯ?
ЭО = ЭО
δ+
Н
ЭО = 2,1
Сl
δ-
::
<
:
:
Н Н
МЕЖДУ АТОМАМИ РАЗНЫХ НЕМЕТАЛЛОВ
·N·
·
ЭО = 3,0
ОБРАЗУЕТСЯ ЗА СЧЕТ ОБЩЕЙ ПАРЫ
ЭЛЕКТРОНОВ МЕЖДУ АТОМАМИ С
ОБРАЗУЕТСЯ ЗА СЧЕТ ОБЩЕЙ ПАРЫ
ЭЛЕКТРОНОВ МЕЖДУ АТОМАМИ С
ОДИНАКОВОЙ
РАЗНОЙ
Na·
·
Ca·
:S·
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ,
ОБЩАЯ ЭЛЕКТРОННАЯ ПАРА СМЕЩЕНА
К ЭЛЕМЕНТУ С БОЛЬШЕЙ ЭО
·
·C·
:
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ,
ОБЩАЯ ЭЛЕКТРОННАЯ ПАРА
РАСПОЛОЖЕНА СИММЕТРИЧНО
9.
А ВСЕ ЛИ ВЕЩЕСТВА СКОВАЛЕНТНОЙ
НЕПОЛЯРНОЙ СВЯЗЬЮ
ОБРАЗУЮТСЯ
ОДИНАКОВО
А КАК СВЯЗАНО
ЧИСЛО
ЭЛЕКТРОНОВ И
ХИМИЧЕСКАЯ
СВЯЗЬ
И ОТ ЧЕГО ЭТО
ЗАВИСИТ
10.
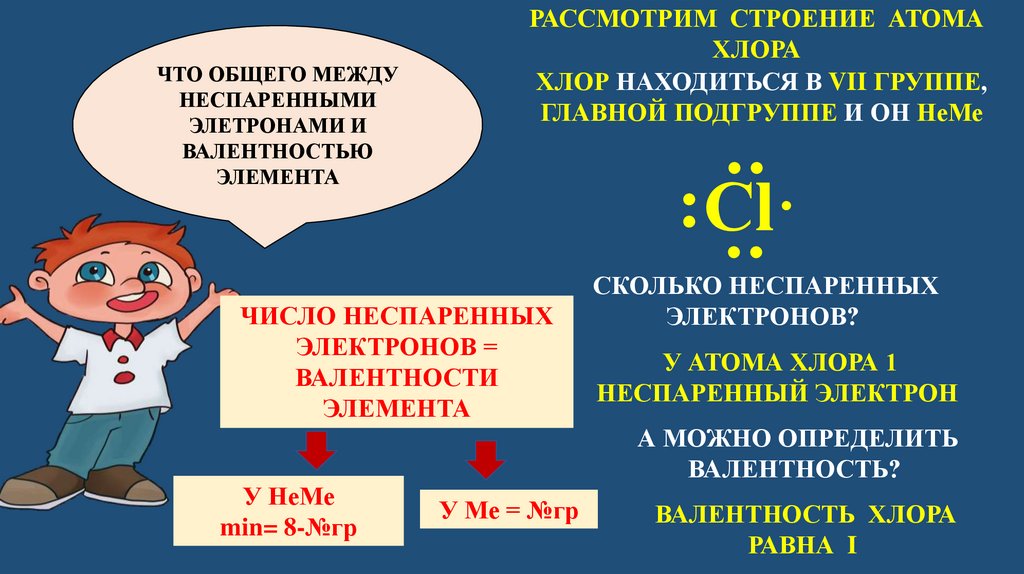
: :ЧТО ОБЩЕГО МЕЖДУ
НЕСПАРЕННЫМИ
ЭЛЕТРОНАМИ И
ВАЛЕНТНОСТЬЮ
ЭЛЕМЕНТА
РАССМОТРИМ СТРОЕНИЕ АТОМА
ХЛОРА
ХЛОР НАХОДИТЬСЯ В VII ГРУППЕ,
ГЛАВНОЙ ПОДГРУППЕ И ОН НеМе
: Сl·
ЧИСЛО НЕСПАРЕННЫХ
ЭЛЕКТРОНОВ =
ВАЛЕНТНОСТИ
ЭЛЕМЕНТА
У НеМе
min= 8-№гр
СКОЛЬКО НЕСПАРЕННЫХ
ЭЛЕКТРОНОВ?
У АТОМА ХЛОРА 1
НЕСПАРЕННЫЙ ЭЛЕКТРОН
А МОЖНО ОПРЕДЕЛИТЬ
ВАЛЕНТНОСТЬ?
У Ме = №гр
ВАЛЕНТНОСТЬ ХЛОРА
РАВНА I
11.
РАССМОТРИМОБРАЗОВАНИЕ
ХИМИЧЕСКОЙ
СВЯЗИ В
МОЛЕКУЛАХ
ХЛОРА,
КИСЛОРОДА И
АЗОТА
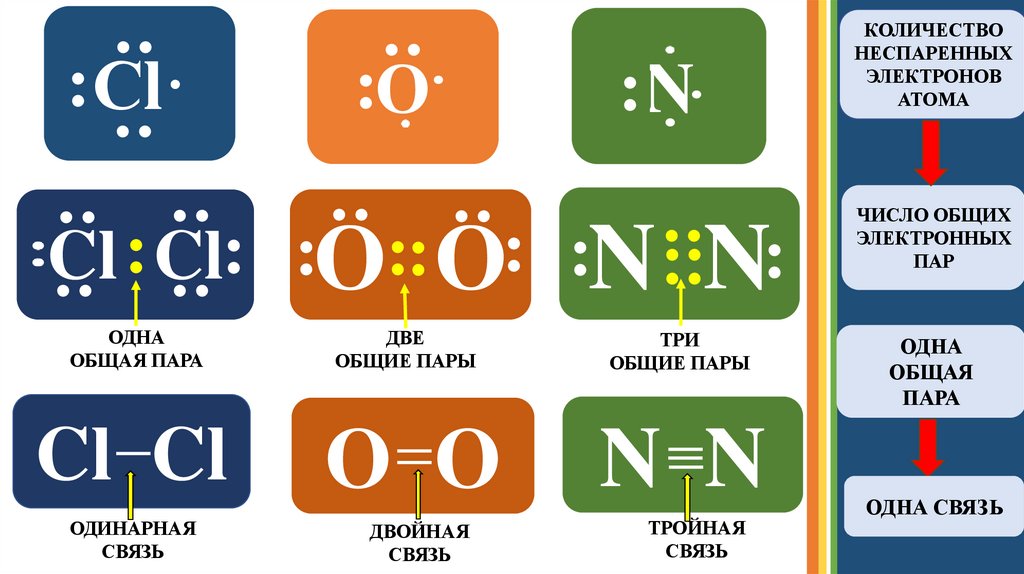
12.
:N:
:
:
:О
: :
: :
: Сl·
:
::
: : :
Cl : Cl: :О:: О: :N N:
ОДНА
ОБЩАЯ ПАРА
ДВЕ
ОБЩИЕ ПАРЫ
ТРИ
ОБЩИЕ ПАРЫ
Cl Cl
O O
N N
ОДИНАРНАЯ
СВЯЗЬ
ДВОЙНАЯ
СВЯЗЬ
ТРОЙНАЯ
СВЯЗЬ
КОЛИЧЕСТВО
НЕСПАРЕННЫХ
ЭЛЕКТРОНОВ
АТОМА
ЧИСЛО ОБЩИХ
ЭЛЕКТРОННЫХ
ПАР
ОДНА
ОБЩАЯ
ПАРА
ОДНА СВЯЗЬ
13.
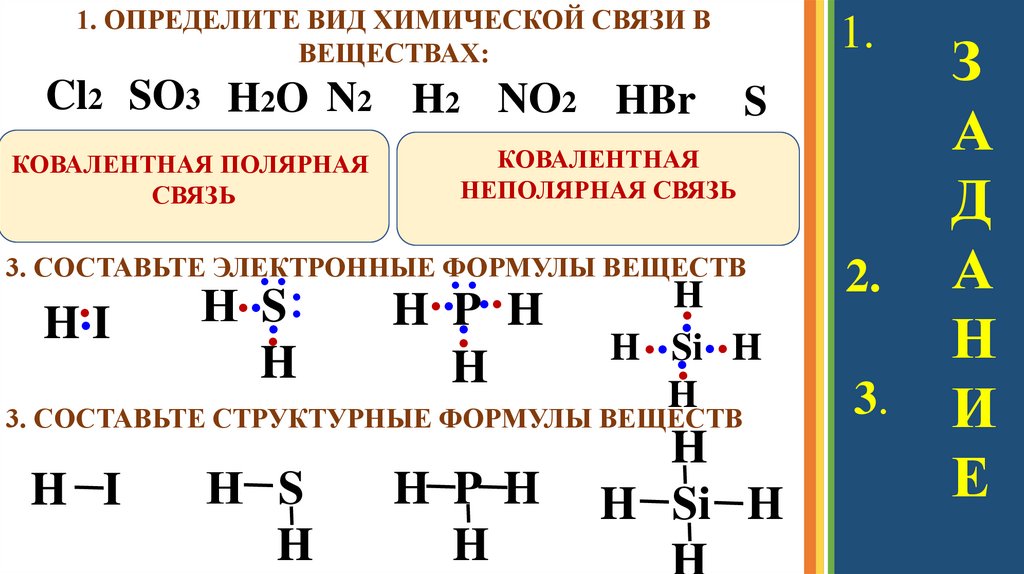
1. ОПРЕДЕЛИТЕ ВИД ХИМИЧЕСКОЙ СВЯЗИ ВВЕЩЕСТВАХ:
Cl2 SO3 H2O N2 H2 NO2 HBr
КОВАЛЕНТНАЯ ПОЛЯРНАЯ
СВЯЗЬ
1.
S
КОВАЛЕНТНАЯ
НЕПОЛЯРНАЯ СВЯЗЬ
3. СОСТАВЬТЕ ЭЛЕКТРОННЫЕ ФОРМУЛЫ ВЕЩЕСТВ
∙∙
H∙∙P
H
∙∙
H
꞉
꞉
H∙∙I
Н∙∙S꞉
∙
∙H
H
∙
∙
H ∙∙ Si∙∙ H
∙H∙
3. СОСТАВЬТЕ СТРУКТУРНЫЕ ФОРМУЛЫ ВЕЩЕСТВ
H I
Н S
H
H P H
H
H
H Si H
H
2.
3.
З
А
Д
А
Н
И
Е
14.
Домашнее заданиеРазобрать и выучить
конспект.
Выучить параграф: § 3.4
Выполнить: упр.6
упр.11 стр.68
https://www.youtube.com/watch?v=f2m1UdeVHuI&t=112s
«Мало знать, надо
и применять.
Мало хотеть, надо
и делать».
Иоганн Вольфганг
Гёте
15. БЛАГОДАРЮ ЗА ВНИМАНИЕ
16.
ИСПОЛЬЗУЕМЫЕ РЕСУРСЫ№
1.
Основы Национального Куррикулума
Ресурс
https://mecc.gov.md/sites/default/files/cadrul_de_referinta_final_rus_tipar.pdf
Источник ресурса
1.
Куррикулум по химии
https://mecc.gov.md/sites/default/files/c-chimiagimnaziuru.pdf
1.
Гид по внедрению куррикулума-2019
https://mecc.gov.md/sites/default/files/ghid-chimiagimnaziuru.pdf
1.
Modele de proiecte didactice de lungă https://mecc.gov.md/sites/default/files/chimie_cl._vii_2019-2020_final.pdf
durată
1.
Repere metodologice privind organizarea plasate pe pagina web: www.mecc.gov.md
peocesului educațional la disciplina
şcolară Chimie în anul de studii 20202021, aprobate de MECC
1.
Приказ
№591
«О
внедрении https://mecc.gov.md/sites/default/files/ordin_591_din_26.06.2020_implementarea_curriculai_a.s.2020-2021.pdf
Куррикулума в 2020-2021 учебном
году»
1.
Картинки
https://www.google.com
https://www.peoples.ru/science/chemistry/linus_pauling/
https://foxford.ru/wiki/himiya/vidy-harakteristiki-i-mehanizmy-obrazovaniya-himicheskoy-svyazi
https://ru.wikipedia.org/
https://infourok.ru
Материалы презентации
https://www.yaklass.ru/p/himija/89-klass/stroenie-veshchestva-18844/elektrootritcatelnost-18845/re-d48636e5-fc98-49bc-aa70-ca5a271dce44
1.
1.










 chemistry
chemistry








