Similar presentations:
Гипопластические состояния кроветворения. Классификация, патогенез, клиника, диагностика и лечение
1.
Гипопластические состояниякроветворения. Классификация,
патогенез, клиника, диагностика и
лечение
Салогуб Галина Николаевна,
Кафедра факультетской терапии СПбГМУ им. акад. И.П. Павлова
2012 г.
2. ПРИЧИНЫ ЦИТОПЕНИЧЕСКИХ СОСТОЯНИЙ
•НАРУШЕНИЕ ПРОДУКЦИИ КЛЕТОККРОВИ
•ПОВЫШЕННОЕ РАЗРУШЕНИЕ КЛЕТОК
КРОВИ
•ПЕРЕРАСПРЕДЕЛЕНИЕ КЛЕТОК
КРОВИ
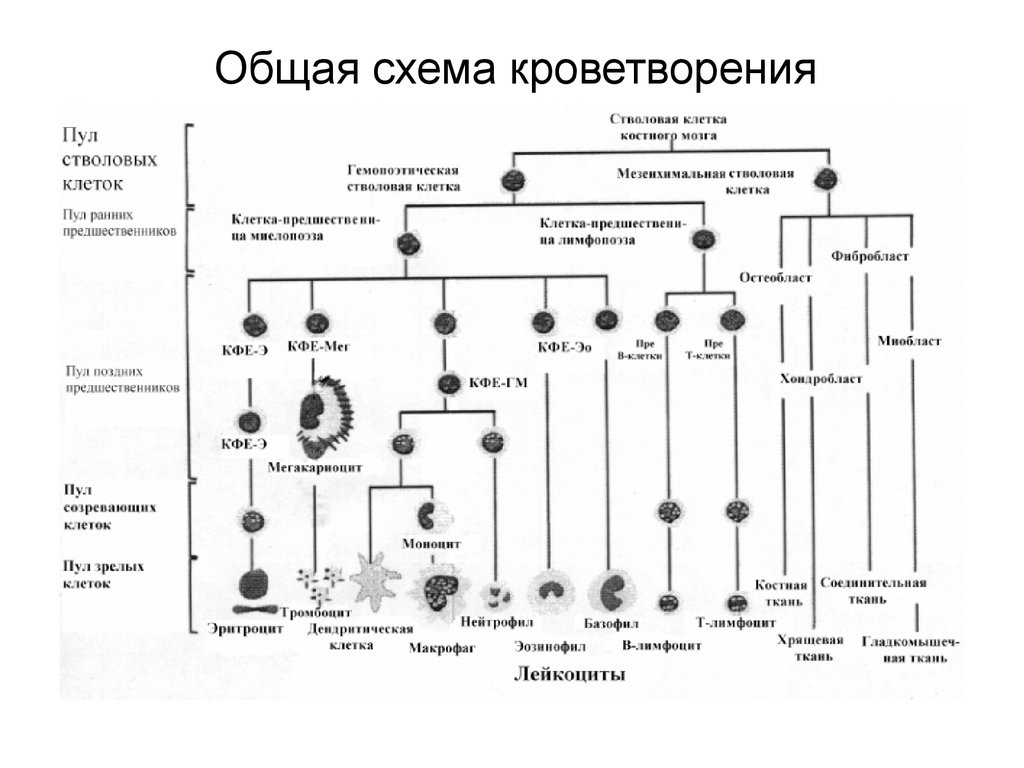
3. Общая схема кроветворения
4. Апластические и гипопластические состояния (приобретенные и врожденные)
Апластические и гипопластические состоянияАпластическая анемия
(приобретенные и врожденные)
Клональные заболевания
пароксизмальная ночная гемоглобинурия
миелодиспластический синдром
лимфопролиферация гипергранулярных Т-лимфоцитов
острый лейкоз
Хронический идиопатический миелофиброз (стадия клеточного истощения и
гипоплазии)
Гипоплазия кроветворения, ассоциированная с инфекциями
(ВИЧ, герпес-вирусы, гепатит, парвовирус, туберкулез, сифилис, бруцеллез, саркоидоз )
Гипопластические состояния, ассоциированные с инфильтративным поражением
костного мозга опухолевыми клетками (лимфомы, солидные опухоли)
Гипоплазия кроветворения, обусловленная химио/лучевой терапией,
трансплантацией костного мозга
Гипоплазия кроветворения, обусловленная другими причинами
(дефицит витамина B12, фолиевой кислоты, беременность, системные заболевания
соединительной ткани, другие причины)
5. Апластические и гипопластические состояния
Одноростковая аплазия костногомозга
•агранулоцитоз,
•парциальная красноклеточная
аплазия,
•амегокариоцитарная
тромбоцитопения
6.
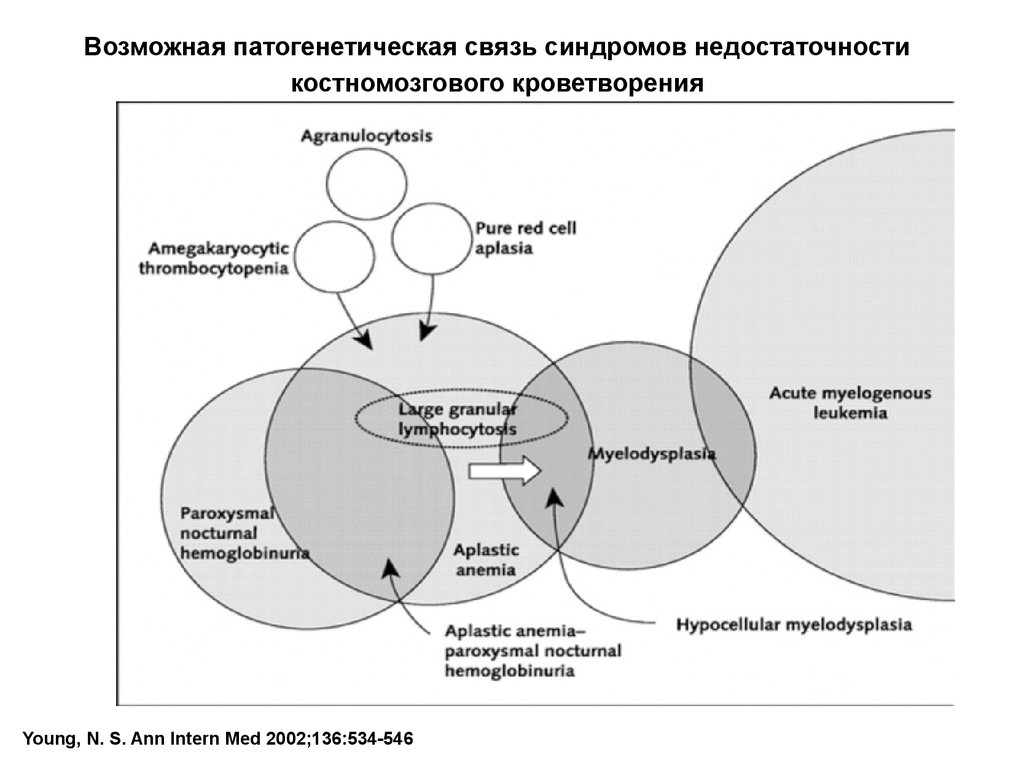
Возможная патогенетическая связь синдромов недостаточностикостномозгового кроветворения
Young, N. S. Ann Intern Med 2002;136:534-546
7.
Апластическая анемия – заболеваниекроветворной ткани, характеризующееся
панцитопенией в периферической крови,
снижением клеточности костного мозга без
увеличения бластных клеток и замещением
кроветворной ткани жировой тканью.
8.
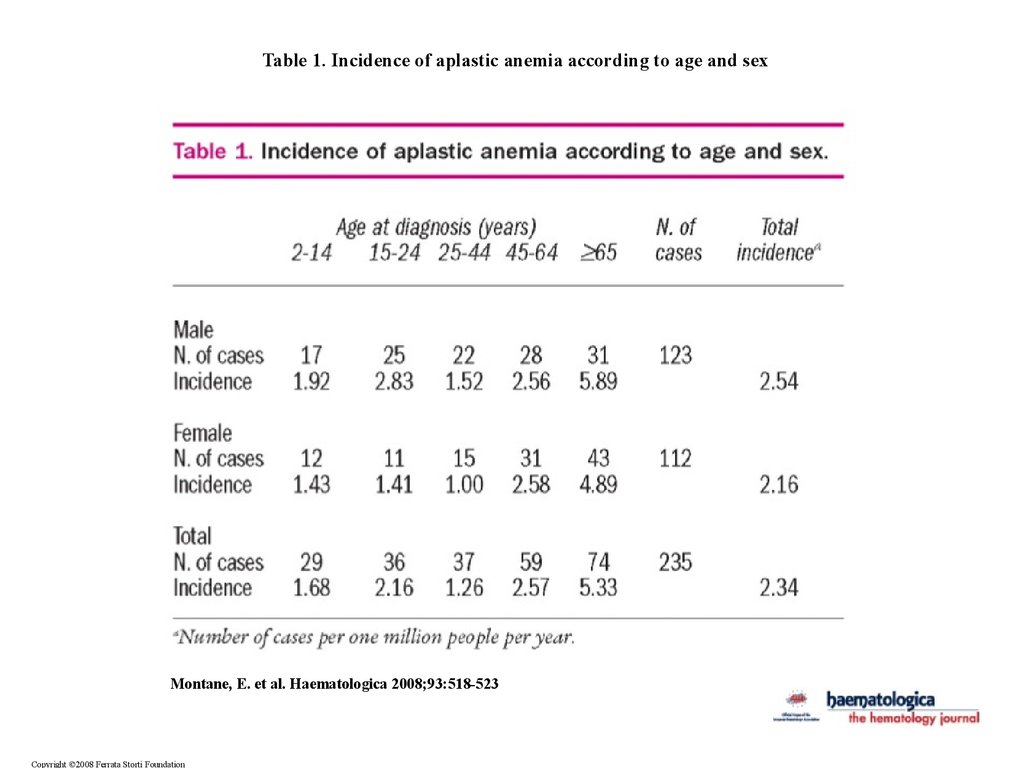
Table 1. Incidence of aplastic anemia according to age and sexMontane, E. et al. Haematologica 2008;93:518-523
Copyright ©2008 Ferrata Storti Foundation
9. Этиологическая классификация апластической анемии
ПриобретеннаяИдиопатическая
Лекарственно обусловленная
Обусловленная действием токсинов и химических веществ
Постлучевая
Обусловленная инфекцией
Гепатит
Парвовирус
ВИЧ
Беременность
Тимома
Ассоциированная с миелодисплазией
Ассоциированная с пароксизмальной ночной гемоглобинурией
Наследственная
Анемия Фанкони
Семейная апластическая анемия
Врожденный дискератоз
10.
Апластическая анемия диагностируетсяпри условии снижения клеточности
костного мозга на 70 и более % и
наличии 2-х любых из указанных ниже 3х лабораторных признаков:
•абсолютное содержание нейтрофилов в
крови меньше чем 0.5 x 109 /л,
•тромбоцитов – меньше чем 20 x10 /л,
9
•ретикулоцитов – меньше, чем 60 x 10 /л
9
11.
При количестве нейтрофилов в кровименьше чем 0.2 x 109 /л, диагностируется
сверхтяжелая апластическая анемия.
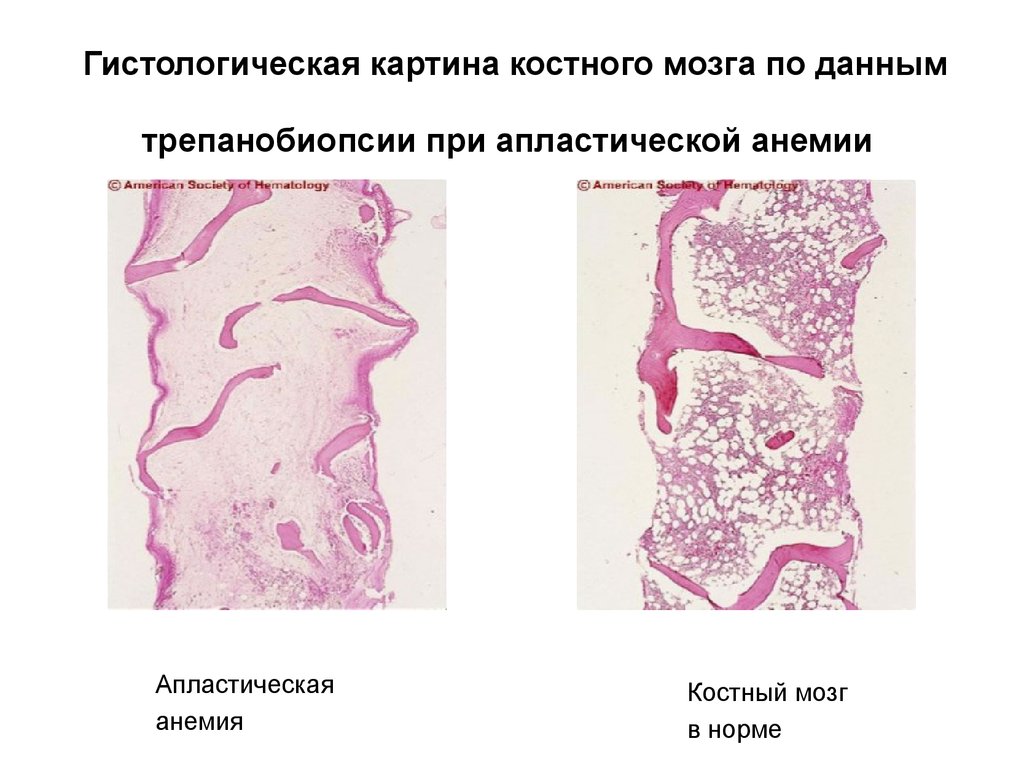
12. Гистологическая картина костного мозга по данным трепанобиопсии при апластической анемии
Апластическаяанемия
Костный мозг
в норме
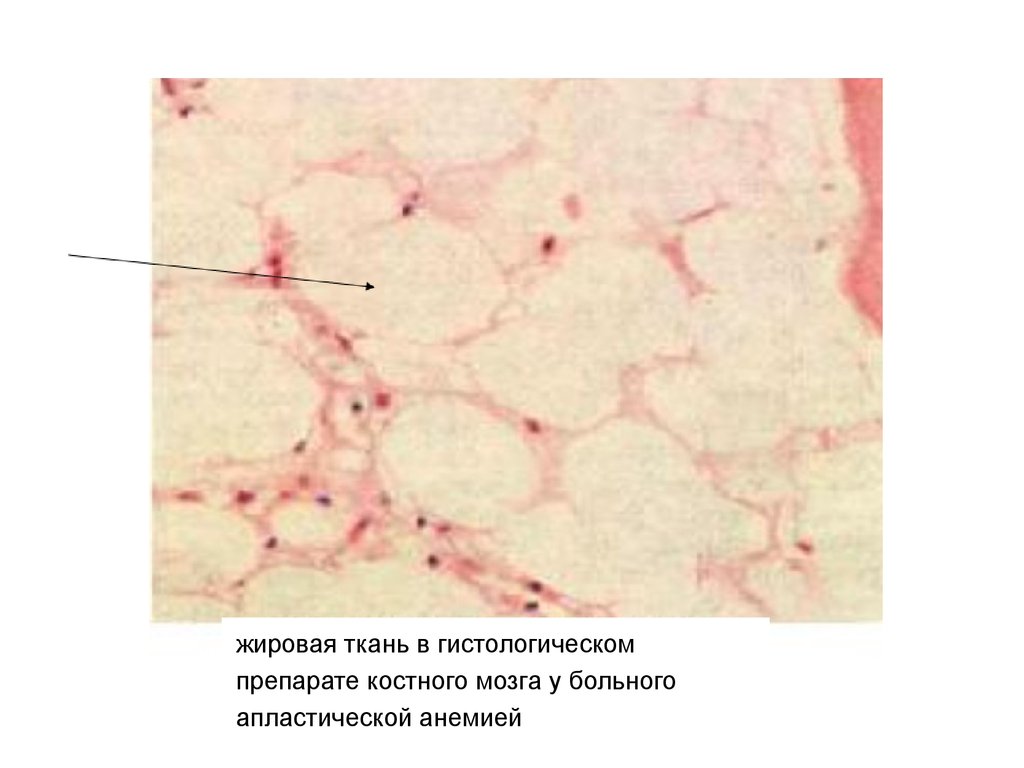
13.
жировая ткань в гистологическомпрепарате костного мозга у больного
апластической анемией
14.
В основе патогенеза идиопатическойапластической анемии, как правило, лежат
иммунные нарушения.
•Лимфоциты больных апластической анемией ингибируют
колониеобразование собственных гемопоэтических
предшественников и клеток крови и костного мозга здоровых лиц.
•В крови больных апластической анемией имеется повышенное
содержание активированных цитотоксических лимфоцитов.
Выделяемые ими цитокины способны ингибировать гемопоэз ин
витро.
Лимфоциты периферической крови больных апластической анемией
секретируют повышенное количество γ-интерферона, оказывающего
ингибирующий эффект на гемопоэз.
Высокая экспрессия гена γ-интерферона в клетках костного мозга у
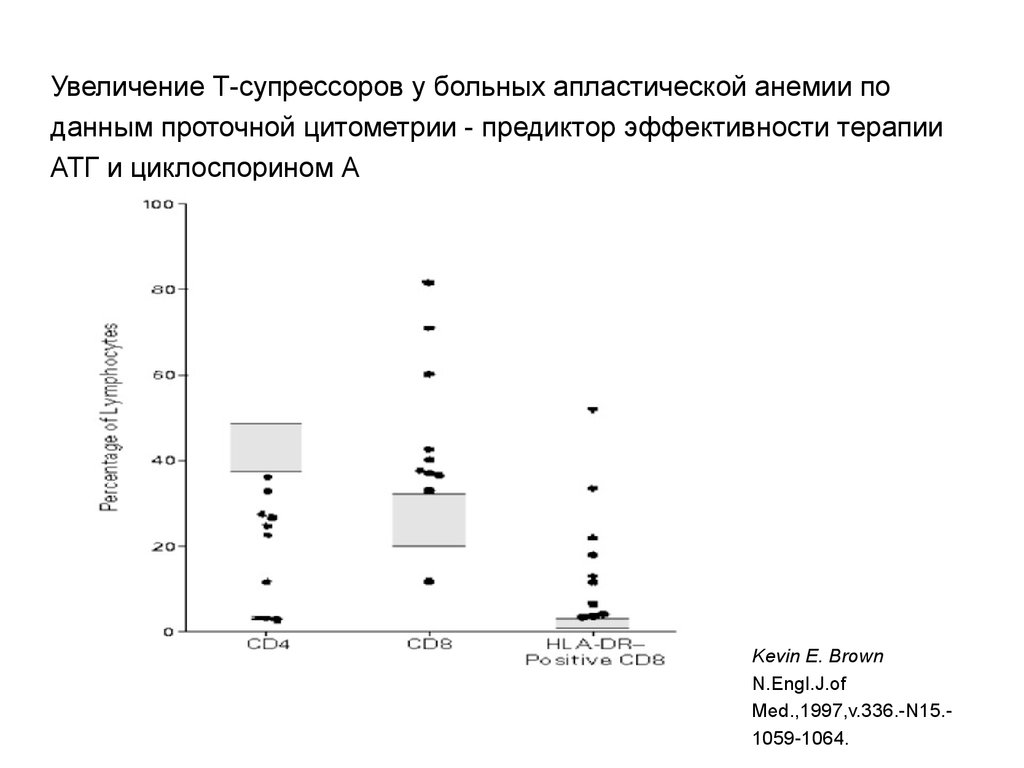
15. Увеличение Т-супрессоров у больных апластической анемии по данным проточной цитометрии - предиктор эффективности терапии АТГ и циклоспор
Увеличение Т-супрессоров у больных апластической анемии поданным проточной цитометрии - предиктор эффективности терапии
АТГ и циклоспорином А
Kevin E. Brown
N.Engl.J.of
Med.,1997,v.336.-N15.1059-1064.
16. Генетическая предрасположенность к развитию апластической анемии
Больные со сниженной способностью метаболизировать канцерогены итоксины имеют повышенный риск развития апластической анемии.
Глютатион – s – трансфераза (GST) – фермент, принимающий
непосредственное участие в разрушении целого ряда токсинов и мутагенов .
Гомозиготная делеция генов GSTM1 и GSTT1 увеличивает риск
развития апластической анемии. У больных апластической анемией в 3 раза чаще встречается
дефект генов GSTM1 и GSTT1 по сравнению с здоровой популяцией.
У 17,5% больных апластической анемией в момент установления диагноза выявляются
хромосомные нарушения и у всех этих пациентов выявляется делеция гена GSTT1.
Генетическая нестабильность и хромосомные изменения могут быть обусловлены нарушением
детоксикации эндогенных и экзогенных токсинов, что и лежит в основе патогенеза
апластической анемии у больных с делецией генов GSTM1 и GSTT1.
(Blood. 2001;98:3483-3485)
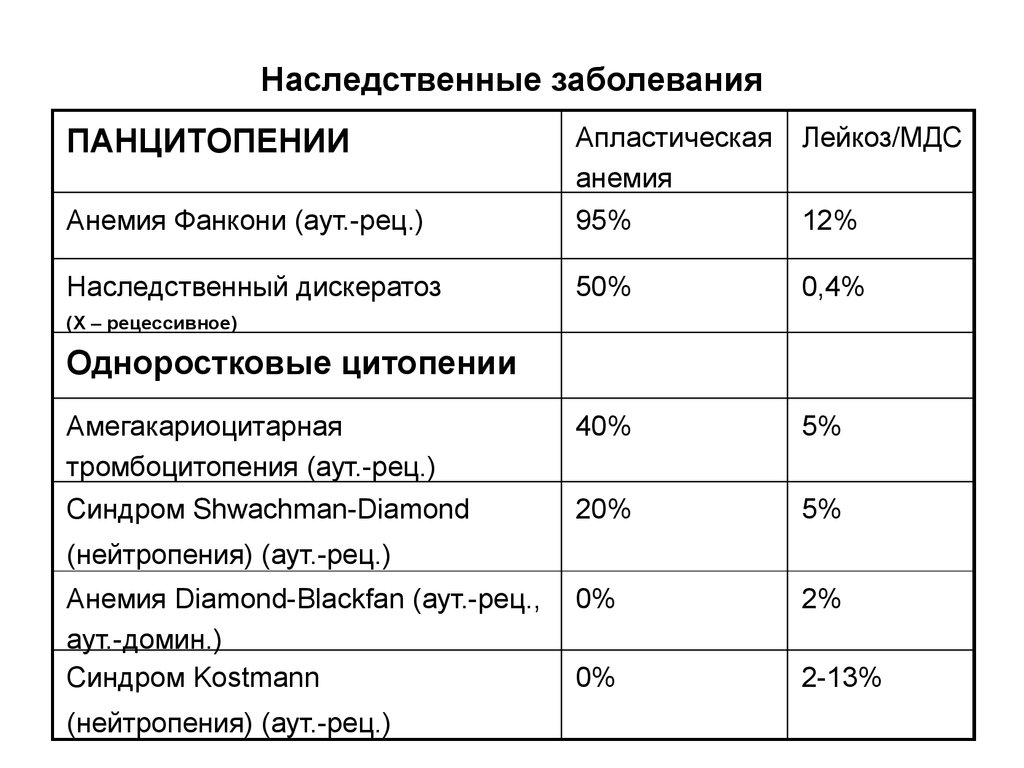
17. Наследственные заболевания
ПАНЦИТОПЕНИИАпластическая
анемия
Лейкоз/МДС
Анемия Фанкони (аут.-рец.)
95%
12%
Наследственный дискератоз
50%
0,4%
40%
5%
20%
5%
0%
2%
0%
2-13%
(Х – рецессивное)
Одноростковые цитопении
Амегакариоцитарная
тромбоцитопения (аут.-рец.)
Синдром Shwachman-Diamond
(нейтропения) (аут.-рец.)
Анемия Diamond-Blackfan (аут.-рец.,
аут.-домин.)
Синдром Kostmann
(нейтропения) (аут.-рец.)
18.
Апластическая анемия может бытьассоциирована с вирусными гепатитами (<
1% случаев) и проявляется в период от
нескольких недель до 8 месяцев с момента
появления гепатита. Обычно это гепатит неA, не-B, не-C типа. Апластическая анемия
может быть ассоциирована с гепатитом C,
редко с гепатитом В.
19. Медицинские препараты, с приемом которых ассоциировано развитие апластической анемии по данным международной группы по апластической ан
Медицинские препараты, с приемом которыхассоциировано развитие апластической анемии
по данным международной группы по апластической анемии и
агранулоцитозу
• Нестероидные противовоспалительные
и анальгетики - риск 4,6-9,8%
Антибиотики (левомицетин!) - риск 5%
Сульфаниламиды - риск 2,8%
Мерказолил - риск 16%
Фуросемид - риск 3,3%
Фенотиазины - риск 3%
Кортикостероиды - риск 5%
Аллопуринол - риск 7,3%
Препараты золота - риск 29%
Young, N. S. Ann Intern Med 2002;136:534-546
20. Апластическая анемияКлинические проявления
•анемический синдром•геморрагический синдром, обусловленный
тромбоцитопенией
•инфекции, обусловленные нейтропенией и
иммуносупрессивной терапией
(глюкокортикоиды!)
21. Лечение тяжелой апластической анемии
Первая линия терапии•Аллогенная трансплантация стволовых клеток от HLAсовместимого донора родственника
Иммуносупрессивная терапия
АТГ
циклоспорин
сакролимус
комбинированная
Дополнительная/ 2-я линия терапии
•Аллогенная трансплантация стволовых клеток от HLAсовместимого неродственного донора
Blood, 1995, vol. 85, №12, p. 3367-3377. Ann Intern Med 2002;136:534-546
22.
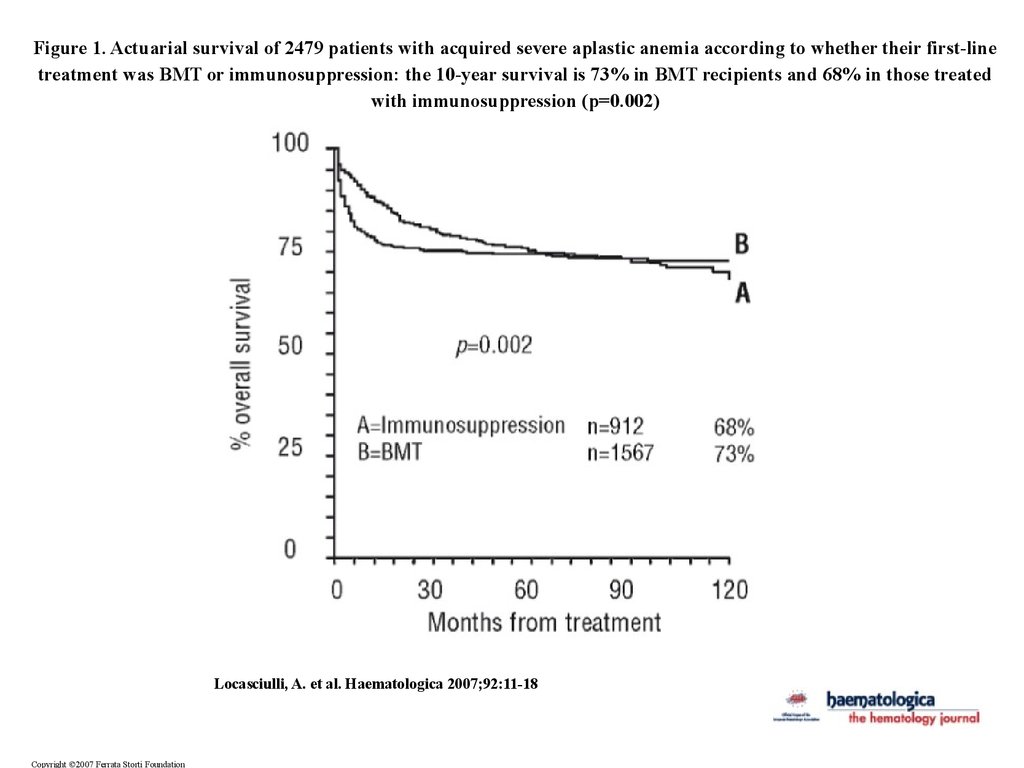
Figure 1. Actuarial survival of 2479 patients with acquired severe aplastic anemia according to whether their first-linetreatment was BMT or immunosuppression: the 10-year survival is 73% in BMT recipients and 68% in those treated
with immunosuppression (p=0.002)
Locasciulli, A. et al. Haematologica 2007;92:11-18
Copyright ©2007 Ferrata Storti Foundation
23.
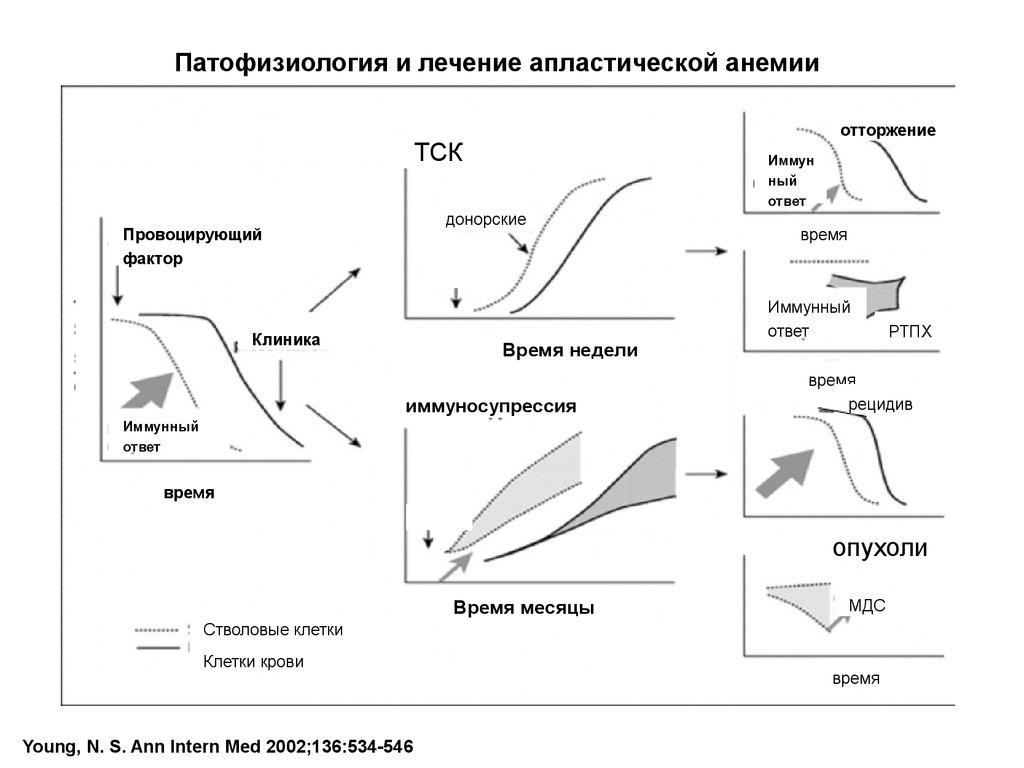
Патофизиология и лечение апластической анемииотторжение
ТСК
Иммун
ный
ответ
донорские
Провоцирующий
фактор
Клиника
Время недели
иммуносупрессия
время
Иммунный
ответ
РТПХ
время
рецидив
Иммунный
ответ
время
опухоли
Время месяцы
МДС
Стволовые клетки
Клетки крови
Young, N. S. Ann Intern Med 2002;136:534-546
время
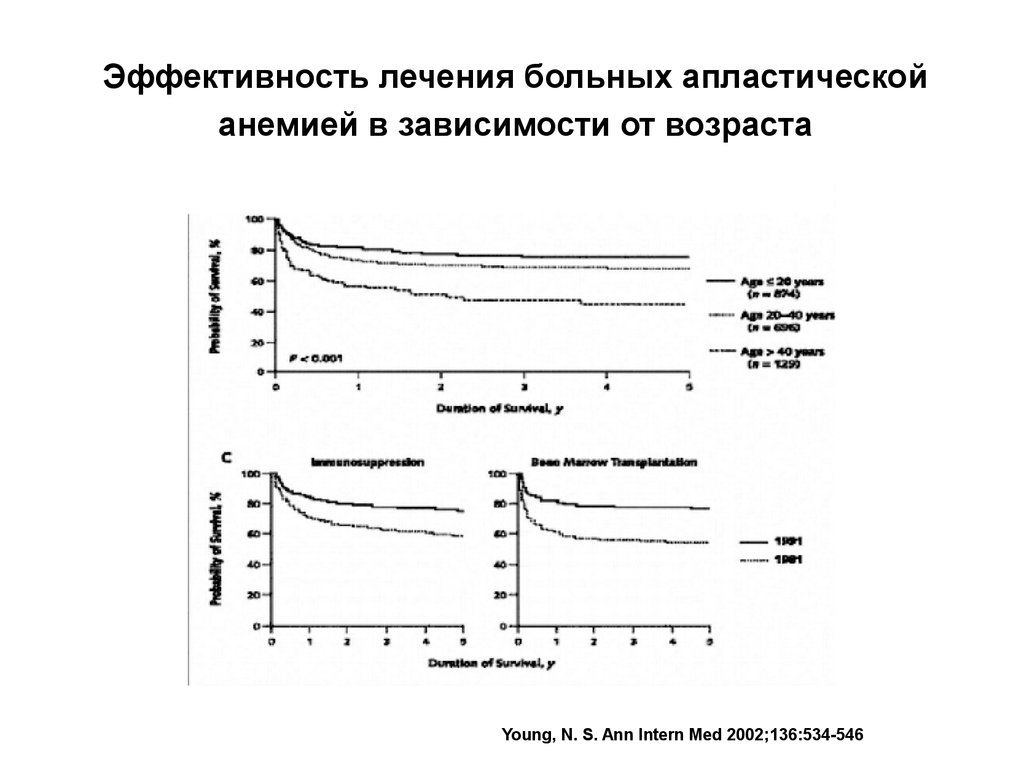
24. Эффективность лечения больных апластической анемией в зависимости от возраста
Young, N. S. Ann Intern Med 2002;136:534-54625.
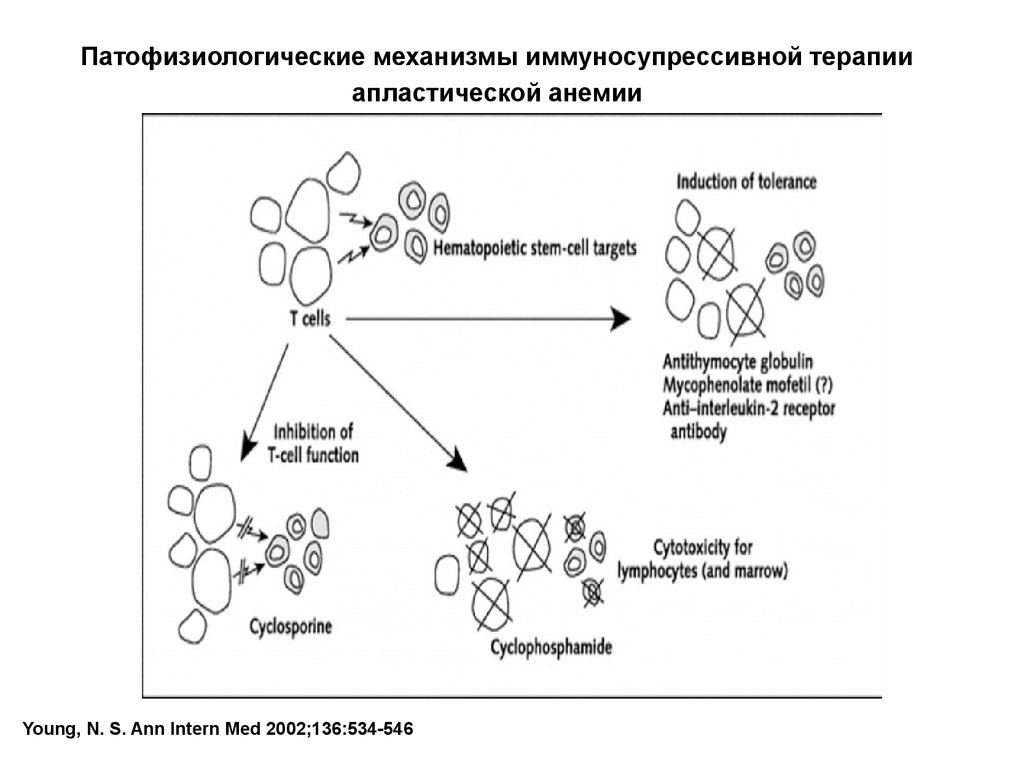
Патофизиологические механизмы иммуносупрессивной терапииапластической анемии
Young, N. S. Ann Intern Med 2002;136:534-546
26. Иммуносупрессивная терапия апластической анемии
АЛГ или АТГ 10-40 мг/кг/день 4-5 дняЦиклоспорин A (12 мг/кг/день для взрослых
и 15 мг/кг/день для детей наиболее эффективны, но
наиболее часто используется доза 5-6 мг/кг/день)
Интенсивная иммуносупрессия
(АТГ + циклоспорин ± метипред)
Экспериментальная интенсивная иммуносупрессия
большими дозами циклофосфамида (60 мг/кг/день в
течение 4-х дней)
27.
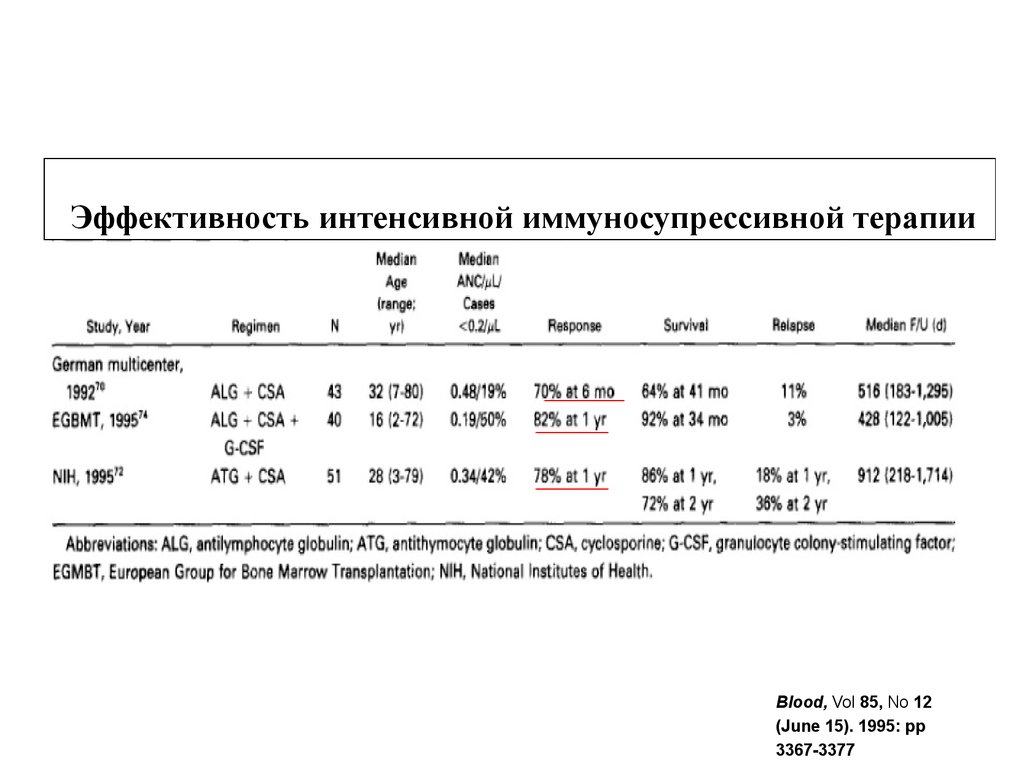
Эффективность интенсивной иммуносупрессивной терапииBlood, Vol 85, No 12
(June 15). 1995: pp
3367-3377
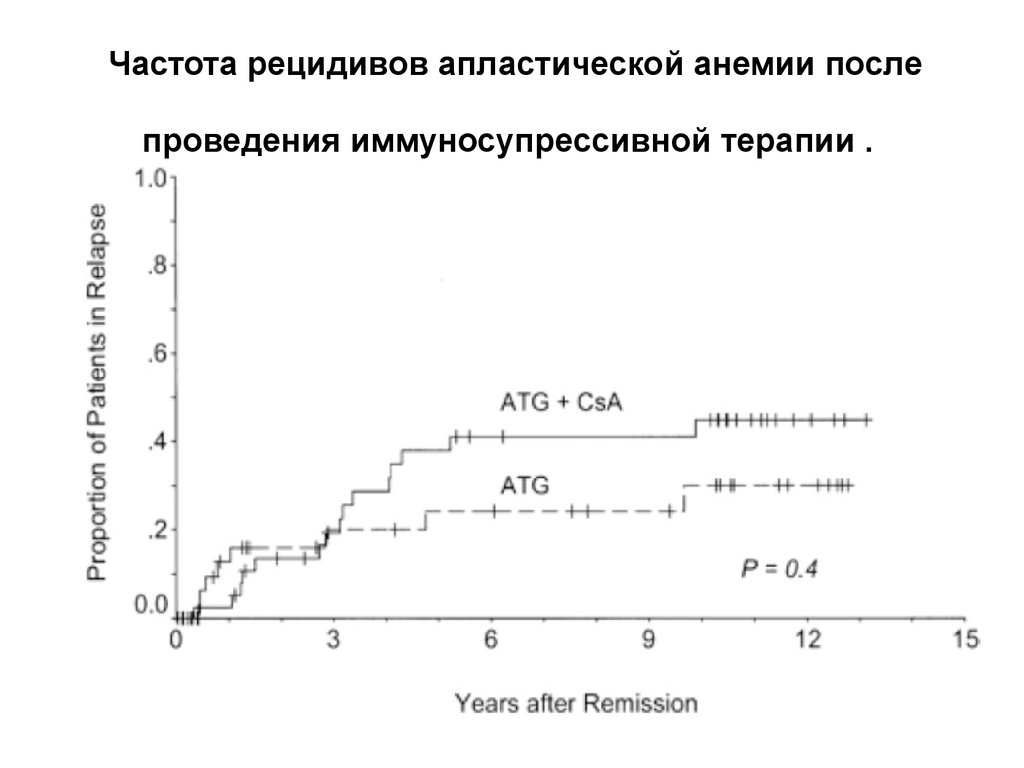
28. Частота рецидивов апластической анемии после проведения иммуносупрессивной терапии .
29. Интенсивная иммуносупрессивная терапия
•Атгам 40 мг/кг день 1-4 дня•Преднизолон 1 мг/кг 1-10 дней
•Циклоспорин А 10 мг/кг 1-60 дней
•Сакролимус 2 мг/день 1-60 дней
30.
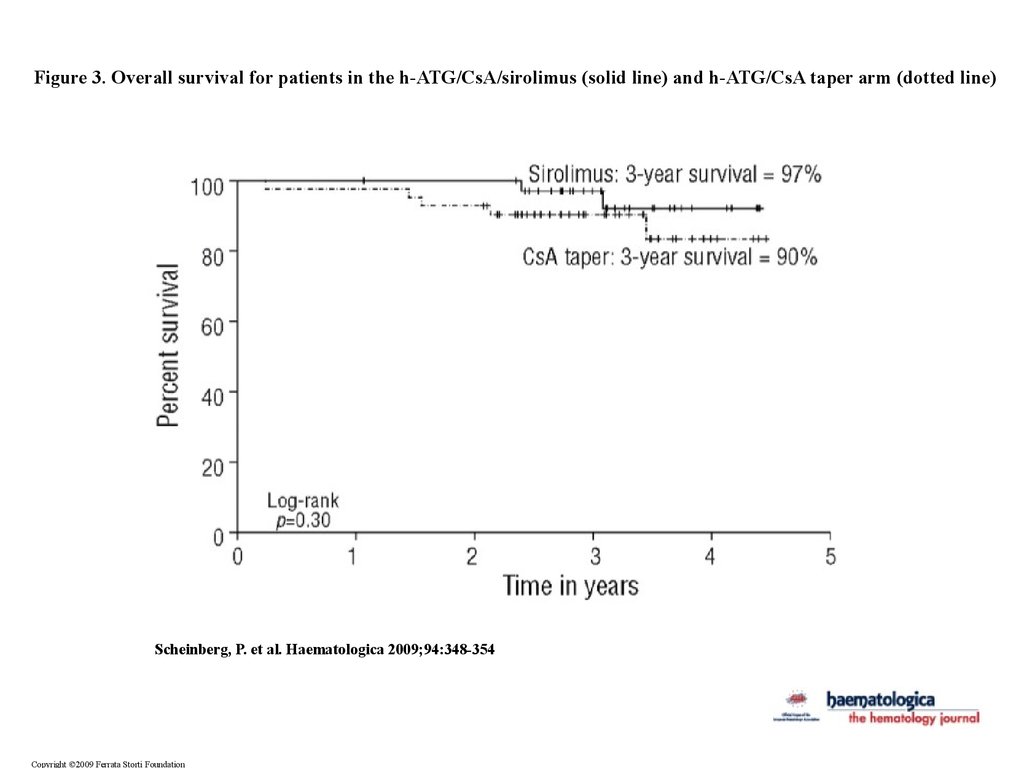
Figure 3. Overall survival for patients in the h-ATG/CsA/sirolimus (solid line) and h-ATG/CsA taper arm (dotted line)Scheinberg, P. et al. Haematologica 2009;94:348-354
Copyright ©2009 Ferrata Storti Foundation
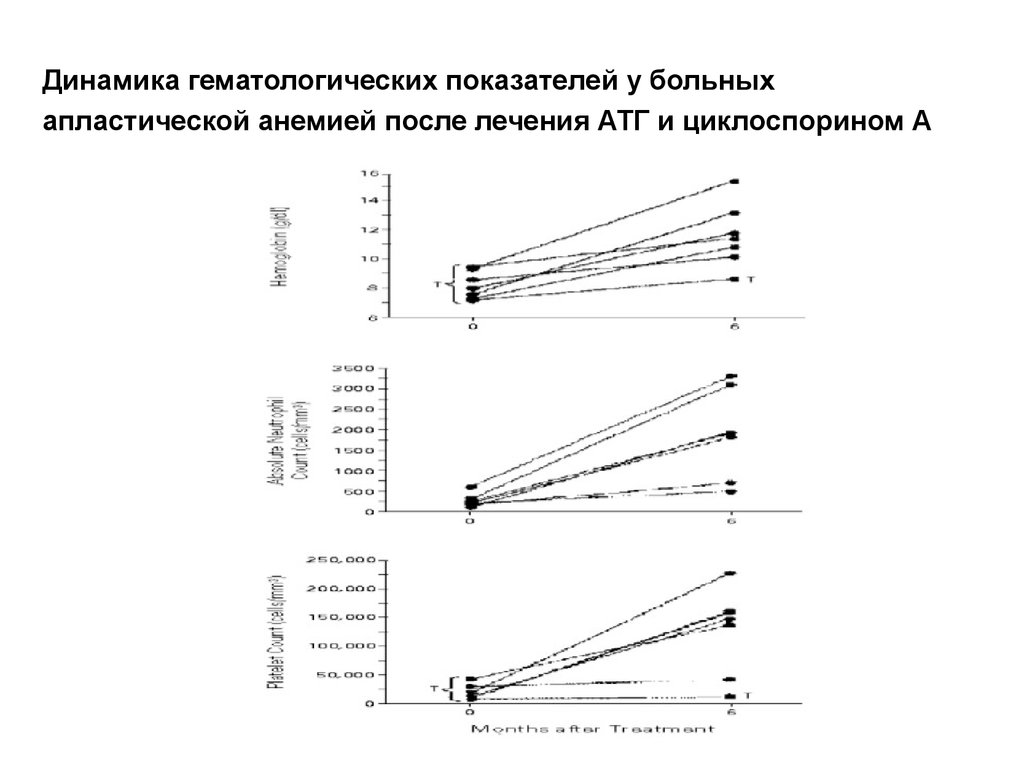
31. Динамика гематологических показателей у больных апластической анемией после лечения АТГ и циклоспорином А
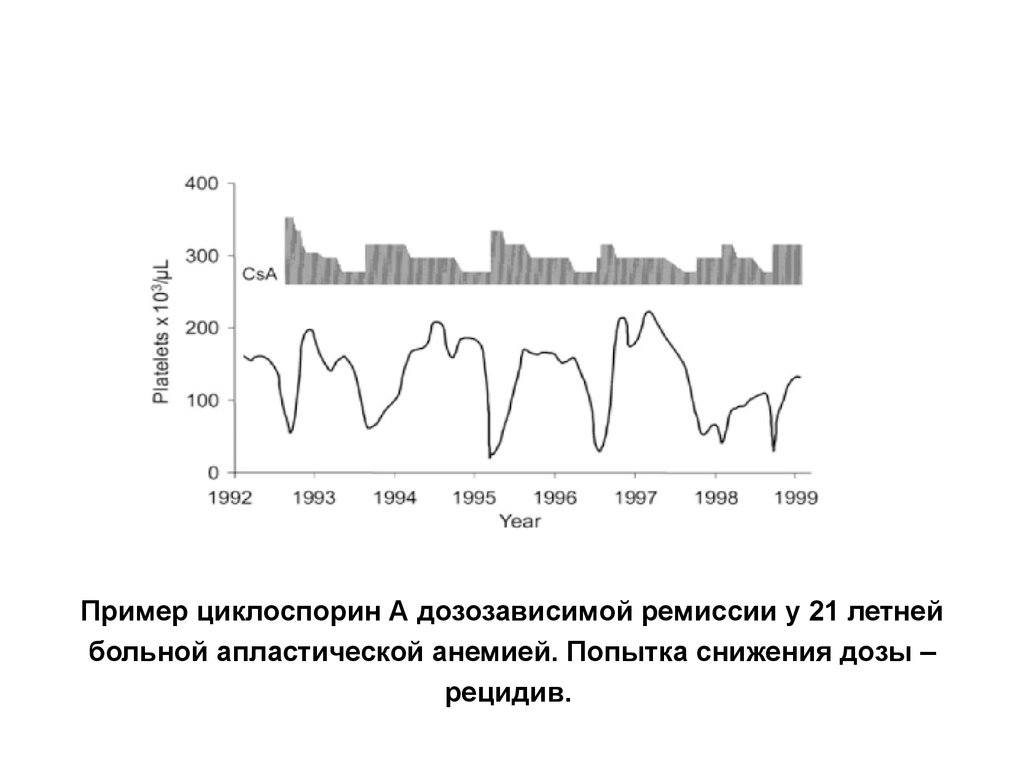
32. Пример циклоспорин А дозозависимой ремиссии у 21 летней больной апластической анемией. Попытка снижения дозы – рецидив.
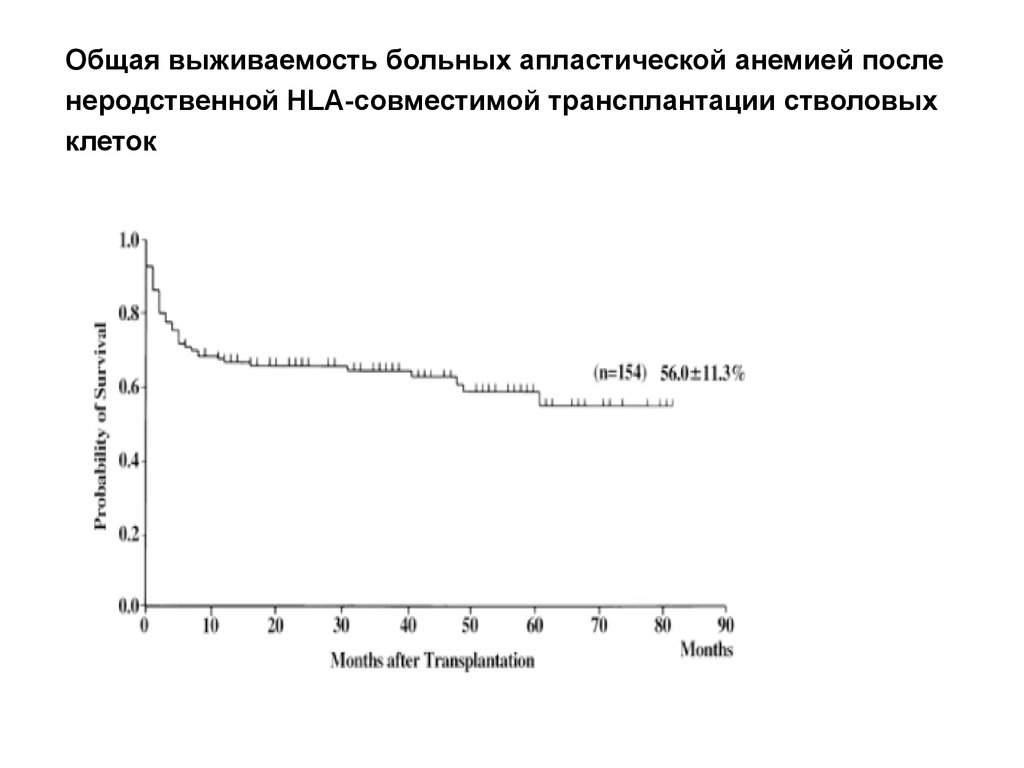
33. Общая выживаемость больных апластической анемией после неродственной HLA-совместимой трансплантации стволовых клеток
34.
Экспериментальная терапиятерапия Mat к Т-лимфоцитам (at
CD3+)
терапия Mat к рецептору ИЛ-2
большие дозы циклофосфамида
микофенолат мофетил (селлсепт)
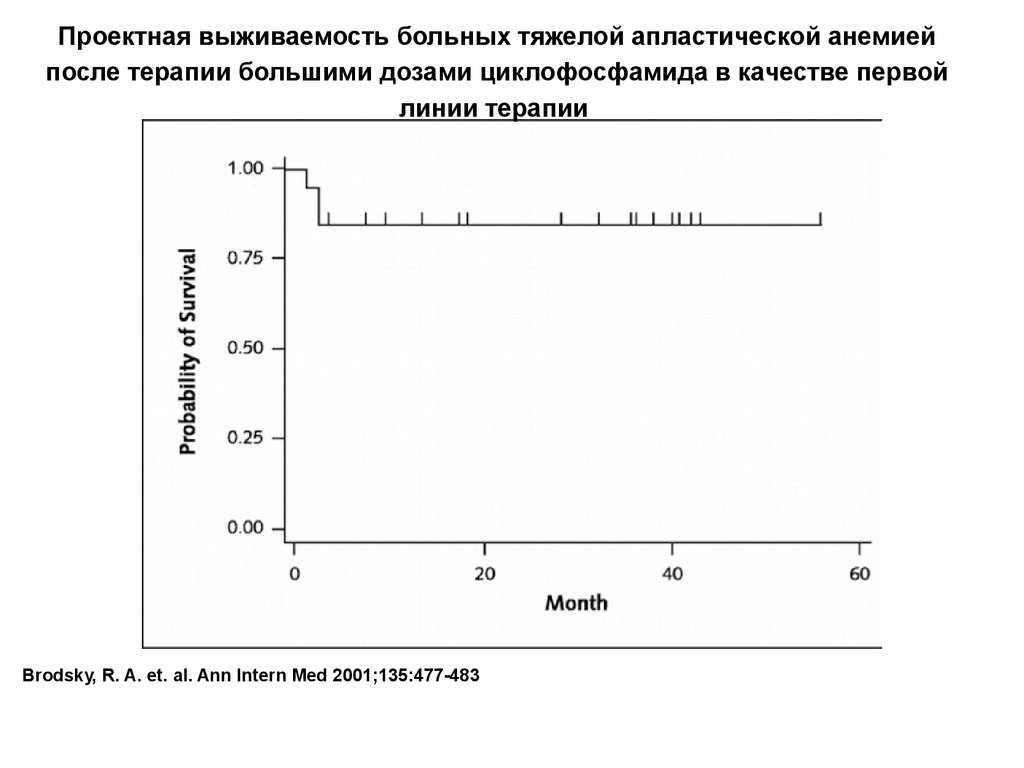
35.
Проектная выживаемость больных тяжелой апластической анемиейпосле терапии большими дозами циклофосфамида в качестве первой
линии терапии
Brodsky, R. A. et. al. Ann Intern Med 2001;135:477-483
36.
Гематологический ответ на терапию больных тяжелой апластическойанемией большими дозами циклофосфамида
Brodsky, R. A. et. al. Ann Intern Med 2001;135:477-483
37.
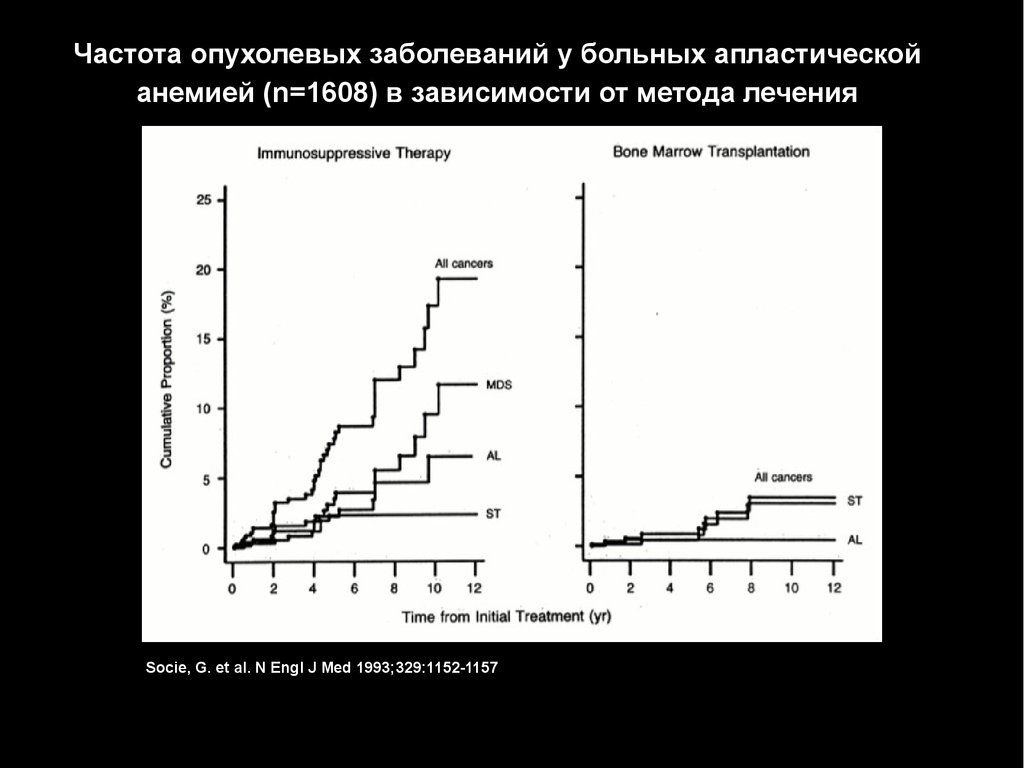
Частота опухолевых заболеваний у больных апластическойанемией (n=1608) в зависимости от метода лечения
Socie, G. et al. N Engl J Med 1993;329:1152-1157
38.
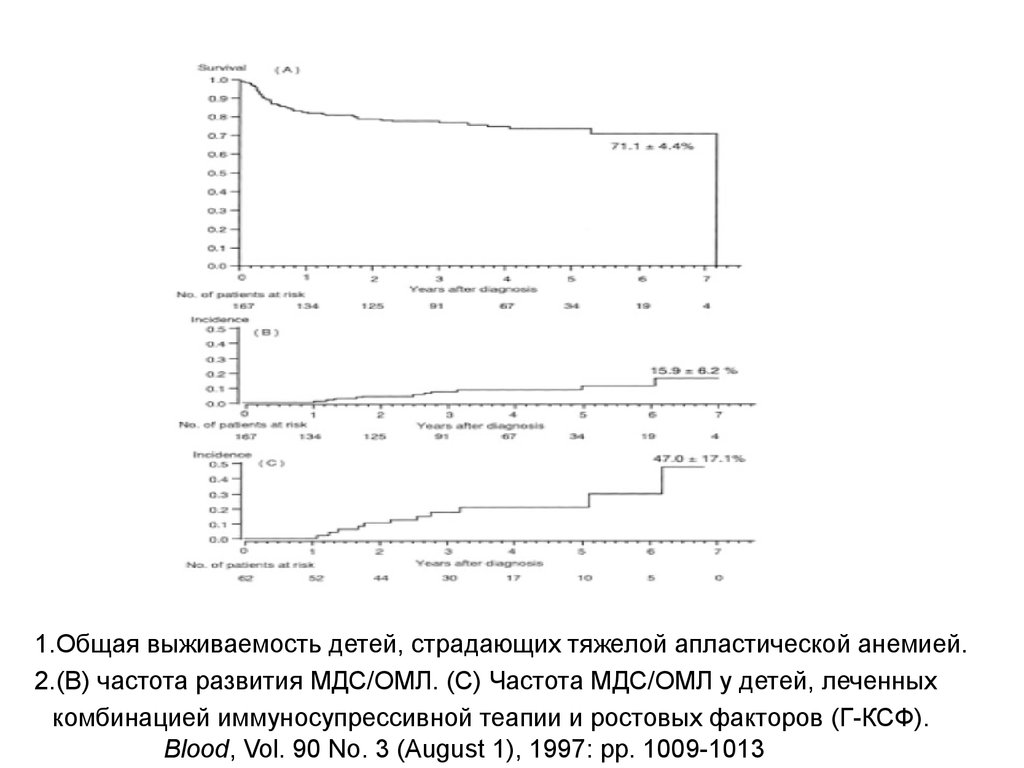
1.Общая выживаемость детей, страдающих тяжелой апластической анемией.2.(B) частота развития МДС/ОМЛ. (C) Частота МДС/ОМЛ у детей, леченных
комбинацией иммуносупрессивной теапии и ростовых факторов (Г-КСФ).
Blood, Vol. 90 No. 3 (August 1), 1997: pp. 1009-1013
39.
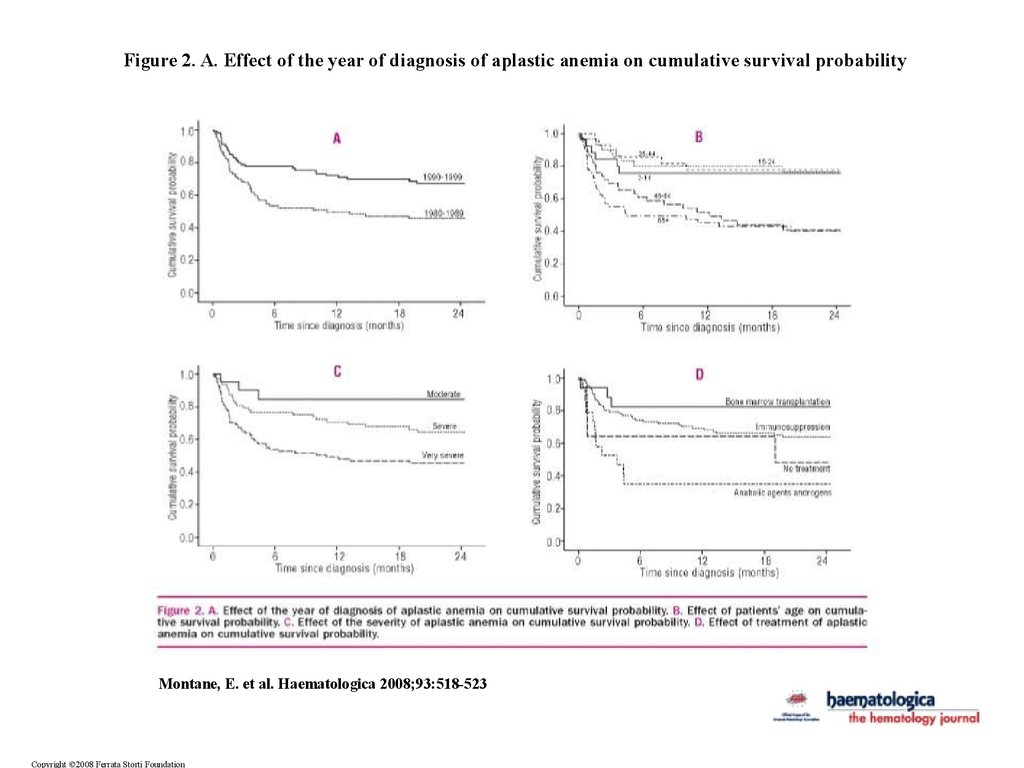
Figure 2. A. Effect of the year of diagnosis of aplastic anemia on cumulative survival probabilityMontane, E. et al. Haematologica 2008;93:518-523
Copyright ©2008 Ferrata Storti Foundation
40.
АНЕМИЯ ФАНКОНИ – редкое аутосомнорецессивное заболевание, характеризующеесяврожденными аномалиями ( пигментацией
кожи, гипоплазией почки или селезенки,
гипоплазией лучевой кости или большого
пальца руки, микроцефалией, отставанием
умственного развития), прогрессирующей
гипоплазии костного мозга с развитием
панцитопении и высоким риском развития
острого лейкоза, миелодиспластического
синдрома или опухолей
41. Внешний вид больного анемией Фанкони
42.
Гематологические проявления анемииФанкони развиваются в первые годы жизни.
Прогрессирующая мегалобластная анемия иногда
в сочетании с тробоцитопенией обычно
предшествует нейтропении.
На эритроцитах часто повышена экспрессия
I антигена.
Диагноз устанавливается в среднем в 7-летнем
возрасте.
43.
•В настоящее время установлены 8основных генов, участвующих в развитии
анемии Фанкони
•У части больных выявляются хромосомные
нарушения в клетках костного мозга
(изменения в 1 или 2 хромосоме, моносомия
7), которые лежат в основе развития
миелодиспластического синдрома или
острого нелимфобластного лейкоза.
44.
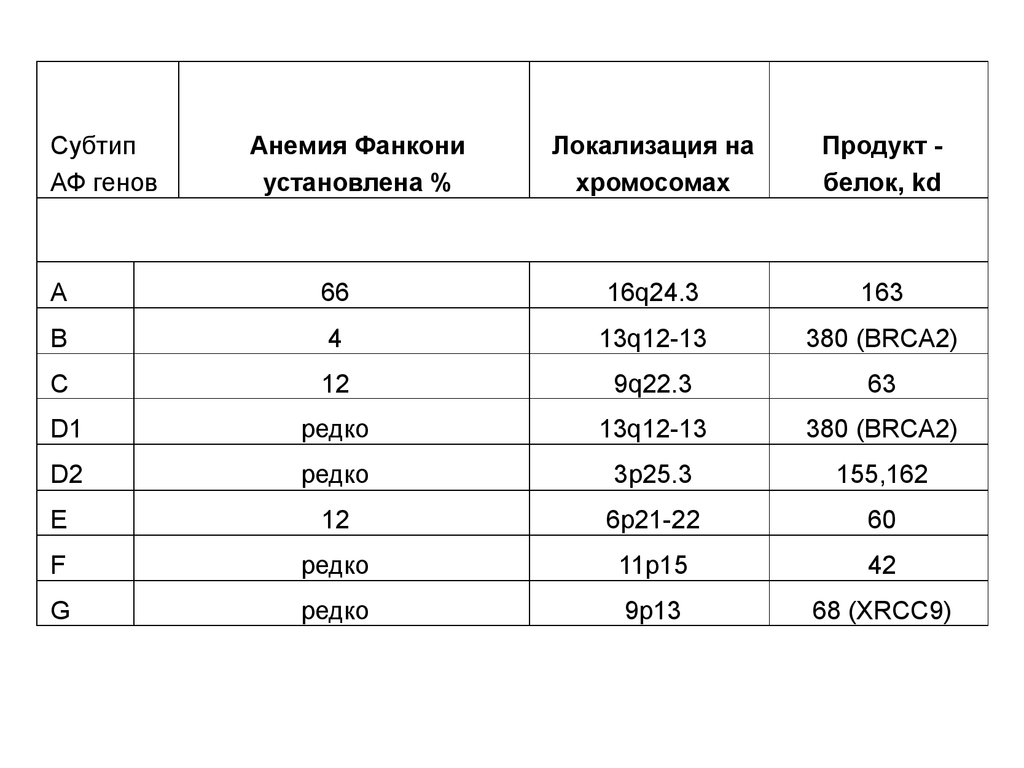
СубтипАФ генов
Анемия Фанкони
установлена %
Локализация на
хромосомах
Продукт белок, kd
A
66
16q24.3
163
B
4
13q12-13
380 (BRCA2)
C
12
9q22.3
63
D1
редко
13q12-13
380 (BRCA2)
D2
редко
3p25.3
155,162
E
12
6p21-22
60
F
редко
11p15
42
G
редко
9p13
68 (XRCC9)
45.
Диагноз анемии Фанкони подтверждается лабораторными тестами.DEB (дайбоксибутановый) тест
Клетки больных анемией Фанкони чувствительны к агентам, вызывающим
сшивку ДНК (diepoxybutane (DEB) и митомицин C ). В результате воздействия
данных веществ отмечается повышенное повреждение хромосом и их
радиальное расположение при использовании метода бандирования. В
качестве мишеней используются лимфоциты периферической крови.
DEB тест может быть выполнен и на культуре фибробластов больного.
Мозаицизм чувствительности лимфоцитов крови к митомицину С. Одна
популяция клеток резистентна к митомицину С, вторая популяция –
гиперчувствительна. Мозаицизм обусловлен соматической реверсией мутации
в генах анемии Фанкони.
Увеличение α-фетопротеина.
Использование секвенирования генов анемии Фанкони для семейной и
пренатальной диагностики. Ретровирусная комплементация с клонированной
ДНК генов анемии Фанкони и определением с помощью иммуноблотинга
46.
Апластическая анемия развивается у 95%больных анемией Фанкони в возрасте 7-9 лет.
Эритропоэз имеет черты стрессового
эритропоэза новорожденных с макроцитозом и
увеличением фетального гемоглобина.
Культивирование гемопоэтических клеток
показывает снижение в костном мозге
клоногенных гемопоэтических клеток, что
коррелирует с панцитопенической картиной
периферической крови.
47.
Лечение апластической анемии у больных с анемией Фанкони•Андрогены (эффект 50%)
•ГМ-КСФ (эффект 80% в отношении гранулоцитарного ростка)
•Г-КСФ (эффект 100% в отношении гранулоцитарного ростка, 30%
в отношении эритроидного и тромбоцитарного ростков
гемопоэза)
Общая продолжительность жизни больных составляет в среднем
30 лет.
Единственный метод лечения трансплантация стволовых гемопоэтических клеток (общая и DFS
70%). Сохраняются скелетные аномалии. Риск солидных
опухолей 5-10%.
Генная терапия возможна при С типе анемии Фанкони.
48.
Миелодиспластический синдром (МДС) – группабиологически и клинически гетерогенных клональных
заболеваний кроветворной ткани,
характеризующихся неэффективным гемопоэзом,
морфологическими (диспластическими)
изменениями в клетках костного мозга без
существенного уменьшения их количества и
снижением числа клеток в периферической крови за
счет активации апоптоза.
Общим для этой группы заболеваний является
высокий риск развития у больных острого
миелобластного лейкоза.
49. ВОЗ классификация МДС (1)
Рефрактерная анемия (РА)анемия > 6 месяцев, наличие дисплазии только в эритроидных
предшественниках,< 5% бластов и < 15% сидеробластов в костном
мозге.
Рефрактерная анемия с кольцевыми сидеробластами
анемия > 6 месяцев, отсутствие бластов в периферической крови, <
5% бластов в костном мозге, наличие дисплазии только в
эритроидных предшественниках, > 15% кольцевых сидеробластов
Рефрактерная цитопения с мультилинейной дисплазией
Двухростковая или панцитопения, отсутствие или единичные бласты
в периферической крови, отсутствие палочек Ауэра, < 1,0x10 9/л
моноцитов, дисплазия в 5-10% клеток в ≥ 2-х ростках гемопоэза,
< 5% бластов и < 15% кольцевых сидеробластов в костном мозге
Рефрактерная цитопения с мультилинейной дисплазией и
кольцевыми сидеробластами
Двухростковая или панцитопения, отсутствие или единичные бласты
в периферической крови, отсутствие палочек Ауэра, < 1,0x10 9/л
моноцитов, дисплазия в >10% клеток в ≥ 2-х ростках гемопоэза, < 5%
бластов, но > 15% кольцевых сидеробластов в костном мозге
50. ВОЗ классификация МДС (2)
Рефрактерная анемия с избытком бластов (РАИБ-1)Цитопения и < 5% бластов в периферической крови, отсутствие палочек
Ауэра, < 1,0x109/л моноцитов, одно-, двух-, трехлинейная дисплазия, 5-9%
бластов в костном мозге.
Рефрактерная анемия с избытком бластов (РАИБ-2)
Цитопения и 5-15% бластов в периферической крови, возможны палочки
Ауэра, < 1,0x109/л моноцитов, одно-, двух-, трехлинейная дисплазия, 1019% бластов в костном мозге.
Миелодиспластический синдром неклассифицируемый
Цитопения и редко единичные бласты в периферической крови,
однолинейная дисплазия в < 5% клетках гранулоцитарного ряда или
мегакариоцитах
Миелодиспластический синдром ассоциированный с изолированной del
(5q)
анемия, <5% бластов в периферической крови, нормальное или
повышенное содержание мегакариоцитов с
гиполобулярным/моноплоидным ядром, <5% бластов в костном мозге,
изолированный 5q- синдром по данным цитогенетического
исследования.
51.
Медиана возраста больных МДС - 69 лет,Частота встречаемости - 4 случая на 100000
населения.
В возрасте моложе 50 лет встречаемость 0,5
:100000
В возрасте старше 80 лет встречаемость
89:100000
52.
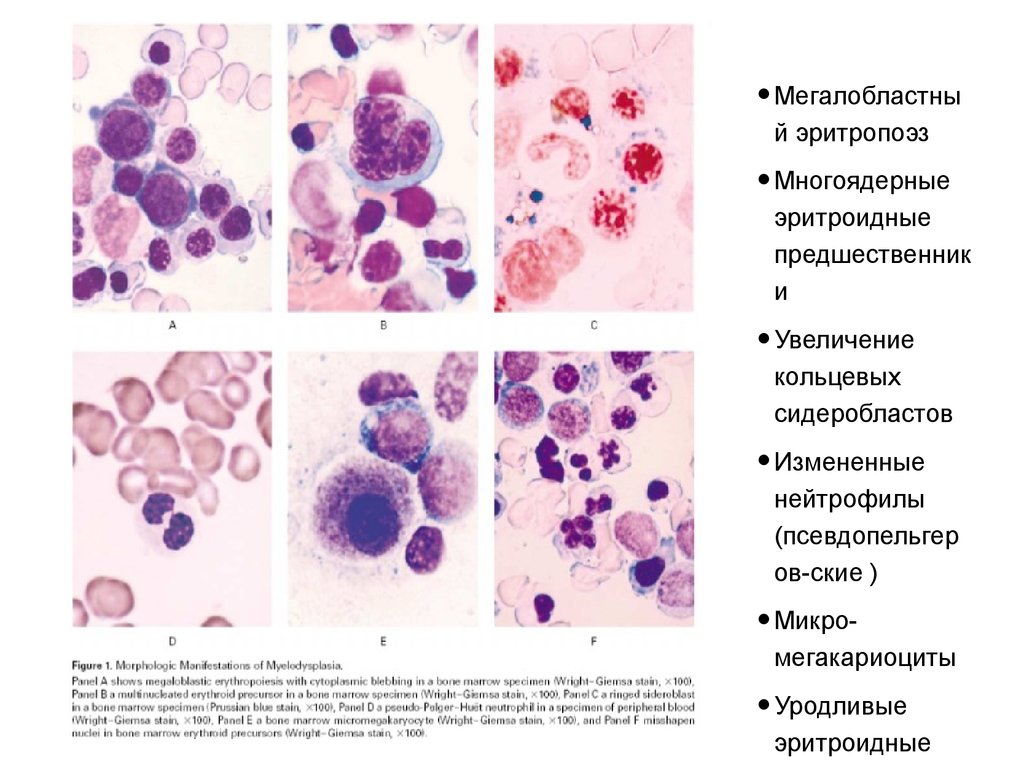
• Мегалобластный эритропоэз
• Многоядерные
эритроидные
предшественник
и
• Увеличение
кольцевых
сидеробластов
• Измененные
нейтрофилы
(псевдопельгер
ов-ские )
• Микро-
мегакариоциты
• Уродливые
эритроидные
53.
Клиническая картина МДСопределяется наличием одно-, двух-,
трехростковой цитопениии. Как
правило доминирует анемический
синдром, реже встречается
геморрагический синдром и
инфекционные осложнения.
54. Лечение больных МДС
• Симптоматическое лечение• Химиотерапия
• Иммуносупрессивная терапия
• Ростовые факторы
• Препараты уменьшающие апоптоз
• Препараты подавляющие ангиогенез
• Трансплантация стволовых клеток
• Препараты влияющие на процессы
метилирования ДНК (5q- синдром)
55.
Пароксизмальная ночная гемоглобинурия (болезньМаркиафавы-Микели) –
приобретенное клональное нарушение гемопоэтических
стволовых клеток, характеризующееся нестабильностью
клеточных мембран и их высокой чувствительностью к
комплементу.
Хотя в основе цитопенического синдрома при
пароксизмальной ночной гемоглобинурии лежит
повышенное разрушение клеток крови и костного мозга
системой комплемента и апоптоз, а при апластической
анемии – иммуноопосредованное подавление гемопоэза,
оба эти заболевания связаны между собой.
ПНГ часто ассоциирована с апластической анемией.
56.
В основе патогенеза пароксизмальной ночнойгемоглобинурии лежат приобретенные
соматические мутации (известны 174
соматические мутации) в гемопоэтических
стволовых клетках. Почти все больные ПНГ
имеют молекулярные повреждения в зоне PIGA гена ( Phosphatidyl Inositol Glycan
complementation group A), который
57.
Продукт гена PIG-A необходим на раннихэтапах синтеза
гликозилфосфатидилинозитольных
структур мембран, которые служат
«якорем» для групп поверхностных
протеинов, участвующих в поддержании
трансмембранной конфигурации белков и
защите клетки от компонентов комплемента.
Дефицит GPI-якорных протеинов приводит
к потере белков (CD59+ и др), которые
ингибируют (C5-C9 компоненты
комплемента) и приводит к повышенному
разрушению клеток крови и костного мозга.
58.
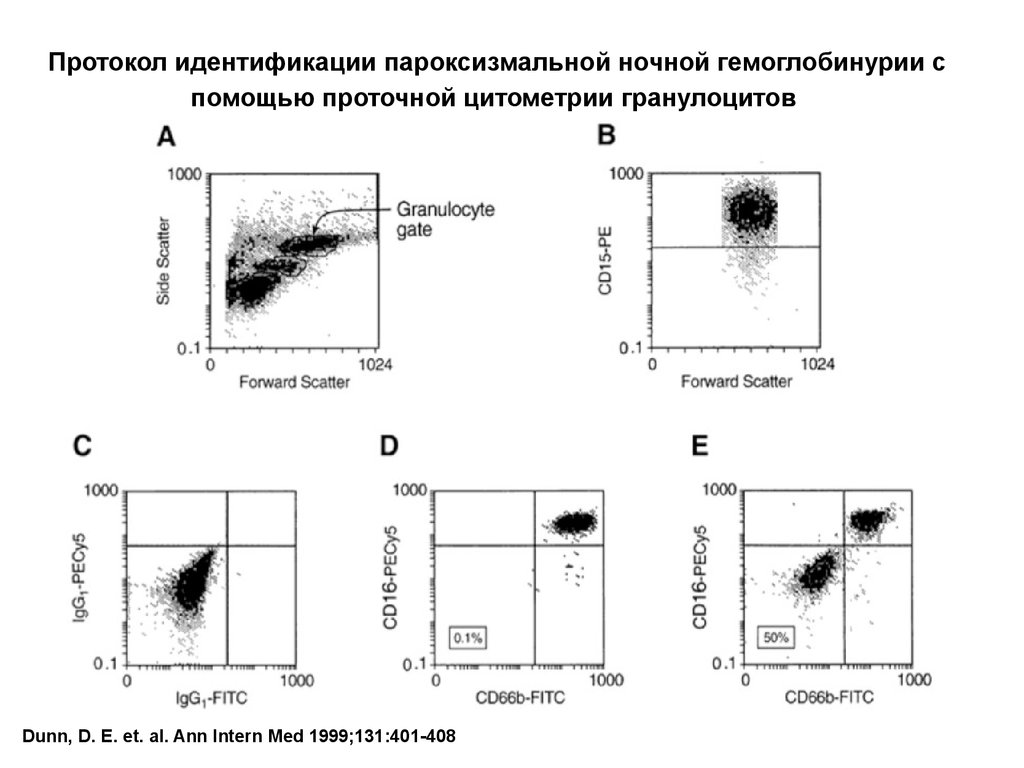
Проточная цитометрия – основной метод диагностики ПНГ, таккак позволяет оценить экспрессию GPI-якорных белков.
Вспомогательное значение для диагностики имеет проба Хема
(кислотный гемолиз) и проба Хартмана (сахарозный тест).
22% больных апластической анемией, 23% больных
миелодиспластическим синдромом имеют дефицит GPIякорных белков на клеточных мембранах. При других формах
аплазии кроветворения данный дефект не выявляется.
Апластическая анемия лечится с помощью
иммуносупрессивной терапии. Больные
миелодиспластическим синдромом с наличием ПНГ
популяции клеток имеют высокую чувствительность к
терапии антитимоцитарным глобулином и имеют
предсказуемый клинически значимый гематологический ответ.
Обнаружение клеток имеющих дефицит GPI-якорных
протеинов, у больных миелодиспластическим синдромом
59.
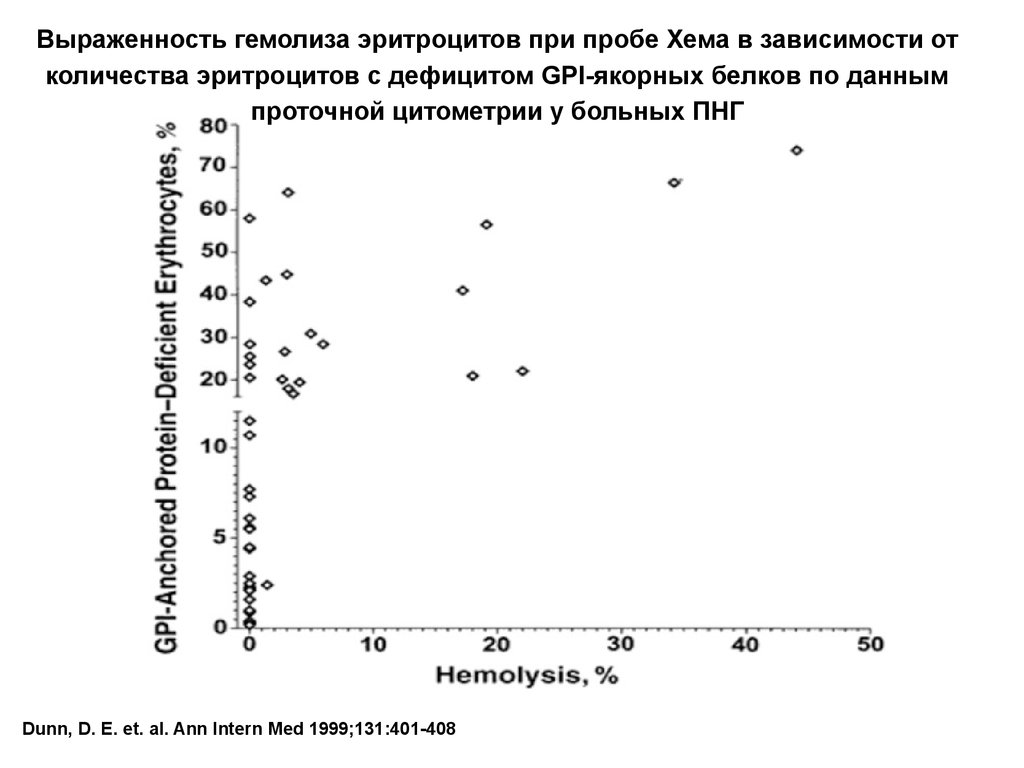
Выраженность гемолиза эритроцитов при пробе Хема в зависимости отколичества эритроцитов с дефицитом GPI-якорных белков по данным
проточной цитометрии у больных ПНГ
Dunn, D. E. et. al. Ann Intern Med 1999;131:401-408
60.
CD55 и CD59 могут использоваться для анализаэкспрессии GPI-якорных протеинов на
эритроцитах. Гликофорин А – неякорный маркер
эритроцитов.
Для оценки экспрессии GPI-якорных протеинов на
гранулоцитах может быть использовано
определение CD66b и CD16Cy . CD15 используется
как неякорный антиген на гранулоцитах.
CD48 и CD52 – на лимфоцитах
CD55, CD58, CD59 – на тромбоцитах
61.
Протокол идентификации пароксизмальной ночной гемоглобинурии спомощью проточной цитометрии гранулоцитов
Dunn, D. E. et. al. Ann Intern Med 1999;131:401-408
62.
Клинические симптомы у больных спароксизмальной ночной гемоглобинурией
зависят от степени вовлечения
мегакариоцитарного и гранулоцитарного ростков
и степени внутрисосудистого гемолиза,
гемоглобинемии, гемоглобинурии.
Классическая триада: гемолитическая анемия,
панцитопения, тромбозы.
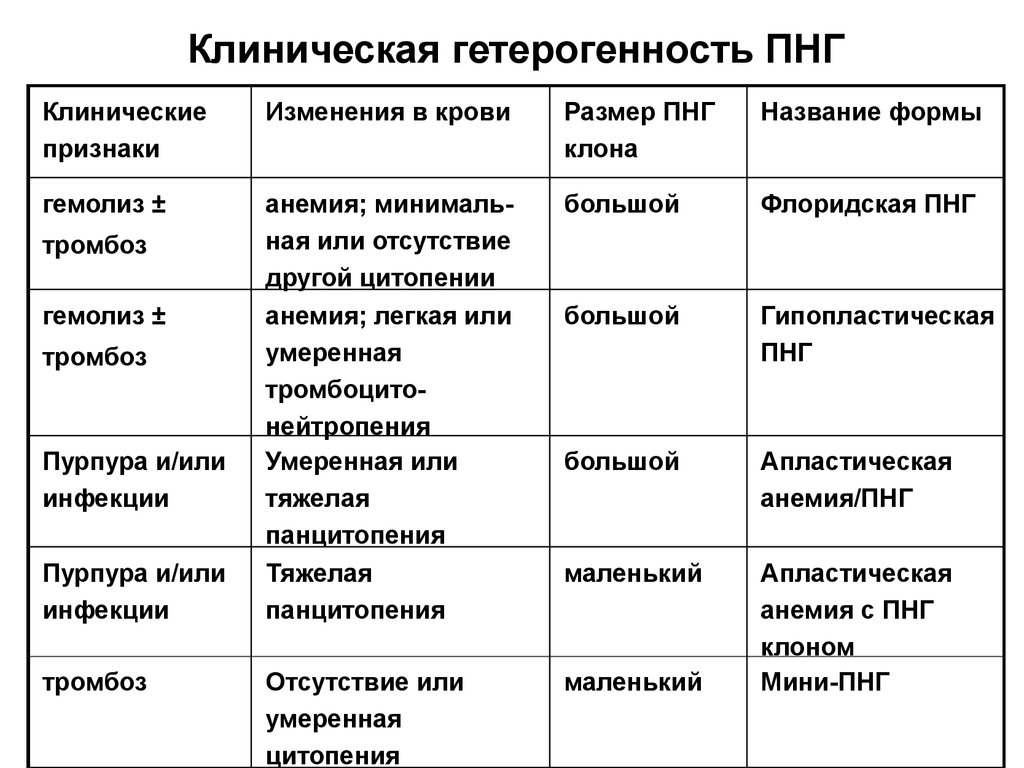
63. Клиническая гетерогенность ПНГ
Клиническиепризнаки
Изменения в крови
Размер ПНГ
клона
Название формы
гемолиз ±
анемия; минимальная или отсутствие
другой цитопении
анемия; легкая или
умеренная
тромбоцитонейтропения
Умеренная или
тяжелая
панцитопения
Тяжелая
панцитопения
большой
Флоридская ПНГ
большой
Гипопластическая
ПНГ
большой
Апластическая
анемия/ПНГ
маленький
Отсутствие или
умеренная
цитопения
маленький
Апластическая
анемия с ПНГ
клоном
Мини-ПНГ
тромбоз
гемолиз ±
тромбоз
Пурпура и/или
инфекции
Пурпура и/или
инфекции
тромбоз
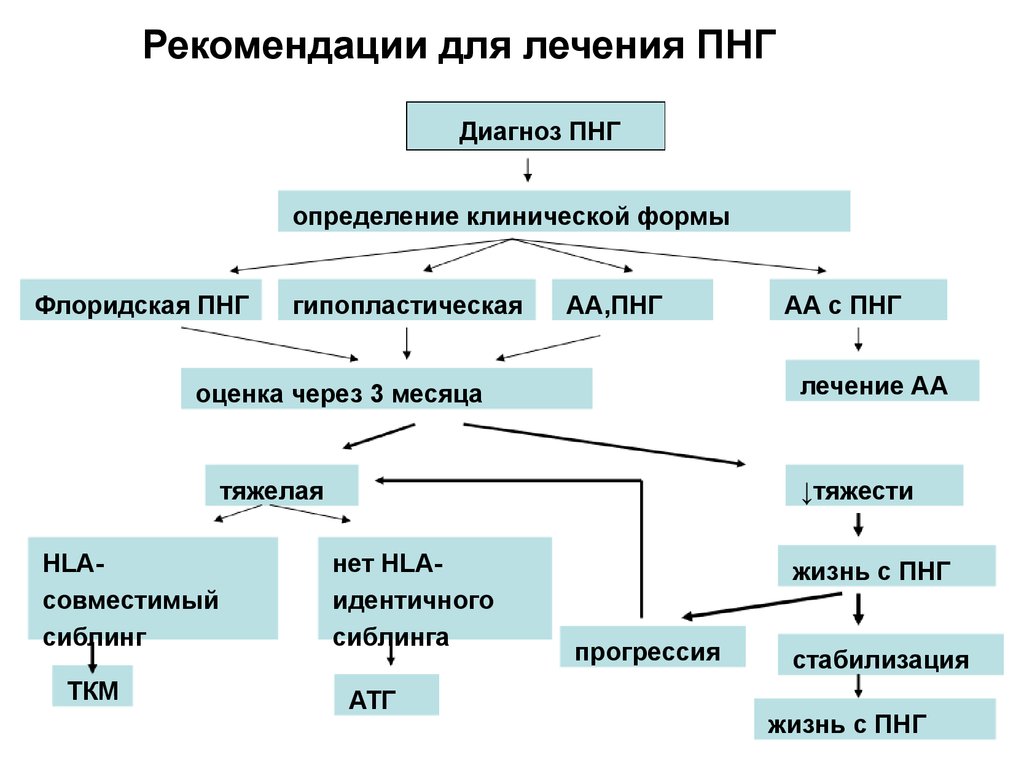
64. Рекомендации для лечения ПНГ
Диагноз ПНГопределение клинической формы
Флоридская ПНГ
гипопластическая
АА,ПНГ
лечение АА
оценка через 3 месяца
тяжелая
HLAсовместимый
сиблинг
ТКМ
АА с ПНГ
↓тяжести
нет HLAидентичного
сиблинга
ATГ
жизнь с ПНГ
прогрессия
стабилизация
жизнь с ПНГ
65.
Парциальная красноклеточная аплазия/чистая красноклеточная аплазия (ЧККА) –
клинический синдром, характеризующийся
отсутствием зрелых эритроидных
предшественников на фоне нормальной
клеточности костного мозга,
тяжелой анемией с ретикулоцитопенией и
нормальным содержанием тромбоцитов и
гранулоцитов в периферической крови
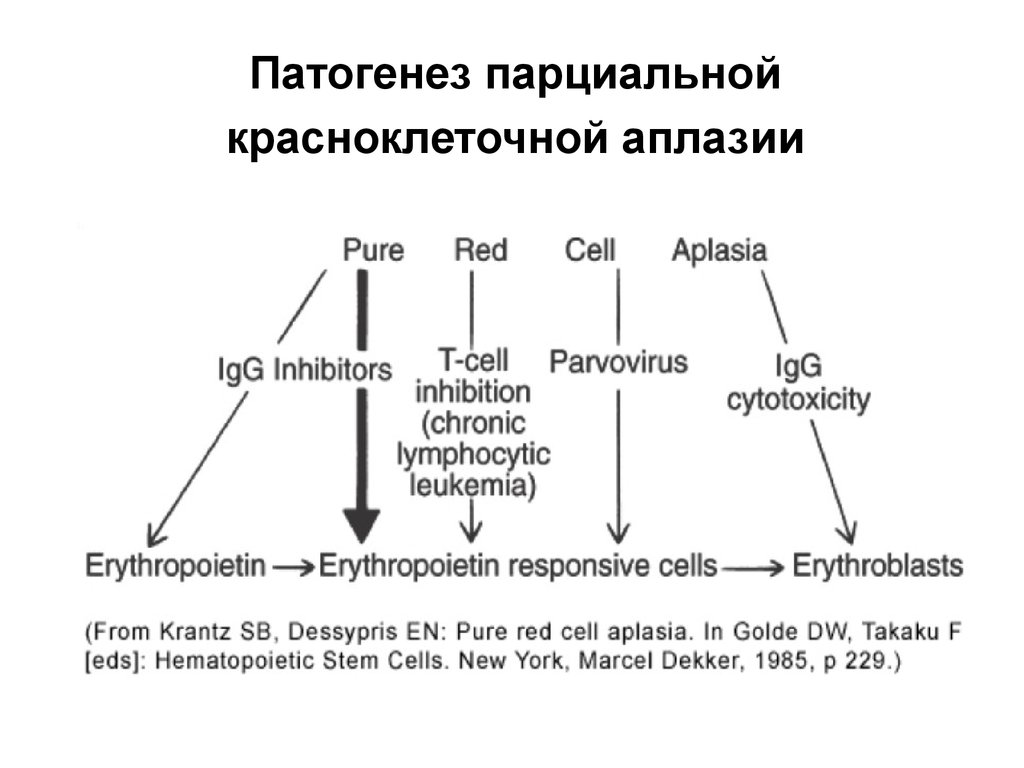
66. Патогенез парциальной красноклеточной аплазии
•T-лимфоцит опосредованная супрессияэритропоэза
•антителообусловленная супрессия
эритропоэза
•смешанный механизм
67. Патогенез парциальной красноклеточной аплазии
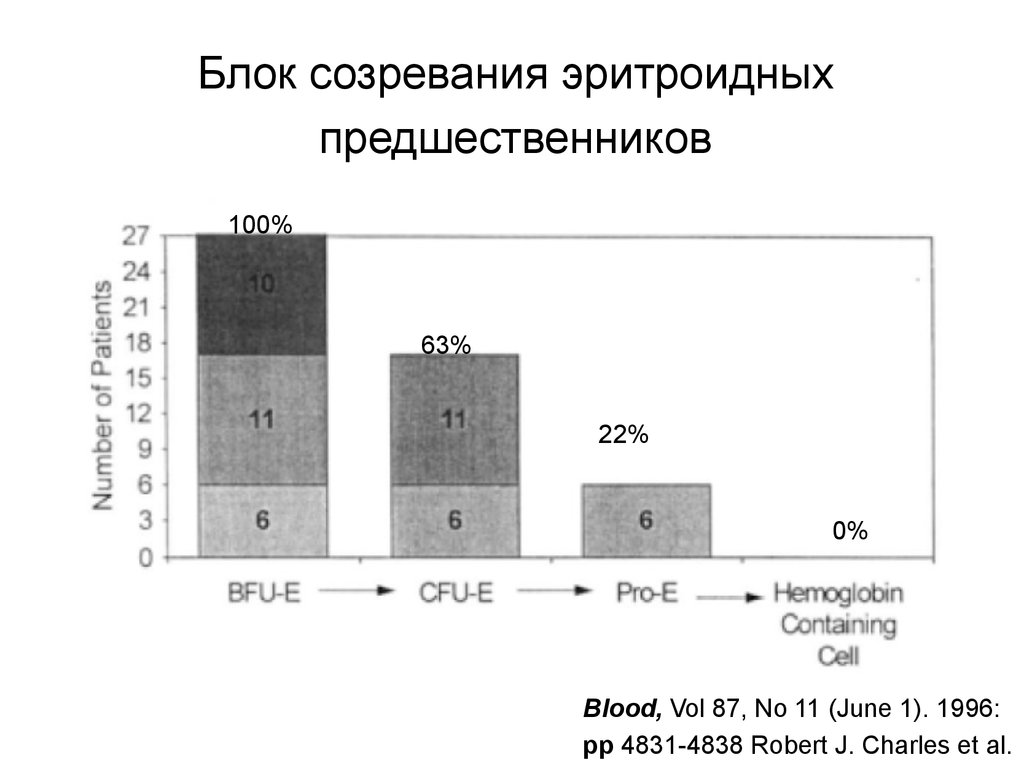
68. Блок созревания эритроидных предшественников
100%63%
22%
0%
Blood, Vol 87, No 11 (June 1). 1996:
pp 4831-4838 Robert J. Charles et al.
69. Этиологическая классификация парциальной красноклеточной аплазии
1.Врожденная гипопластическая анемия (синдромДаймонда-Блекфана)
2.Приобретенная
А. Первичная
1. Аутоиммунная
2. Прелейкемическая
3. Идиопатическая
Б. Вторичная, связанная с различными
заболеваниями и состояниями
70.
Б. Вторичная ЧККА, связанная с различными заболеваниями и состояниями:1.Тимома
2.Онкогематологические заболевания (Т-, В-ХЛЛ, лимфома/лейкоз из
гипергранулярных лимфоцитов, лимфомы, ОЛЛ, ММ, БВ, хронические
миелопролиферативные заболевания)
3.Солидные опухоли
4.Инфекции (вирусные: парвовирус B19,HIV, HTLV, гепатиты, инфекционный
мононуклеоз, CMV,инфекционный паротит; менингококцемия, лейшманиоз,
атипичная пневмония, стафилоккокковый сепсис)
5.Гемолитические анемии
6.Системные заболевания соединительной ткани (СКВ, ревматоидный артрит,
СЗСТ, с-м Шегрена)
7.Лекарственноопосредованная
8.Беременность
9.Тяжелая почечная недостаточность
10.Выраженный дефицит питания
11.Различные причины:
АВО-несовместимая ТКМ
аутоимунный гипотиреоз
аутоиммунная полиэндокринная недостаточность
другие
71. Иммуносупрессивная терапия парциальной красноклеточной аплазии
Первая линияПреднизолон
Вторая линия
•Циклофосфамид
•Циклоспорин
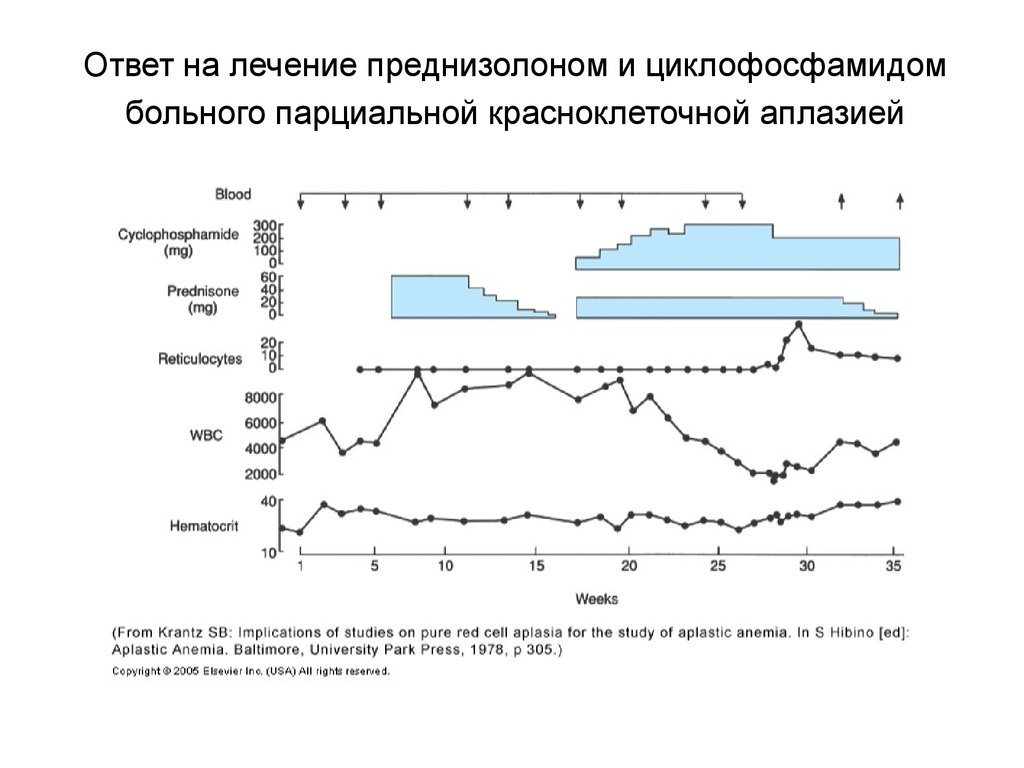
72. Ответ на лечение преднизолоном и циклофосфамидом больного парциальной красноклеточной аплазией
73.
Агранулоцитоз – наличие убольного тяжелой (IV степени)
нейтропении (количество
нейтрофилов в крови <500
клеток/мм3) или абсолютное
отсутствие циркулирующих в крови
зрелых гранулоцитов
74. Этиологическая классификация нейтропений (приобретенные и врожденные)
I. Приобретенные нейтропении1)IИнфекции (наиболее частая причина)
Вирусные
Бактериальные
Протозойные
Риккетсиозные
Грибковые
(нейтропения ( количество нейтрофилов < 2000 в 1 мкл)
развивается в течение первых дней заболевания и
связана с пиком виремической фазы, персистирует от 3-х
до 7 дней).
75.
I. Приобретенныенейтропении
2) Лекарство- или химически опосредованные:
- соли тяжелых металлов
- анальгетики, нестероидные противовоспалительные
- антидепрессанты, нейротропные
- противосудорожные
- антитиреоидные
- препараты для лечения сердечно-сосудистых заболеваний
- антигистаминные
- антибактериальные
- сульфамиды
- бигуаниды
- аллопуринол
- другие
(механизмы развития нейтропении: иммуноопосредованное разрушение
гранулоцитов и их предшественников через образование антител и иммунных
комплексов, дозозависимое угнетение гранулоцитопоэза, прямой токсический
эффект на миелоидные предшественники и клетки стромы. Иммуноопосредованная
нейтропения развивается быстро – от нескольких часов до нескольких дней В
случае прямого миелотоксического эффекта – нейтропения развивается через
несколько дней-недель. Длительность нейтропении вариабельна : от 3 до 56 дней)
76.
1.Приобретенные нейтропении3) Иммунные нейтропении
Изоиммунная неонатальная нейтропения
Хроническая аутоиммунная нейтропения
Tγ – лимфоцитоз
Смешанные иммуноопосредованные нейтропении
4) Связанные с нарушением питания
Кахексия
дефицит витамина B12 и фолиевой кислоты
дефицит меди
5) Синдром Фелти
6) Нейтропения, связанная с активацией системы
комплемента (диализ,экстракорпоральная мембранная
оксигенация, анафилактический шок)
7) Гиперспленизм (повышенная секвестрация)
77.
II. Врожденные нейтропении1) Тяжелая врожденная нейтропения (синдром
Костмана)
2) Циклическая нейтропения
3) Хроническая доброкачественная нейтропения
4) Идиопатическая хроническая тяжелая
нейтропения
5) Нейтропении, ассоциированные с
врожденными иммунными дефектами
6) Нейтропении ассоциированные с
фенотипическими аномалиями (Chediak-Higashi
синдром, Shwachman синдром и др. )
78. Лечение тяжелых нейтропений/агранулоцитоза
•Асептическая палата с очисткой воздуха•Удаление провоцирующей причины
•Г-КСФ или ГМ-КСФ
•Кортикостероиды
•Внутривенные иммуноглобулины
•Профилактика и лечение инфекций
•Трансфузия гранулоцитов (>10 /kg)
10
















































 medicine
medicine








