Similar presentations:
Химическая связь и ее типы. Кристаллические решетки
1.
Химическая связь и ее типы.Кристаллические решетки
2.
Под химической связью понимаюттакое взаимодействие атомов,
которое связывает их в молекулы,
ионы, радикалы, кристаллы
3.
Как атомысоединяются в
молекулы?
4.
это способность атомов элемента притягивать ксебе электроны, связывающие их с другими
атомами.
Значение электроотрицательности
химических элементов второго периода
(по шкале Полинга)
Li
Be
B
C
N
O
1.0 1.5 2.0 2.5 3.0 3.5
F
4
5.
II
II
III
IV
V
VI
H
2.1
Li
1.0
Na
0.9
K
0.8
Rb
0.8
Cs
0.7
Значение
электроотрицательности
химических элементов
первой группы главной
подгруппы
6.
Как изменяется электроотрицательностьв таблице химических элементов?
ЭО
уменьшается
увеличивается
7.
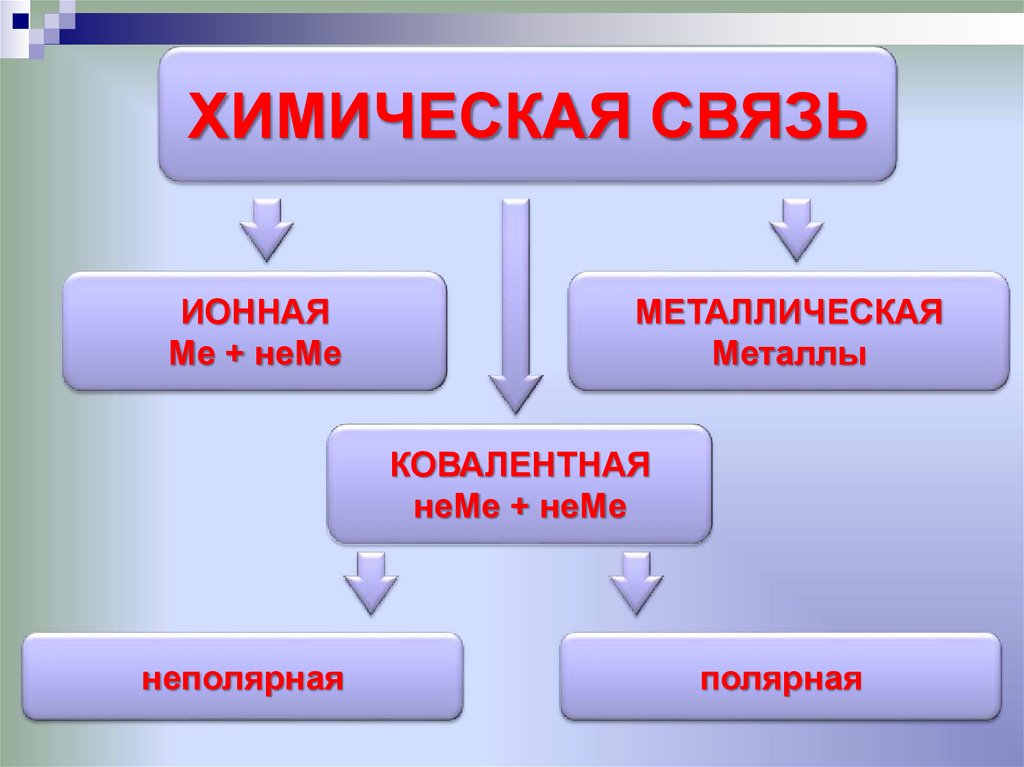
ХИМИЧЕСКАЯ СВЯЗЬИОННАЯ
Ме + неМе
МЕТАЛЛИЧЕСКАЯ
Металлы
КОВАЛЕНТНАЯ
неМе + неМе
неполярная
полярная
8.
Ионная химическая связьэто связь, образовавшаяся за счет
электростатического притяжения ионов.
Образуется между атомами с различной
электроотрицательностью (ЭО>2)
9.
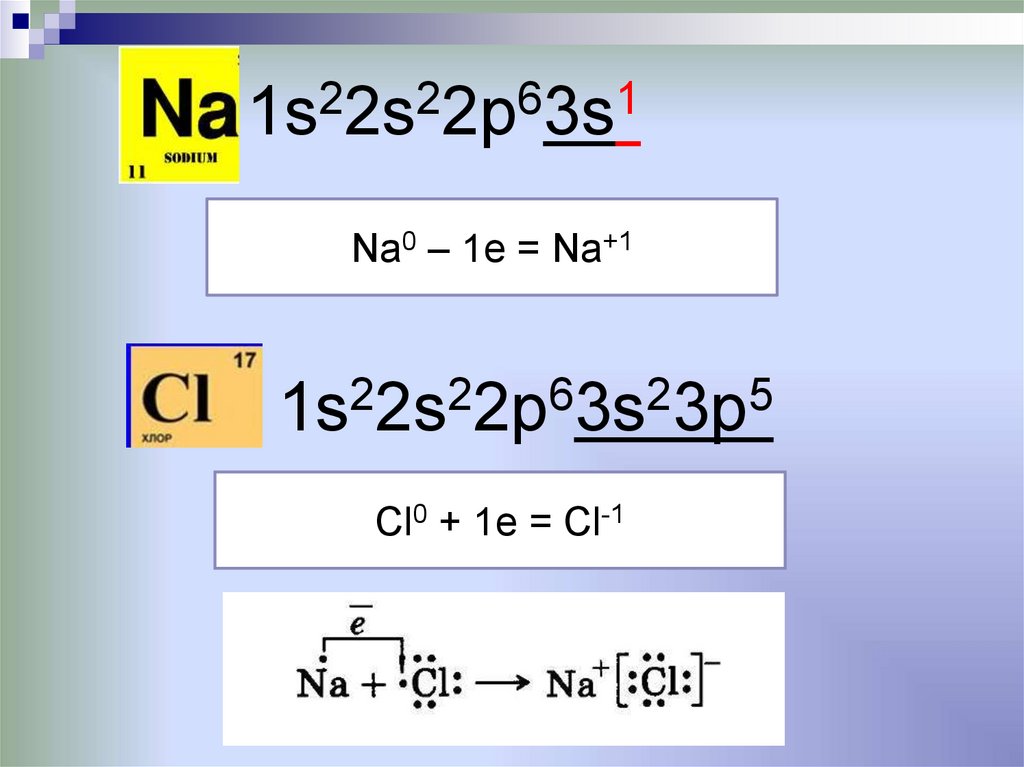
1s22s22p63s1Na0 – 1e = Na+1
1s22s22p63s23p5
Cl0 + 1e = Cl-1
10.
Ионы: катионы (+); анионы (-)Для катионов: энергия ионизации –
свойство терять свои валентные
электроны
Для анионов: сродство к электрону –
свойство притягивать к себе электроны
от других атомов
11.
Ионная кристаллическаярешетка
Электростатическое
притяжение не имеет
направления и
распространяется во
все стороны
Вещества имеют
высокие температуры
кипения и плавления,
при н.у. являются
твердыми,
подвергаются
электролитической
диссоциации
12.
Металлическая связьсвязь в металлах и сплавах, которую
выполняют относительно свободные
электроны между ионами металлов в
металлической кристаллической решетке
Схема образования металлической связи:
о
М — пе
п+
М
13.
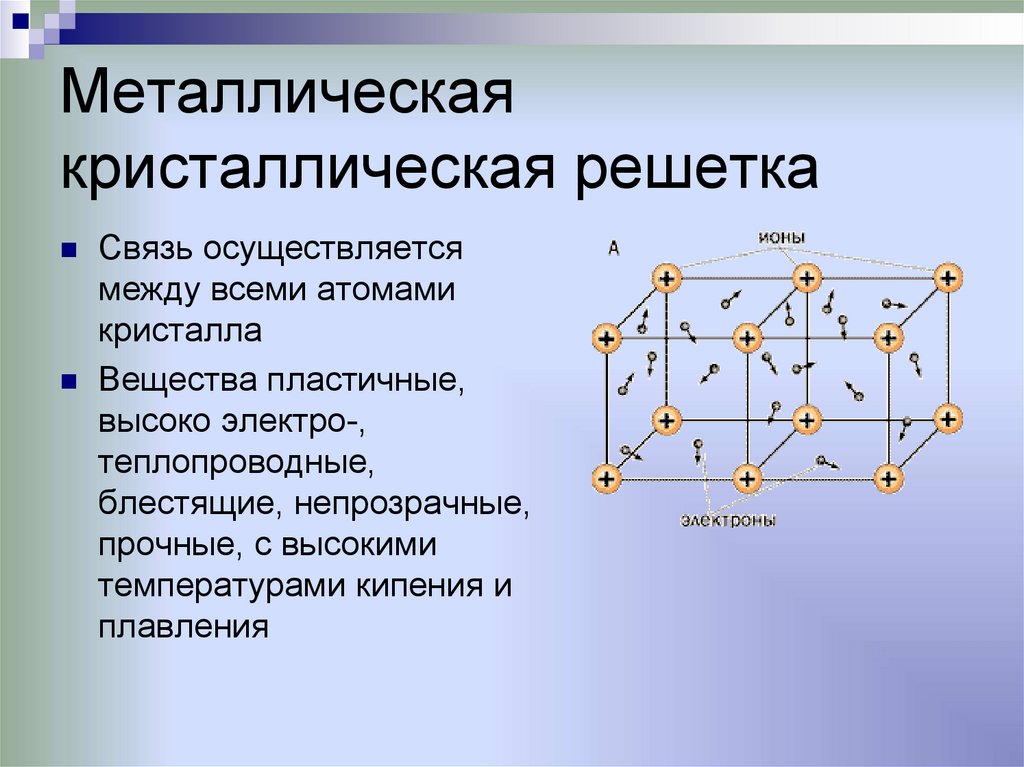
Металлическаякристаллическая решетка
Связь осуществляется
между всеми атомами
кристалла
Вещества пластичные,
высоко электро-,
теплопроводные,
блестящие, непрозрачные,
прочные, с высокими
температурами кипения и
плавления
14.
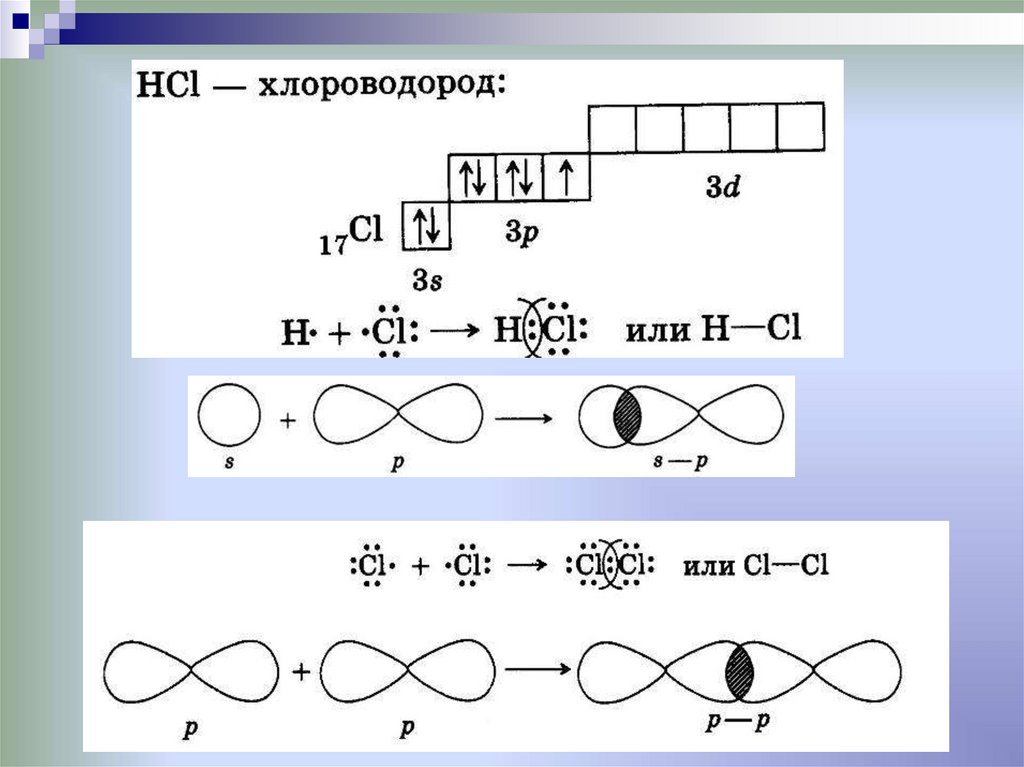
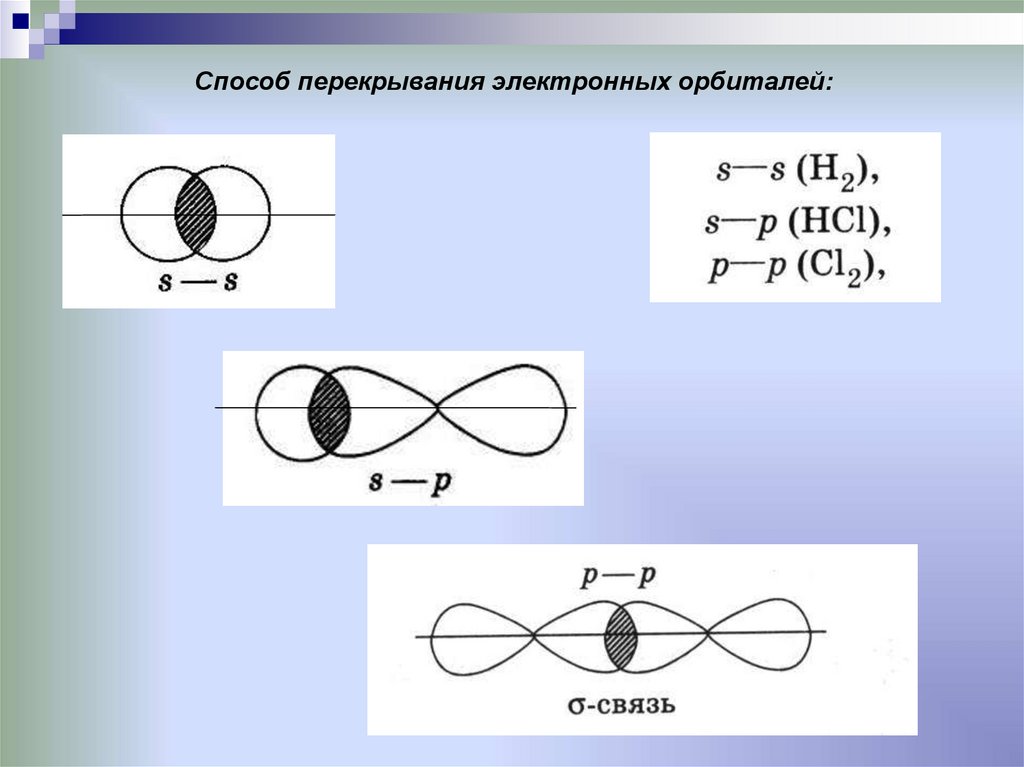
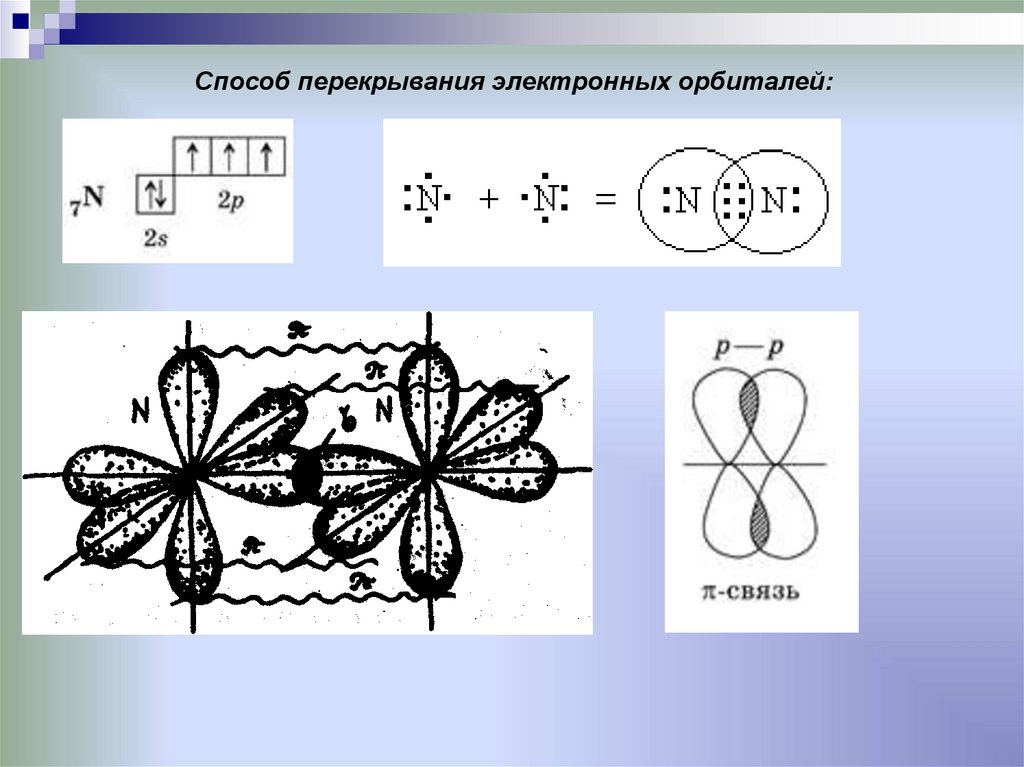
Ковалентная химическая связьэто связь, возникающая между атомами за счет
образования общих электронных пар
Механизм образования связи: • Обменный
15.
16.
•Донорно-акцепторный механизм17.
Способ перекрывания электронных орбиталей:18.
Способ перекрывания электронных орбиталей:19.
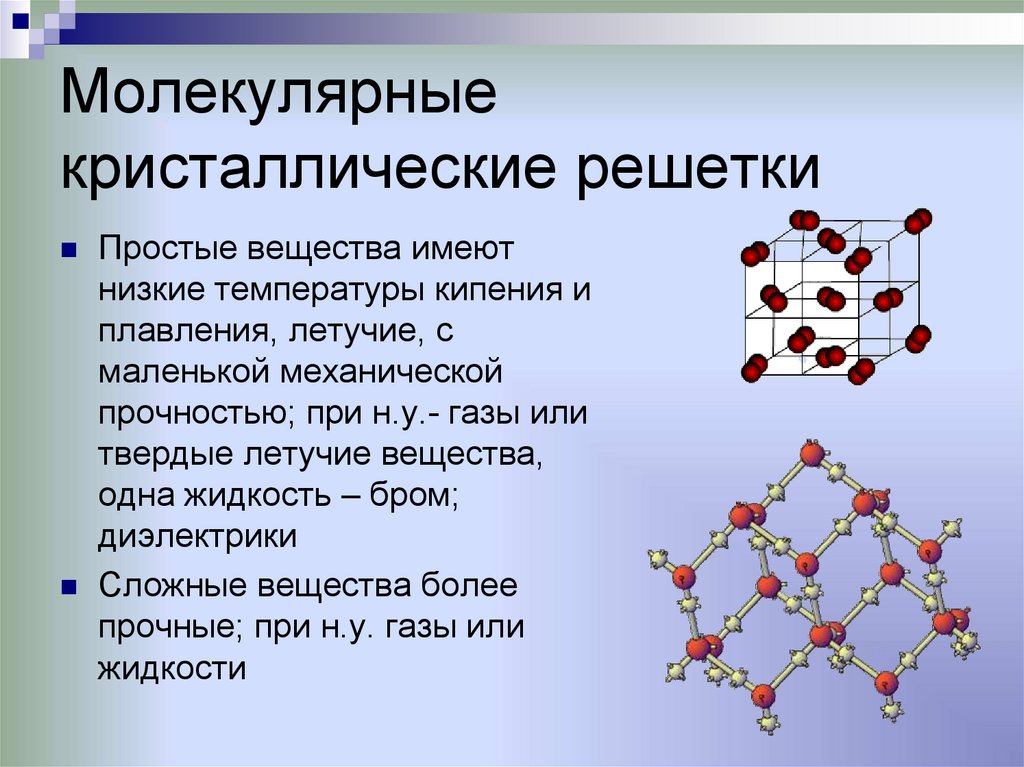
Молекулярныекристаллические решетки
Простые вещества имеют
низкие температуры кипения и
плавления, летучие, с
маленькой механической
прочностью; при н.у.- газы или
твердые летучие вещества,
одна жидкость – бром;
диэлектрики
Сложные вещества более
прочные; при н.у. газы или
жидкости
20.
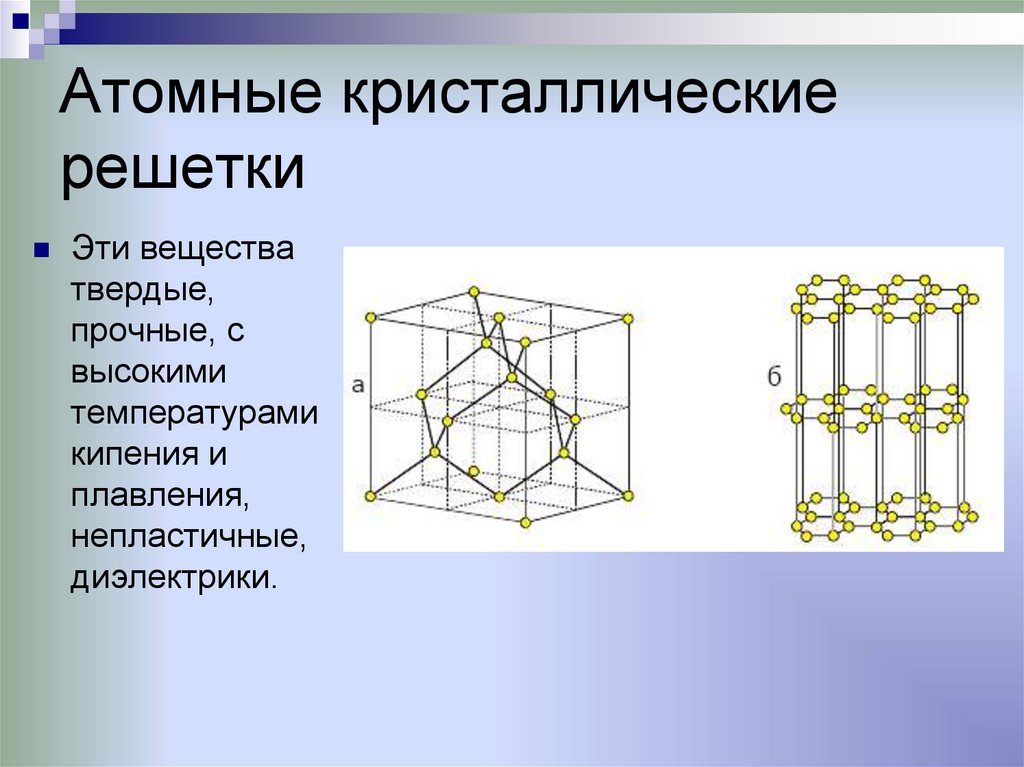
Атомные кристаллическиерешетки
Эти вещества
твердые,
прочные, с
высокими
температурами
кипения и
плавления,
непластичные,
диэлектрики.
21.
Задание: определить агрегатное состояниевеществ
Частицы вещества не связаны друг с другом, способны
свободно перемещаться. Очень высокая энергия тепловых
колебаний. Вещества способны сжиматься и расширяться.
Не имеют собственной формы и собственного объема.
Расширяются до тех пор, пока не заполнят сосуд и не
примут его форму. Разные вещества смешиваются друг с
другом в любых соотношениях.
Энергия связей частиц больше, чем энергия тепловых
колебаний. Вещества имеют форму и собственный объем.
Энергия тепловых колебаний больше энергии связи
частиц. Вещества не имеют формы, принимают форму
сосуда, но имеют собственный объем.
22.
Задание:Составьте сводную таблицу, в которой
необходимо соотнести все виды
агрегатных состояний, типы
кристаллических решеток и типы
химической связи
23.
СВОЙСТВА КОВАЛЕНТНОЙСВЯЗИ
24.
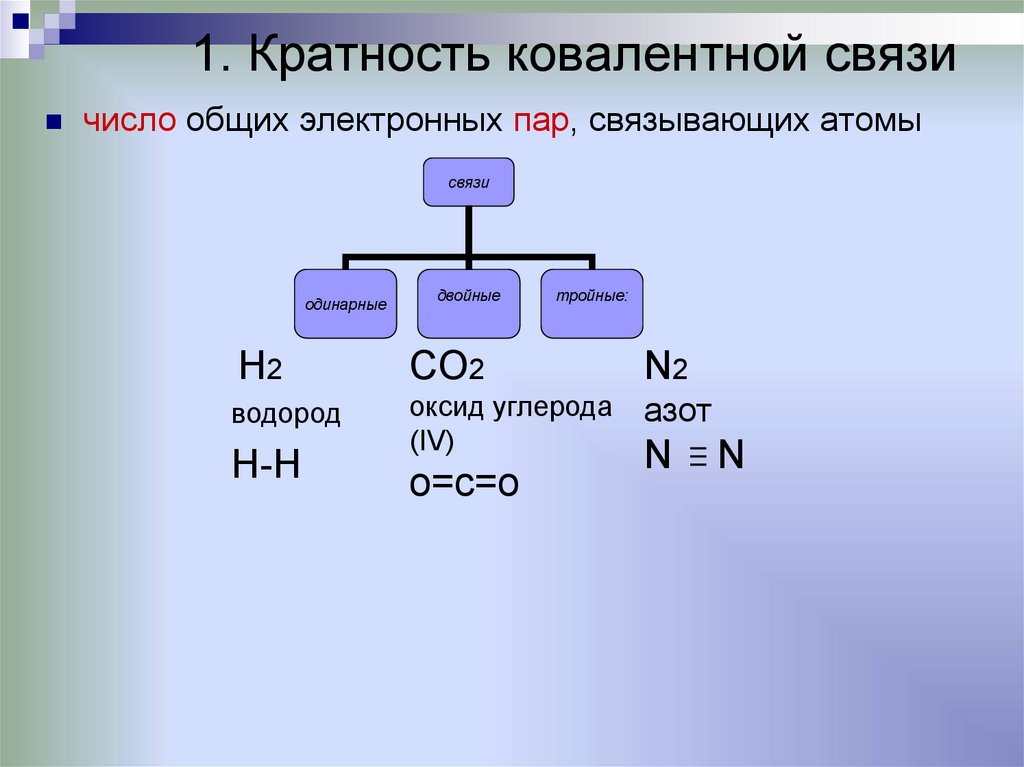
1. Кратность ковалентной связичисло общих электронных пар, связывающих атомы
связи
одинарные
двойные
тройные:
H2
CO2
N2
водород
оксид углерода
(IV)
азот
H-H
о=с=о
N
N
25.
2. Полярность ковалентной связистепень смещенности общих электронных пар к
одному из связанных ими атомов
связь
неполярной
Ковалентную химическую связь,
образующуюся между атомами с
одинаковой
электроотрицательностью,
называют неполярной
HH
полярной
Ковалентную химическую связь,
образующуюся между атомами с
разной
электроотрицательностью,
называют полярной
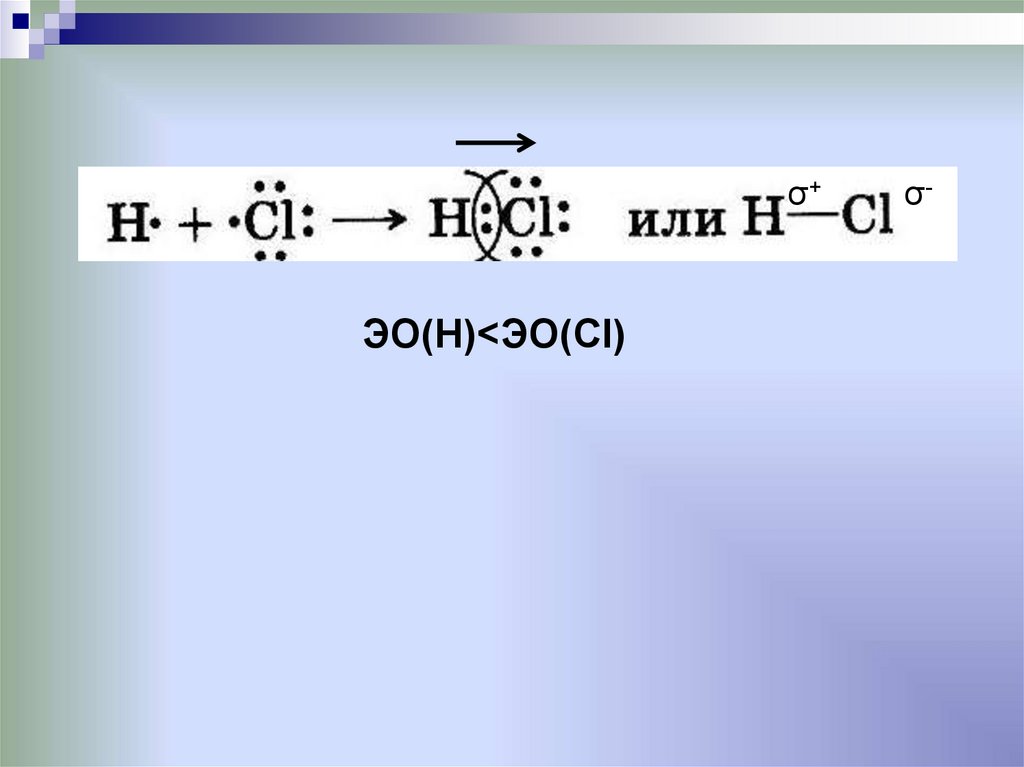
H СL
26.
σ+ЭО(Н)<ЭО(Cl)
σ-
27.
3. ДлинаМежъядерное расстояние, обозначатся ג, измеряется в
нм. Чем больше длина связи, тем она прочнее.
Н-F
H-Cl
ג > ג
сила кислоты
больше
28.
4. Энергия связиЭнергия, необходимая для разрыва связи. В 1 моль
вещества энергия связи измеряется в кДж/моль. Чем
больше энергия связи, тем она прочнее
29.
5. Насыщенностьспособность химического элемента образовывать
определенное число связей
У водорода – 1 связь; у кислорода -2 связи
О=О
Н-Н
Н-О-Н
30.
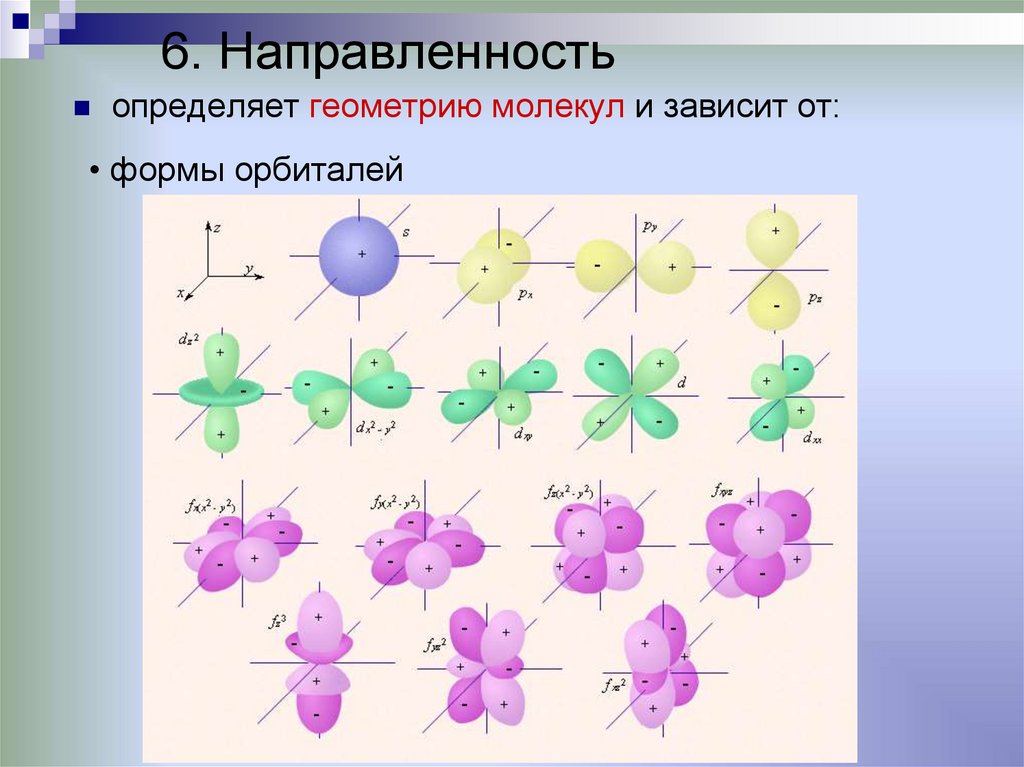
6. Направленностьопределяет геометрию молекул и зависит от:
• формы орбиталей
31.
• взаимодействия электронных пар, котороеприводит к возможному отталкиванию орбиталей
32.
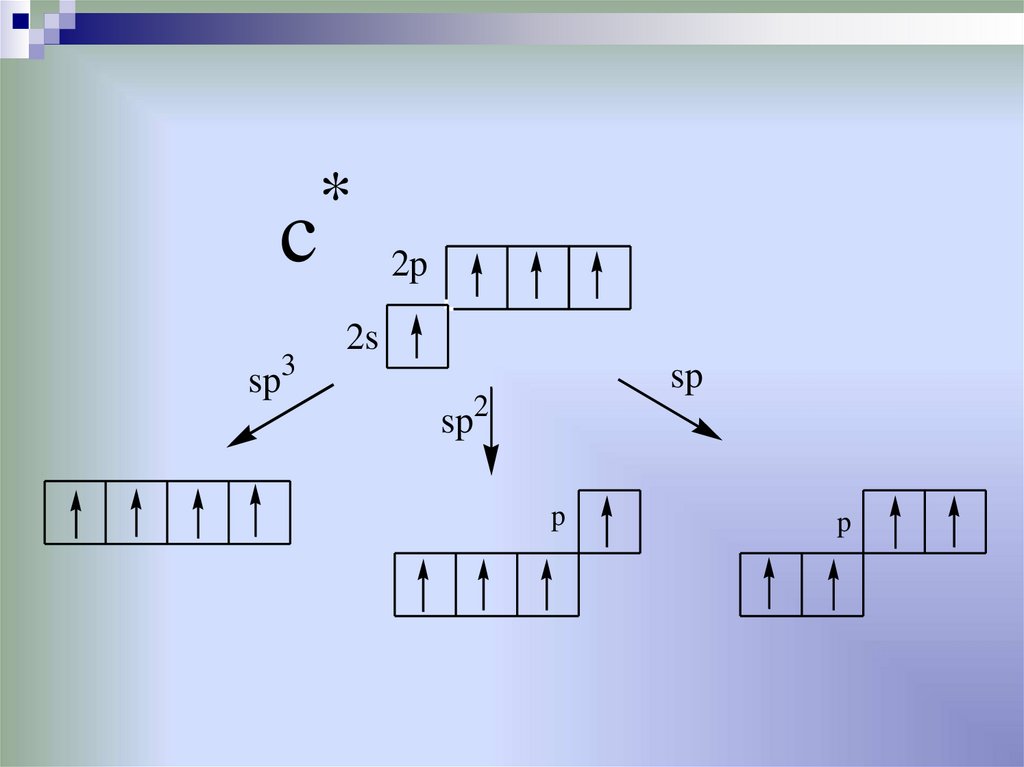
•от образования гибридных орбиталейнормальное состояние
33.
возбужденное состояние*
34.
csp3
*
2p
2s
sp
sp2
p
p
35.
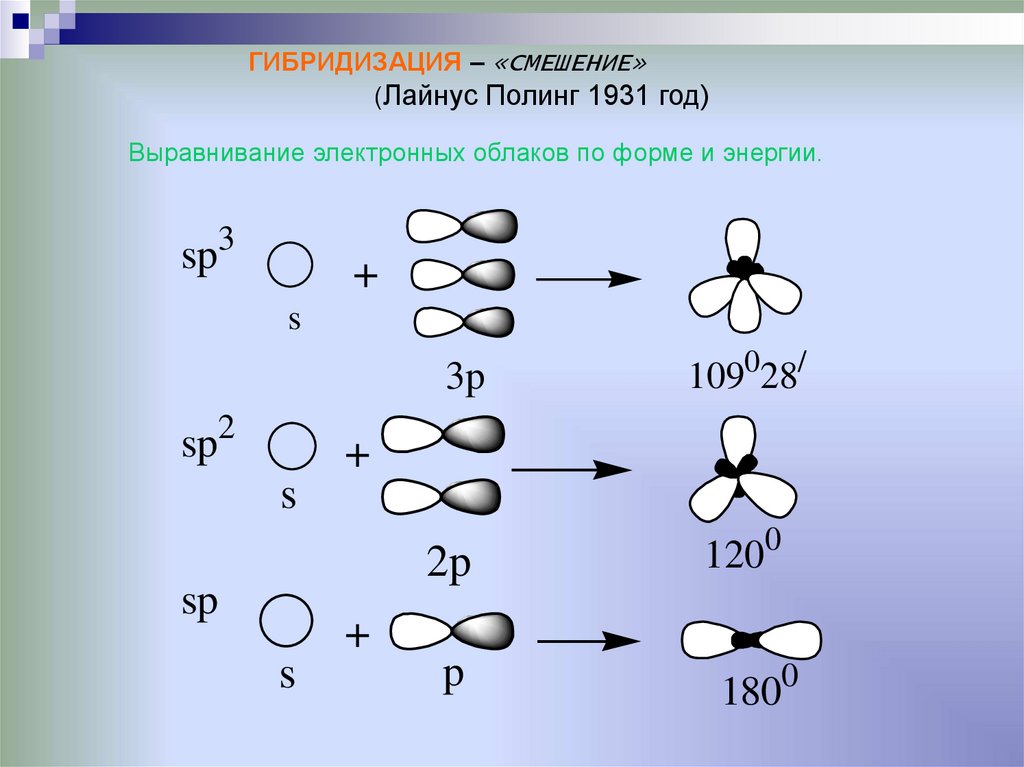
ГИБРИДИЗАЦИЯ – «СМЕШЕНИЕ»(Лайнус Полинг 1931 год)
Выравнивание электронных облаков по форме и энергии.
3
sp
+
s
3p
2
sp
109028/
+
s
2p
sp
+
s
p
1200
1800
36.
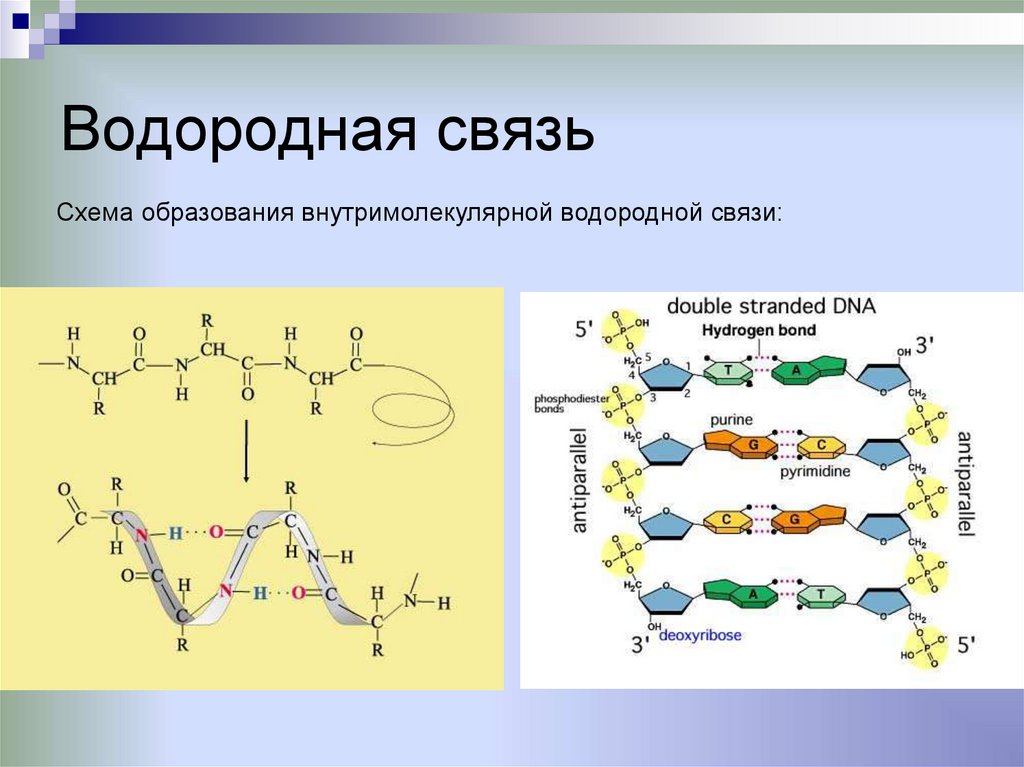
Водородная связьвозникает в соединениях, где водород связан
с атомами, имеющими высокую
электроотрицательность (О, N, F)
Схема образования межмолекулярной водородной связи:
37.
Водородная связьСхема образования внутримолекулярной водородной связи:






















 chemistry
chemistry








