Similar presentations:
Виды химической связи. Кристаллические решетки
1.
2. Виды химической связи. Кристаллические решетки
3.
ИоннаяКовалентная
Химическая
связь
Водородная
Металлическая
3
4.
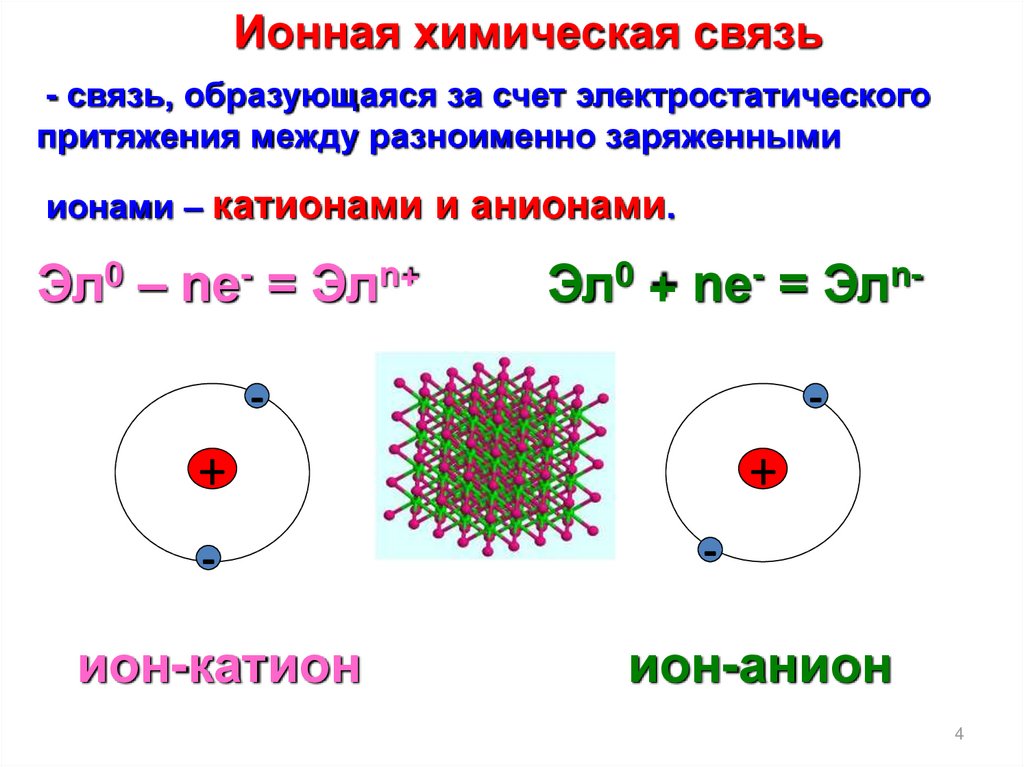
Ионная химическая связь- связь, образующаяся за счет электростатического
притяжения между разноименно заряженными
ионами – катионами и анионами.
Эл0 – nе- = Элn+
Эл0 + nе- = Элn-
-
-
+
-
ион-катион
+
-
ион-анион
4
5.
Ионыпо составу
простые:
Na+, Ca2+,
Cl-
сложные:
OH-, SO42-,
No3-
по заряду
положительные:
Ca2+, Na+
отрицательные:
OH-, SO42-
5
6.
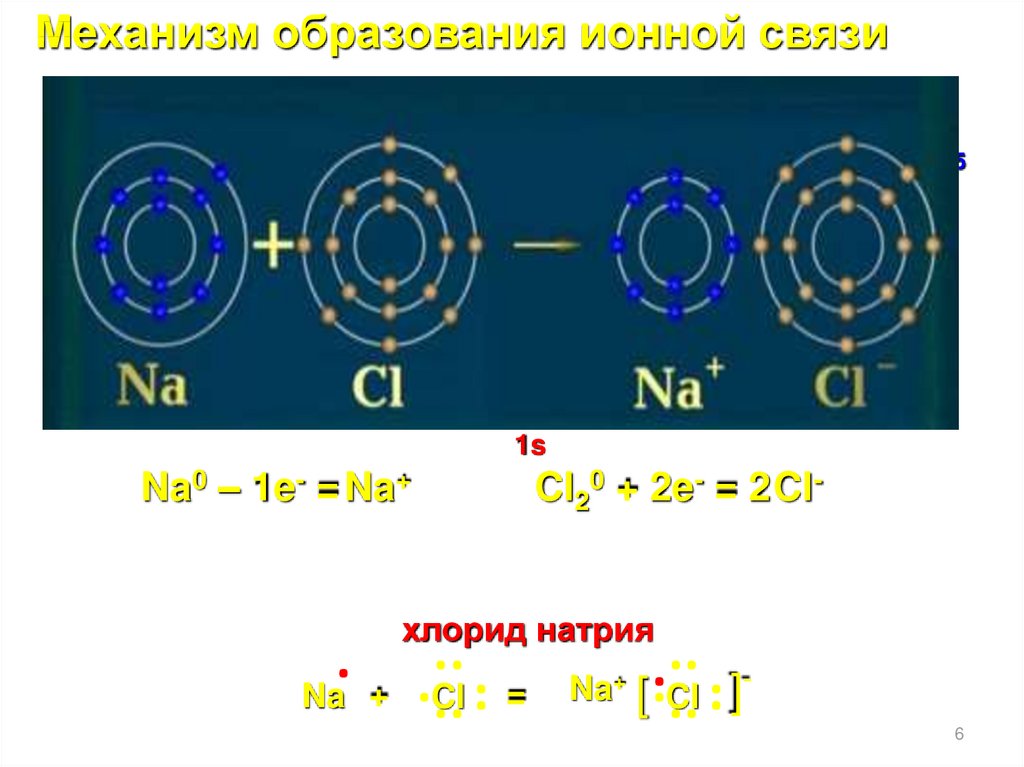
Механизм образования ионной связиСоставьте электронные и графические формулы атомов:
22s22p63s1
Na
1s
+11
22s22p63s23p5
Cl
1s
+17
3s
3p
2p
3s
2s
2p
1s
2s
1s
Na0 – 1e- = Na+
Na +
хлорид натрия
.. .
.Cl
.. . =
Na+
.. .
.
[ .Cl
.. .
-[
.
Cl20 + 2e- = 2 Cl-
6
7.
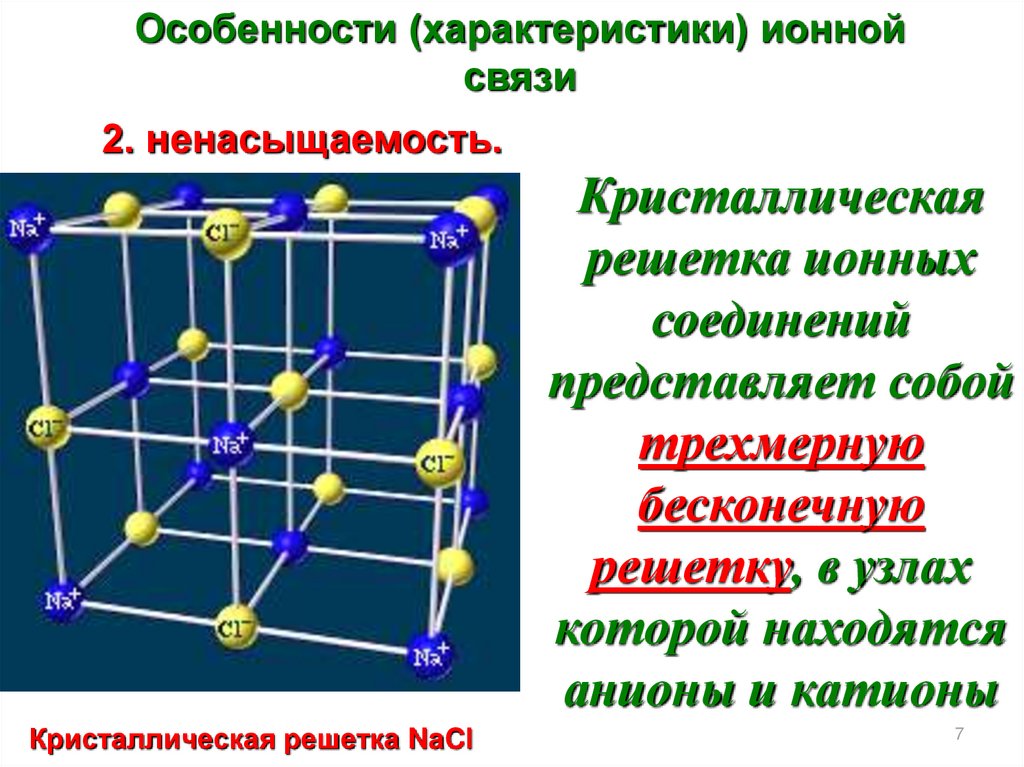
Особенности (характеристики) ионнойсвязи
2. ненасыщаемость.
Кристаллическая
решетка ионных
соединений
представляет собой
трехмерную
бесконечную
решетку, в узлах
которой находятся
анионы и катионы
Кристаллическая решетка NaCl
7
8.
Домашнее заданиеФлюорит СаF2
8
Периклаз MgO
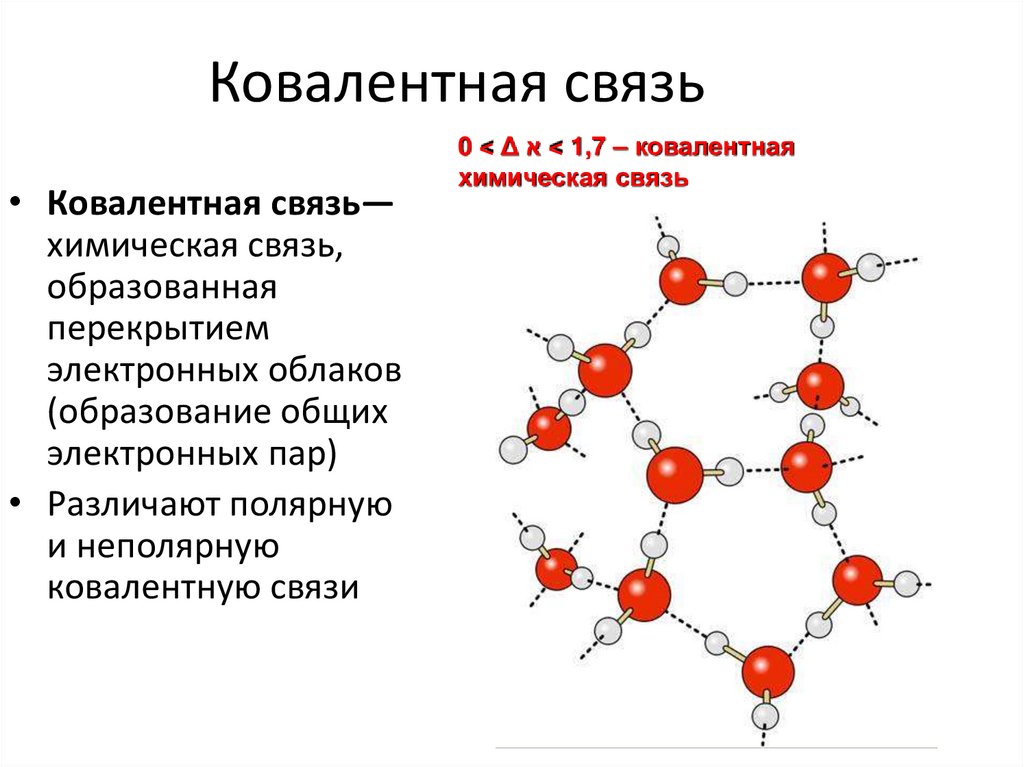
9. Ковалентная связь
• Ковалентная связь—химическая связь,
образованная
перекрытием
электронных облаков
(образование общих
электронных пар)
• Различают полярную
и неполярную
ковалентную связи
0 < Δ < א1,7 – ковалентная
химическая связь
10.
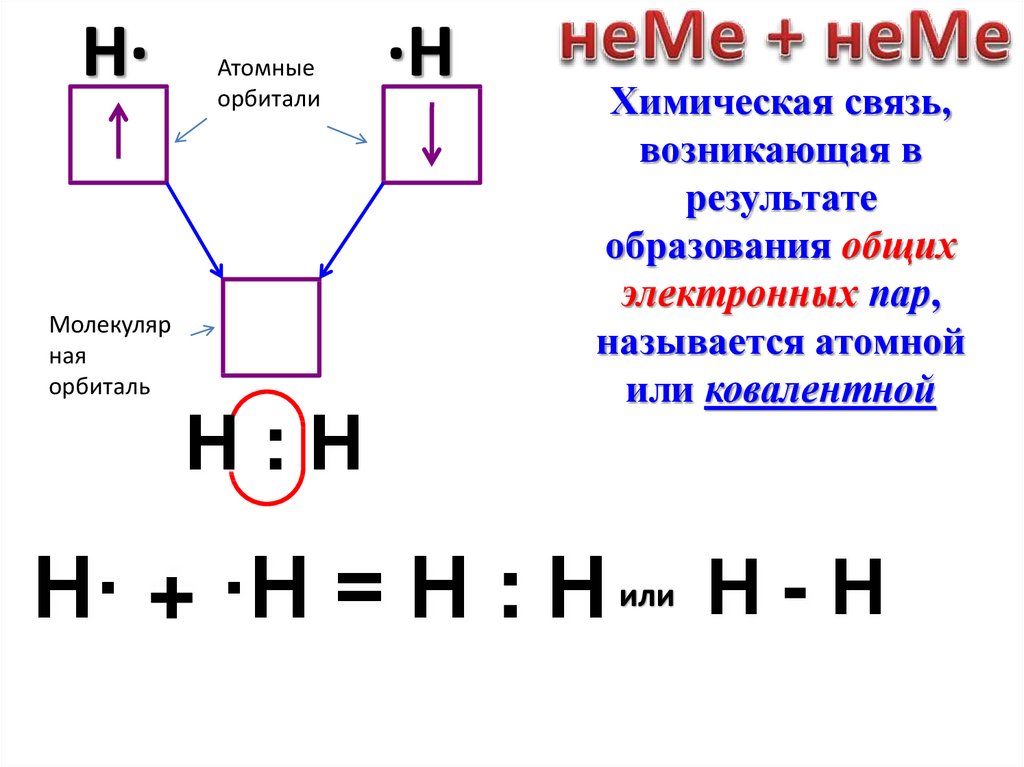
H·Молекуляр
ная
орбиталь
Атомные
орбитали
Н:Н
·H
Химическая связь,
возникающая в
результате
образования общих
электронных пар,
называется атомной
или ковалентной
H· + ·Н = Н : Н
или
Н-Н
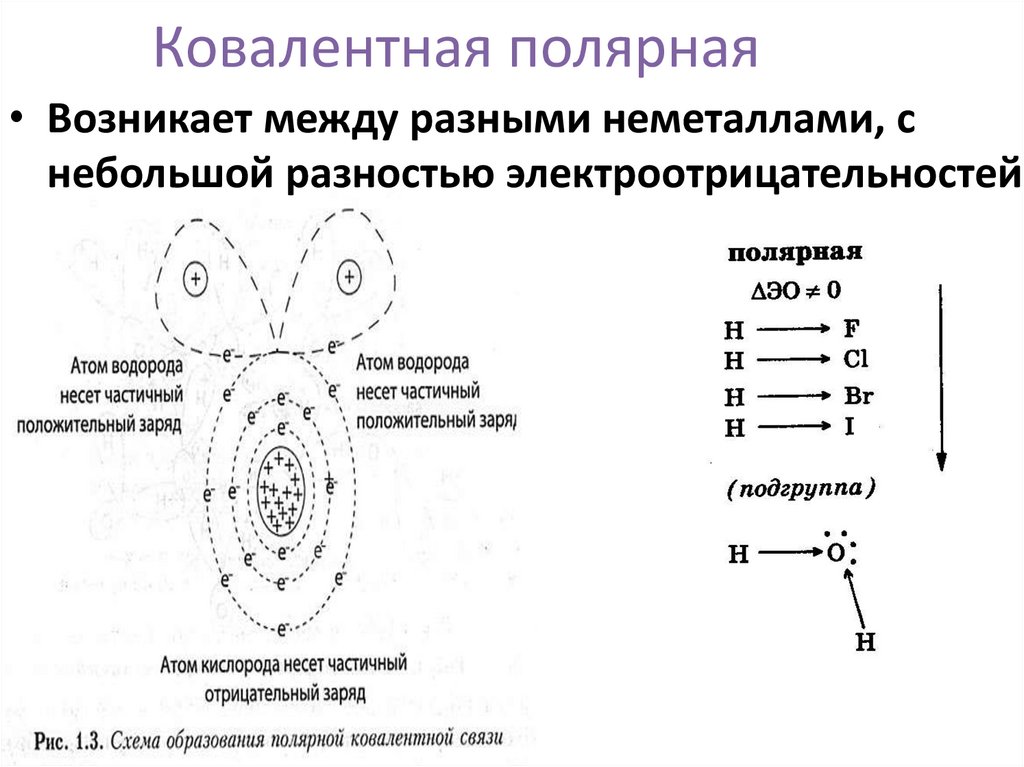
11. Ковалентная полярная
• Возникает между разными неметаллами, снебольшой разностью электроотрицательностей.
12. Электроотрицательность
Способность атомов химических
элементов оттягивать к себе общие
электронные пары, называется
электроотрицательнос
-тью (ЭО)
13. Ряд электроотрицательности химических элементов
H As I Si P Se C S Br Cl N O F
Усиление электроотрицательности
14.
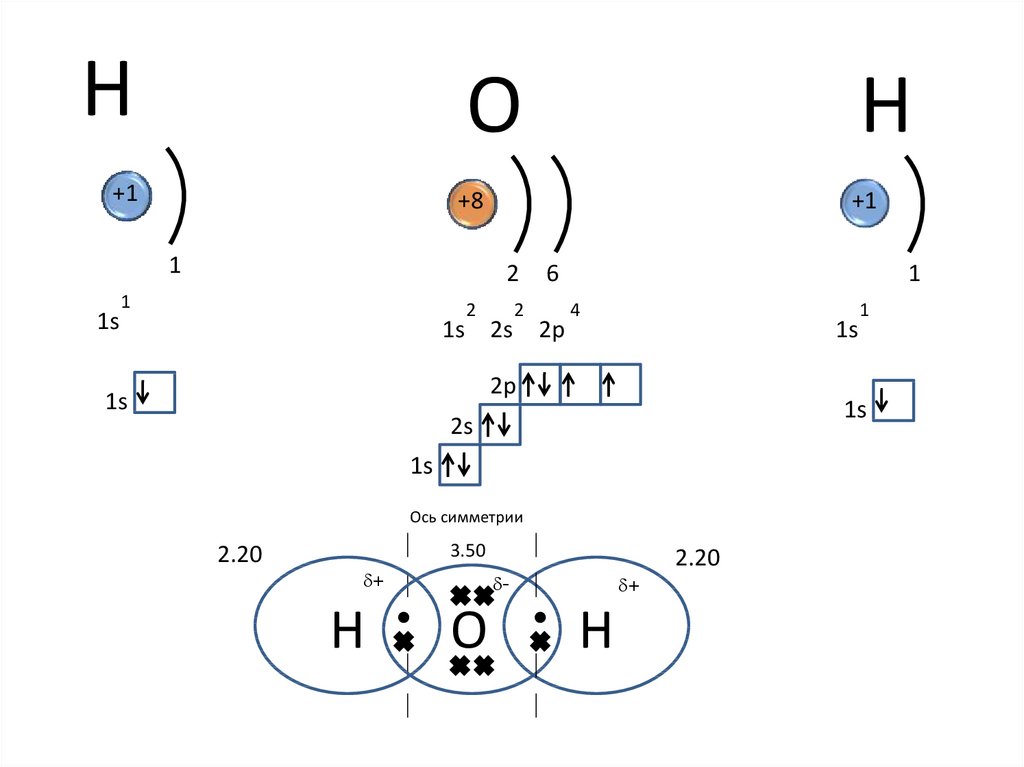
HО
+1
+8
1
1s
H
+1
2
1
2
2
6
1s 2s 2p
1
4
1s
2p
1s
1s
2s
1s
Ось симметрии
2.20
3.50
d+
H
2.20
d-
О
1
d+
Н
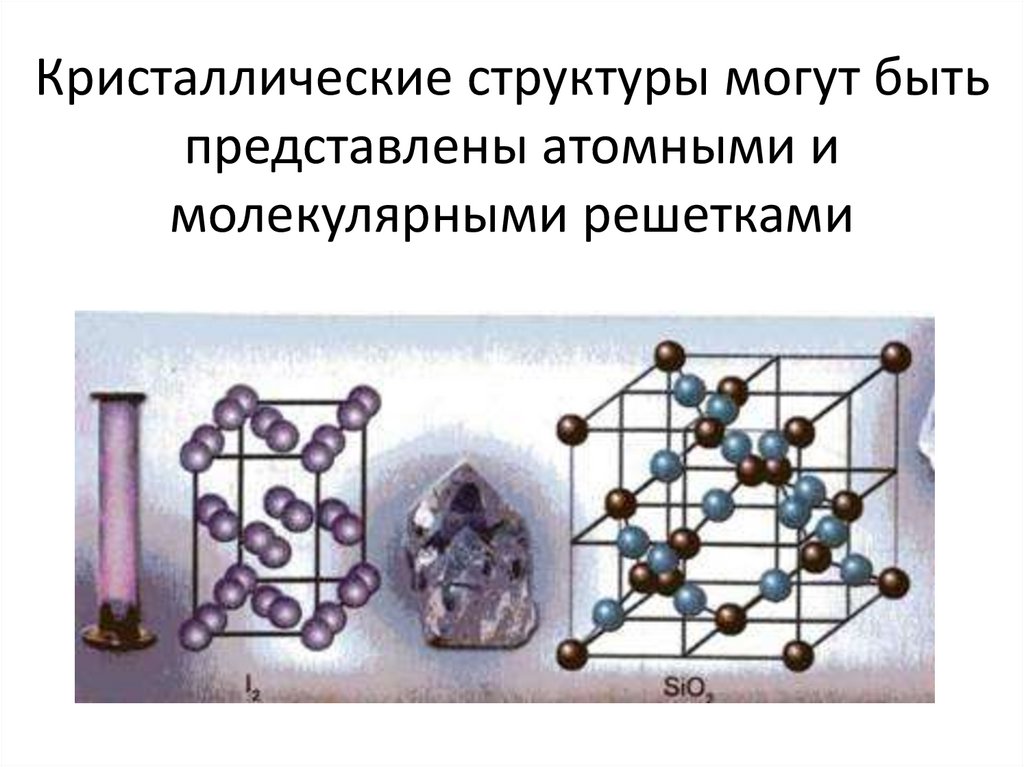
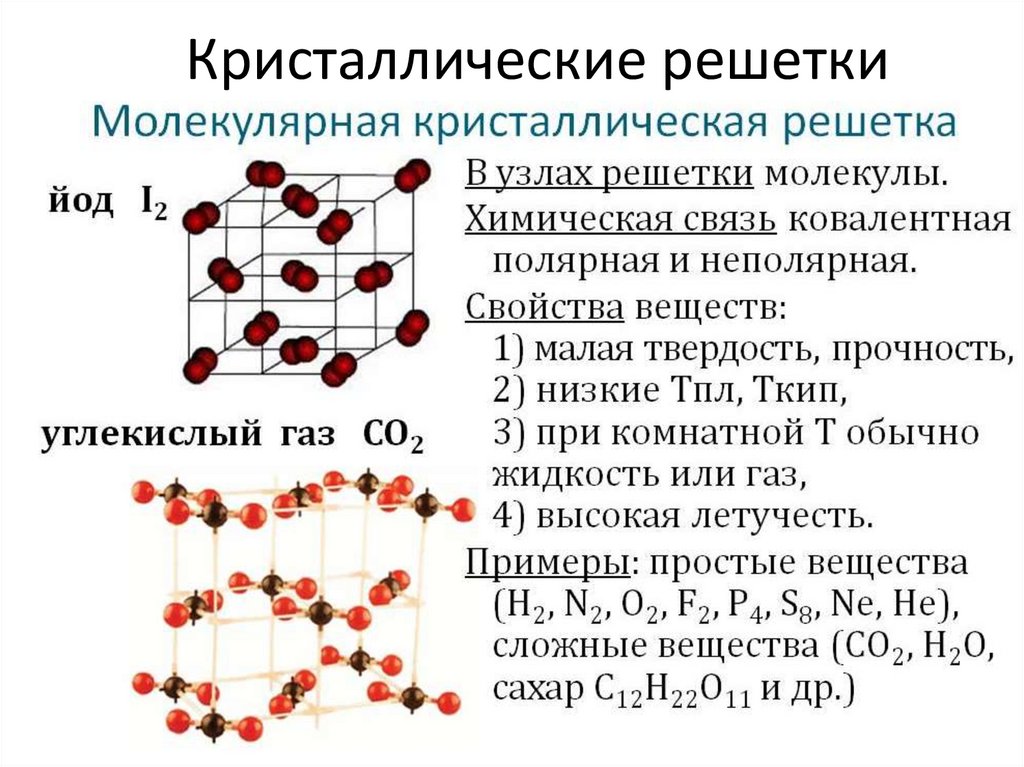
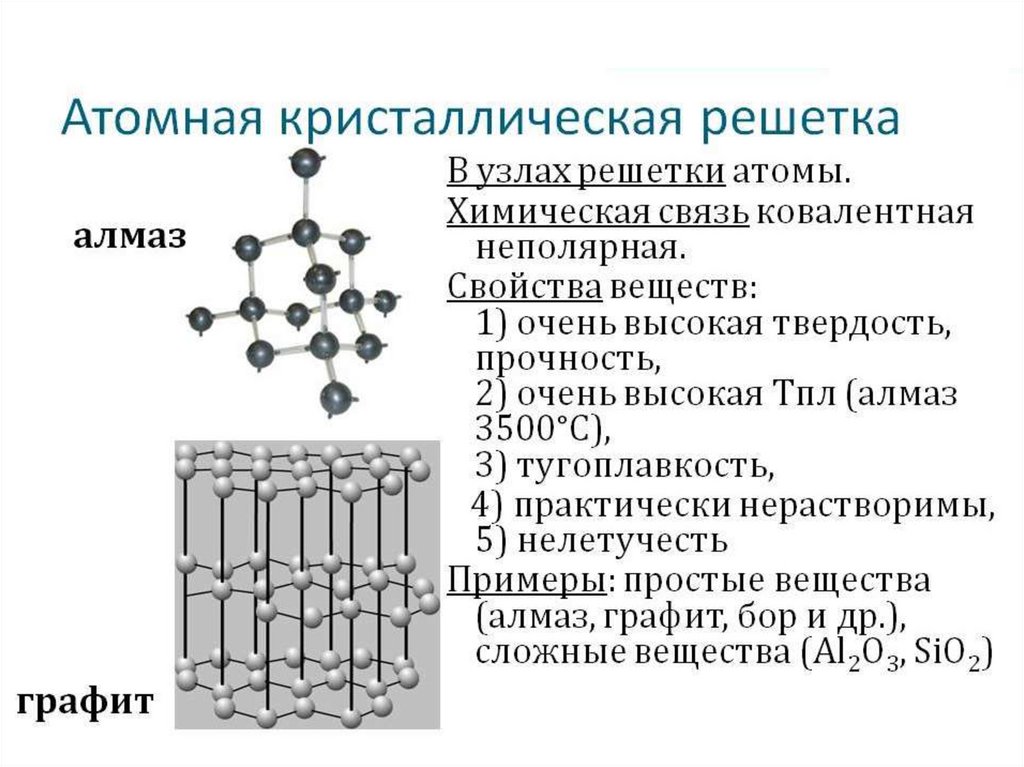
15. Кристаллические структуры могут быть представлены атомными и молекулярными решетками
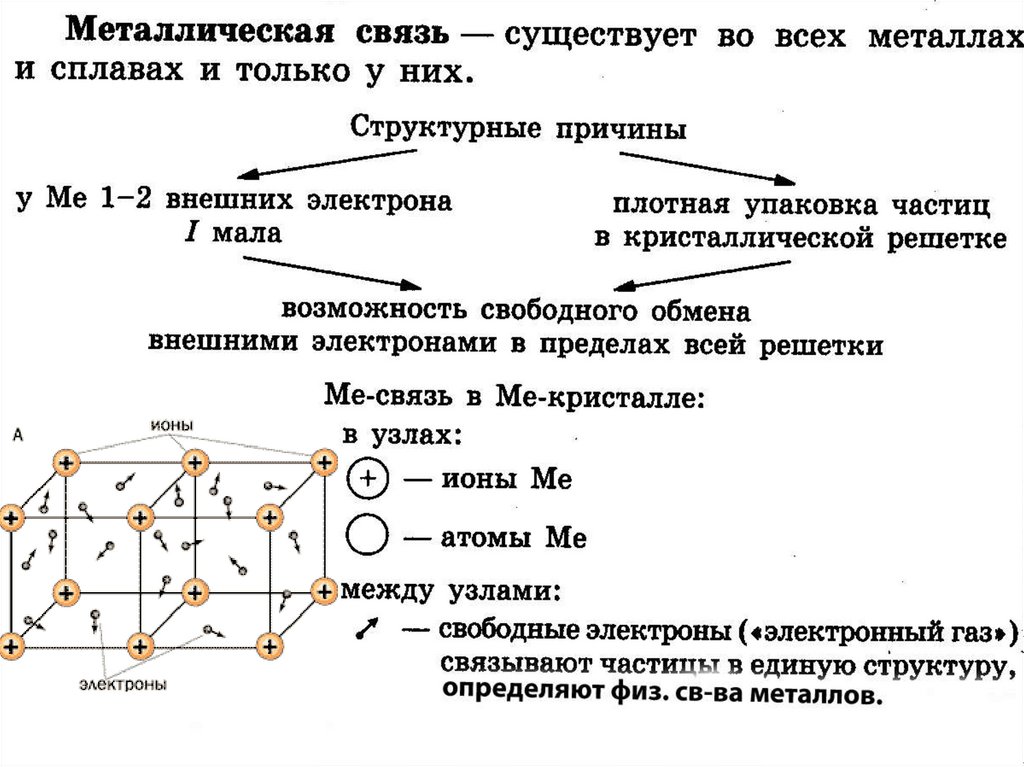
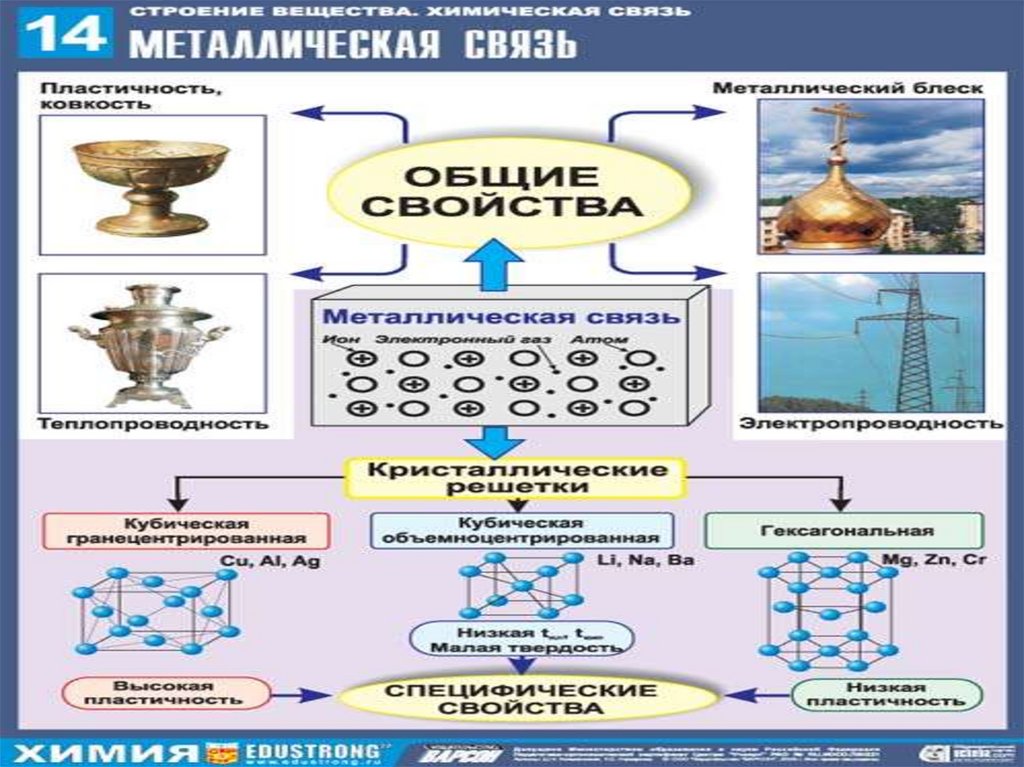
16. Кристаллические решетки
17.
18.
19.
20. Домашнее задание
Конспект в тетрадиОпределить тип химической связи:
К2О
CS2
Зарисовать схемы образования связи









 chemistry
chemistry








