Similar presentations:
Окислительно-восстновительные реакции
1.
2.
3.
Цель урока:1.Сформировать понятие об
окислительновосстановительных реакциях.
2.Научиться уравнивать записи
ОВР
методом электронного баланса.
4.
Вспомним …1.Валентность.
2.Степень окисления.
3.Восстановитель.
4.Окислитель.
5.Типы химических
реакций.
5.
6.
7.
8.
9.
10.
11.
Правила определения степеней окисленияСледует запомнить:
1.
2.
Степени окисления атомов в простых веществах равны нулю:
Na0; H20
Алгебраическая сумма степеней окисления всех атомов,
входящих в состав молекулы, всегда равна нулю
3. Постоянную степень окисления в сложных веществах имеют
атомы:
-щелочных металлов (+1)
K+1CI, Li+1NO3
-щелочноземельных металлов (+2) Ca+2CO3
-водорода (+1)
H2+1SO4
-кислорода (-2)
H2O-2
12.
Правила определения степеней окисления1.
2.
Степени окисления атомов в простых веществах равны
нулю:
Na0; H20
Алгебраическая сумма степеней окисления всех атомов,
входящих в состав молекулы, всегда равна нулю
3. Постоянную степень окисления в сложных веществах
имеют атомы:
-щелочных металлов (+1)
K+1CI, Li+1NO3
-щелочноземельных металлов (+2) Ca+2CO3
-водорода (+1)
H2+1SO4
-кислорода (-2)
H2O-2
13.
Расчет степени окисления1. Для веществ из двух элементов:
-поставить постоянную степень окисления CO-2
-рассчитать степень окисления другого элемента:
сумма степеней окисления должна быть равна 0,
поэтому степень окисления атома C также будет равна 2,
но иметь противоположный знак, т.е. +
-поставить вторую степень окисления
C+2O-2
-выполнить упражнения:
определить степени окисления элементов в следующих веществах
NaCI; CaBr2; MgO; H2S
14.
Расчет степени окисления2.Для веществ из трех и более элементов:
-поставить постоянные степени окисления
H+1MnO4-2
-рассчитать степень окисления марганца
сумма положительных степеней окисления равна 1
сумма отрицательных степеней окисления равна 8
так как эти суммы должны быть равны, то на атом марганца
приходится 7 положительных СО
-поставить рассчитанную степень окисления
H+1Mn+7O4-2
-выполнить упражнения:
определить степени окисления элементов в следующих
веществах
H2MnO4, H2SO4, HNO3, KCIO3
15.
Гимнастикадля глаз
16.
Зрительная гимнастикаТренажер Базарного В.Ф.
17.
18.
19.
20.
21.
22.
23.
Будьте здоровы!24.
25.
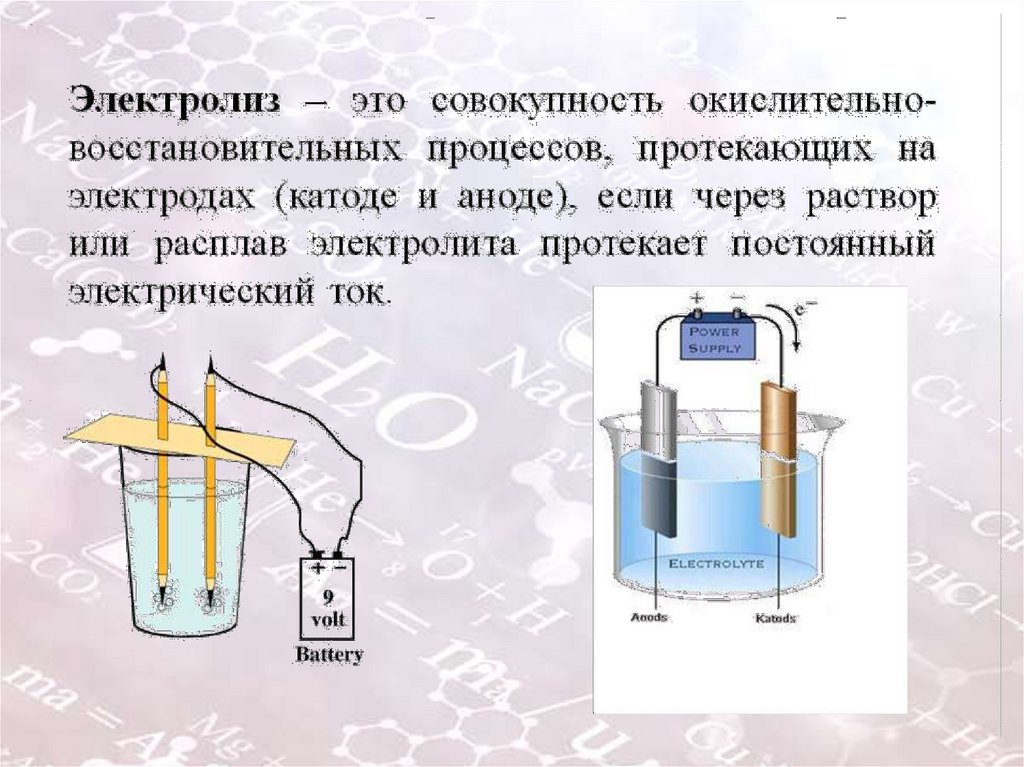
Цель:Сформировать представление учащихся об электролизе как
совокупности окислительно- восстановительного процессов.
.
Задачи:
1. Что такое электролиз. Процесс электролиза. Основные
закономерности протекания электролиза.
2. Правила написания электролиза. Разбор теории
электролиза.
3. Научиться применять полученные знания при решении
заданий ЕГЭ.
26.
27.
При растворении электролитов в воде происходитэлектролитическая диссоциация. Носителями зарядов в
водных растворах или расплавах электролитов являются
анионы (-) и катионы (+). Если сосуд с растворов
электролита включить в электрическую цепь, то анионы (-)
начнут двигаться к аноду (+), а катионы (+) – к катоду (-). В
результате установится электрический ток - направленное
движение заряженных частиц.
Такую проводимость называют ионной.
При ионной проводимости происхождение тока связанно с
переносом вещества. На электродах происходит выделение
веществ, входящих в состав электролитов. Электрод – это
проводник в виде пластинки, сетки, стержня, шара и т. д.,
через который электрический ток проходит в
жидкость или газ. Процесс выделения
на электроде вещества называют электролизом.
28.
29.
30.
Исследовал электролиз и открыл его законы английскийфизик Майкл Фарадей в 1834 году
Первый закон электролиза
Масса вещества, выделившегося на
электродах при электролизе, прямо
пропорциональна величине заряда,
прошедшего через электролит
k – электрохимический эквивалент вещества
(равен массе вещества, выделившегося при
прохождении через электролит заряда 1 Кл)
Майкл Фарадей (1791 – 1867)
Открыл явление электромагнитной
индукции, законы электролиза, ввел
представления об электрическом и
магнитном поле
m kq
k - электрохимический эквивалент (кг \ Кл)
Q – количество электричества (Кл)
31.
Второй закон электролизаПри одинаковом количестве электричества (электрическом заряде, прошедшем
через электролит) масса вещества, выделившегося при электролизе,
пропорциональна отношению молярной массы вещества к валентности
M- Молярная масса ( Г \ моль) n Валентность
F- Число Фарадея F= 96500 Кл \ моль
Заряд, необходимый для выделения 1 моля вещества,
одинаков для всех электролитов. Он называется
числом Фарадея F
F N A e 9.65 10 Кл / моль
4
32.
ПРИМЕНЕНИЕЭЛЕКТРОЛИЗА
Получение химически
чистых веществ
Гальваностегия
Гальванопластика
33.
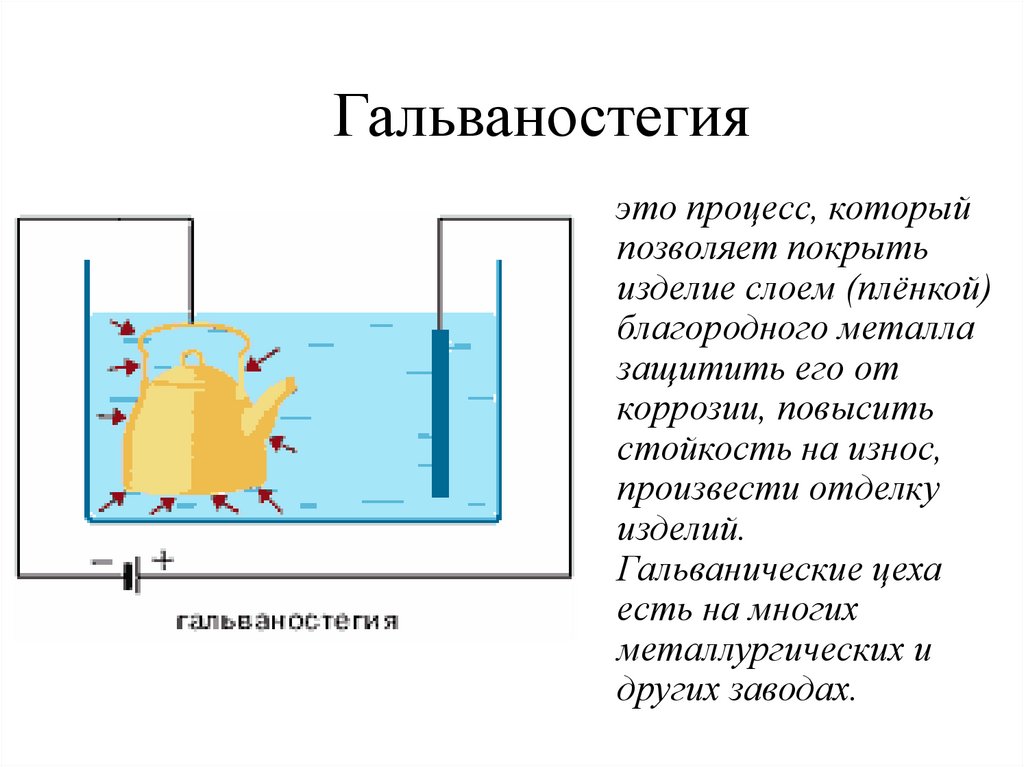
Гальваностегияэто процесс, который
позволяет покрыть
изделие слоем (плёнкой)
благородного металла
защитить его от
коррозии, повысить
стойкость на износ,
произвести отделку
изделий.
Гальванические цеха
есть на многих
металлургических и
других заводах.
34.
Покрытие предметов слоемблагородного металла
35.
ГАЛЬВАНОПЛАСТИКАэто получение электролитическим
способом более толстых отложений (до
нескольких миллиметров).
Копия барельефа,
полученная методом
гальванопластики
36.
• Изготовление медалей, монет.37.
38.
Добрый день, уважаемые студенты!Работы с домашним заданием по химии направлять до 14 ноября 2020г. на эл.
адрес: zavaylova.inna@kitnk.ru,отправлять на Вайбер, Ватцап контактный
телефон ( 89050721618 Солуянова Инна Валерьевна ) с обязательным
указанием Ф.И.О. студента +№ группы студента.
Вам необходимо согласно приложенного файла (презентация Рower Point –
Электролиз. оформить письменно подробный опорный конспект + оформить
домашнюю работу) . Материал сфотографировать и отравить на выше
представленные координаты.
С уважением, Солуянова И.В.
39.
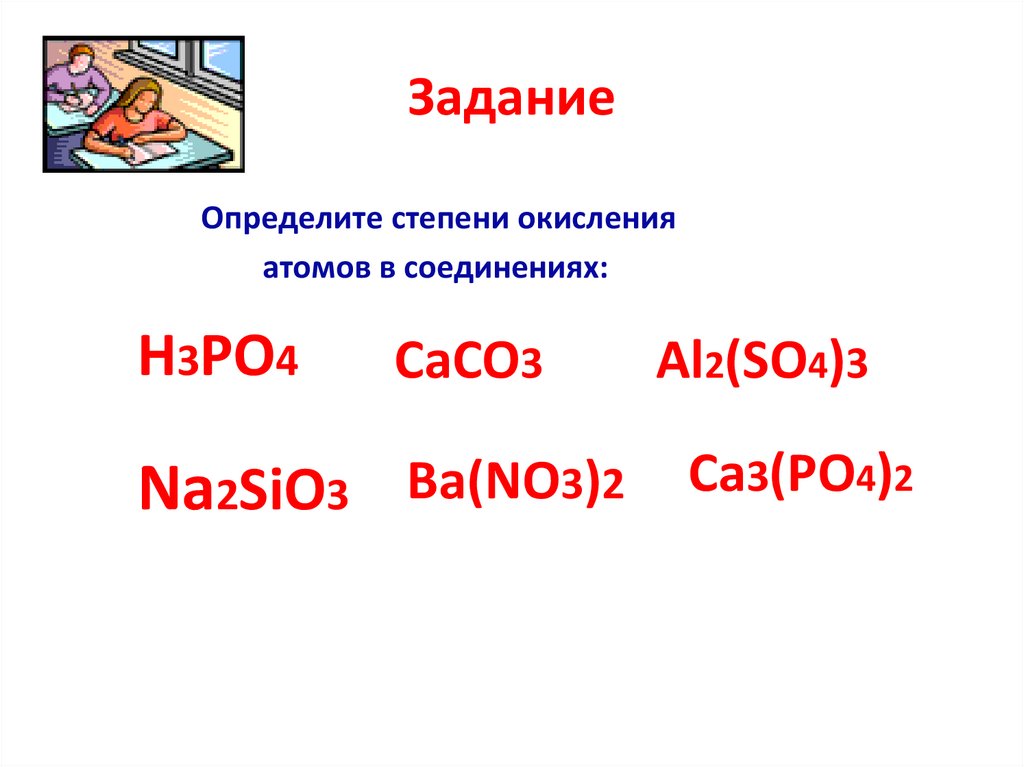
ЗаданиеОпределите степени окисления
атомов в соединениях:
Na2S , P2O5 , MgS , CO2, FeO
O2, Cl2 , K3P, NaCl , NH3, H2S
40.
ЗаданиеОпределите степени окисления
атомов в соединениях:
H3PO4
CaCO3
Al2(SO4)3
Na2SiO3 Ba(NO3)2 Ca3(PO4)2
41.
•Проверочный тест по теме «Электролиз».Задание 1. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора на
инертных электродах.
Формула вещества
Продукты электролиза
А) AlCl3
Б) RbOH
В) Hg(NO3)2
Г) AuCl3
1) металл, галоген
2) гидроксид металла, хлор, водород
3) металл, кислород
4) водород, галоген
5) водород, кислород
6) металл, кислота, кислород
В
А
Б
Г
Задание 2 Установите соответствие между формулой вещества и продуктом, который
образуется на инертном аноде в результате электролиза его водного раствора.
Формула вещества
Продукт электролиза
А) NiSO4
Б) NiCl 2
В) NiF 2
Г) K2S
1) Cl2
2) O2
3) H2
4) S
5) SO2
6) HF
А
Б
В
Г
Задание 3.Установите соответствие между металлом и способом его электролитического получения.
Металл
Электролиз
А) натрий
Б) алюминий
В) серебро
Г) медь
А
Б
1) водного раствора солей
2) водного раствора гидроксида
3) расплава поваренной соли
4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) расплавленного нитрата
В
Г
42.
СПАСИБО ЗА ВНИМАНИЕ!42
43.
Рефлексия.Если вы согласны с утверждениями,
поставьте плюс, а если нет, то
минус.
1. Я узнал много нового и интересного.
2. На все возникшие в ходе урока вопросы я
получил ответы.
3. Мне было интересно и комфортно.
4. Считаю, что работал добросовестно и
достиг цели урока.






































 chemistry
chemistry








