Similar presentations:
Непредельные углеводороды. Алкены
1.
Непредельныеуглеводороды.
Алкены
МАОУ СОШ «Финист»№30
г.Ростов-на-Дону
2.
Цели урокаизучить способы
получения,
химические свойства
применение алкенов
на примере непредельного
углеводорода - этилена
3.
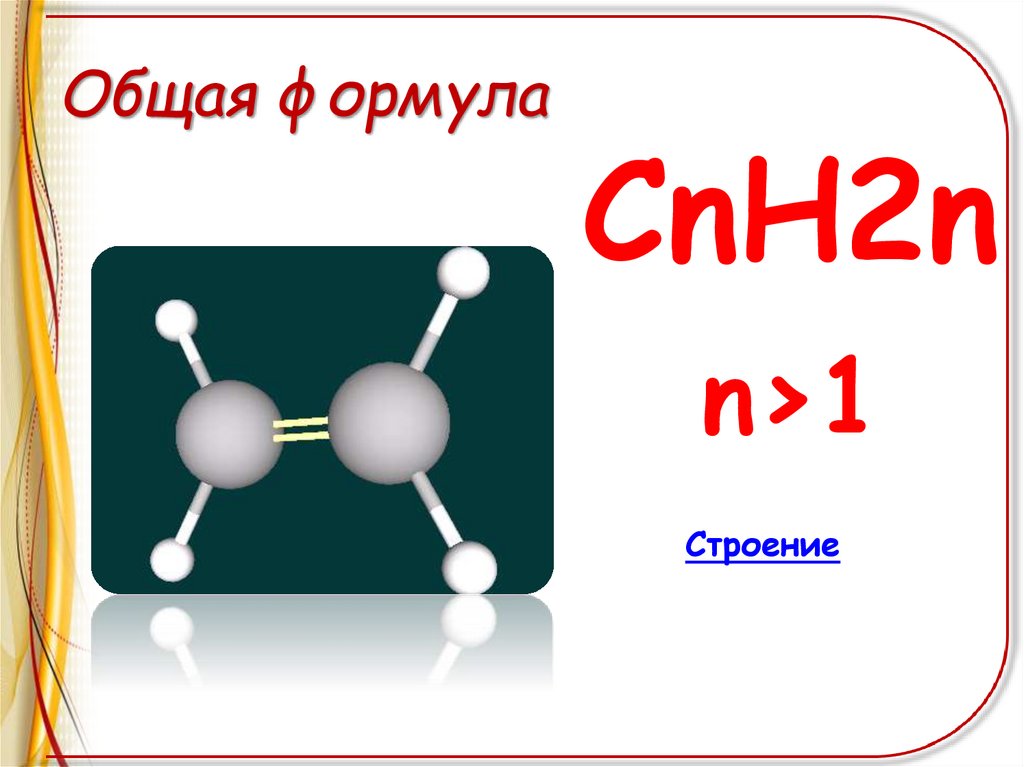
Общая формулаСnH2n
n>1
Строение
4.
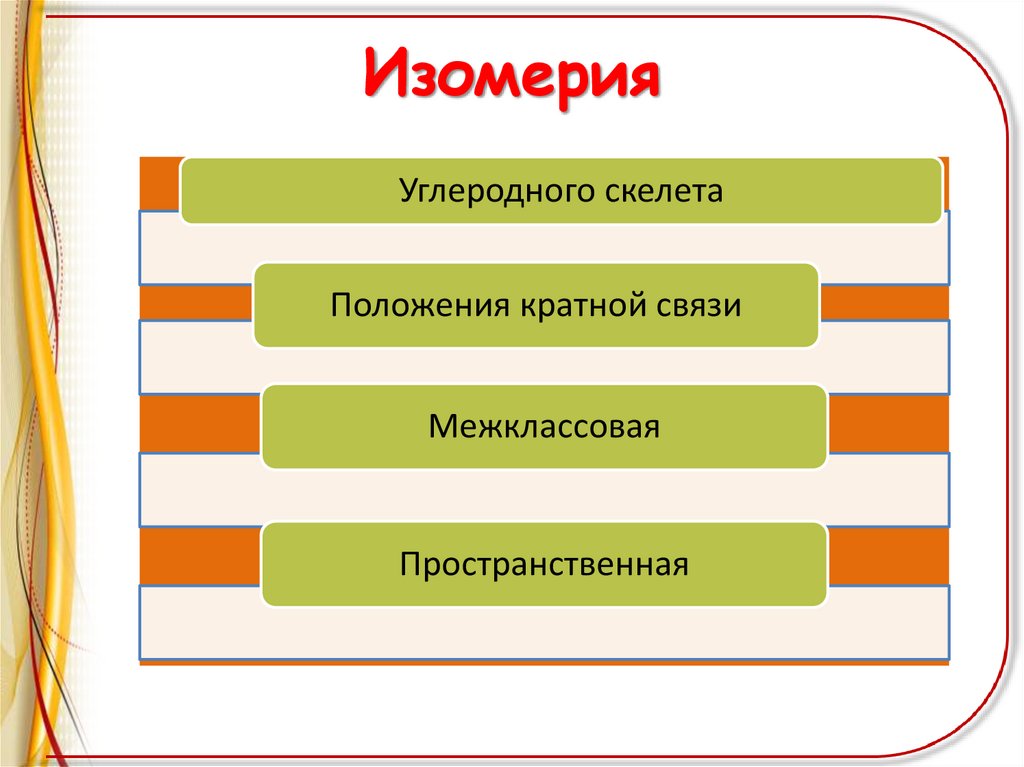
ИзомерияУглеродного скелета
Положения кратной связи
Межклассовая
Пространственная
5.
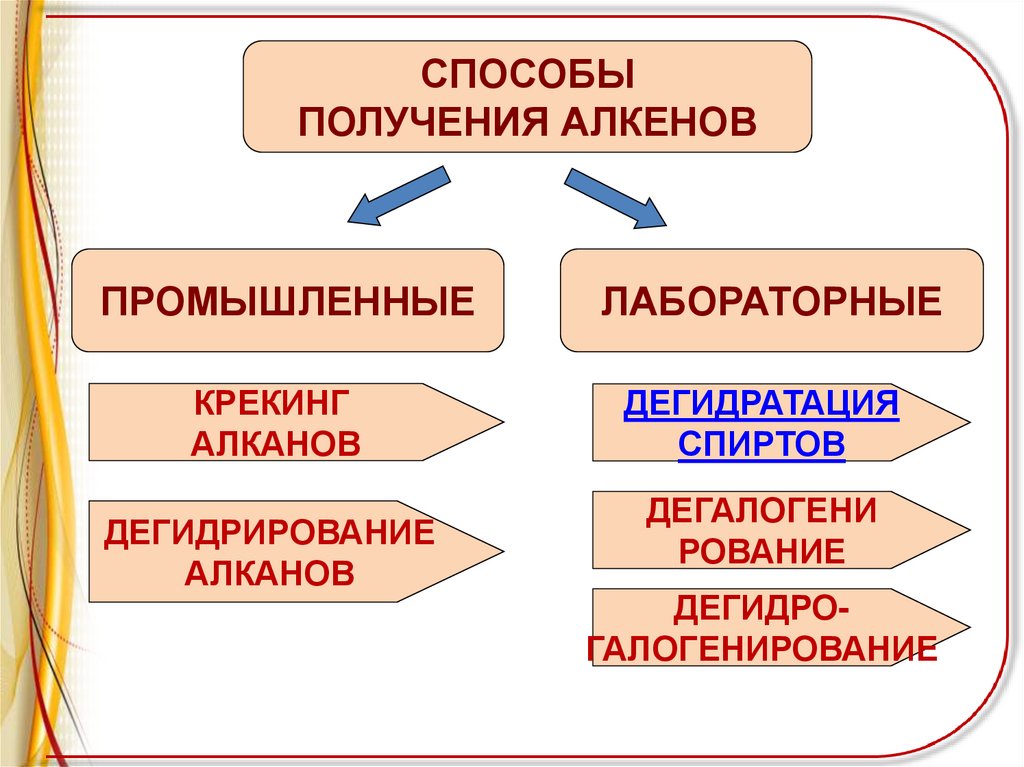
СПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВ
ПРОМЫШЛЕННЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ЛАБОРАТОРНЫЕ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
6.
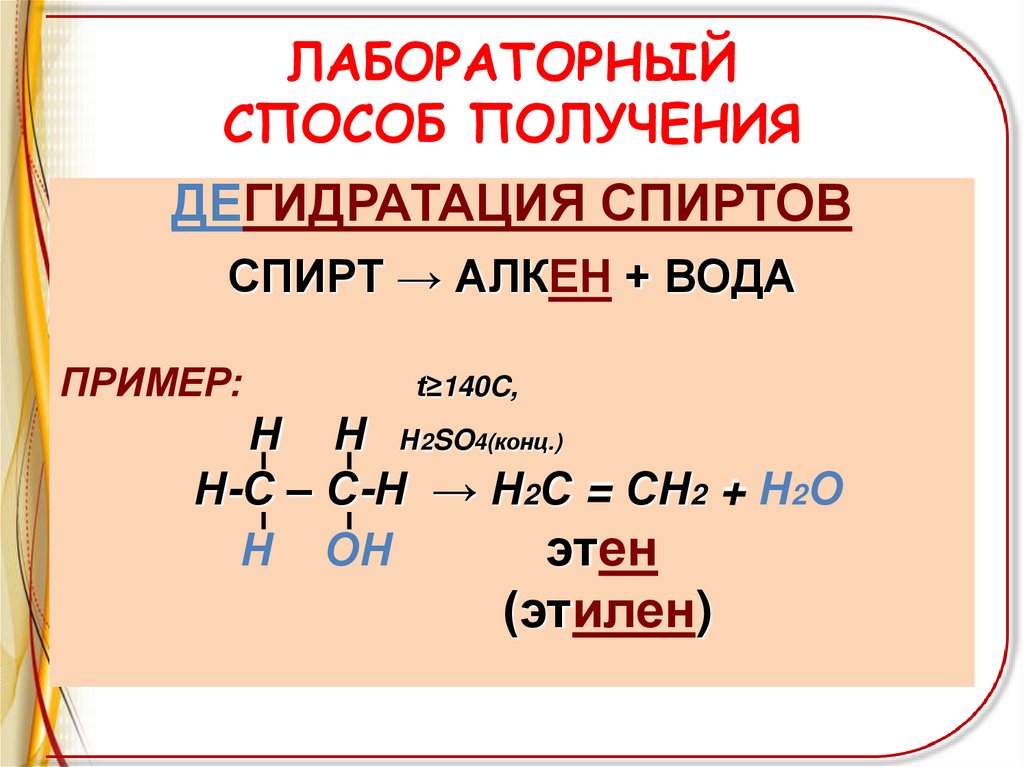
ЛАБОРАТОРНЫЙСПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР:
t≥140C,
Н Н Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН
этен
(этилен)
7.
Получение алкеновКРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ
С МЕНЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
ЦЕПЬЮ
ПРИМЕР:
С 10
t=400-700C
Н 22→ С5Н 12+ С5Н10
декан
пентан
пентен
8.
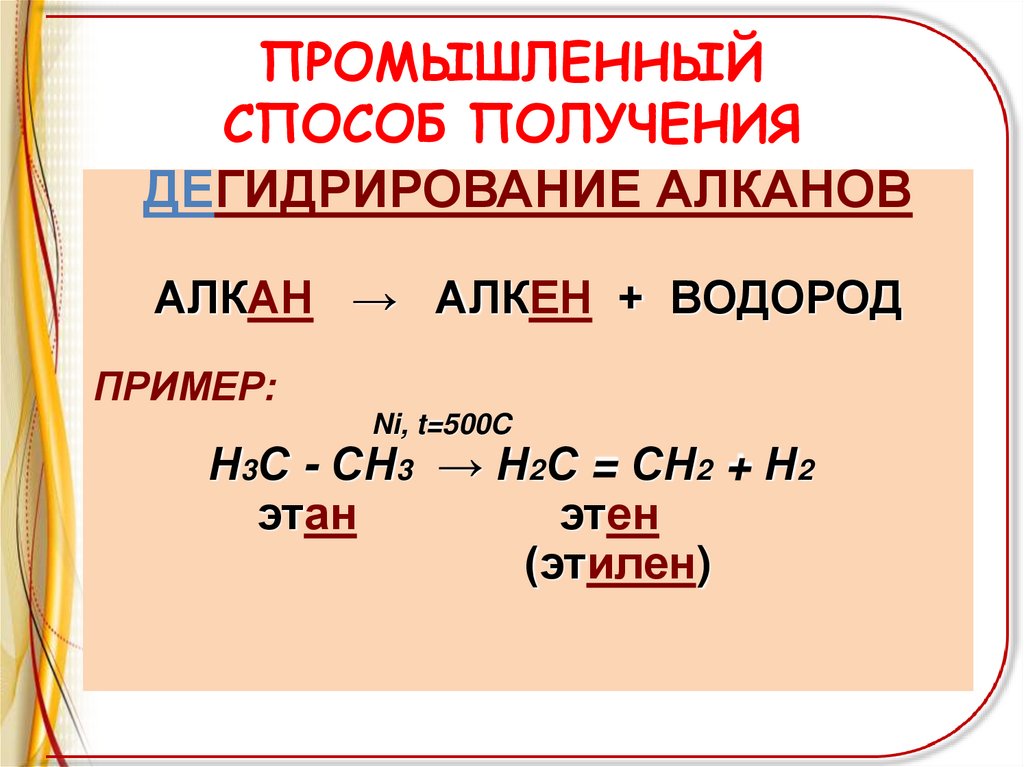
ПРОМЫШЛЕННЫЙСПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
этан
этен
(этилен)
9.
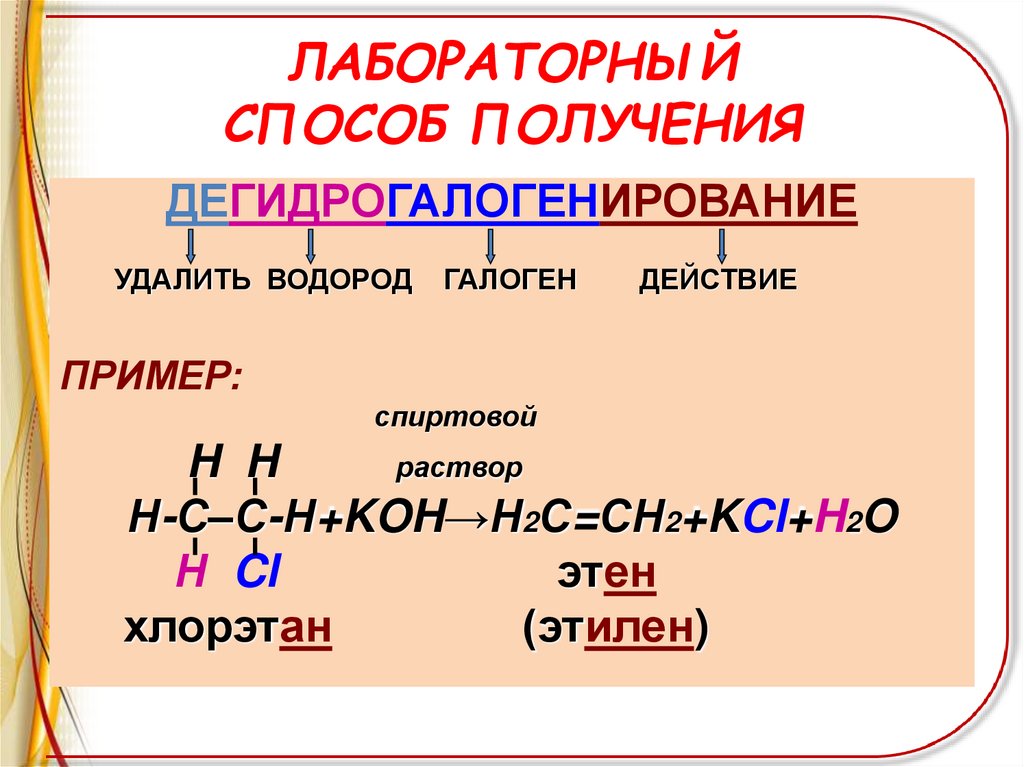
ЛАБОРАТОРНЫЙСПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД
ГАЛОГЕН
ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H
раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н Cl
этен
хлорэтан
(этилен)
10.
РЕАКЦИИ ОКИСЛЕНИЯГОРЕНИЕ АЛКЕНОВ
ПРИМЕР:
С2Н4 + 3О2
2СО2 + 2Н2О
11.
РЕАКЦИИ ОКИСЛЕНИЯМЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С
РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O H2C - CH2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность
углеводорода – на кратную связь
12.
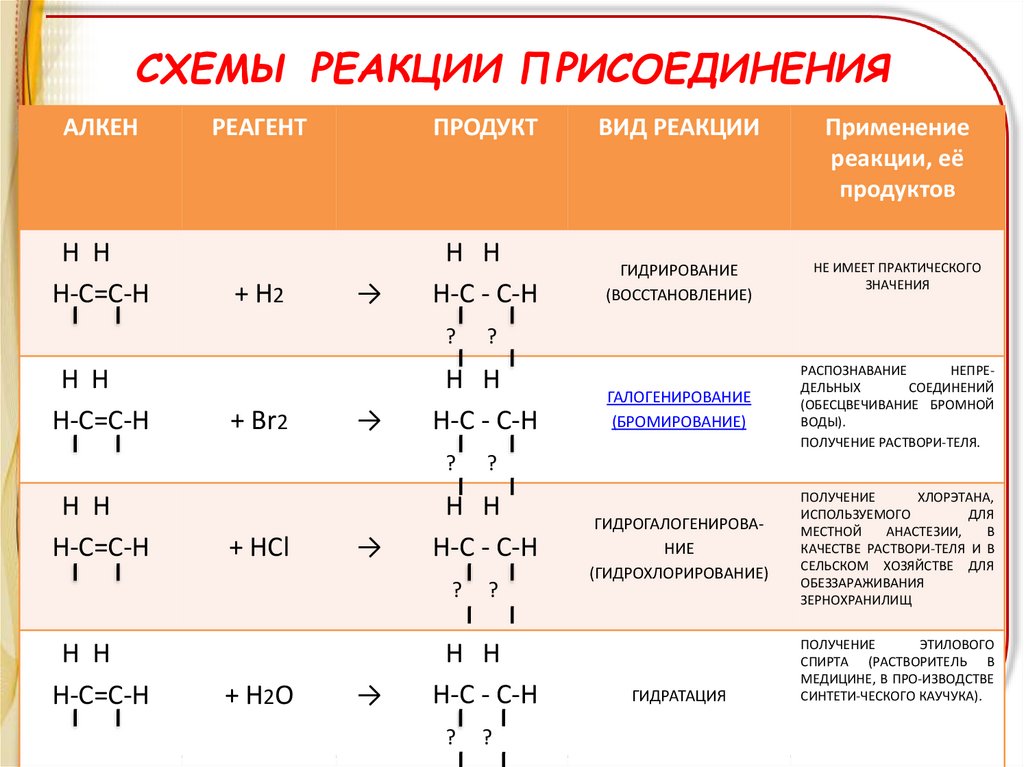
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯАЛКЕН
Н Н
Н-С=С-Н
РЕАГЕНТ
ПРОДУКТ
ВИД РЕАКЦИИ
Применение
реакции, её
продуктов
+ Н2
Н Н
Н-С - С-Н
ГИДРИРОВАНИЕ
(ВОССТАНОВЛЕНИЕ)
НЕ ИМЕЕТ ПРАКТИЧЕСКОГО
ЗНАЧЕНИЯ
ГАЛОГЕНИРОВАНИЕ
(БРОМИРОВАНИЕ)
РАСПОЗНАВАНИЕ
НЕПРЕДЕЛЬНЫХ
СОЕДИНЕНИЙ
(ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ
ВОДЫ).
ПОЛУЧЕНИЕ РАСТВОРИ-ТЕЛЯ.
ГИДРОГАЛОГЕНИРОВАНИЕ
(ГИДРОХЛОРИРОВАНИЕ)
ПОЛУЧЕНИЕ
ХЛОРЭТАНА,
ИСПОЛЬЗУЕМОГО
ДЛЯ
МЕСТНОЙ
АНАСТЕЗИИ,
В
КАЧЕСТВЕ РАСТВОРИ-ТЕЛЯ И В
СЕЛЬСКОМ ХОЗЯЙСТВЕ ДЛЯ
ОБЕЗЗАРАЖИВАНИЯ
ЗЕРНОХРАНИЛИЩ
→
?
Н Н
Н-С=С-Н
+ Br2
→
Н Н
Н-С - С-Н
?
Н Н
Н-С=С-Н
+ HCl
→
+ H2O
→
?
Н Н
Н-С - С-Н
?
Н Н
Н-С=С-Н
?
?
Н Н
Н-С - С-Н
?
?
ГИДРАТАЦИЯ
ПОЛУЧЕНИЕ
ЭТИЛОВОГО
СПИРТА (РАСТВОРИТЕЛЬ В
МЕДИЦИНЕ, В ПРО-ИЗВОДСТВЕ
СИНТЕТИ-ЧЕСКОГО КАУЧУКА).
13.
РЕАКЦИЯ ПОЛИМЕРИЗАЦИИЭто процесс соединения
молекул в более крупные.
ПРИМЕР:
n CH2=CH2
этилен
(мономер)
одинаковых
(-CH2-CH2-)n
полиэтилен
(полимер)
n – степень полимеризации, показывает
число молекул, вступивших в реакцию
-CH2-CH2- структурное звено
14.
Домашнее задание§ 4,
упр. 4, 7, 8







 chemistry
chemistry








