Similar presentations:
Катализ
1.
КАТАЛИЗ2.
Что такое катализатор и каталитическиереакции?
Демонстрационный опыт
3.
Это надознать
Катализат
Катализ
(от греч.
сatalysis –
разрушение) –
изменение
скорости
химической
реакции при
воздействии
веществ
оры
это
вещества,
повышающ
ие скорость
химических
реакций, но
состав и
количество
4.
12
1
3
18
1
9
18
18 9
1
1
1
9
3
2
5.
Это надоПромото
Ингибито
знать
ры
Вещества,
замедляющие
скорость
химических
реакций, но состав
и количество
которых в конце
реакции остаётся
неизменным
ры
Вещества, которые сами
по себе не обладают
каталитической
активностью, но, будучи
добавленными к
катализатору,
значительно повышают
его действие
6.
Видыкатализа
ГЕТЕРОГЕ
ГОМОГЕНН
ЫЙ
Катализ, при
котором катализатор
и реагируемые
вещества находятся
в одной фазе.
2SO2 N
+ O2
Oг3
2 SO
ННЫЙ
Катализ, при котором
реагируемые
вещества и
катализатор
находятся в разных
фазах
2SO2V+
O
O
2 5 2
2 (тв)
SO3
7.
Наблюдаем изапоминаем…
Гомогенный
катализ
Демонстрацион
Гетерогенный катализ
Демонстрацион
8.
Экспериментируеми запоминаем…
Полученный раствор
К
3
мл
воды
В
две
другие
разлить на 2 пробирки
пробирки
наливаем
добавить
Каплю тиосульфат
натрия Na2S2O3 , а в одну
роданида
калия
Каплю
хлорида
Далее
из них приливаем
добавляем к2
KNCS
тиосульфату
натрия
железа
(III)
FeCl3(II)
капли сульфата
меди
роданид железа (III).
Наблюдаем, что
исчезновение окраски
происходит с разной
скоростью.
9.
Экспериментируеми запоминаем…
Наливаем в две пробирки по 2 мл
В
обе пробирки
кладем
раствора
сульфата
медипо
(II)
В
одну из
них добавляем несколько
грануле
алюминия
кристаллов хлорида натрия
10.
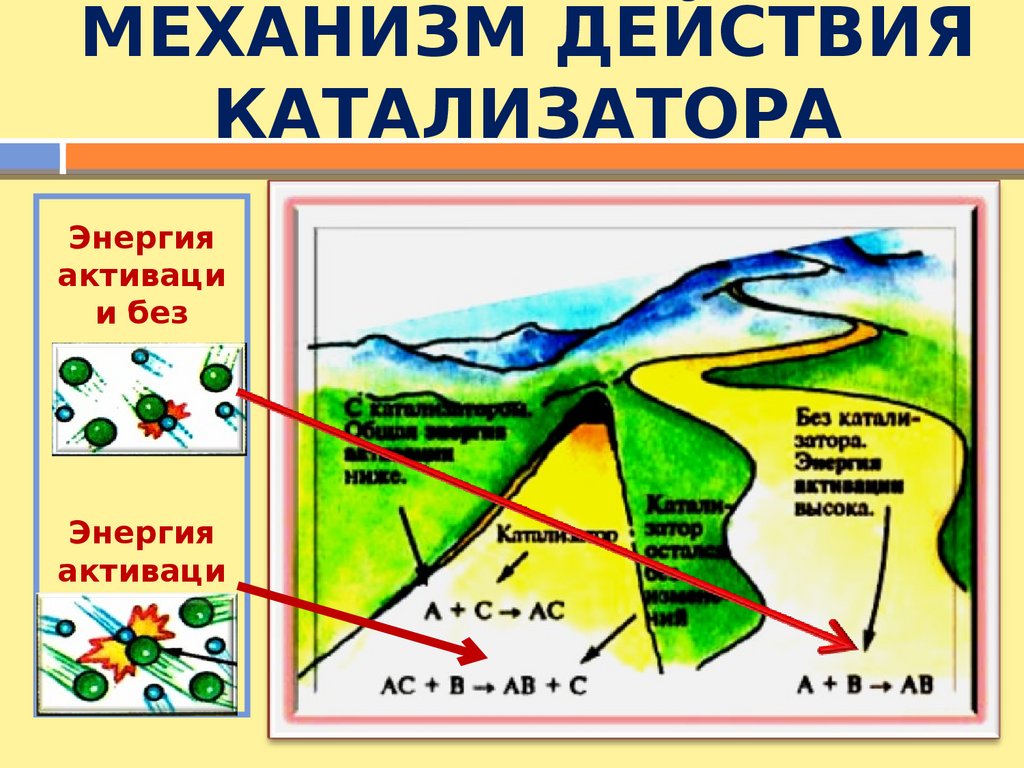
МЕХАНИЗМ ДЕЙСТВИЯКАТАЛИЗАТОРА
Энергия
активаци
и без
катализа
тора
Энергия
активаци
ис
катализа
тора
11.
Свойствакатализаторов
2.
Для
обратимых
1.
Катализаторы
3.
Катализатор
4. Катализаторы
реакций
не
создают
снижает
обладают
катализаторы
не
процесса,
а
необходимую
для
избирательностью,
смещают
т.е. ускоряют
только
изменяют
реакции
энергию
равновесие,
а
лишь
только
одну из
его
скорость;
активации,
ускоряют
процесс
нескольких
предоставляя
достижения
реакций.
реагентам
равновесного
12.
Селективностькатализатора
Способность ускорять одну из возможных при
данных условиях параллельных реакций.
Благодаря этому можно, применяя различные
катализаторы, из одних и тех же исходных
веществ получать различные продукты:
реагент катализат
ы
ор
Со, Ni. Ru
СО +
Fe
продукты
Алканы
(преимущественн
о)
Алкены
(преимущественн
о)
13.
Биологическиекатализаторы
• Строгая
1.
2.
избирательнос
ть
• Высокая
скорость
Вареная
Морковны
14.
Значениекатализа
ю катализатора многие полезные и
превратить
в
полезные
синт
15.
Значениекатализа
Производство твёрдых жиров,
например маргарина, из
16.
Значениекатализа
В хлебопечении большое
значение имеет фермент
амилаза, расщепляющий
17.
№Веществ Катализата,
вступаю
щие в
реакцию
1 Алюминий и
йод
2
3
Пероксид
водорода
ор
Вид
катали
за
Уравнение
химической
реакции
Вода
Гетерогенный
2Al +3 I2 = 2 AlI3
Тетраамминмеди
(II)
Гомогенный
2Н2О2 = 2Н2О +О2
Гетерогенный
4NH3 +5O2=4NO + 6H2O
Гомогенный
2Fe(NCS)3+Na2S2O3=
=2Fe(NCS)2+2NaNCS+Na2S4O8
Гетерогенный
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Аммиак и
Оксид хрома
кислород
(III)
Роданид
4
железа (III) и Сульфат меди
тиосульфат
(II)
натрия
5 Алюминий и
сульфат меди Хлорид натрия
(II)
18.
СИНКВЕЙНКАТАЛИЗ
ГОМОГЕННЫЙ,
ГЕТЕРОГЕННЫЙ
РАЗРУШАЕТ,
УСКОРЯЕТ,
Нормальные
герои
ВПЕЧАТЛЯЕТ
всегда
идут в обход
ЧУДО
















 chemistry
chemistry








