Similar presentations:
Классы неорганических соединений
1. Классы неорганических соединений
12.
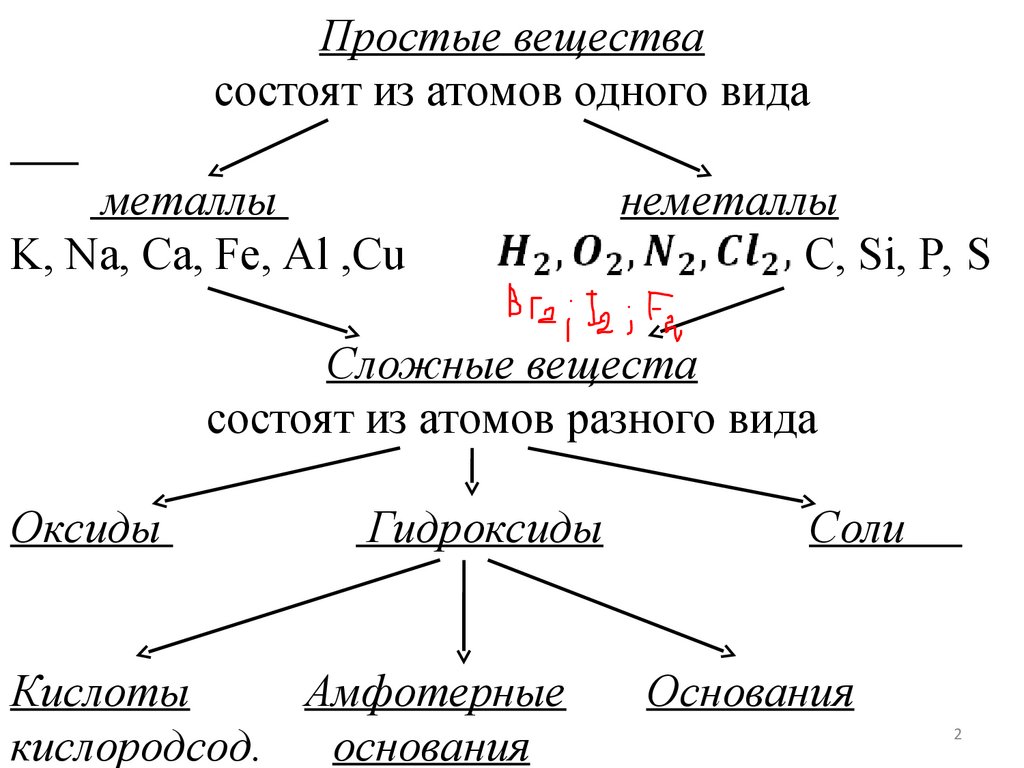
Простые веществасостоят из атомов одного вида
металлы
K, Na, Ca, Fe, Al ,Cu
неметаллы
C, Si, P, S
Сложные вещеста
состоят из атомов разного вида
Оксиды
Гидроксиды
Кислоты
Амфотерные
кислородсод.
основания
Соли
Основания
2
3.
ОКСИДЫ -это сложные вещества, состоящие из двухэлементов, один из которых кислород в степени
окисления -2.
Несолеобразующие – оксиды, которые не
образуют солей, т.к. не реагируют ни с кислотами,
ни со щелочами:
.
cолеобразующие – оксиды, которые образуют
соли при взаимодействии с кислотами или
основаниями.
3
4.
- кислотные -,CrO3,
- амфотерные – BeO,
- основные -
MnO
Существуют двойные (смешанные) оксиды –
содержащие атомы элемента в различных степенях
окисления :
- оксид железа ( II, III ) -
4
5.
Кислотные оксиды- оксиды, которым соответствуют кислоты,
большинство из которых могут быть получены при
взаимодействии этих оксидов с водой.
5
6.
Некоторые оксиды, в которых атомы неметалланаходятся в неустойчивой, нехарактерной им
промежуточной степени окисления, при
взаимодействии с
в результате реакции
диспропорционирования могут образовать
одновременно 2 кислоты:
6
7.
Амфотерные оксиды- оксиды, которым соответствуют амфотерные
основания.
Амфотерность – двойственность.
Амфотерные оксиды в зависимости от условий
могут проявлять свойства как кислотных, так и
основных оксидов.
7
8.
Основные оксиды- оксиды, которым соответствуют основания.
При взаимодействии оксидов щелочных и
щелочноземельных металлов (Li, Na, K, Ca, Ba) с
водой образуются щелочи – растворимые в воде
основания.
8
9.
Кислоты- это сложные вещества, состоящие из атомов
водорода, которые способны замещаться на атомы
металла, и кислотного остатка.
Основность кислоты определяется числом атомов
водорода в молекуле кислоты.
Одноосновные: HCI , HBr,
Двухосновные:
,
Трехосновные:
H+CIˉ - хлороводородная - сероводородная
- сернистая -
CIˉ - хлорид
- сульфид
- сульфит
9
10.
- серная- ортофосфорная - азотистая
- азотная
- угольная
- кремниевая - марганцовая перманганат
- хромовая
- хлорноватистая - хлорноватая
- хлорная
- муравьиная
- уксусная
-
- сульфат
- фосфат
- нитрит
- нитрат
- карбонат
- силикат
- хромат
-гипохлорит
- хлорат
- перхлорат
- формиат
- ацетат
10
11.
Основания- это сложные вещества, состоящие из атомов
металла и одной или нескольких гидроксогрупп.
ОНˉ - гидроксогруппа
-
гидроксид натрия
гидроксид железа (II)
гидроксид магния
гидроксид аммония
Кислотность основания определяется числом
гидроксогрупп.
11
12.
Амфотерные гидроксиды-это сложные вещества, имеющие свойства как
кислот, так и оснований.
Формулы амфотерных гидроксидов можно
записывать как в форме оснований, так и в форме
кислот.
- цинковая кислота
12
13.
- ортоалюминиевая кислота- ортоалюминат
- ортоалюминат натрия
- метаалюминиевая кислота
- метаалюминат натрия
- ортохромистая кислота
- метахромистая кислота
- хромит натрия
13
14.
Соли- это сложные вещества, состоящие из атомов
металла (ионов аммония) и кислотного остатка.
Средние соли
- это продукты полного замещения атомов
водорода в кислоте на атомы металла или
гидроксогрупп основания на кислотные остатки.
- сульфат железа (II)
- cульфат железа (III)
- нитрат аммония
- фосфат натрия
14
15.
Кислые соли- это продукты неполного замещения водорода в
многоосновной кислоте на атомы металла.
- гидрокарбонат натрия
- дигидрофосфат калия
- гидрофосфат калия
Основные соли
- это продукты неполного замещения
гидроксогрупп в многокислотном основании на
кислотный остаток.
- карбонат гидроксомеди (II)
(гидроксокарбонат меди (II))
16.
Спасибоза
вниманиие.
16















 chemistry
chemistry








