Similar presentations:
Электрохимия. Гальванические цепи. (Лекция 6.2)
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Гальванические цепи
1.Потенциометрическое титрование.
2.Направление окислительновосстановительных процессов.
Лектор: Степанова Ирина Петровна,
доктор биологических наук, профессор,
зав. кафедрой химии
2.
Потенциометрический метод анализаПотенциометрический метод анализа
основан на использовании зависимости
ЭДС электрохимической цепи
от активности анализируемого иона.
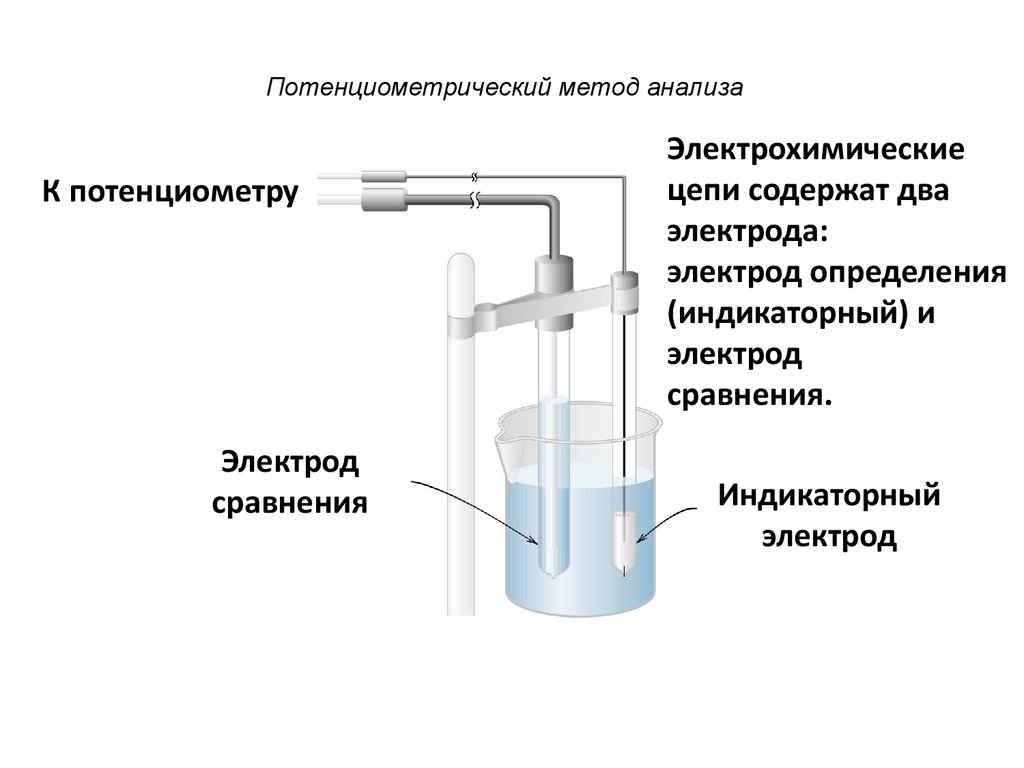
3. Потенциометрический метод анализа
К потенциометруЭлектрод
сравнения
Электрохимические
цепи содержат два
электрода:
электрод определения
(индикаторный) и
электрод
сравнения.
Индикаторный
электрод
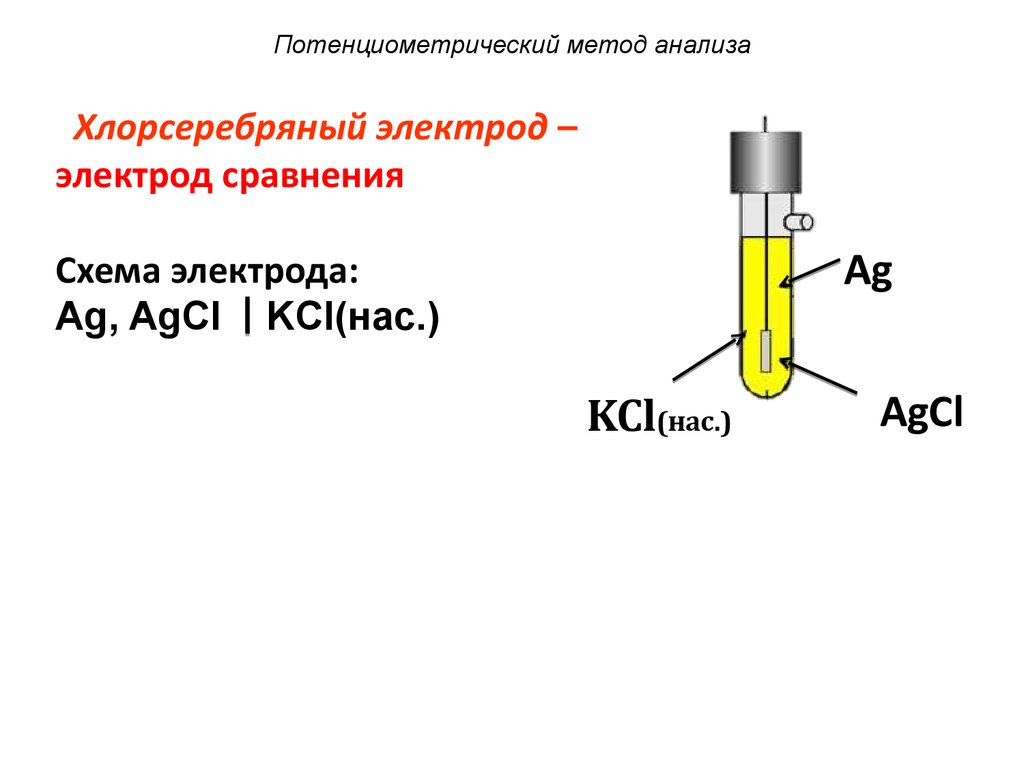
4. Потенциометрический метод анализа
Хлорсеребряный электрод –электрод сравнения
Ag
Схема электрода:
Ag, AgCl KCl(нас.)
KCl(нас.)
AgCl
5.
Потенциометрический метод анализаБуферный раствор
Стеклянная
мембрана
Хлорсеребряный
электрод
6.
Потенциометрический метод анализа7. Потенциометрический метод анализа
Виды потенциометрического анализа:- прямая потенциометрия, или ионометрия;
- потенциометрическое титрование.
Метод прямой потенциометрии основан
на определении концентрации иона
непосредственно по измеренной ЭДС
электрохимической цепи.
8. Потенциометрический метод анализа
Потенциометрическое титрованиеосновано
на
определении
точки
эквивалентности по резкому изменению в
ней ЭДС электрохимической цепи.
Техника титрования:
заполнение кончика
бюретки
9. Потенциометрический метод анализа
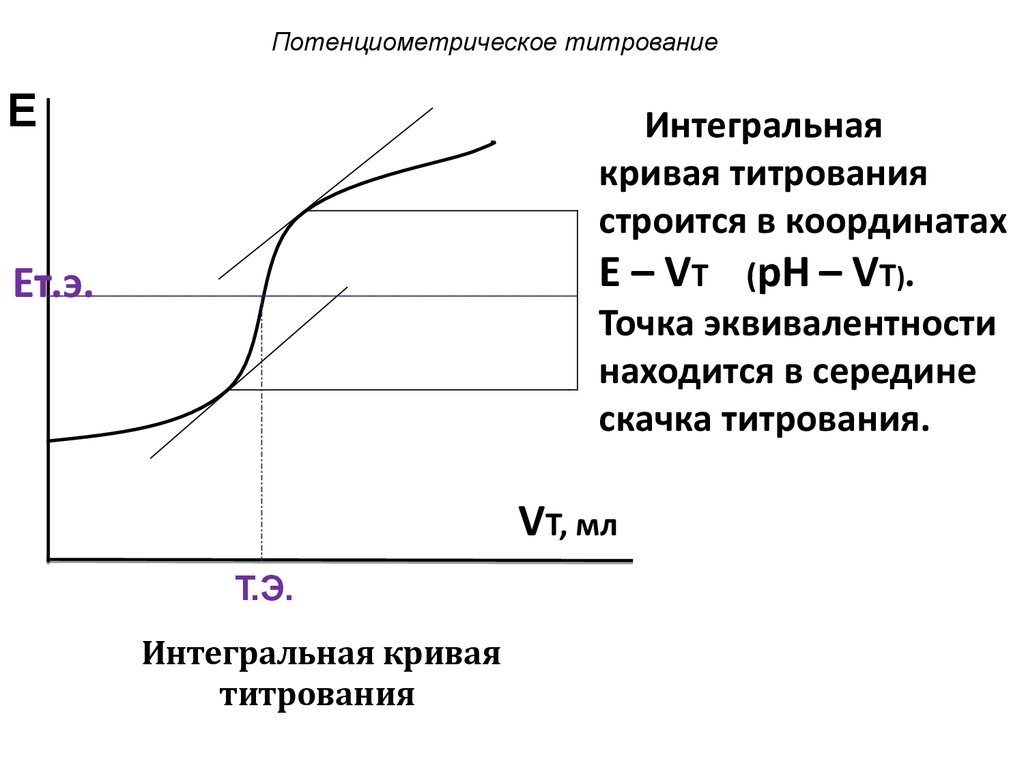
Техника титрования10. Потенциометрическое титрование
EИнтегральная
кривая титрования
строится в координатах
E – VТ (pH – VТ).
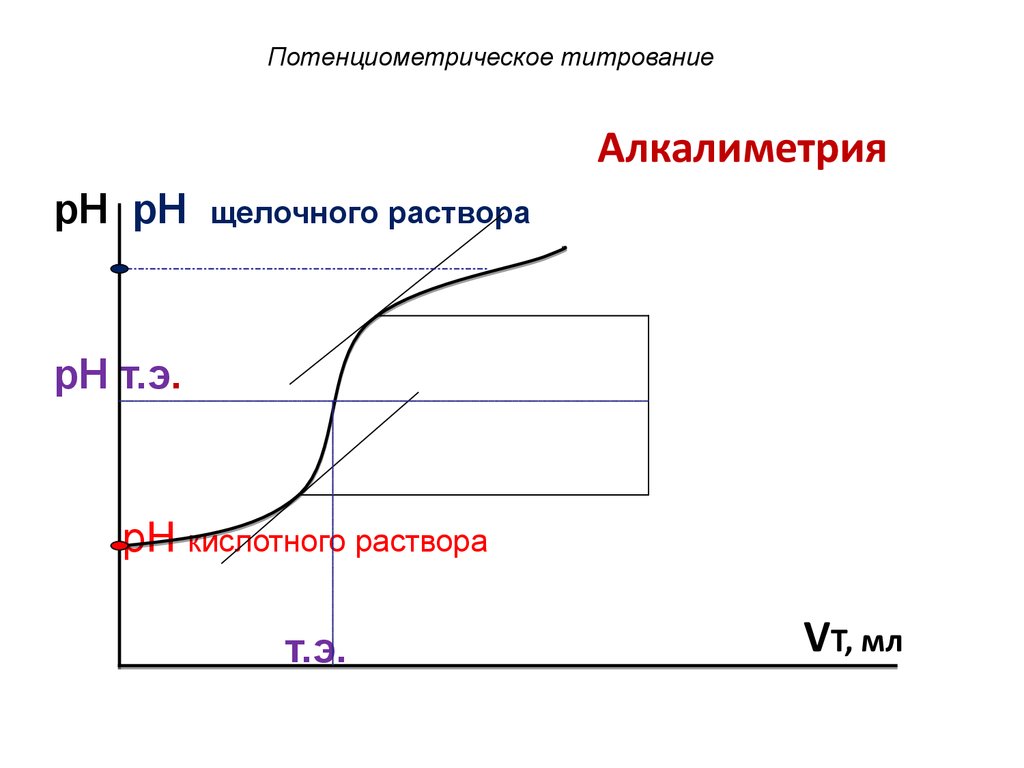
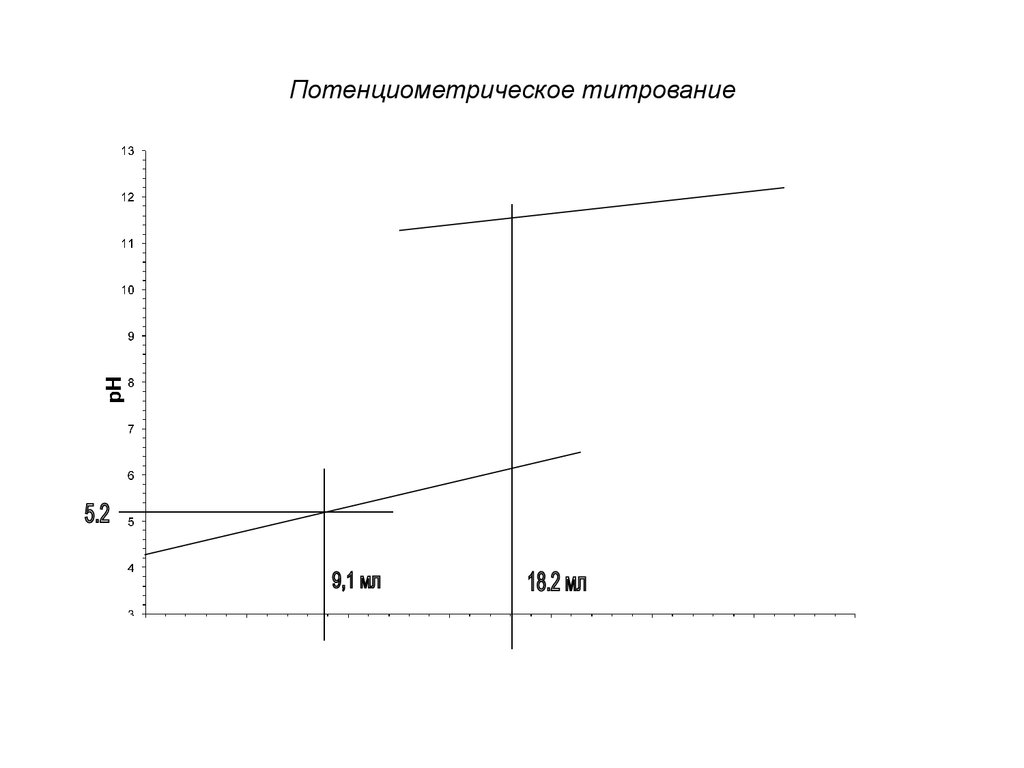
Точка эквивалентности
находится в середине
скачка титрования.
Eт.э.
VT, мл
Т.Э.
Интегральная кривая
титрования
11. Потенциометрическое титрование
АлкалиметрияpH pH
щелочного раствора
pH т.э.
pH кислотного раствора
т.э.
VT, мл
12. Потенциометрическое титрование
Построение интегральной кривой13. Потенциометрическое титрование
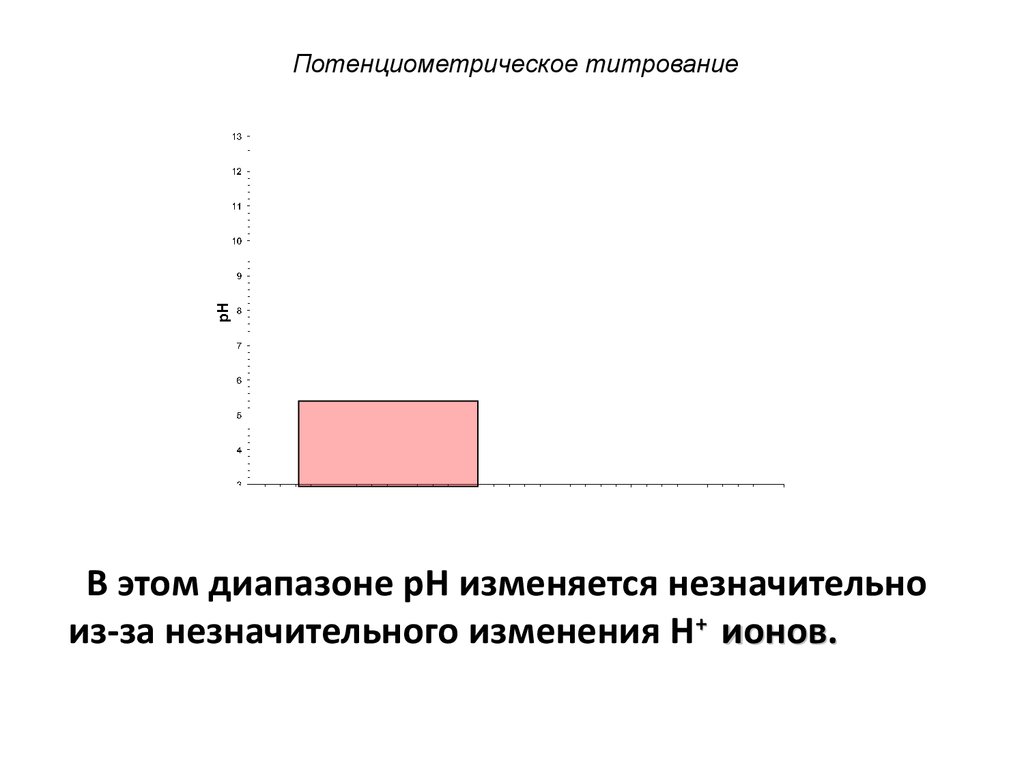
В этом диапазоне pH изменяется незначительноиз-за незначительного изменения H+ ионов.
14. Потенциометрическое титрование
В этом диапазоне pH изменяется незначительноиз-за незначительного изменения концентрации
OH--ионов.
15. Потенциометрическое титрование
16. Потенциометрическое титрование
17. Потенциометрическое титрование
18. Потенциометрический метод анализа
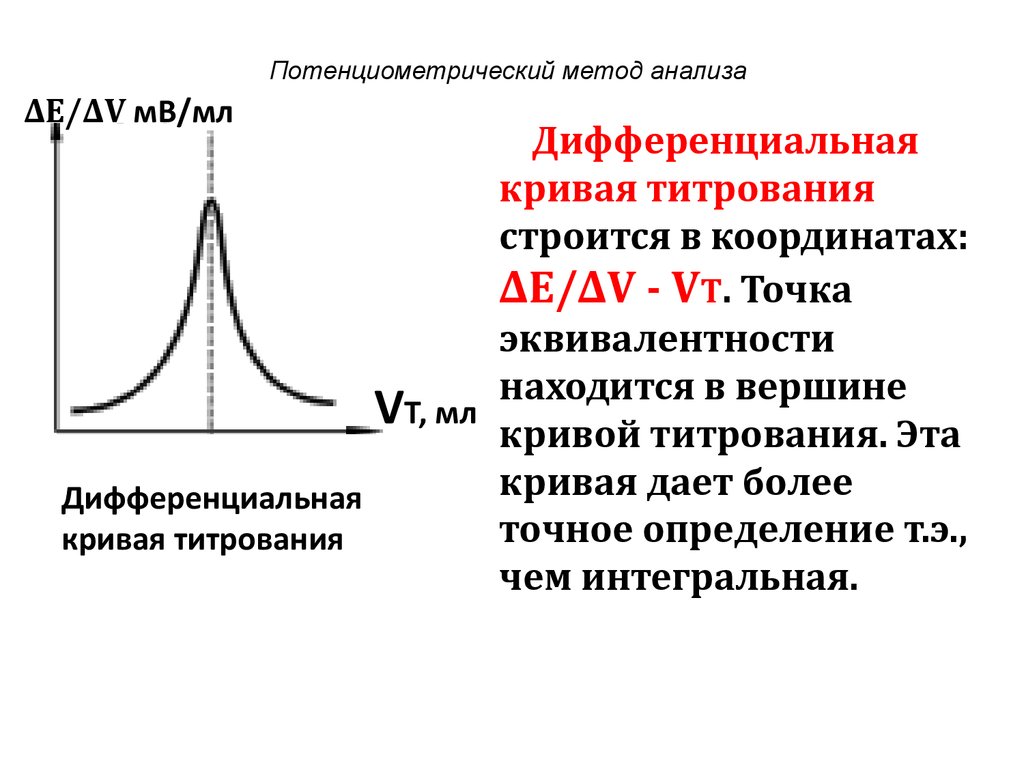
∆Е/∆V мВ/млДифференциальная
кривая титрования
строится в координатах:
∆Е/∆V - VT. Точка
эквивалентности
находится в вершине
VТ, мл кривой титрования. Эта
кривая дает более
Дифференциальная
точное определение т.э.,
кривая титрования
чем интегральная.
19. Потенциометрический метод анализа
Количественные расчеты производятпо закону эквивалентов:
1
1
С ( X )V ( X ) С ( Т )V (Т )
z
z
Метод потенциометрического титрования
применяют при анализе мутных,
загрязненных и окрашенных растворов в
смешанных и неводных растворителях.
20. Направление окислительно-восстановительных процессов
Направление окислительновосстановительных процессовОкислительно-восстановительный
процесс будет протекать в нужном
направлении при условии, что
разность электродных потенциалов
будет положительной.
21. Направление окислительно-восстановительных процессов
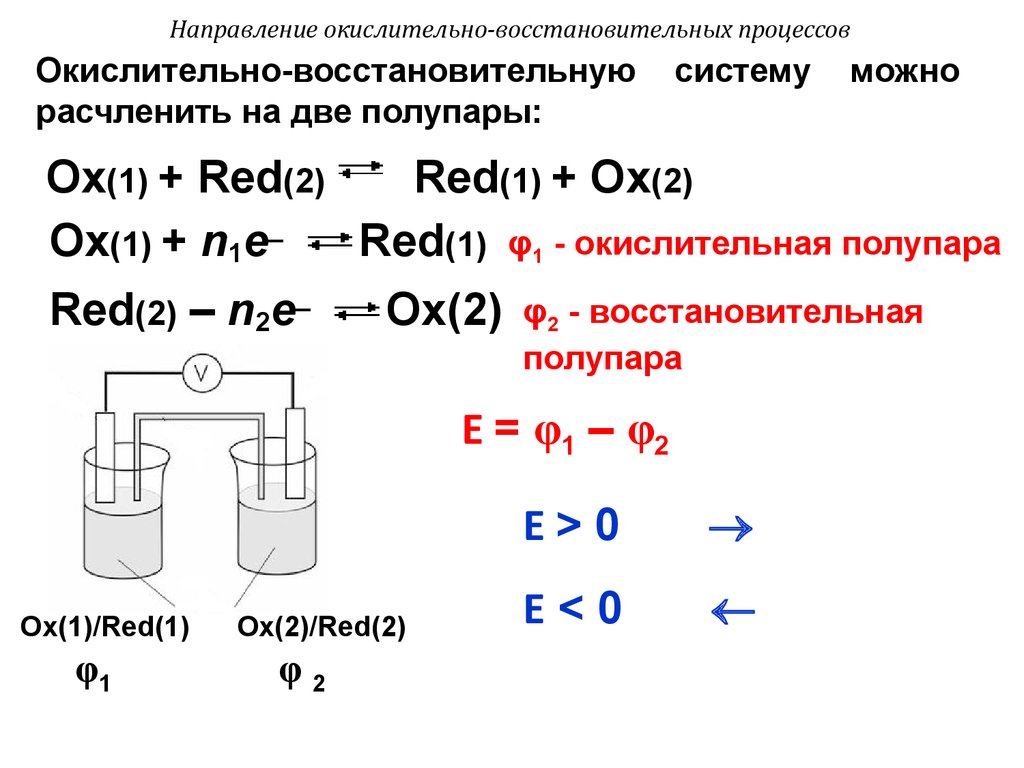
Окислительно-восстановительнуюрасчленить на две полупары:
систему
можно
Оx(1) + Red(2)
Red(1) + Оx(2)
Оx(1) + n1e–
Red(1) φ1 - окислительная полупара
Red(2) – n2e–
Оx(2)
φ2 - восстановительная
полупара
Е = φ1 – φ2
Ox(1)/Red(1)
φ1
Оx(2)/Red(2)
φ2
Е>0
Е<0
22. Направление окислительно-восстановительных процессов
Часто вместо таких полупаррассматривают две полуреакции, в которые
включают не только атомы, изменяющие
свою
степень
окисления,
но
и
взаимодействующие с ними ионы Н+ и ОН-.
Любая полупара, играющая в одной о/в
реакции роль окислительной, может в
другой
реакции
играть
роль
восстановительной.
23. Направление окислительно-восстановительных процессов
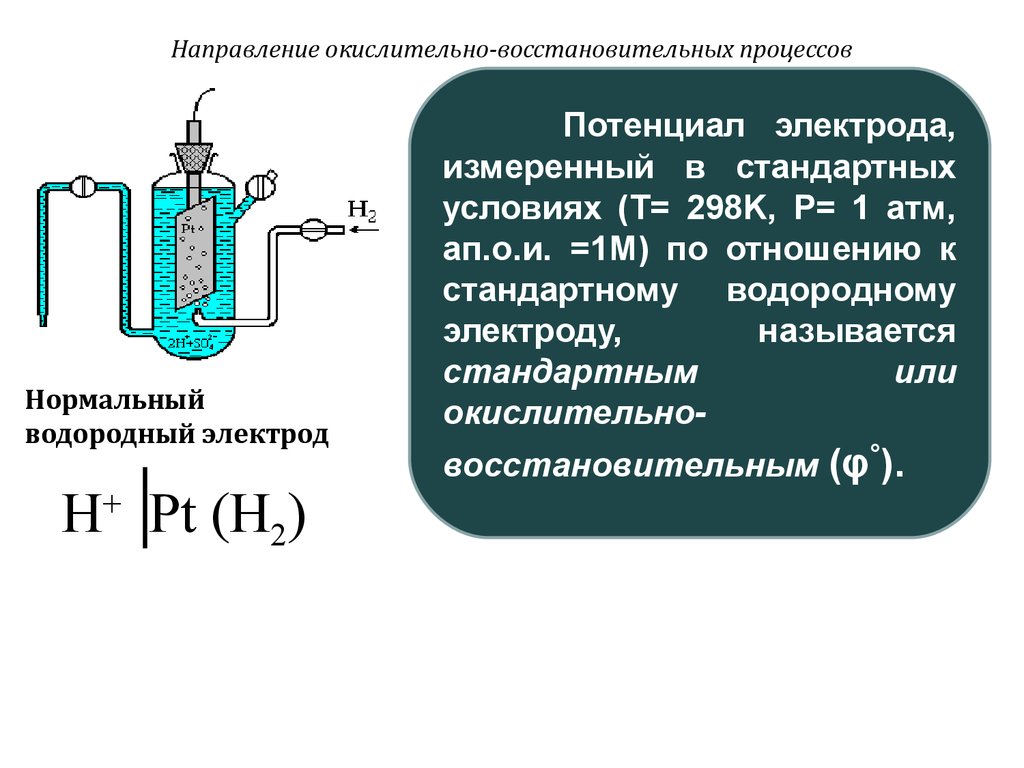
Нормальныйводородный электрод
H+ Pt (H2)
Потенциал электрода,
измеренный в стандартных
условиях (T= 298K, P= 1 атм,
ап.о.и. =1M) по отношению к
стандартному водородному
электроду,
называется
стандартным
или
окислительновосстановительным (φ°).
24. Направление окислительно-восстановительных процессов
Оx + Н2Red + 2Н+
Е° = φ°(Оx/Red) – φ°(Н+/1/2Н2) = φ°(Оx/Red)
Данные стандартного потенциала
полуреакции восстановления φ° приведены в
справочниках.
25. Направление окислительно-восстановительных процессов
Окислительно-восстановительныйпроцесс протекает в прямом
направлении до конца при любых
начальных условиях, если Е > 0,4 В.
26. Направление окислительно-восстановительных процессов
Чемвыше
значение
стандартного
электродного потенциала φ0, тем выше у
данной полупары окислительная способность,
т.е. на этом электроде будет протекать процесс
восстановления (+ е-). На электроде с более
отрицательным значением φ0 протекает
процесс окисления (- е-). У такой полупары
выше восстановительная способность.
27.
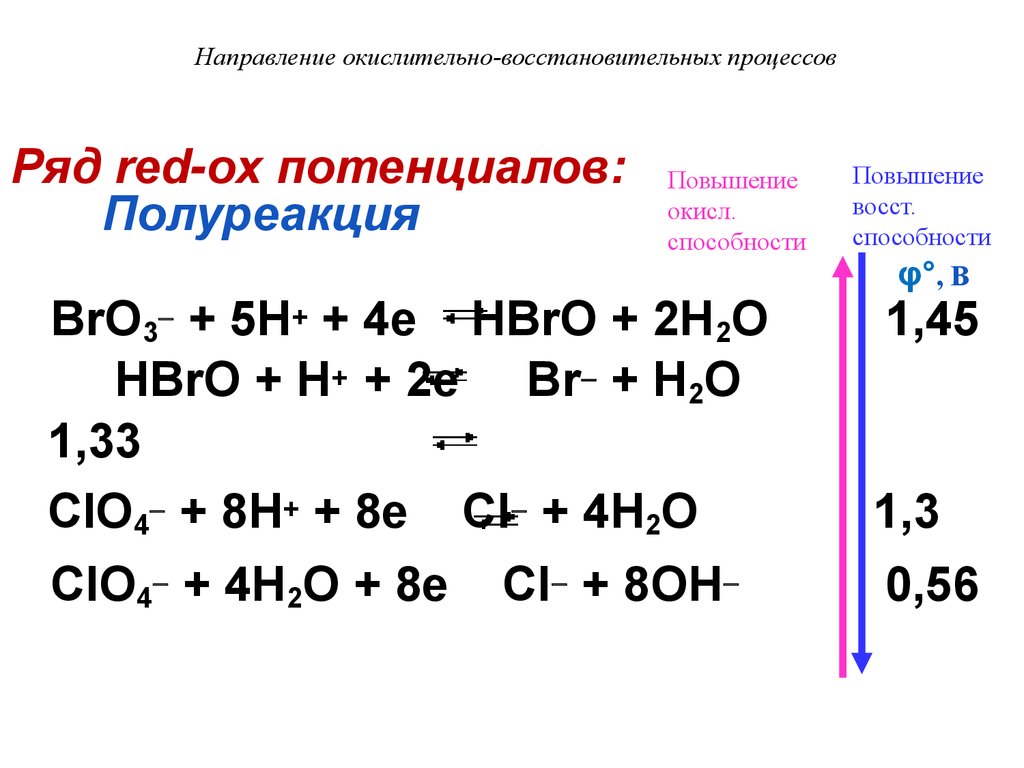
Направление окислительно-восстановительных процессовРяд red-ox потенциалов:
Полуреакция
Повышение
окисл.
способности
Повышение
восст.
способности
φ°, В
BrO3 + 5H+ + 4e HBrO + 2H2O
HBrO + H+ + 2e Br + H2O
1,33
ClO4 + 8H+ + 8e Cl + 4H2O
1,3
ClO4 + 4H2O + 8e
0,56
Cl + 8OH
1,45
28. Направление окислительно-восстановительных процессов
Например:0
Cd0,
Сd2+ + 2e-
Cd 2 / Cd 0
IO3- + 6H+ + 6e-
0
/I
IO3
0,4B
I- + 3Н2О,
1,085B
29. Направление окислительно-восстановительных процессов
Перваясистема
является
системой
восстановителя. На этом электроде будет протекать
процесс отдачи электронов (процесс окисления):
Cd0 - 2e- Сd2+
Вторая система – система окислителя. На этом
электроде будет протекать процесс присоединения
электронов (процесс восстановления): IO3- + 6H+ +
6eI- + 3Н2О
30. Направление окислительно-восстановительных процессов
Суммарное уравнение реакции:Cd0 - 2e- Сd2+
IO3- + 6H+ + 6e3Cd0 + IO3- + 6H+
I- + 3Н2О
3
1
3Сd2+ + I- + 3Н2О
31. Направление окислительно-восстановительных процессов
Гальваническая цепь:Cd0 Сd2+
IO3-, H+ Pt
I-
Е = φ° IO3-/I- - φ° Сd2+/Cd0 = 1,085 – (-0,4) = 1,485 В
Е ˃ 0, процесс возможен.
32.
Направление окислительно-восстановительных процессовНапример:
Cd2+ (р) + 2e-
Cd (т)
φ0 = -0,40 В
Cd2+ - окислитель,
Cr3+ (р) + 3e-
Cr (т)
φ0 = -0,74 В
Cr - восстановитель
Aнод (окисление):
Катод (восстановление):
2Cr (s) + 3Cd2+
Cr (s) -3eCd2+ + 2e3Cd (s) + 2Cr3+
0
0
Е = φ катода - φанода
Е = -0,40 – (-0,74)
Е = 0,34 В
Cr3+
x2
Cd (s)
x3
33. Направление окислительно-восстановительных процессов
Например:MnO4- + 8H+ + 5e-
Mn+2 + 4H2O,
φ0 MnO4-, H+/Mn+2 = 1,51 В
Fe+3 + eFe+2, φ0 Fe+3/Fe+2 = 0,77 В
34.
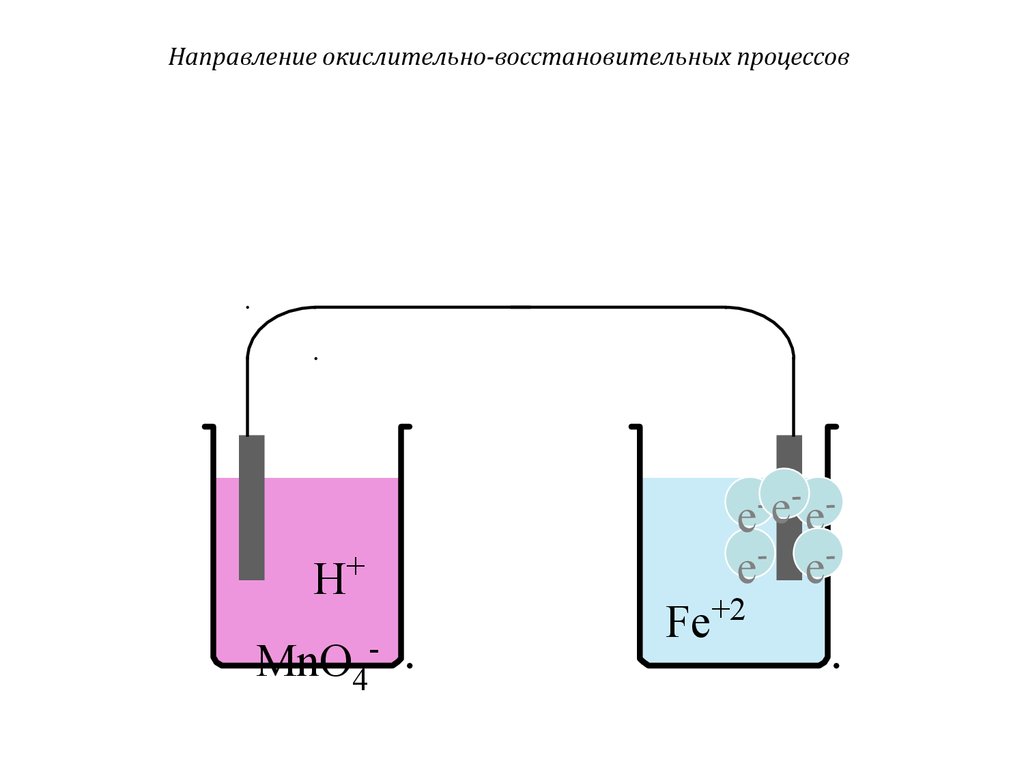
Направление окислительно-восстановительных процессов- e- -
H+
MnO4-
e e
e- e-
Fe+2
35. Направление окислительно-восстановительных процессов
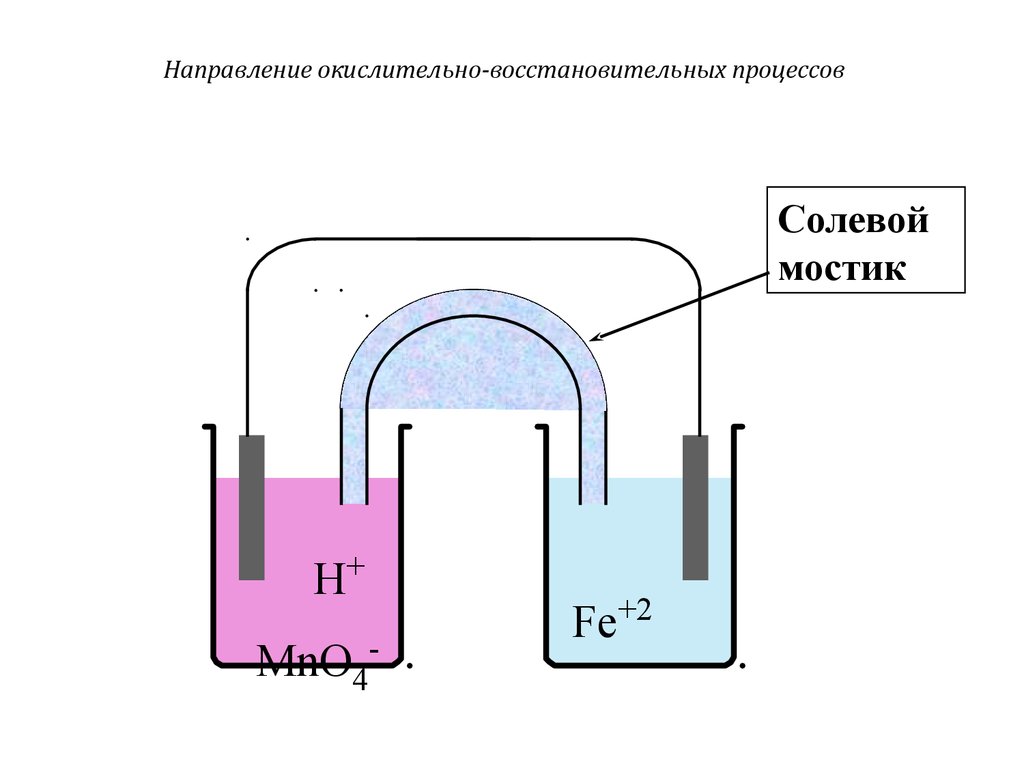
Солевоймостик
H+
MnO4-
Fe+2
36.
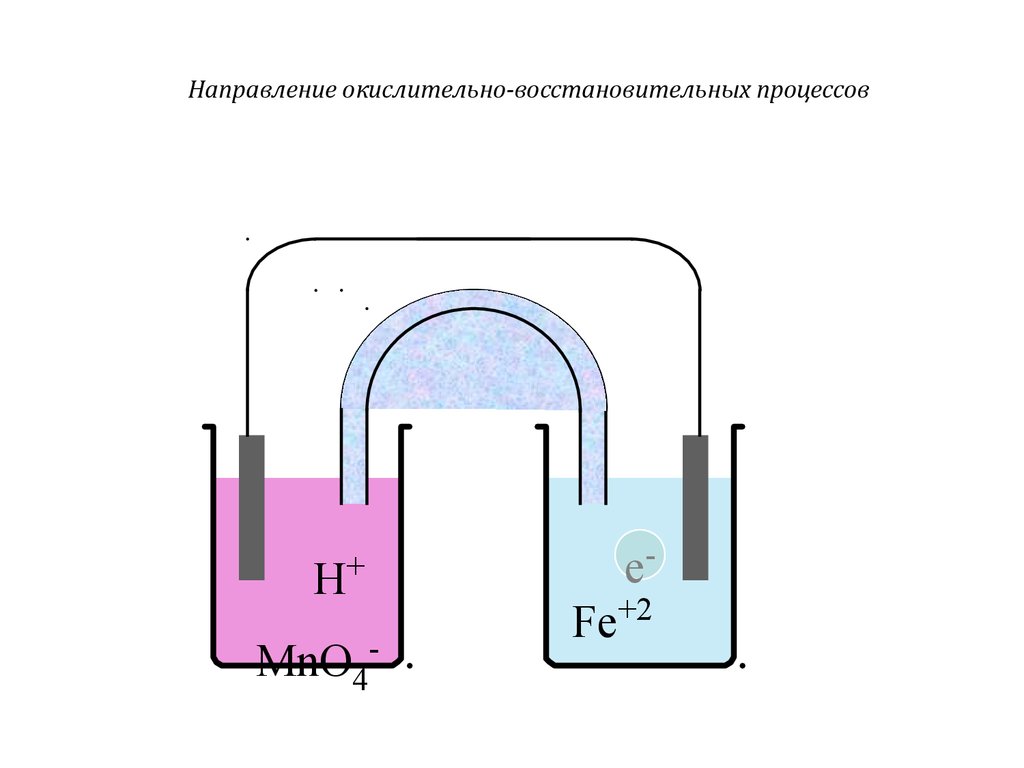
Направление окислительно-восстановительных процессовH
+
MnO4-
e-
Fe+2
37.
Направление окислительно-восстановительных процессовПористый
диск
H+
MnO4-
Fe+2
38.
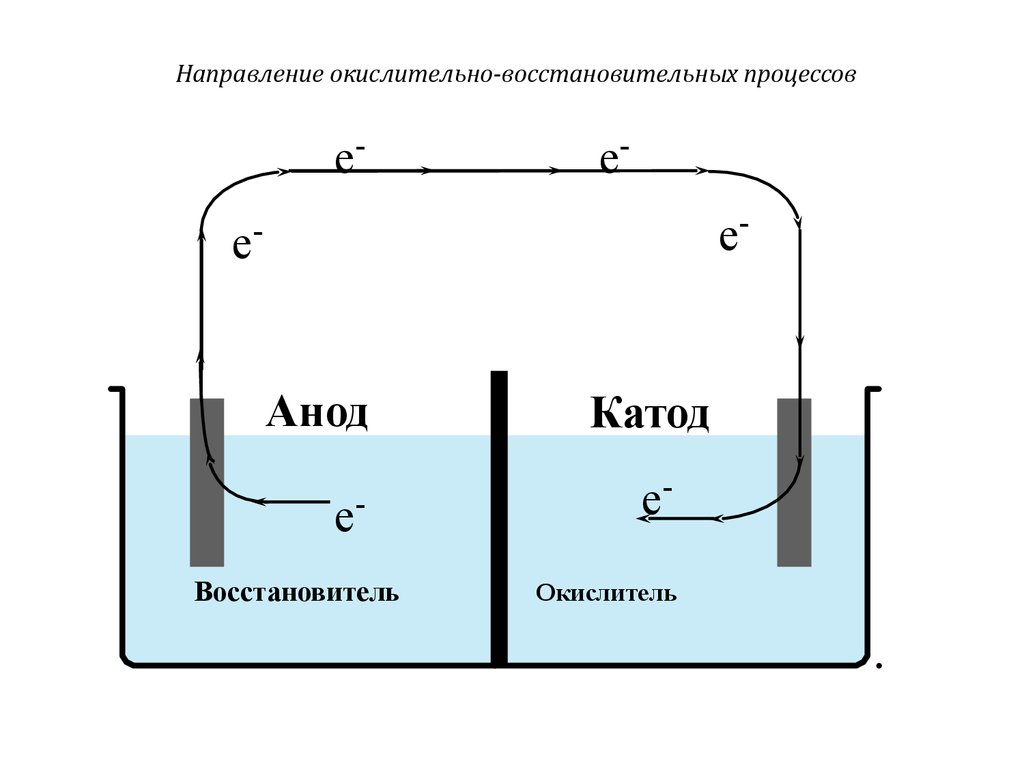
Направление окислительно-восстановительных процессовee
ee-
-
Анод
e
-
Восстановитель
Катод
eОкислитель
39. Направление окислительно-восстановительных процессов
Первая система является системой окислителя. На этомэлектроде будет протекать процесс присоединения
электронов (процесс восстановления):
MnO4- + 8H+ + 5e-
Mn+2 + 4H2O
Вторая система – система восстановителя. На этом
электроде будет протекать процесс электронов (процесс
окисления):
Fe+2 - e-
Fe+3
40. Направление окислительно-восстановительных процессов
Суммарное уравнение реакции:MnO4- + 8H+ + 5e- Mn+2 + 4H2O 1
5
Fe+2 - e- Fe+3
MnO4-+ 8H++ 5Fe+2 Mn+2 +5Fe+3+4H2O
41. Направление окислительно-восстановительных процессов
42.
Практическое приложение ГЭ43.
е–К: 2Н2 + ОН– + 4е– = 4Н2О
А: О2 + 2Н2О = 4ОН–+ 4е–
Н2O
Н2
ОН–
-
КОН
Етеор = 1,229 В
+
О2
Епракт = 0,7 – 0,9 В
44. Практическое использование гальванических элементов
батарейкааккумулятор
Катод
Анод
Электролит
Сепаратор
Анод
Катод
45.
-Батарейка
Источник
тока
+
ee-
(-)
(+)
Инертные
электроды
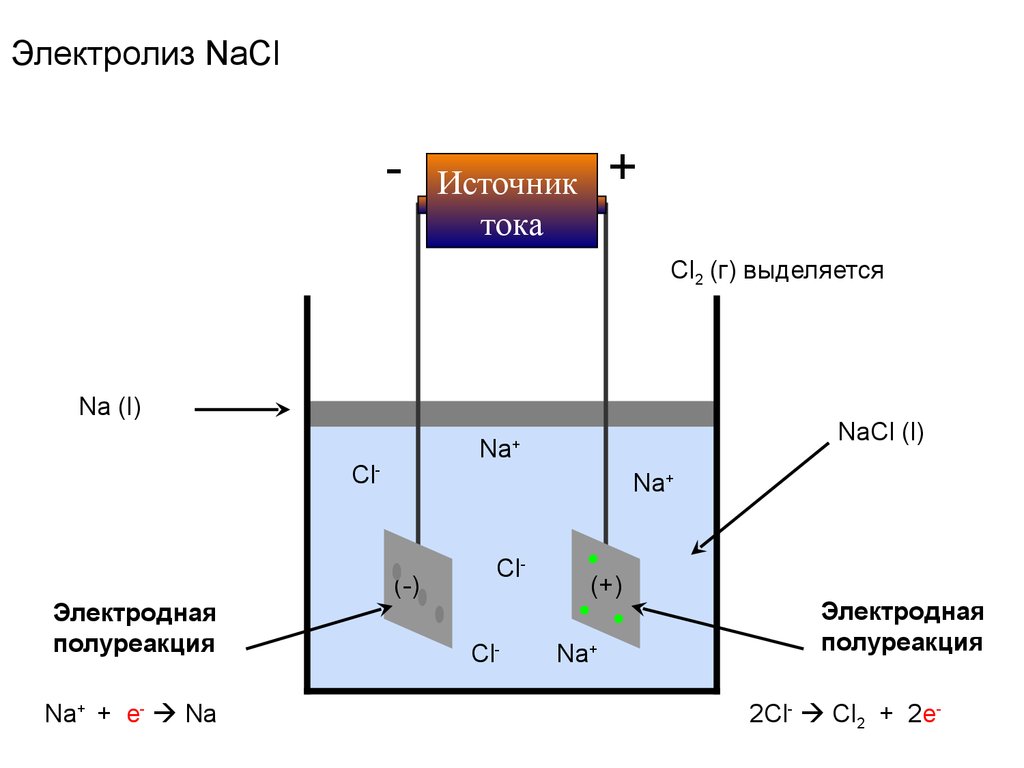
46. Химические процессы при электролизе расплава хлорида натрия, NaCl?
Na+Cl-
47.
Электролиз NaCl-
+
Источник
тока
Cl2 (г) выделяется
Na (l)
Cl-
Электродная
полуреакция
Na+ + e- Na
NaCl (l)
Na+
Na+
(-)
ClCl-
(+)
Na+
Электродная
полуреакция
2Cl- Cl2 + 2e-
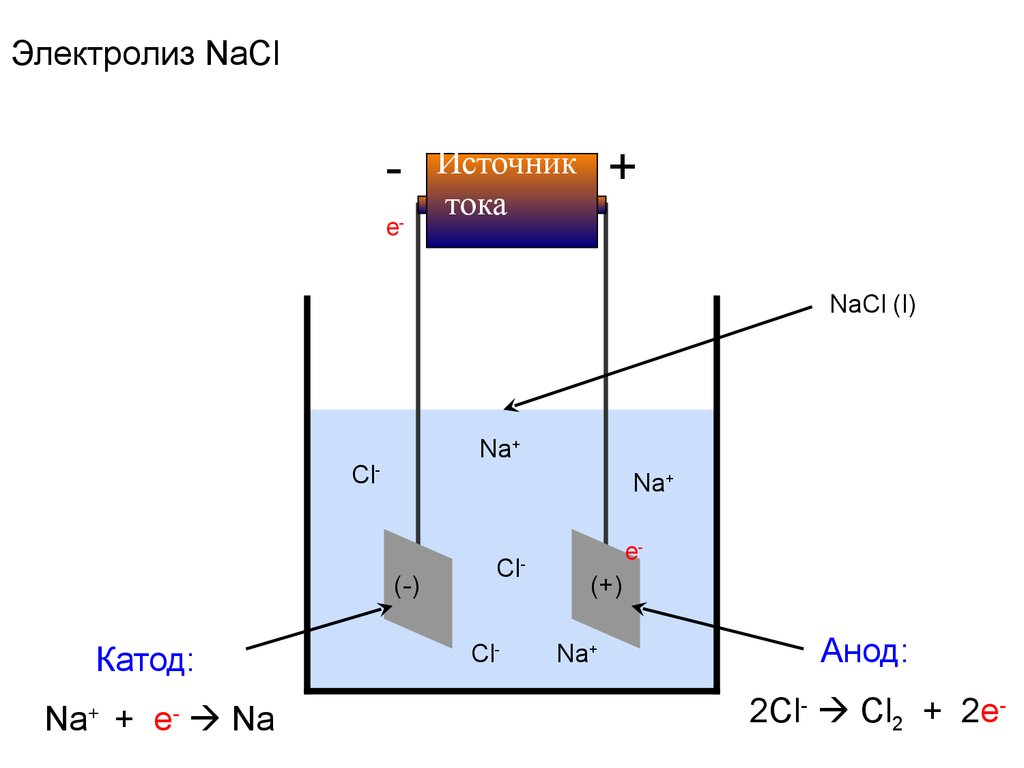
48.
Электролиз NaCle-
+
Источник
тока
NaCl (l)
Na+
Cl-
Na+
(-)
Катод:
Na+ + e- Na
Cl
-
Cl-
e(+)
Na+
Анод:
2Cl- Cl2 + 2e-
49. Электродные процессы
Катод (-)ВОССТАНОВЛЕНИЕ
Na+ + e- Na
Анод (+)
ОКИСЛЕНИЕ
2Cl- Cl2 + 2e-
Суммарная реакция:
2Na+ + 2Cl- 2Na + Cl2
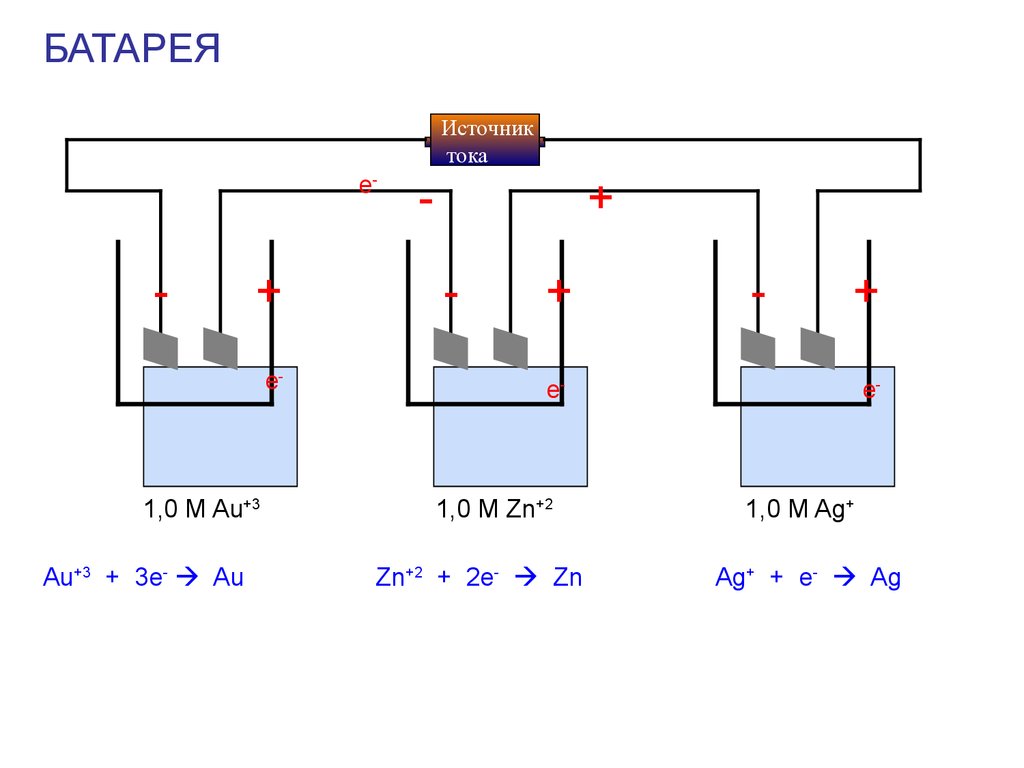
50.
БАТАРЕЯИсточник
тока
e-
-
+
e-
1,0 M Au+3
Au+3 + 3e- Au
-
+
-
+
-
+
e-
1,0 M Zn+2
Zn+2 + 2e- Zn
e-
1,0 M Ag+
Ag+ + e- Ag
51. Вопросы для самоконтроля
1. Сформулируйте правило «правого плюса».2. Укажите области применения гальванических
элементов.
3. В чем сущность потенциометрического
метода анализа?
4. Как определяется направление окислительновосстановительных процессов?
52.
БЛАГОДАРЮ ЗАВАШЕ ВНИМАНИЕ!

































 medicine
medicine biology
biology chemistry
chemistry








